Точность биологических часов, хронотип, здоровье и долголетие
Автор: Губин Д.Г., Коломейчук С.Н.
Журнал: Тюменский медицинский журнал @tmjournal
Статья в выпуске: 2 т.21, 2019 года.
Бесплатный доступ
Предложено обоснование взаимосвязи между точностью хода циркадианных биологических часов, хронотипом и здоровьем. На примере разных видов животных, а также человека, показано, что близкий к 24 часам циркадный период (tau) ассоциирован с продолжительностью жизни и, вероятно, присущ преимущественно обладателям умеренного утреннего хронотипа. Точный tau способствует поддержанию высокой амплитуды циркадианных ритмов, фенотипическому признаку, тесно связанному со здоровьем и долголетием. Рассмотрены некоторые генетические факторы, координирующие tau и обеспечивающие точный ход биологических часов (БЧ).
Хронотип, здоровье, долголетие, циркадный резонанс, циркадианный период, амплитуда, продолжительность жизни, заболеваемость, смертность, генетика, гены, полиморфизм
Короткий адрес: https://sciup.org/140257627
IDR: 140257627 | DOI: 10.36361/2307-4698-2019-21-2-14-27
Текст научной статьи Точность биологических часов, хронотип, здоровье и долголетие
Скорость хода биологических часов и циркадный период. Биологические часы (БЧ) клетки идут с разной скоростью. Скорость хода клеточных БЧ является видоспецифическим признаком и определяется внутренним циркадианным, или циркадным периодом, (далее – tau ), варьирующем в диапазоне ~24 ± 4 часа (Dibner et al., 2010). Каждый индивидуум имеет собственное значение tau , который обусловлен полиморфизмом ключевых часовых ( core clock genes, CG ), а также ряда других генов. Клеточные БЧ генетически консервативны на разных уровнях организации живого и имеют общие эволюционные предпосылки (Reppert & Weaver, 2002; Partch et al, 2014; Takahashi, 2017). Оптимальная синхронизация БЧ подразумевает фазовую подстройку и согласование циркадных ритмов (ЦР) метаболизма (соотношения фаз ассимиляции и диссимиляции) (Губин, 2013; Dibner et al, 2010; Eckel-Mahan & Sassone-Corsi, 2013; Millius & Ueda, 2017; Takahashi, 2017) и баланса окислительно-восстановительных реакций (Edgar et al, 2012).
Эндогенный циркадный период tau можно точно определить в условиях отсутствия изменения внешней освещенности. При постоянных световых условиях БЧ испытывают свободно-текущий, или фазово-дрей-фующий характер с эндогенным периодом, tau, отличным от 24 часов. Отклонения τau возможны в диапазоне 24 ± 4 часа (откуда и появилось представление о циркадианной ритмичности). Существует 2 основ- ных модели световой синхронизации БЧ (Daan, 2000). Согласно параметрической модели Юргена Ашоффа, направление сдвига в ту или иную сторону от 24 ч зависит от уровня внешней освещенности и у видов с дневным и ночным типом активности, изменяется разнонаправлено. У животных с дневным типом активности, включая человека, постоянный свет ускоряет ход БЧ, сокращая tau. В темноте tau, напротив, увеличивается. У ночных видов закономерность носит противоположный характер. Непараметрическая модель Колина Питтендриха учитывает роль моментов перехода уровня освещенности от света в темноту и обратно в фазовой подстройке ЦР и синхронизации с внешними фотопериодическими условиями.
В повседневных условиях основным синхронизирующим фактором выступает свет (изменение его физических характеристик – освещенности и спектрального состава) (Beersma & Daan, 1993). Свет поступает на сетчатку, через преимущественно меланопсиновые рецепторы, через которые сигнал передается далее через ретино-гипоталамический тракт центральному осциллятору гипоталамуса, парным супрахиазмати-ческим ядрам, СХЯ (Provencio & Warthen, 2012), опосредованно влияя также на продукцию мелатонина эпифизом (Phillips et al, 2019). Даже незначительных изменений внешней освещенности в течение суток достаточно для синхронизации ЦР, что обеспечивает их точный ход с tau = 24 ч.
tau, амплитуда фенотипических ЦР и здоровье . Амплитуда фенотипических ритмов (большинства измеряемых в клинике параметров – например, физиологических и биохимических показателей) предопределяется фазовой стабильностью лежащих в их основе БЧ. Факторы, способные влиять на tau , либо разобщать фазовую синхронность ЦР, способны тем самым снижать амплитуду ЦР и провоцировать развитие внутреннего десинхроноза. Амплитуда ЦР является важнейшим интегральным показателем синхронизации. Геннадий Губин одним из первых выделил данный параметр как неспецифический критерий надежности биологической системы и ее адаптивных резервов, развивающийся в ходе эволюции и изменяющийся в процессе индивидуального развития (Губин и Герловин, 1980), установив общебиологическую закономерность постепенного снижения амплитуды ЦР в процессе старения (Губин и Вайнерт, 1991). Также Геннадий Губин предвидел, что данный интегральный маркер ЦР может служить маркером уровня здоровья, который необходимо целенаправленно изучать для ранней диагностики патологий (Губин и Чесноков, 1976).
В последние годы во многих работах амплитуда ЦР была соотнесена с комплексной оценкой состояния здоровья, кроме того была подтверждена позитивная роль высокой амплитуды ЦР (Buhr & Takahashi, 2013; Eckel-Mahan & Sassone-Corsi, 2013; van der Berg et al, 2017; Gubin et al, 2013, 2017; Chen et al, 2013; Dupont Rocher et al, 2016; Maloney et al, 2019; Weinert & Gubin, 2018; Takahashi et al, 2017; Zare et al, 2017). В частности, высокая амплитуда ЦР сывороточного холестерина была ассоциирована с продолжительностью жизни человека (van der Berg et al, 2017), а высокая амплитуда ЦР температуры и двигательной активности служила предиктором продолжительности жизни лабораторных мышей (Basso et al, 2016). Более высокий уровень физической активности и кислородной емкости пожилых лиц коррелирует с высокой амплитудой ЦР экспрессии часового гена Per3 (Takahashi et al, 2017) и амплитудой ЦР температуры в полости рта (Dupont Rocher et al, 2016). Ограничение калорийности питания, зарекомендованный способ увеличения продолжительности жизни, сопровождается увеличением амплитуды ЦР (Nelson and Halberg, 1986; Escobar et al, 2011). Напротив, снижение амплитуды (вплоть до нивелирования значимого ЦР) тиреотропного гормона, ТТГ выявлено при болезни Альцгеймера на фоне более низкой среднесуточной продукции данного гормона (Chen et al, 2013). Резкое снижение амплитуды ЦР, вплоть до исчезновения ритмичности одного из ключевых часовых генов у Drosophila, TIMELESS и нарушение ЦР экспрессии другого ключевого гена Per в периферических тканях является предиктором более скорой смерти в разных возрастных группах (Zhao et al, 2018). Снижение амплитуды ЦР ритма температуры тела, сердечного ритма и уровня глюкозы натощак характеризуют клиническую картину предиабета и сахарного диабета 2 типа среди лиц с повышением индекса массы тела (Gubin et al, 2017). Выраженные фазовые и амплитудные изменения ЦР температуры (Gubin et al, 2019) и амплитудно-фазовые изменения внутриглазного давления, ВГД (Губин и др, 2018) наблюдаются при прогрессировании первичной открыто-угольной формы глаукомы. Именно низкая амплитуда ЦР наряду со снижением качества сна оказалась ведущим фактором, взаимосвязанным с прогнозом отсутствия на рабочем месте из-за временной нетрудоспособности среди работников газодобывающей отрасли (Zare et al, 2017). Наконец, снижение амплитуды ЦР является характерным атрибутом самого процесса старения (обзоры: Губин и Вайнерт, 2015; Gubin et al, 2016), а сохранение генетически обусловленной высокой амплитуды ЦР взаимосвязано с большей продолжительностью жизни (Hurd & Ralf, 1998; Froy et al, 2006).
Взаимосвязь tau и амплитуды ЦР. Гипотеза циркадного резонанса. Высокая амплитуда ЦР может быть обусловлена эндогенными БЧ с точным ходом, т.е. с tau , имеющим небольшое отклонение от 24 часов (Pitterndrigh et al, 1991; Агаджанян и Губин, 2004). Соответственно, можно предполагать существование более высокой устойчивости к факторам десинхроно-за для организмов с наиболее точным значением τ au . Гипотеза, обосновывающая общебиологическую целесообразность и адаптивность точного τ au, известная также как гипотеза «циркадного резонанса» была впервые высказана Питтендрихом и Брюсом в 1959 г. (Pittendrigh & Bruce, 1959). Впоследствии было показано, что взаимосвязь между внутренним (биологическим) ходом времени и внешними водителями ритма для представителей разных видов, включая человека, определяется преимущественно величиной τau (Wright et al, 2005).
Внутренний tau и продолжительность жизни. Весьма интересны данные, которые свидетельствуют о том, что точный эндогенный τau может быть связан как с более высокой и устойчивой к десинхронизации циркадной амплитудой, так и с большей продолжительностью жизни, что было показано в работах на различных видах не только модельных животных, в частности, некоторых видах грызунов и приматов
(Pittendrigh & Minis, 1972; Hurd & Ralf, 1998; Martino et al, 2008; Wyse et al, 2010; Gutman et al, 2011; Libert et al, 2012), но также растений (Dodd et al, 2005) и даже цианобактерий (Ouyang et al, 1998). Мыши, имеющие точный tau сохраняют его стабильным и в процессе старения (Gutman et al, 2011). В исследовании на линии мышей был установлен приблизительный доверительный интервал необходимой точности tau с отклонением в пределах не более 7 минут, ассоциированный с достоверным увеличением продолжительности жизни (Libert et al, 2012).
Хронотип и tau. До настоящего времени точное измерение tau остается трудоемким методом, т.к. возможно лишь при нахождении испытуемого в контролируемых лабораторных условиях в течение нескольких дней при постоянных условиях (протокол constant routine) или при навязанной десинхронизации (forced desynchrony) (Czeisler et al, 1999; Chang et al, 2019), либо с меньшей точностью при исследовании культур клеток фибробластов, ( Pagani et al, 2010; Hida et al, 2013). Однако, оценка хронотипа с помощью простых анкет также дает ориентировочное представление о tau (Duffy et al, 2001; Emens et al., 2009). Анкетирование хронотипа по одному из двух наиболее распространенных методов, по Horne-Ostberg (Horne and Ostberg, 1976), либо по Мюнхенскому тесту (Roenneberg et al., 2003) является широко распространенным и простым способом оценки также фазы биологических часов.
В наиболее внушительной на данный момент по статистической выборке работе (Knutson & von Shantz, 2018) был проведен анализ данных биобанка почти полумиллиона англичан, который показал четкую взаимосвязь вечернего хронотипа с повышенным риском заболеваемости и смертности. В обсуждении авторы данной работы сходятся во мнении с другими авторами, что такая взаимосвязь может являться следствием сложившейся «социальной дискриминации» вечерних хронотипов, вынужденных подстраиваться под прокрустово ложе стандартных социальных режимов труда. В условиях современной цивилизации лица с вечерним хронотипом являются наиболее подверженными внешнему десинхронозу – в частности, социальному джет-лагу (десинхронизации между фазой эндогенных БЧ и социальными факторами) (Roenneberg et al, 2003). Действительно, выраженность социального джет-лага коррелирует с комплексными метаболическими нарушениями, сопровождающими в т.ч. процесс старения – со снижением липопротеинов высокой плотности, повышением триглицеридов, инсулина натощак, резистентности к инсулину, риском метаболического синдрома, предрасположенностью к сахарному диабету 2 типа и атеросклерозу (Wong et al, 2015), а также более высокой распространённость апноэ сна и более высоким уровнем стрессовых гормонов (Lucassen et al, 2013). Во многих исследованиях также прослеживается взаимосвязь между нарушением режима сна / дефицитом сна c изменениями липидного (Aho et al, 2016; Weljie et al, 2015) и углеводного метаболизма (Maury, 2019; Poggiogalle et al, 2018).
Однако, для такой взаимосвязи кроме социального может существовать и биологическое обоснование – а именно, сопряженность определенного хронотипа с более точным tau .
tau, хронотип и здоровье, или какой хронотип лучше? Вряд ли на данный вопрос можно дать простой ответ. Однако, вполне возможно обосновать взаимосвязь между точным tau и хронотипом. Взяв за основу табличные данные, представленные в работе ( Knutson & von Shantz, 2018), мы предприняли попытку проанализировать ассоциативную свзяь между 4 вариантами хронотипа и природой заболеваемости. На рис. 1 приведены наши расчеты по оригинальным табличным данным авторов (Knutson & von Shantz, 2018). Данные таблицы 1 исходной статьи по коморбидной патологии были выражены в процентах для каждого из 9-ти маркеров ведущей коморбидной патологии. Затем для каждого хронотипа была рассчитана средняя относительная заболеваемость. Мы исключили из расчетов заболеваемость с маркером «психологические расстройства» (« psychological disorders» ), отличительной особенностью которых является четкая линейная зависимость между хронотипами. В таком случае соматическая патология приобретает нелинейную зависимость и укладывается в концепцию «циркадного резонанса» – наименьшая заболеваемость по разным соматическим патологиям стабильно ассоциирована
Таблица 1
Выраженная в процентах относительная заболеваемость с различной превалирующей коморбидной нозологией по 4-м вариантам хронотипа ( дополнительный анализ данных UK BioBank, включающим более 430 тысяч англичан в возрасте 38-73 лет, по Knutson & von Schantz, 2018).
|
Превалирующая коморбидная нозология (КН) |
ЧУТ |
УУТ |
УВТ |
ЧВТ |
|
Кардиоваскулярная |
106.0773 |
98.0663 |
97.23757 |
99.72376 |
|
Диабет |
108 |
88 |
98 |
124 |
|
Неврологическая |
95.74468 |
96.80851 |
102.1277 |
114.8936 |
|
Эндокринная (кроме диабета) |
101.5873 |
98.4127 |
100 |
106.3492 |
|
Почечная |
102.1739 |
100 |
95.65217 |
100 |
|
Дыхательная |
99.38272 |
93.82716 |
101.8519 |
116.6667 |
|
Мышечноскелетная |
102.7907 |
97.2093 |
100 |
103.7209 |
|
Желудочно-кишечная |
97.94521 |
96.57534 |
103.4247 |
109.589 |
|
Психологическая |
82.43243 |
87.83784 |
116.2162 |
151.3514 |
|
Среднее по всем КН |
99.57048 |
95.19302 |
101.6122 |
114.0327 |
|
Среднее по соматическим КН |
101.7127 |
96.11241 |
99.78674 |
109.3679 |
ЧУТ – четкий утренний тип; УУТ – умеренный утренний тип; УВТ – умеренный вечерний тип; ЧВТ – четкий вечерний тип.
не с четким (маргинальным), а с умеренным утренним хронотипом (вероятными обладателями наиболее точного tau). При этом различия между обладателями четкого и умеренного утреннего хронотипа являются достоверными (p = 0.01), рис. 1. Указанная тенденция наиболее отчетливо проявляется в случае диабета и другой эндокринной патологии, сохраняясь для ды- хательной, желудочно-кишечной и мышечно-скелетной патологий. Интерес представляет также инверсия закономерности по кардиоваскулярной и почечной патологии, для которой наибольшая заболеваемость напротив присуща крайним утренним вариантам. Для неврологической патологии сохраняется обратная линейная тенденция, наиболее четко проявляющаяся
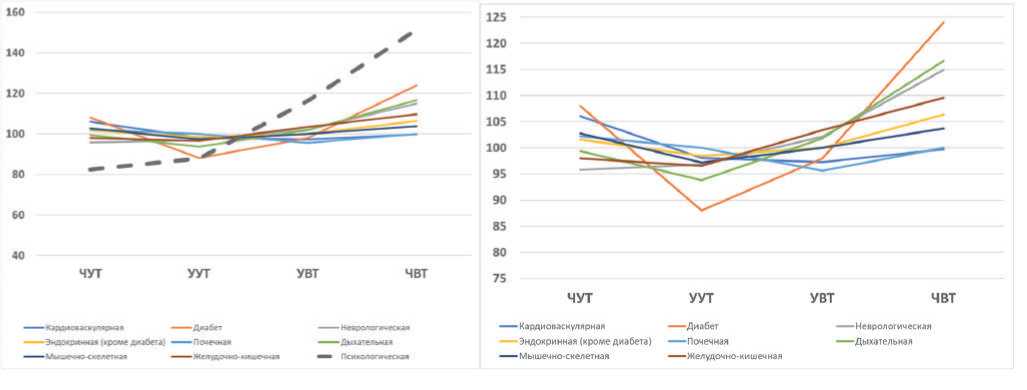
A
B
C
D
Рис. 1. Хронотип и коморбидная патология (дополнительный анализ на основе данных UK BioBank, включающим более 430 тысяч англичан в возрасте 38-73 лет (по Knutson & von Schantz, 2018)
Однонаправленный тренд роста заболеваемости от утренних к вечерним хронотипам прослеживается для ведущей коморбидной патологии «психологические расстройства» («psychological disorders»), пунктирная линия (А). Соматическая патология восьми различных нозологий (B), как и вся общая заболеваемость (С) лишены подобной линейной зависимости. При исключении из расчетов заболеваемости «психологические расстройства», отличительной особенностью которых является линейная зависимость между хронотипами, вся соматическая патология приобретает нелинейную зависимость и укладывается в концепцию «циркадного резонанса» – наименьшая заболеваемость стабильно ассоциирована с умеренным утренним хронотипом (вероятными обладателями наиболее точного внутреннего циркадного периода, tau). Причем различия средней относительной заболеваемости соматической патологией между обладателями четкого и умеренного утреннего хронотипа становятся достоверными (p = 0.01; двусторонний тест Стьюдента) (D). По абсциссе слева направо: четкий утренний тип (ЧУТ, DMT); умеренный утренний тип (УУТ, MMT); умеренный вечерний тип (УУВ, MET); четкий вечерний тип (ЧВТ, DЕT).
для психологических патологий, хотя и выраженная в меньшей степени.
Данное наблюдение служит аргументом в пользу скорее биологического, нежели социального обоснования взаимосвязи между хронотипом и соматической патологией. Оно также предполагает разноплановую природу взаимосвязи хронотипиче-ских особенностей с психологическими расстройствами и соматической патологией.
Интересно, что tau также имеет достоверные половые различия (Duffy et al, 2011): у женщин средний tau ближе к точному значению 24 часа, рис. 2, что примечательно, учитывая большую среднюю продолжительность жизни женщин (Austad & Fischer, 2019). Но если гипотеза циркадного резонанса верна для обоснования половых отличий по продолжительности жизни, то качество сна в данном случае, по-види-мому, не играет роли, т.к. нарушения сна в большей мере свойственны женскому полу (Zhang & Wing, 2006; Bailey & Silver, 2014).
Аналогично, во многих работах было отмечено, что женщины в большей мере являются представителями утренних хронотипов (Adan & Natale, 2002;
Bailey & Silver, 2014; Hu et al, 2016). Однако, хронотип в отличие от tau , который практически не меняется с возрастом (Duffy et al, 2001), претерпевает значительные возрастные изменения в сторону более ранних (жаворонковых) вариантов (обзор в Hood & Amir, 2017). Любопытно, что изменение хронотипа с возрастом у мужчин и женщин происходит в разной степени: у мужчин изменения более значительны. После 40 лет хронотип мужчин, будучи исходно более «вечерним» становится в среднем более «утренним» (Duarte et al, 2014; Fischer et al, 2017). Данная закономерность, вероятно, обусловлена эпигенетическими факторами, прежде всего особенностями возрастной гормональной динамики (Bailey & Silver, 2014). Таким образом, взаимосвязь между tau и хронотипически-ми особенностями (приверженностью определенной фазе сна) лучше прослеживается на более ранних этапах онтогенеза, снижаясь с возрастом, что, в частности, было показано на примере других приматов (макак) (Zhdanova et al, 2011). Примечательно, что наиболее высокая стабильность tau свойственна мышам, имеющим более высокую амплитуду ЦР и большую продолжительность жизни (Gutman et al, 2011).
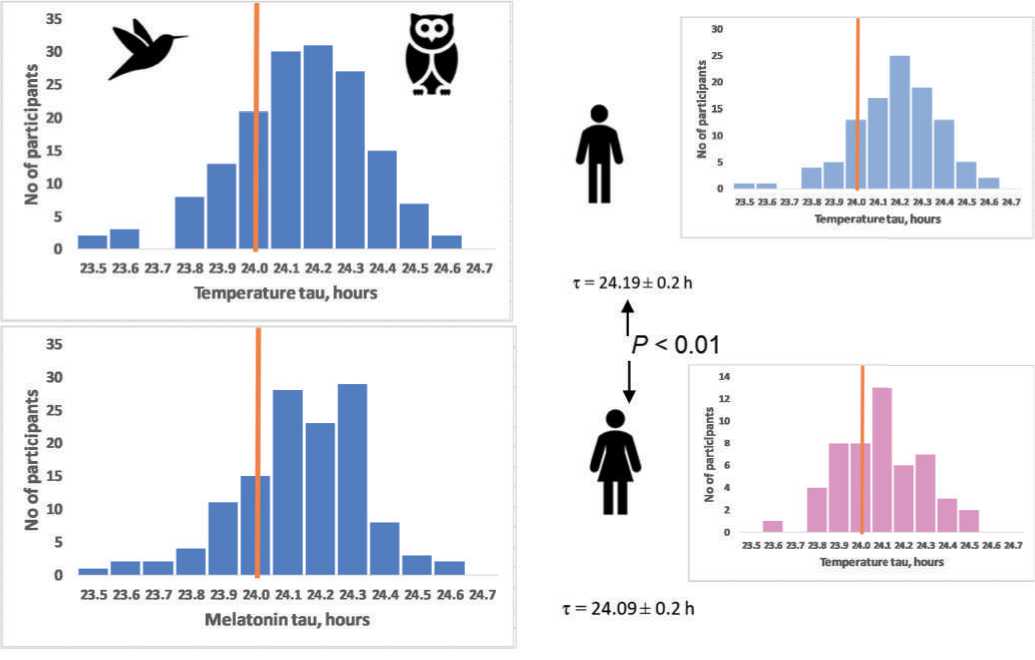
Рис. 2. Предполагаемая взаимосвязь точного циркадного периода tau с умеренным утренним хронотипом на примере половых особенностей.
Частотное распределение данных по внутреннему периоду tau предполагает, что обладатели наиболее точных часов, вероятно, соответствуют умеренному утреннему хронотипу ( A ). Женщины, имеющие в среднем более высокую среднюю продолжительность жизни, также являются и обладателями в среднем более точных БЧ (tau = 24.09 ± 0.2 часа), чем мужчины (tau = 24.19 ± 0.2 часа), p < 0.01 ( B ) (по Duffy et al, 2011). Вертикальной линией отмечена частота точного tau = 24 часа.
Любопытно, взаимосвязь между оптимальной для большинства людей продолжительностью сна и заболеваемостью, с одной стороны, также носит U-образный характер, возрастая у крайних вариантов – прежде всего, при длительности сна менее 6 и более 9 часов (Ferrie et al, 2007; Yin et al, 2017). С другой стороны, характер U-образной кривой отличен от нормального распределения и также имеет выраженные межполовые различия (Ferrie et al, 2007).
Значительный интерес представляют дальнейшие исследования индивидуальных генетических особенностей, определяющих устойчивость к факторам десинхронизации. В частности, интересно в какой мере резко выраженные индивидуальные различия ответной реакции в виде снижения продукции мелатонин на свет одинаковой интенсивности (Phillips et al, 2019), могут быть взаимосвязаны с tau и с определенным хронотипом.
В современной индустриальной цивилизации человек активно манипулирует световым фактором. Типичными последствиями таких манипуляций является существенный дефицит дневного и избыток ночного света (Roenneberg et al, 2003; Yetish et al, 2015; Dijk & Skeldon, 2015;
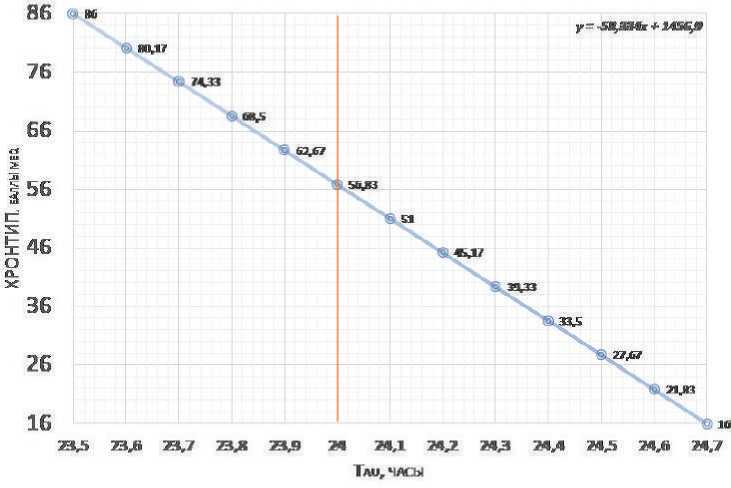
Рис. 3. Возможное соотношение величины tau к баллам хронотипа шкалы MEQ по Horne & Ostberg (на основе данных Duffy et al, 2011, см. также рис.2 и Horne & Ostberg, 1976 ).
Частотное распределение данных по внутреннему периоду tau предполагает, что обладатели точного tau = 24 ч. соответствуют баллу MEQ57 (~56.83). Вертикальной линией отмечен tau = 24 часа.
вопрос – в какой мере люди с разным хронотипом и различными особенностями генетического полиморфизма, определяющего их эндогенный tau, осуществляют контроль (самоограничение) внешнего светового воздействия. Возможно, существуют варианты, склонные спонтанно выбирать физиологически оптимальные режимы хроногигиены, подобно тому, как некоторые долгоживущие линии мышей спонтанно выбирают оптимальный режим питания ограниченной калорийности (Froy & Miskin, 2010).
Какой хронотип ближе к tau24 (“самым точным биологическим часам”)?
Приблизительный пересчет баллов теста на хронотип по шкале опросника (Morningness-Eveningness Questionnaire, MEQ) по Horne-Ostberg и среднего периода, tau может быть основана на том, что согласно полученным в наиболее репрезентативном исследовании (Duffy et al, 2001) данным, диапазон фактически зарегистрированных значений tau у человека составляет 23.5-25.7 ч, а шкала хронотипов MEQ (Horne & Ostberg, 1976) варьирует в диапазоне от 86 (крайние утренние) до 16 (крайние вечерние) варианты хронотипа. Так как более позднее положение фазы соответствует более медленным БЧ (Toh et al., 2001; Duffy et al, 2001; Merrow et al, 2005), то гипотетическая линейная зависимость хронотипа и tau может иметь вид, представленный на рис.3. Частотное распределение данных по внутреннему периоду tau предполагает, что обладатели точного tau = 24 ч. соответствуют баллу MEQ = 57. Таким образом, величина отклонения от MEQ57 ( Δ MEQ57 ) в некоторой мере может характеризовать предполагаемое отклонение от точного tau = 24 ч.
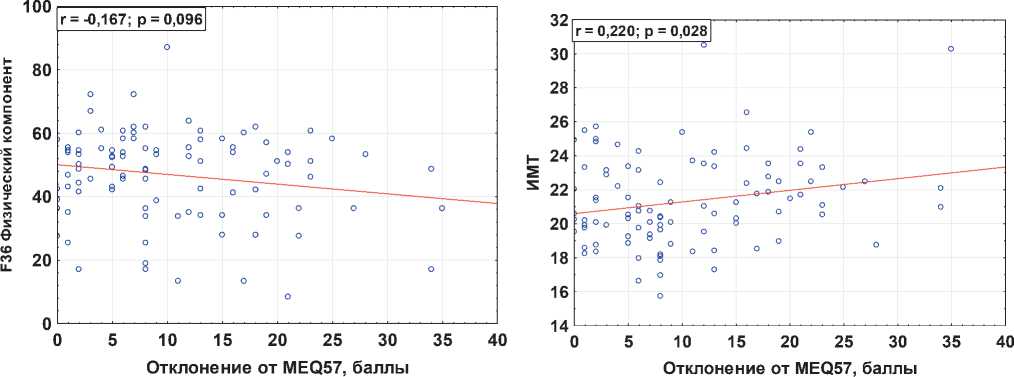
Данные корреляционной связи между ΔMEQ57 и результатами анкетирования физического и психического здоровья по опроснику IF-36 (Brazier et al, 1992; Амир-джанова и др, 2008), а также индексом массы тела (ИМТ), полученные нами по результатам исследования 100 студентов первого курса медицинского университета, косвенно подтверждают высказанную выше гипотезу. Примечательно, что наиболее выраженная достоверная корреляция наблюдалась между ΔMEQ57 и ИМТ (p = 0.028). Стоит отметить, учитывая результаты, представленные в таблице 1, что наиболее выраженная связь низкой заболеваемости у представителей умеренного утреннего хронотипа ассоциирована с ди-
Список литературы Точность биологических часов, хронотип, здоровье и долголетие
- Агаджанян НА, Губин ДГ. Десинхроноз: механизмы развития от молекулярно-генетического до организменного уровня. Успехи физиол. наук. 2004;35 (2):57-72.
- Амирджанова ВН, Горячев ДВ, Коршунов НИ и др. Популяционные показатели качества жизни по опроснику SF-36 (результаты многоцентрового исследования качества жизни «МИРАЖ»). Научно-практическая ревматология. 2008 (1):36-48.
- Губин ГД, Чесноков АА. Биоритм как диагностический тест нормы и патологии. Лабораторное дело. 1976;7:432.
- Губин ГД, Герловин ЕШ. Суточные ритмы биологических процессов и их адаптивное значение в онто- и филогенезе позвоночных. Новосибирск: Наука, 1980. 276 с.
- Губин ГД, Вайнерт Д. Биоритмы и возраст. Успехи физиол. наук. 1991;22:96.
- Губин ГД, Губин ДГ, Комаров ПИ. Старение в свете временной организации биологических систем. Успехи геронтологии. 1998 (2):67-73.
- Губин ДГ. Молекулярные механизмы циркадианных ритмов и принципы развития десинхроноз. Успехи физиологических наук. 2013;44 (4):65-87.
- Губин ДГ, Вайнерт Д. Динамика временной организации в процессе старения: I. Центральные и периферические механизмы. Успехи геронтологии. 2015;28 (2):257-268.
- Губин ДГ, Вайнерт Д. Динамика временной организации в процессе старения: 2. Системные механизмы и способы коррекции возрастного десинхроноза. Успехи геронтологии. 2015;28 (3):423-434.
- Губин ДГ, Малишевская ТH, Вайнерт Д, и др. Особенности циркадианного ритма внутриглазного давления при стабильной и прогрессирующей первичной открытоугольной форме глаукомы. Тюменский медицинский журнал. 2018;20 (3):3-9.
- Губин ДГ. Хронодиагностика и хронотерапия – основа персонализированной медицины. Тюменский медицинский журнал. 2019;21 (1):20-40.
- Дуров АМ. Биологический возраст человека (Хронобиологические аспекты). Тюмень, 1999.
- Abraham U, Granada AE, Westermark PO, et al. Coupling governs entrainment range of circadian clocks. Mol Syst Biol. 2010;6:438. doi:10.1038/msb.2010.92.
- Adan A, Natale V. Gender differences in morningnesseveningness preference. Chronobiology International. 2002;19 (4):709-720.
- Aho V, Ollila HM, Kronholm E, et al. Prolonged sleep restriction induces changes in pathways involved in cholesterol metabolism and inflammatory responses. Sci Rep. 2016; 6:24828.
- Archer SN, Viola AU, Kyriakopoulou V, von Schantz M, Dijk DJ. Inter-individual differences in habitual sleep timing and entrained phase of endogenous circadian rhythms of BMAL1, PER2 and PER3 mRNA in human leukocytes. Sleep. 2008;31 (5):608-617. doi:10.1093/sleep/31.5.608.
- Archer SN, Schmidt C, Vandewalle G, Dijk DJ. Phenotyping of PER3 variants reveals widespread effects on circadian preference, sleep regulation, and health. Sleep Med Rev. 2018;40:109-126. doi:10.1016/j.smrv.2017.10.008.
- Austad SN, Fischer KE. Sex Differences in Lifespan. Cell Metab. 2016;23 (6):1022-1033. doi:10.1016/j.cmet.2016.05.019.
- Ayala FJ, Campbell CA. 1974. Frequency-dependent selection. Annu. Rev. Ecol. Syst. 5, 115-138. (10.1146/annurev.es.05.110174.000555).
- Bailey M, Silver R. Sex differences in circadian timing systems: implications for disease. Front Neuroendocrinol. 2014;35 (1):111-139. doi:10.1016/j.yfrne.2013.11.003.
- Bandín C, Martinez-Nicolas A, Ordovás JM, et al. Differences in circadian rhythmicity in CLOCK 3111T/C genetic variants in moderate obese women as assessed by thermometry, actimetry and body position. Int J Obes (Lond). 2013;37 (8):1044-50. doi: 10.1038/ijo.2012.180.
- Barclay NL, Eley TC, Mill J, et al. Sleep quality and diurnal preference in a sample of young adults: associations with 5HTTLPR, PER3, and CLOCK 3111. Am J Med Genet B Neuropsychiatr Genet. 2011;156B (6):681-90. doi: 10.1002/ajmg.b.31210.
- Basso A, Del Bello G, Piacenza F, Giacconi R, Costarelli L, Malavolta M. Circadian rhythms of body temperature and locomotor activity in aging BALB/c mice: early and late life span predictors. Biogerontology. 2016;17 (4):703-714. doi:10.1007/s10522-016-9635-y.
- Beersma DGM and Daan S. Strong or weak phase resetting by light pulses in humans? J Biol Rhythms. 1993;8:340-347.
- Benedetti F, Dallaspezia S, Fulgosi MC, et al. Actimetric evidence that CLOCK 3111 T/C SNP influences sleep and activity patterns in patients affected by bipolar depression. Am J Med Genet B Neuropsychiatr Genet. 2007 Jul 5;144B (5):631-5.
- Bordyugov G, Abraham U, Granada A, et al. Tuning the phase of circadian entrainment. J R Soc Interface. 2015;12 (108):20150282. doi:10.1098/rsif.2015.0282.
- Buhr ED, Takahashi JS. Molecular components of the Mammalian circadian clock. Handb Exp Pharmacol. 2013; (217):3-27. doi:10.1007/978-3-642-25950-0_1.
- Challet E. The circadian regulation of food intake. Nat Rev Endocrinol. 2019;15 (7):393-405. doi:10.1038/s41574-019-0210-x.
- Chang AM, Buch AM, Bradstreet DS, Klements DJ, Duffy JF. Human diurnal preference and circadian rhythmicity are not associated with the CLOCK 3111C/T gene polymorphism. J Biol Rhythms. 2011;26 (3):276-279. doi:10.1177/0748730411402026.
- Chang AM, Duffy JF, Buxton OM, et al. Chronotype Genetic Variant in PER2 is Associated with Intrinsic Circadian Period in Humans. Sci Rep. 2019;9 (1):5350. doi:10.1038/s41598-019-41712-1.
- Chen JM, Huang CQ, Ai M, Kuang L. Circadian rhythm of TSH levels in subjects with Alzheimer’s disease (AD). Aging Clin Exp Res. 2013;25 (2):153-7. doi: 10.1007/s40520-013-0025-x.
- Czeisler CA, Duffy JF, Shanahan TL, et al. Stability, precision, and near-24-hour period of the human circadian pacemaker. Science. 1999;284 (5423):2177-2181. doi:10.1126/science.284.5423.2177.
- Daan S. Colin Pittendrigh, Jurgen Aschoff, and the natural entrainment of circadian systems. J Biol. Rhythms. 2000;15:195-207.
- Dibner C, Schibler U, Albrecht U. The mammalian circadian timing system: organization and coordination of central and peripheral clocks. Annu Rev Physiol. 2010;72: 517-49.
- Dijk DJ, Archer SN. PERIOD3, circadian phenotypes, and sleep homeostasis. Sleep Med Rev. 2010;14 (3):151-160. doi:10.1016/j.smrv.2009.07.002.
- Dijk DJ, Skeldon AC. Biological rhythms: Human sleep before the industrial era. Nature. 2015;527 (7577):176-177. doi:10.1038/527176a.
- Dodd AN, Salathia N, Hall A, et al. Plant circadian clocks increase photosynthesis, growth, survival, and competitive advantage. Science. 2005;309 (5734):630-633. doi:10.1126/science.1115581.
- Doi M, Ishida A, Miyake A, et al. Circadian regulation of intracellular G-protein signalling mediates intercellular synchrony and rhythmicity in the suprachiasmatic nucleus. Nat Commun. 2011;2:327. doi:10.1038/ncomms1316.
- Duarte LL, Menna-Barreto L, Miguel MA, et al. Chronotype ontogeny related to gender. Braz J Med Biol Res. 2014;47 (4):316-320. doi:10.1590/1414-431x20143001.
- Duffy JF, Rimmer DW, Czeisler CA. Association of intrinsic circadian period with morningness-eveningness, usual wake time, and circadian phase. Behav Neurosci. 2001;115 (4):895-899. doi:10.1037//0735-7044.115.4.895.
- Duffy JF, Cain SW, Chang AM, et al. Sex difference in the near-24-hour intrinsic period of the human circadian timing system. Proc Natl Acad Sci U S A. 2011;108 Suppl 3:15602-15608.
- Dupont Rocher S, Bessot N, Sesboüé B, Bulla J, Davenne D. Circadian Characteristics of Older Adults andAerobic Capacity. J Gerontol A Biol Sci Med Sci. 2016;71 (6):817-822. doi:10.1093/gerona/glv195.
- Eckel-Mahan K, Sassone-Corsi P. Metabolism and the Circadian Clock Converge. Physiol. Rev. 2013;93 (1):107-135.
- Edgar RS, Green EW, Zhao Y, et al. Peroxiredoxins are conserved markers of circadian rhythms. Nature. 2012;485:459-464.
- Emens JS, Yuhas K, Rough J, Kochar N, Peters D, Lewy AJ. Phase angle of entrainment in morning- and evening-types under naturalistic conditions. Chronobiol Int. 2009;26 (3):474-493. doi:10.1080/07420520902821077.
- Escobar C, Salgado-Delgado R, Gonzalez-Guerra E, et al. Circadian disruption leads to loss of homeostasis and disease. Sleep Disord. 2011;2011:964510. doi: 10.1155/2011/964510.
- Feeney KA, Hansen LL, Putker M, et al. Daily magnesium fluxes regulate cellular timekeeping and energy balance. Nature. 2016;532 (7599):375-379.
- Ferrie JE, Shipley MJ, Cappuccio FP, et al. A prospective study of change in sleep duration: associations with mortality in the Whitehall II cohort. Sleep. 2007;30 (12):1659-1666. doi:10.1093/sleep/30.12.1659.
- Fischer D, Lombardi DA, Marucci-Wellman H, Roenneberg T. Chronotypes in the US – Influence of age and sex. PLoS One. 2017;12 (6): e0178782. doi:10.1371/journal.pone.0178782.
- Froy O, Chapnik N, Miskin R. Long-lived alphaMUPA transgenic mice exhibit pronounced circadian rhythms. Am J Physiol Endocrinol Metab. 2006;291: E1017–E1024.
- Froy O, Miskin R. Effect of feeding regimens on circadian rhythms: implications for aging and longevity. Aging (Albany NY). 2010;2 (1):7-27. doi:10.18632/aging.100116.
- Garaulet M, Sánchez-Moreno C, Smith CE, Lee YC, Nicolás F, Ordovás JM. Ghrelin, sleep reduction and evening preference: relationships to CLOCK 3111 T/C SNP and weight loss. PLoS One. 2011;6 (2): e17435. Published 2011 Feb 28. doi:10.1371/journal.pone.0017435.
- Gouda M, Matsukawa M, Iijima H. Associations between eating habits and glycemic control and obesity in Japanese workers with type 2 diabetes mellitus. Diabetes Metab Syndr Obes. 2018; 11:647-658. doi: 10.2147/DMSO.S176749. eCollection 2018.
- Granada AE, Bordyugov G, Kramer A, Herzel H. Human chronotypes from a theoretical perspective. PLoS One. 2013;8 (3): e59464. doi:10.1371/journal.pone.0059464.
- Gubin D, Cornélissen G, Halberg F, et al. The human blood pressure chronome: a biological gauge of aging. In Vivo. 1997;11:485-494.
- Gubin D, Cornelissen G, Weinert D. et al. Circadian disruption and Vascular Variability Disorders (VVD) – mechanisms linking aging, disease state and Arctic shiftwork: applications for chronotherapy. World Heart Journal. 2013;5 (4): 285-306.
- Gubin DG, Weinert D, Bolotnova TV. Age-Dependent Changes of the Temporal Order – Causes and Treatment. Curr Aging Sci. 2016;9 (1):14-25.
- Gubin DG, Nelaeva AA, Uzhakova AE, et al. Disrupted circadian rhythms of body temperature, heart rate and fasting blood glucose in prediabetes and type 2 diabetes mellitus. Chronobiol Int. 2017;34 (8):1136-1148. doi: 10.1080/07420528.2017.1347670.
- Gubin DG, Malishevskaya TN, Astakhov YS, et al. Progressive retinal ganglion cell loss in primary open-angle glaucoma is associated with temperature circadian rhythm phase delay and compromised sleep. Chronobiol Int. 2019; 36 (4):564-577. doi: 10.1080/07420528.2019.1566741.
- Gubin D, Weinert D, Solovieva SV, et al. Melatonin attenuates light-at-night effects on systolic blood pressure and body temperature but does not affect diastolic blood pressure and heart rate circadian rhythms. Biol Rhythm Res. 2019. https://doi.org/10.1080/09291016.2018.1564586.
- Gutman R, Genzer Y, Chapnik N, et al. Long-lived mice exhibit 24 h locomotor circadian rhythms at young and old age. Exp Gerontol. 2011;46 (7):606-9. doi: 10.1016/j.exger.2011.02.015.
- Hasan S, Santhi N, Lazar AS, et al. Assessment of circadian rhythms in humans: comparison of real-time fibroblast reporter imaging with plasma melatonin. FASEB J. 2012;26 (6):2414-2423. doi:10.1096/fj.11-201699.
- Hasan S, van der Veen DR, Winsky-Sommerer R, et al. A human sleep homeostasis phenotype in mice expressing a primate-specific PER3 variable-number tandem-repeat coding-region polymorphism. FASEB J. 2014;28 (6):2441-2454. doi:10.1096/fj.13-240135.
- Herzog ED, Hermanstyne T, Smyllie NJ, Hastings MH. Regulating the Suprachiasmatic Nucleus (SCN) Circadian Clockwork: Interplay between Cell-Autonomous and Circuit-Level Mechanisms. Cold Spring Harb Perspect Biol. 2017;9 (1): a027706. doi:10.1101/cshperspect.a027706.
- Hida A, Kitamura S, Ohsawa Y, et al. In vitro circadian period is associated with circadian/sleep preference. Sci Rep. 2013;3:2074. doi:10.1038/srep02074.
- Hida A, Kitamura S, Katayose Y, et al. Screening of clock gene polymorphisms demonstrates association of a PER3 polymorphism with morningness-eveningness preference and circadian rhythm sleep disorder. Sci Rep. 2014;4:6309. doi:10.1038/srep06309.
- Hirota T, Okano T, Kokame K, et al. Glucose downregulates Per1 and Per2 mRNA levels and induces circadian gene expression in cultured Rat-1 fibroblasts. J Biol Chem. 2002 Nov 15;277 (46):44244-51. Epub 2002 Sep 3.
- Hood S, Amir S. The aging clock: circadian rhythms and later life. J Clin Invest. 2017;127 (2):437-446. doi:10.1172/ JCI90328.
- Horne JA, Ostberg OA. self-assessment questionnaire to determine morningness-eveningness in human circadian rhythms. Int J Chronobiol. 1976;4 (2):97-110.
- Hu Y, Shmygelska A, Tran D, Eriksson N, Tung JY, Hinds DA. GWAS of 89,283 individuals identifies genetic variants associated with self-reporting of being a morning person. Nat Commun. 2016;7:10448. doi:10.1038/ncomms10448.
- Hurd MW, Ralph MR. The significance of circadian organization for longevity in the golden hamster. J Biol Rhythms. 1998;13:430-436.
- Jones SE, van Hees VT, Mazzotti DR, et al. Genetic studies of accelerometer-based sleep measures yield new insights into human sleep behaviour. Nat Commun. 2019;10 (1):1585. doi:10.1038/s41467-019-09576-1.
- Jordan SD, Lamia KA. AMPK at the crossroads of circadian clocks and metabolism. Mol Cell Endocrinol. 2013;366 (2):163-169. doi:10.1016/j.mce.2012.06.017.
- Kalmbach DA, Schneider LD, Cheung J, et al. Genetic Basis of Chronotype in Humans: Insights From Three Landmark GWAS. Sleep. 2017;40 (2): zsw048. doi:10.1093/sleep/zsw048.
- Katzenberg D, Young T, Finn L, et al. A clock polymorphism associated with human diurnal preference. Sleep. 1998;21:569-576.
- Kolbe I, Oster H. Chronodisruption, Metabolic Homeostasis, and the Regulation of Inflammation in Adipose Tissues. Yale J Biol Med. 2019;92 (2):317-325.
- Knutson KL, von Schantz M. Associations between chronotype, morbidity and mortality in the UK Biobank cohort. Chronobiol Int. 2018;35 (8):1045-1053. doi:10.1080/07420528.2018.1454458.
- Kelly KP, McGuinness OP, Buchowski M, et al. Eating breakfast and avoiding late-evening snacking sustains lipid oxidation. PLoS Biol. 2020;18 (2): e3000622. doi:10.1371/journal.pbio.3000622.
- Lane JM, Vlasac I, Anderson SG, et al. Genome-wide association analysis identifies novel loci for chronotype in 100,420 individuals from the UK Biobank. Nat Commun. 2016;7:10889. doi:10.1038/ncomms10889.
- Li X, Ploner A, Wang Y, et al. Longitudinal trajectories, correlations and mortality associations of nine biological ages across 20-years follow-up. Elife. 2020;9: e51507. doi:10.7554/eLife.51507.
- Libert S, Bonkowski MS, Pointer K, Pletcher SD, Guarente L. Deviation of innate circadian period from 24 h reduces longevity in mice. Aging Cell. 2012;11 (5):794-800. doi:10.1111/j.1474-9726.2012.00846.x.
- Longo VD, Panda S. Fasting, Circadian Rhythms, and Time-Restricted Feeding in Healthy Lifespan. Cell Metab. 2016;23 (6):1048-1059. doi: 10.1016/j.cmet.2016.06.001.
- Lowrey PL, Takahashi JS. Genetics of Circadian Rhythms in Mammalian Model Organisms. Advances in Genetics. 2011; 74:175-230.
- Lucassen EA, Zhao X, Rother KI, et al. Evening chronotype is associated with changes in eating behavior, more sleep apnea, and increased stress hormones in short sleeping obese individuals. PLoS One. 2013;8 (3): e56519. doi:10.1371/journal.pone.0056519.
- Maloney SK, Meyer LC, Blache D, Fuller A. Energy intake and the circadian rhythm of core body temperature in sheep. Physiol Rep. 2013;1 (5): e00118. doi:10.1002/phy2.118.
- Mansour HA, Wood J, Chowdari KV, et al. Associations between period 3 gene polymorphisms and sleep- / chronotype-related variables in patients with late-life insomnia. Chronobiol Int. 2017;34 (5):624-631. doi:10.1080/07420528.2017.1287083.
- Martino TA, Oudit GY, Herzenberg AM, et al. Circadian rhythm disorganization produces profound cardiovascular and renal disease in hamsters. Am J Physiol Regul Integr Comp Physiol. 2008;294 (5): R1675–R1683. doi:10.1152/ajpregu.00829.2007.
- Maury E. Off the Clock: From Circadian Disruption to Metabolic Disease. Int J Mol Sci. 2019;20 (7):1597. doi:10.3390/ijms20071597.
- Meng Q-J, Logunova L, Maywood ES, et al. Setting clock speed in mammals: The CK1ε tau mutation in mice accelerates the circadian pacemaker by selectively destabilizing PERIOD proteins. Neuron. 2008;58:78-88. doi: 10.1016/j.neuron.2008.01.019.
- Merrow M, Spoelstra K, Roenneberg T. The circadian cycle: daily rhythms from behaviour to genes. EMBO Rep. 2005;6 (10):930-935. doi:10.1038/sj.embor.7400541.
- Millius A, Ueda HR. Systems Biology-Derived Discoveries of Intrinsic Clocks. Frontiers in Neurology. 2017;8:25.
- Moskalev A, Anisimov V, Aliper A, et al. A review of the biomedical innovations for healthy longevity. Aging (Albany NY). 2017;9 (1):7-25. Published 2017 Jan 29. doi:10.18632/aging.101163.
- Münch M, Wirz-Justice A, Brown SA, et al. The Role of Daylight for Humans: Gaps in Current Knowledge. Clocks & Sleep. 2020;2:61-85.
- Nelson W, Halberg F. Schedule-shifts, circadian rhythms and lifespan of freely-feeding and meal-fed mice. Physiol. Behav. 1986;38:781-788. doi: 10.1016/0031-9384 (86) 90043-0.
- Nohara K, Mallampalli V, Nemkov T, et al. Nobiletin fortifies mitochondrial respiration in skeletal muscle to promote healthy aging against metabolic challenge. Nat Commun. 2019;10 (1):3923. doi:10.1038/s41467-019-11926-y.
- Pagani L, Semenova EA, Moriggi E, et al. The physiological period length of the human circadian clock in vivo is directly proportional to period in human fibroblasts. PLoS One. 2010;5 (10): e13376. doi:10.1371/journal.pone. 0013376. Partch C, Green C, Takahashi J. Molecular Architecture of the Mammalian Circadian Clock. Trends in cell biology. 2014;24 (2):90-99.
- Patke A, Murphy PJ, Onat OE, et al. Mutation of the Human Circadian Clock Gene CRY1 in Familial Delayed Sleep Phase Disorder. Cell. 2017;169 (2):203-215.e13.doi:10.1016/j.cell.2017.03.027.
- Phillips AJK, Vidafar P, Burns AC, et al. High sensitivity and interindividual variability in the response of the human circadian system to evening light. Proc Natl Acad Sci U S A. 2019;116 (24):12019-12024.
- 100. Pittendrigh CS, Bruce VG. 1959. In Photoperiodism and related phenomena in plants and animals (ed. Withrow R. B., editor.), pp. 475-505 Washington, DC: American Association for the Advancement of Science.
- 101. Pittendrigh C, Minis DH. Circadian systems: longevity as a function of circadian resonance in Drosophila melanogaster. Proc. Natl. Acad. Sci. U.S.A. 1972;69:1537-1539. 10.1073/pnas.69.6.1537.
- 102. Pittendrigh CS, Kyner WT, Takamura T. 1991. The amplitude of circadian oscillations: temperature dependence, latitudinal clines, and the photoperiodic time measurement. J. Biol. Rhythms 6, 299-313. (10.1177/074873049100600402).
- 103. Poggiogalle E, Jamshed H, Peterson CM. Circadian regulation of glucose, lipid, and energy metabolism in humans. Metabolism. 2018;84:11-27. doi: 10.1016/j.metabol.2017.11.017.
- 104. Provencio I, Warthen DM. Melanopsin, the photopigment of intrinsically photosensitive retinal ganglion cells. Wiley Interdiscip Rev Membr Transp Signal. 2012;1 (2):228-23.
- 105. Ouyang Y, Andersson CR, Kondo T, Golden SS, Johnson CH. Resonating circadian clocks enhance fitness in cyanobacteria. Proc Natl Acad Sci U S A. 1998;95:8660-8664.
- 106. Ozburn AR, Purohit K, Parekh PK, et al. Functional Implications of the CLOCK 3111T/C Single-Nucleotide Polymorphism. Front Psychiatry. 2016;7:67. doi:10.3389/fpsyt.2016.00067.
- 107. Ralph MR, Menaker M. A mutation of the circadian system in golden hamsters. Science. 1988;241:1225-1227.
- 108. Ralph MR, Foster RG, Davis FC, Menaker M. Transplanted suprachiasmatic nucleus determines circadian period. Science. 1990;247:975-978.
- 109. Reppert SM, Weaver DR. Coordination of circadian timing in mammals. Nature. 2002;418:935-941 (doi:10.1038/nature00965).
- 110. Riddle M, Mezias E, Foley D, LeSauter J, Silver R. Differential localization of PER1 and PER2 in the brain master circadian clock. Eur J Neurosci. 2017;45 (11):1357-1367. doi:10.1111/ejn.13441.
- 111. Roenneberg T, Wirz-Justice A, Merrow M. Life between clocks: daily temporal patterns of human chronotypes. J Biol Rhythms. 2003; 18:80-90.
- 112. Samson DR, Crittenden AN, Mabulla IA, et al. Chronotype variation drives night-time sentinel-like behaviour in hunter-gatherers. Proc Biol Sci. 2017;284 (1858):20170967. doi:10.1098/rspb.2017.0967.
- 113. Takahashi JS. Transcriptional architecture of the mammalian circadian clock. Nat Rev Genet. 2017;18 (3):164-179.
- 114. Tamiya H, Ogawa S, Ouchi Y, Akishita M. Rigid Cooperation of Per1 and Per2 proteins. Scientific Reports. 2016;6: 32769.
- 115. Thaiss CA, Zeevi D, Levy M, et al. Transkingdom control of microbiota diurnal oscillations promotes metabolic homeostasis. Cell. 2014;159 (3):514-529. doi:10.1016/j. cell.2014.09.048.
- 116. Toh KL, Jones CR, He Y, Eide EJ, et al. An hPer2 phosphorylation site mutation in familial advanced sleep phase syndrome. Science. 2001;291 (5506):1040-3.
- 117. Turco M, Biscontin A, Corrias M, et al. Diurnal preference, mood and the response to morning light in relation to polymorphisms in the human clock gene PER3. Sci Rep. 2017;7 (1):6967. doi:10.1038/s41598-017-06769-w.
- 118. van den Berg R, Noordam R, Kooijman S, et al. Familial longevity is characterized by high circadian rhythmicity of serum cholesterol in healthy elderly individuals. Aging Cell. 2017;16 (2):237-243. doi:10.1111/acel.12547.
- 119. Viena TD, Gobin CM, Fins AI, et al. A PER3 Polymorphism Interacts with Sleep Duration to Influence Transient Mood States in Women. J Circadian Rhythms. 2016;14:3. doi:10.5334/jcr.135.
- 120. Vieira Musse GN, Moreira T, Ayumi Kimura M, et al. Skipping breakfast concomitant with late-night dinner eating is associated with worse outcomes following ST-segment elevation myocardial infarction. Eur J Prev Cardiol. 2019; Apr 17:2047487319839546. doi: 10.1177/2047487319839546.
- 121. Viola AU, Archer SN, James LM, et al. PER3 polymorphism predicts sleep structure and waking performance. Curr Biol. 2007;17 (7):613-618. doi:10.1016/j.cub.2007.01.073.
- 122. von Schantz M, Archer SN. Clocks, genes and sleep. J R Soc Med. 2003;96 (10):486-489. doi:10.1258/jrsm.96.10.486.
- 123. Weinert D, Gubin D. The Circadian Body Temperature Rhythm – Origin and Implications for Health and Wellbeing. Тюменский медицинский журнал. 2018;20 (2):6-14.
- 124. Weljie AM, Meerlo P, Goel N, et al. Oxalic acid and diacylglycerol 36:3 are cross-species markers of sleep debt. Proc Natl Acad Sci USA. 2015;112 (8):2569-2574.
- 125. Wilking M, Ndiaye M, Mukhtar H, Ahmad N. Circadian rhythm connections to oxidative stress: implications for human health. Antioxid Redox Signal. 2013;19 (2):192-208. doi:10.1089/ars.2012.4889.
- 126. Wong PM, Hasler BP, Kamarck TW, Muldoon MF, Manuck SB. Social jetlag, chronotype, and cardiometabolic risk. J Clin Endocrinol Metab. 2015;100 (12):4612-4620.
- 127. Wright KP Jr, Gronfier C, Duffy JF, Czeisler CA. Intrinsic period and light intensity determine the phase relationship between melatonin and sleep in humans. J Biol Rhythms. 2005;20 (2):168-177. doi:10.1177/0748730404274265.
- 128. Wyse CA, Coogan AN, Selman C, Hazlerigg DG, Speakman JR. Association between mammalian lifespan and circadian free-running period: the circadian resonance hypothesis revisited. Biol Lett. 2010;6 (5):696-698. doi:10.1098/rsbl.2010.0152.
- 129. Yamaguchi Y, Suzuki T, Mizoro Y, et al. Mice genetically deficient in vasopressin V1a and V1b receptors are resistant to jet lag. Science. 2013;342:85-90.
- 130. Yetish G, Kaplan H, Gurven M, et al. Natural sleep and its seasonal variations in three pre-industrial societies. Curr Biol. 2015;25 (21):2862-2868. doi:10.1016/j.cub.2015.09.046.
- 131. Yin J, Jin X, Shan Z, et al. Relationship of Sleep Duration With All-Cause Mortality and Cardiovascular Events: A Systematic Review and Dose-Response Meta-Analysis of Prospective Cohort Studies. J Am Heart Assoc. 2017;6 (9): e005947. doi:10.1161/JAHA.117.005947.
- 132. Zare R, Choobineh A, Keshavarzi S. Association of Amplitude and Stability of Circadian Rhythm, Sleep Quality, and Occupational Stress with Sickness Absence among a Gas Company Employees-A Cross Sectional Study from Iran. Saf Health Work. 2017;8 (3):276-281. doi:10.1016/j.shaw.2016.09.007.
- 133. Zhao J, Warman GR, Cheeseman JF. Clock gene expression and locomotor activity predict death in the last days of life in Drosophila melanogaster. Sci Rep. 2018;8 (1):11923. doi:10.1038/s41598-018-30323-x.
- 134. Zhang B, Wing YK. Sex differences in insomnia: a metaanalysis. Sleep. 2006;29 (1):85-93. doi:10.1093/sleep/29.1.85.
- 135. Zhavoronkov A, Mamoshina P, Vanhaelen Q, Scheibye-Knudsen M, Moskalev A, Aliper A. Artificial intelligence for aging and longevity research: recent advances and perspectives. Ageing Research Reviews. 2019;49:49-66. doi: 10.1016/j.arr.2018.11.003.
- 136. Zhdanova IV, Masuda K, Quasarano-Kourkoulis C, Rosene DL, Killiany RJ, Wang S. Aging of intrinsic circadian rhythms and sleep in a diurnal nonhuman primate, Macaca mulatta. J Biol Rhythms. 2011;26 (2):149-159. doi:10.1177/0748730410395849.
- 137. Zylka MJ, Shearman LP, Weaver DR, Reppert SM. Three period homologs in mammals: differential light responses in the suprachiasmatic circadian clock and oscillating transcripts outside of brain. Neuron. 1998; 20 (6):1103-10.


