Токсичность новых фунгицидов для эукариотических микроорганизмов, изолированных из кишечника продовольственно значимого опылителя овощных культур Bombus terrestris L.
Автор: Сыромятников М.Ю., Савинкова О.В., Попов В.Н.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 4 (86), 2020 года.
Бесплатный доступ
В настоящее время в мире наблюдается тенденция снижения численности опылителей, что уже является вопросом продовольственной безопасности. Шмели Bombus terrestris L. являются экономически значимыми опылителями овощей и других сельскохозяйственных культур. В последнее время было предположено, что резкому снижению численности насекомых-опылителей способствует синергетическое действие пестицидов и болезней, которые поражают опылителей. В данной работе нами было исследовано влияние новых биоразлагаемых фунгицидов на эукариотические микроорганизмы Penicillium commune и Rhodotorula mucilaginosa, изолированные из кишечника личинок Bombus terrestris L. В ходе проведенных исследований было показано, что исследованные новые фунгициды способны ингибировать рост как мицелиальных эукариотических микроорганизмов, так и дрожжевых эукариотических микроорганизмов. Среди исследованных веществ наиболее эффективным оказался фунгицид 2. Исследованные вещества избирательно токсичны только для эукариотических микроорганизмов и не оказывают выраженного токсического эффекта на животных, в частности насекомых и могут быть использованы для лечения инфекций насекомых-опылителей, вызванных грибковыми микроорганизмами. Было отмечено, что новые фунгициды более токсичны для дрожжей, чем для мицелиальных грибов.
Новые фунгициды, эукариотические микроорганизмы, ингибирование роста, токсичность
Короткий адрес: https://sciup.org/140257302
IDR: 140257302 | УДК: 632.952 | DOI: 10.20914/2310-1202-2020-4-54-59
Текст научной статьи Токсичность новых фунгицидов для эукариотических микроорганизмов, изолированных из кишечника продовольственно значимого опылителя овощных культур Bombus terrestris L.
В настоящее время в мире наблюдается тенденция снижения численности опылителей [1–3]. Вымирание шмелей и пчел уже является вопросом продовольственной безопасности [4] поскольку опыление насекомыми является обязательным условием получения урожая энтомофильных культур потребляемых в пищу человеком. Одной из возможных причин этому является токсическое действие пестицидов [5–7].
This is an open access article distributed under the terms of the Creative Commons Attribution 4.0 International License
В последнее время было предположено, что резкому снижению численности насекомых-опылителей способствует синергетическое действие пестицидов и болезней, которые поражают опылителей [13–15]. Пестициды снижают общий иммунитет насекомых, что приводит к их повышенной восприимчивости к патогенам. Среди патогенов важнейших опылителей выделяют эукариотические микроорганизмы (патогены грибковой природы). Актуальным в настоящее время является поиск фунгицидов, которые способны эффективно уничтожать различные грибковые патогены, но при этом не причинять вреда полезным насекомым, таким как пчелы и шмели. В данной работе нами было исследовано влияние новых биоразлагаемых фунгицидов на эукариотические микроорганизмы, изолированные из личинок шмелей Bombus terrestris L . Кроме того, было оценена токсичность данных соединений на шмелей.
Материалы и методы
В качестве объектов исследования было выбрано 4 вновь синтезированных фунгицида, разработанных в НИИ Органической химии им. Зелинского (г. Москва, Россия):
-
• фунгицид 1-7-Hexyl-1,4-dimethyl-2,3,5,6-tetraoxabicyclo[2.2.1] heptanes;
-
• фунгицид 2-7-(1-Adamantyl)-1,4-dimethyl-2,3,5,6-tetraoxabicyclo[2.2.1] heptanes;
-
• фунгицид 3-7-Isopentyl-1,4-dimethyl-2,3,5,6-tetraoxabicyclo[2.2.1] heptanes;
-
• фунгицид 4-3-(4-Methoxyphenyl)-6,7 a-dime-thyltetrahydro-3Н,4Н-3,6-epoxy[1,2] dioxolo[3,4-b] pyran.
Самцы и личинки шмелей B. terrestris L. были использованы для исследования влияния фунгицидов.
Посев содержимого кишечника личинок шмелей осуществляли на среду Сабуро: панкреатический гидролизат рыбной муки – 10 г/л; панкреатический гидролизат казеина – 10 г/л; дрожжевой экстракт – 2 г/л; NаН 2 РО 4 – 2 г/л; Д-глюкоза – 40 г/л; агар микробиологический – 10 г/л; рН 6,0. Для подавления роста посторонней микрофлоры в среду перед посевом вносили 0,1% раствора хлорамфеникола.
Для испытания на фунгицидную активность наводили растворы веществ в ДМСО. Полученные растворы добавили в разогретую до 50 ºС среду Сабуро. Приготовленные таким образом среды разлили по 15 мл в чашки Петри с внутренним диаметром 9 см.
Поверхность среды инокулировали кусочками мицелия трехдневной культуры грибов либо 100 мкл культуры дрожжей. Чашки Петри помещали в термостат при 25 ºС и держали в течение 72 часов. Затем измеряли диаметр колоний мицелиального микроорганизма либо осуществляли подсчет выросших колоний дрожжевого микроорганизма.
ДНК выделяли из выросших на среде Сабуро колоний с использованием набора Проба-ГС (ДНК-технология, Россия). ДНК выделяли в соответствии с протоколом, приложенным к набору.
Полимеразная цепная реакция проводилась с использованием Taq-полимеразы на приборе Mastercycler personal (Eppendorf, Германия). Смешивали в пробирке 0,25 мл следующие компоненты: 5Х реакционная смесь (Евроген, Россия) – 5 мкл; 5 мкМ прямой праймер – 1 мкл; 5 мкМ обратный праймер – 1 мкл; ДНК – 2 мкл; деионизованная вода – до 25 мкл. Использовали следующий температурный цикл: 94 °С 4 мин, 35 циклов: 94 °С 30 сек 54 °С 30 сек, 72 °С 45 сек, конечная элонгация 72 °С 10 мин. В качестве праймеров использовали следующие: прямой IТS1TCCGTAGGTGAACCTGCGG, обратный IТS4TCCTCCGCTTATTGATATGC [16]. Визуализацию продуктов ПЦР проводили с помощью электрофореза в 2% агарозном геле.
Извлечение из агарозного геля и очистку ампликона проводили с помощью коммерчески доступного набора Cleanup Standard (Евроген, Россия). Секвенирование очищенных продуктов ПЦР проводилось на генетическом анализаторе Applied Biosystems 3730 с использованием BigDye Terminator v3.1 Cycle Sequencing Kit. В качестве праймеров для секвенирования использовались те же, что и для амплификации целевого фрагмента (IТS1 и IТS4).
Для исследования токсичности новых фунгицидов для насекомых исследуемые вещества добавляли в 500 мкл ДМСО, после чего полученный раствор разбавляли в 10 мл дистилированной воды. В качестве контрольного раствора использовали раствор дистиллированной воды (10 мл) в который предварительно добавляли 500 мкл ДМСО. Шмелей аккуратно с помощью пинцета в течение 1 сек помещали в пробирку с раствором. После чего их держали в течение 2 часов в специализированном садке с фильтровальной бумагой на дне садка для того чтобы они обсохли. Далее шмелей помещали в цилиндрические садки (диаметр – 14 см, высота – 7 см) с сетчатым дном и крышкой, по 10 шмелей в каждом садке. Инвертированный сахарный сироп (60%) использовали в качестве корма. Шмели содержались при температуре 27–28,5 °С и при влажности воздуха 55–68%.
Для измерения полетной активности шмели (3 шт.) помещались в прозрачную камеру: длина 25 см, ширина 15 см, высота 20 см. Для освещения использовали лампу дневного света. Далее каждые 5 сек регистрировали количество шмелей, находящихся в состоянии полёта. Измерение проводили в течение 20 мин. После чего высчитывали среднее количество шмелей, которые находились в состоянии полета в течение этого времени.
Результаты и обсуждение
Первоначально содержимое кишечника личинок шмеля высевали на универсальную питательную среду для грибов. По истечении 3–5 суток отбирали отдельные колонии, выделяли из них ДНК и осуществляли амплификацию маркерного для грибов региона (IТS1 и IТS2), после чего амплифицированные области секвенировали. Полученные нуклеотидные последовательности сопоставляли с международной системой GenBank. В результате были идентифицированы следующие эукариотические микроорганизмы: Lachancea thermotolerans, Naganishia adeliensis, Penicillium commune, Rhodotorula mucilaginosa. При этом при анализе 10 образцов личинок шмелей изолированных из различных колоний, было выявлено, что наиболее часто встречаемые в кишечнике личинок шмелей эукариотические микроорганизмы были P. commune (80% образцов) и R. mucilaginosa (70% образцов). Поскольку эти эукариотические микроорганизмы наиболее часто встречались в кишечнике личинок шмелей и в норме в кишечнике личинок не должно содержаться каких-либо эукариотических микроорганизмов (как мицелиальных грибов, так и дрожжей), дальнейшие исследования новых фунгицидов проводились с данными микроорганизмами.
Исследуемые новые фунгициды добавляли в питательную среду в концентрациях 0,005; 0,02; 0,05 и 0,1 г/л и затем вносили на чашки Петри. На рисунке 1 изображено влияние различных концентраций фунгицида 1 на диаметр мицелиального гриба P. commune
При внесении фунгицида № 1 в концентрации 0,005 г./л игибирующего действия на рост мицелиального микроорганизма не было (по отношению к контрольному образцу, в котором препарат отсутствует). При увеличении концентрации фунгицида, наблюдалось слабое ингибирование роста гриба. Максимальное ингибирование роста гриба (на 25%) наблюдалось в концентрации фунгицида в питательной среде 0,1 г/л.
На рисунке 2 изображено влияние различных концентраций фунгицида 2 на диаметр мицелиального гриба. В концентрации 0,1 г/л данный фунгицид ингибировал рост P. commune на 48%.
На рисунке 3 изображено влияние различных концентраций фунгицида 3 на диаметр мицелиального гриба. Небольшое ингибирование роста мицелиального гриба (на 18%) наблюдалось уже при концентрации фунгицида 0,005 г./л. Однако затем, с повышением концентрации фунгицида, дальнейшего подавления роста гриба не наблюдалось.
При исследовании влияния фунгицида 4 на рост гриба P. commune было выявлен, что данный фунгицид достоверно снижает скорость роста гриба на 19% только в концентрации 0,05 и 0,1 г/л (рисунок 4).
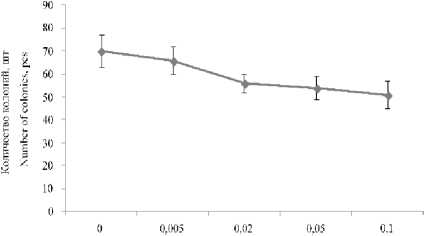
Далее нами оценивалось ингибирующее действие новых фунгицидов на количество выросших колоний дрожжевого микроорганизма R. mucilaginosa . Так, фунгицид 1 в концентрации 0,1 г/л сокращал количество выросших колоний на 17% (рисунок 5).
Фунгицид 2 показал высокую активность против дрожжей R. mucilaginosa . Уже при концентрации фунгицида 0,005 г./л количество колоний дрожжей сократилось в два раза, а при концентрации 0,05% фунгицид полностью подавил рост колоний дрожжей (рисунок 6).
Слабый ингибирующий эффект на рост дрожжей R. mucilaginosa оказал фунгицид 3. В максимальной концентрации фунгицида количество колоний дрожжей уменьшилось только на 24% (рисунок 7).
Фунгицид 4 показал высокую активность против дрожжей R. mucilaginosa в максимальной концентрации. В концентрации фунгицида 0,1 г/л количество колоний дрожжей сократилось в 16,4 раза (рисунок 8).
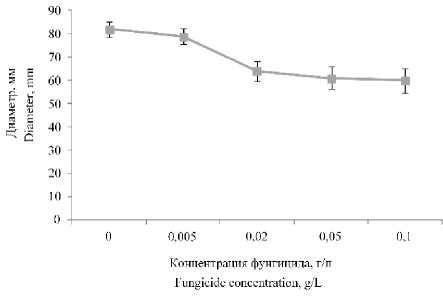
Рисунок 1. Влияние фунгицида 1 на рост гриба P. commune
Figure 1. Effect of fungicide 1 on the growth of the fungus P. commune
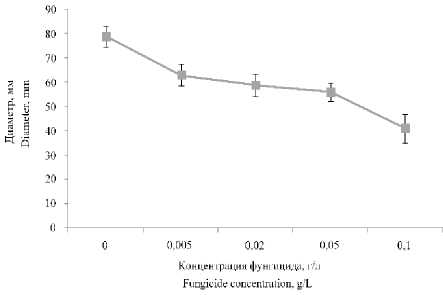
Рисунок 2. Влияние фунгицида 2 на рост гриба P. commune
Figure 2. Effect of fungicide 2 on the growth of the fungus P. commune
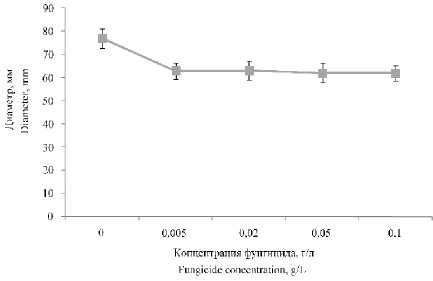
Рисунок 3. Влияние фунгицида 3 на рост гриба P. commune
Figure 3. Effect of fungicide 3 on the growth of the fungus P. commune
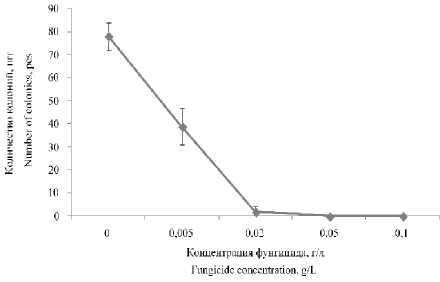
Рисунок 6. Влияние фунгицида 2 на количество колоний дрожжей R. mucilaginosa
Figure 6. Effect of fungicide 2 on the number of colonies of yeast R. mucilaginosa
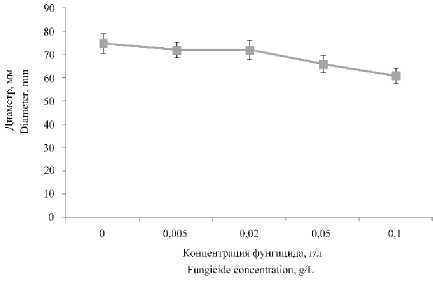
Рисунок 4. Влияние фунгицида 4 на рост гриба P. commune
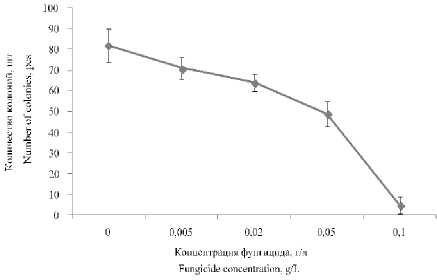
Рисунок 7. Влияние фунгицида 3 на количество колоний дрожжей R. mucilaginosa
Figure 7. Effect of fungicide 3 on the number of colonies of yeast R. mucilaginosa
Figure 4. Effect of fungicide 4 on the growth of the fungus P. commune
Копиейграция фунгицида, г/л Fungicide concentration, g/L
Рисунок 5. Влияние фунгицида 1 на количество колоний дрожжей R. mucilaginosa
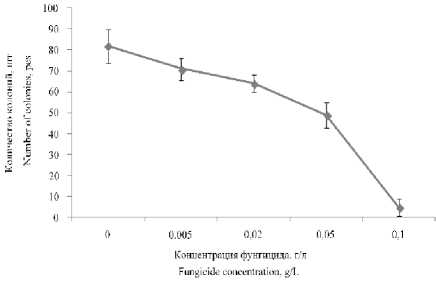
Рисунок 8. Влияние фунгицида 4 на количество колоний дрожжей R. mucilaginosa
Figure 8. Effect of fungicide 4 on the number of colonies of yeast R. mucilaginosa
Figure 5. Effect of fungicide 1 on the number of colonies of yeast R. mucilaginosa
На следующем этапе оценивалось влияние новых фунгицидов на полётную активность самцов шмелей. В ходе эксперимента было выявлено, что новые фунгициды даже в максимально возможной концентрации (0,1 г/л) не снижали полётную активность насекомых. В то время как классический фунгицид дифеноконазол снизил полётную активность B. terrestris L. в 1,43 раза. Гибель шмелей не вызвал ни один фунгицид.
Таким образом, нами было показано, что исследованные вещества (см. материалы и методы) имеют фунгицидную активность как по отношению к мицелиальным эукариотическим микроорганизмам, так и по отношении дрожжевым эукариотическим микроорганизмам. По отношению к дрожжевым микроорганизмам исследованные вещества оказывали более выраженную фунгицидную активность. Среди исследованных веществ наиболее эффективным оказался фунгицид 2 (7-(1-Adamantyl)-1,4-dimethyl-2,3,5,6-tetraoxabicyclo[2.2.1]heptanes). Это вещество наиболее сильно подавляло рост P. commune (на 48%) и полностью подавляло рост дрожжевого микроорганизма (R. mucilaginosa).
Примечательно, что исследованные новые фунгициды не снижали полетную активность B. terrestris . Это говорит о том, что данные вещества избирательно токсичны только для грибов и не оказывают выраженного токсического эффекта на животных, в частности насекомых. Таким образом, они могут быть потенциальными эффективными препаратами для лечения инфекций насекомых-опылителей, вызванных грибковыми микроорганизмами.
Заключение
В ходе проведенных исследований было показано, что исследованные новые фунгициды способны ингибировать рост как мицелиальных эукариотических микроорганизмов, так и дрожжевых эукариотических микроорганизмов.
Среди исследованных веществ наиболее эффективным оказался фунгицид 2 (7-(1-Adamantyl)-1,4-dimethyl-2,3,5,6-tetraoxabicyclo[2.2.1] heptanes). При этом исследованные вещества избирательно токсичны только для грибов и не оказывают выраженного токсического эффекта на животных, в частности насекомых и могут быть использованы для лечения инфекций насекомых-опылителей, вызванных грибковыми микроорганизмами. Таким образом, применение новых биоразлагаемых фунгицидов для лечения болезней шмелей, вызванных эукариотическими микроорганизмами, позволит получить экологически чистую овощную продукцию и, в целом, повысит продовольственную безопасность населения.
Работа выполнена в рамках нацпроекта «Наука» (проект FZGW-2020-0001, уникальный номер реестра государственных заданий 075001X39782002) и при поддержке гранта Президента РФ для молодых кандидатов наук (проект MK-3173.2019.11)
Список литературы Токсичность новых фунгицидов для эукариотических микроорганизмов, изолированных из кишечника продовольственно значимого опылителя овощных культур Bombus terrestris L.
- Potts S.G., Biesmeijer J.C., Kremen C., Neumann P. et al. Global pollinator declines: Trends, impacts and drivers//Trends Ecol. Evol. 2010. V. 25(6). P. 345-353. doi: 10.1016/j.tree.2010.01.007
- Rhodes C.J. Pollinator decline - an ecological calamity in the making? // Sci. Prog. 2018. V. 101(2). P. 121-160. doi: 10.3184/003685018X15202512854527
- Thomann M., Imbert E., Devaux C., Cheptou P.O. Flowering plants under global pollinator decline // Trends Plant Sci. 2013. V. 18(7). P. 353-359. doi: 10.1016/j.tplants.2013.04.002
- Klein A.M., Vaissiere B.E., Cane J.H., Steffan-Dewenter I. et al. Importance of pollinators in changing landscapes for world crops//Proc. Roy. Soc. B. 2007. V. 274(1608). P. 303-313. doi: 10.1098/rspb.2006.3721
- Lu C., Warchol K.M., Callahan R.A. Sub-lethal exposure to neonicotinoids impaired honey bees winterization before proceeding to colony collapse disorder // Bulletin of Insectology. 2014. V. 67(1). P. 125-130.
- Simon-Delso N, San Martin G, Bruneau E, Minsart L-A. et al. Honeybee colony disorder in crop areas: the role of pesticides and viruses //PLoS ONE. 2014. V. 9(7). el03073. doi: 10.1371/journal.pone.0103073
- Bryden J, Gill R.J., Mitton R.A., Raine N.E. et al. Chronic sublethal stress causes bee colony failure // Ecol Lett. 2013. V. 16(12). P. 1463-1469. doi: 10.1111/ele. 12188
- Fisher A., Coleman C., Hoffmann C., Fritz B. et al. The Synergistic Effects of Almond Protection Fungicides on Honey Bee (Hymenoptera: Apidae) Forager Survival //J. Econ. Entomol. 2017. V. 110(3). P. 802-808. doi: 10.1093/jee/tox031
- Raimets R., Karise R., Mand M., Kaart T. et al. Synergistic interactions between a variety of insecticides and an ergosterol biosynthesis inhibitor fungicide in dietary exposures of bumble bees (Bombus terrestris L.) // Pest Manag. Sci. 2018. V. 74(3). P. 541-546. doi: 10.1002/ps.4756
- Zhu Y.C., Yao J.X., Adamczyk J., Luttrell R. Feeding toxicity and impact of imidacloprid formulation and mixtures with six representative pesticides at residue concentrations on honey bee physiology (Apis mellifera) // PLoS ONE. 2017. V. 12(6). eOl78421. doi: 10.1371/joumal.pone.0178421
- Sgolastra F., Medrzycki P., Bortolotti L., Renzi M.T. et al. Synergistic mortality between a neonicotinoid insecticide and an ergosterol-biosynthesis-inhibiting fungicide in three bee species // Pest Manag. Sci. 2017. V. 73(6). P. 1236-1243. doi: 10.1002/ps.4449
- Degrandi-Hoffman G., Chen Y., Dejong W.E., Chambers M.L. et al. Effects of Oral Exposure to Fungicides on Honey Bee Nutrition and Virus Levels//J Econ Entomol. 2015. V. 108(6). P. 2518-2528. doi: 10.1093/jee/tov251
- Lopez J.H., Krainer S., Engert A., Schuehly W. et al. Sublethal pesticide doses negatively affect survival and the cellular responses in American foulbrood-infected honeybee larvae // Sci. ReP. 2017. V. 7. P. 40853. doi: 10.1038/srep40853
- Grassl J., Holt S., Cremen N., Peso M. et al. Synergistic effects of pathogen and pesticide exposure on honey bee (Apis mellifera) survival and immunity//J. fnvertebr. Pathol. 2018. V. 159. P. 78-86. doi: 10.1016/j,jip.2018.10.005
- Aufauvre J., Biron D.G., Vidau C., Fontbonne R. et al. Parasite-insecticide interactions: A case study of Nosema ceranae and fipronil synergy on honeybee // Sci. ReP. 2012. V. 2. P. 326. doi: 10.1038/srep00326
- White T.J., Bruns T., Lee S., Taylor J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics // In: PCR Protocols: A Guide to Methods and Applications. New York: Academic Press. 1990. V. 18. P. 315-322.


