Топографическое распределение и возможная роль про- и антивоспалительных субпопуляций макрофагов в разных типах атеросклеротических поражений
Автор: Шишкина Валентина Сергеевна, Ильинская Ольга Петровна, Челомбитько Мария Александровна, Васильева Тамара Викторовна, Федоров Артем Валерьевич, Тарарак Эдуард Михайлович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.22, 2014 года.
Бесплатный доступ
Проведен анализ распределения и возможной роли субпопуляций макрофагов (Мф) про- (М1) и антивоспалительного (М2) фенотипа в развитии атеросклеротического поражения. Морфогистологическую оценку типов поражений проводили согласно классификации ВОЗ. В каждом образце с помощью иммуногистохимического окрашивания выявляли Мф М1 (MCP1+ - клетки) и М2 (CD206+ и CD163+ - клетки). Показали, что во всех типах поражений присутствуют обе субпопуляции Мф, численное соотношение между которыми может существенно меняться в разных областях и типах бляшек. Субпопуляция Мф М1 численно преобладает в областях инфильтрации клетками воспаления и активного поглощения липидов, а М2 - в зонах репарации межклеточного матрикса и ангиогенеза. Проведена количественная оценка распределения обеих субпопуляций в клинически наиболее значимых областях поражений, предрасположенных к разрыву - фиброзных покрышках (адлюминальные фиброзные слои) и плечах. Достоверной разницы по содержанию Мф М1 и М2 в плечах выявлено не было. В фиброзных покрышках атером, фиброатером и осложненных поражений по сравнению с фиброзными и фиброкальцинозными обнаружена достоверно более интенсивная инфильтрация Мф обеих субпопуляций. Сделано заключение, что баланс сил между про- и антивоспалительной субпопуляциями Мф существенно влияет на процессы формирования атеросклеротического поражения и развитие осложнений при атеросклерозе.
Атеросклероз, сонные артерии, про- и антивоспалительные субпопуляции макрофагов
Короткий адрес: https://sciup.org/143177005
IDR: 143177005
Текст научной статьи Топографическое распределение и возможная роль про- и антивоспалительных субпопуляций макрофагов в разных типах атеросклеротических поражений
Введение. В последние годы сформировалось представление о том, что макрофаги (Мф) в зависимости от получаемых ими сигналов могут изменять свой фенотип, проявляя как про-, так и антивоспалительную активность. In vitro провоспа-лительные Мф (М1) развиваются в ответ на стимуляцию IFNγ, TNFα и LPS, что повышает секрецию ими различных провоспалительных цитокинов, в основном IL-12 и MCP1 и ведет к снижению ими секреции IL-10. Деятельность таких клеток обеспечивает Tх1-зависимый иммунный ответ и она направлена, в основном, на стимуляцию процесса воспаления [1, 2, 3]. Напротив, антивоспалитель-ные Мф (М2) развиваются в ответ на действие IL-4, IL-13, IL-10, TGF-b, стимулируя их к высокой продукции антивоспалительных цитокинов, в основном IL-10 и угнетению секреции IL-12, тем самым способствуя подавлению воспалительной реакции и восстановлению ткани [1, 2, 3]. Кроме того, in vivo Мф М2 стимулируют ангиогенез и усиливают перестройку и репарацию ткани путём синтеза факторов, стимулирующих пролиферацию гладкомышечных клеток и фибробластов, а также синтез ими соединительнотканного матрикса [4].
Известно, что морфологическая основа атеросклеротических поражений, развивающихся в интиме артерий человека - это результат сложного взаимодействия различных типов клеток, как пришедших из кровеносного русла (моноцитов (Мц), Мф, лимфоцитов и др.), так и стромального компонента сосудистой стенки (эндотелия, гладкомышечных клеток и др.). Проникновение в субэндотелиальное пространство Мц периферической крови, их последующая макрофагальная дифференцировка и активация в интиме – это ключевые моменты развития атеросклеротических бляшек (АСБ) [5]. По данным последних исследований в АСБ присутствуют как про-, так и антивоспалительные Мф. Эти супопуляции Мф были выявлены в различных эндартерэктоми-рованных образцах артерий человека, а также в бляшках аорт атеросклеротических моделей мышей [3, 6, 7, 8, 9]. Однако, роль этих субпопуляций в процессе формирования, прогрессии и дестабилизации атеросклеротического поражения до сих пор остается мало изученной.
Цель исследования – изучение распределения про- и антивоспалительных субпопуляций Мф М1 и М2 в различных областях и типах атеросклеротических поражений внутренних сонных артерий человека и их возможной роли в формировании и дестабилизации АСБ.
Материалы и методы исследования. Материалом исследования служили пораженные атеросклерозом участки внутренних сонных артерий человека, изъятые в ходе операций каротидной эндартерэктомии в отделении неотложной сосудистой хирургии института скорой помощи им. Н.В.Склифосовского. Исследовано 16 таких образцов от 10 мужчин (средний возраст 59 ± 6 года) и 6 женщин (средний возраст 73 ± 5 года) с верифицированным гемодинамически значимым каротидным стенозом (степень стеноза 69 ± 14%). Биоптаты, состоявшие из интимы и медии, содержали 27 АСБ удлиненной формы с участками поражений разных типов от липидного пятна/ полосы до осложненного поражения, которые разрезали поперек на фрагменты шириной 5 – 7 мм (n = 66) и замораживали в парах жидкого азота. Для морфологического и иммуногистохимического анализа готовили криосрезы, часть из которых после фиксации в смеси метанол: хлороформ: ледяная уксусная кислота (6:3:1) окрашивали для общеморфологической оценки типов поражений гематоксилин-эозином, по Ван-Гизону и масляным красным О. Типы атеросклеротических поражений классифицировали по Г. Стари [10].
Другую часть криосрезов использовали для иммуногистохимического выявления различных антигенов с помощью непрямого пероксидазного метода с использованием авидин-биотинового комплекса. Для идентификации типов клеток использовали мышиные моноклональные антитела в разведении 1:100 (DAKO, Дания) против специфических клеточных маркеров: CD14 (Мц), HAM56 (Мф человека), vWF (эндотелиальные клетки), CD3 (Т-лимфоциты – Т-Лц) и SM-aktin (гладкомышечные клетки). Субпопуляции Мф выявляли согласно принятой на сегодняшний день схеме, используя мышиные моноклональные антитела в разведении 1:100 (BD, Франция): против маркера провоспали-тельных Мф – MCP-1 (моноцит-хемотаксический фактор 1) и против двух маркеров антивоспа-лительных Мф – СD206 (маннозный рецептор) и CD163 (гемоглобиновый – гаптоглобиновый рецептор – маркер регуляторных М2) [6, 11]. Криосрезы атеросклеротических поражений после инкубации с первыми антителами фиксировали 10% забуференным формалином (Биовитрум, Россия), обрабатывали 3% перекисью водорода для ингибирования эндогенной пероксидазы и инкубировали с биотинилированными козьими поликлональными антителами к мышиным IgG в разведении 1:200 (Vector, США). Последующее выявление мест связывания антител с антигенами проводили с помощью коньюгата авидина D с пероксидазой хрена (Vector, США), а визуализацию – с помощью стандартного набора на основе диаминобензидина (Vector, США).
Измерение и подсчет различных морфометрических параметров проводили на цифровых микрофотоснимках гистологических срезов в программе ImageJ. В первой части исследования анализировали топографию распределения Мф М1 и М2 на срезах в неизмененной интиме сосуда и при различной степени прогрессии атеросклеротического поражения. Во второй части работы была проведена количественная оценка распределения Т-Лц, Мц, Мф М1 и М2 в участках АСБ наиболее предрасположенных к разрыву и тромбозу – в покрышке и плечах. При этом проводили подсчет числа клеток каждого типа, приходящихся на общую площадь участка среза в 1мм2.
Рис. 1. Поперечные гистологические срезы внутренней сонной артерии. А – фрагмент неизмененной интимы, окраска по Ван-Гизону, ядра окрашены гематоксилином; Б – фрагмент липидной полосы, липиды окрашены масляным красным О, ядра – гематоксилином; рамки ограничивают области, представленные далее (В, Г, соответственно). В, Г – распределение Мц и Мф М1 и М2 на последовательных срезах тех же фрагментов неизмененной интимы и начального атеросклеротического поражения – липидного пятна. Иммунопероксидазный (АВС-kit) метод окрашивания с помощью моноклональных антител против специфических клеточных маркеров: В-а, Г-а – CD14 (Мц); В-б, Г-б – HAM56 (Мф человека); В-в, Г-в – MCP1 (Мф М1); В-г, Г-г – CD206 (Мф М2). Клетки, содержащие перечисленные антигены, имеют коричневое окрашивание. Буквенные обозначения: И – интима, М – медия, Пс – просвет сосуда. А, Б, В, Г. Ув. 200.
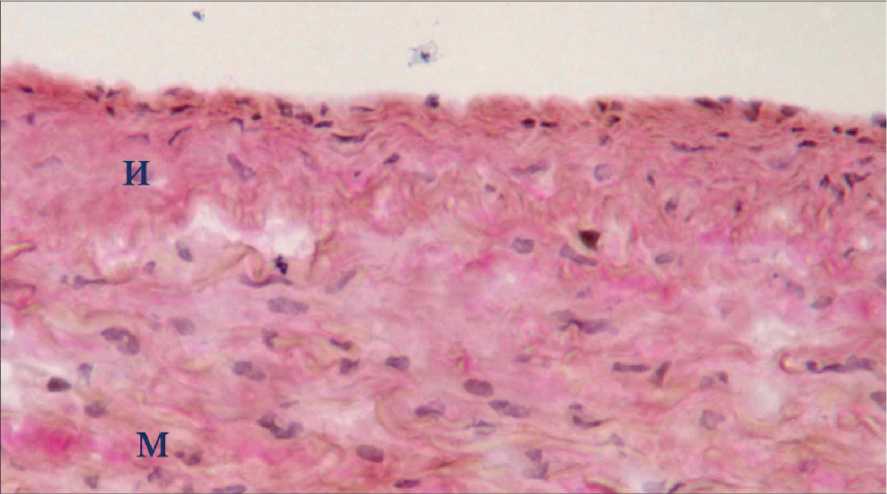
Рис. 1А.
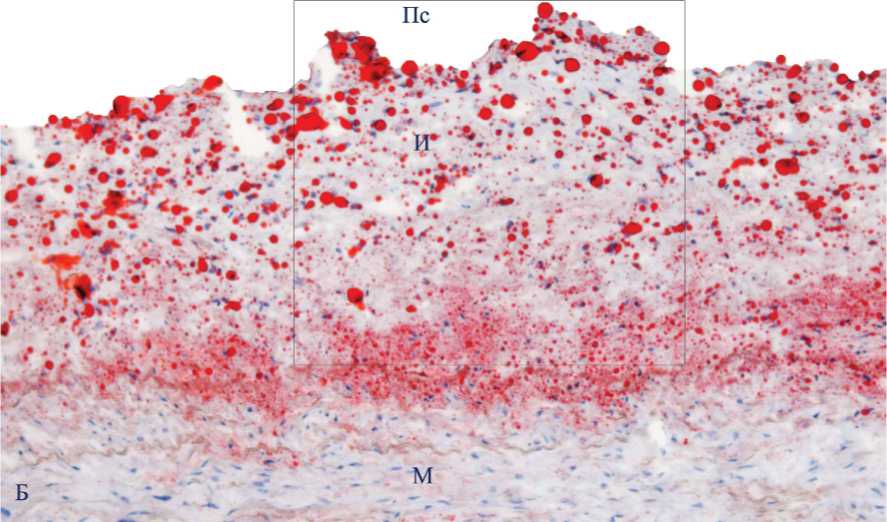
Рис. 1Б.
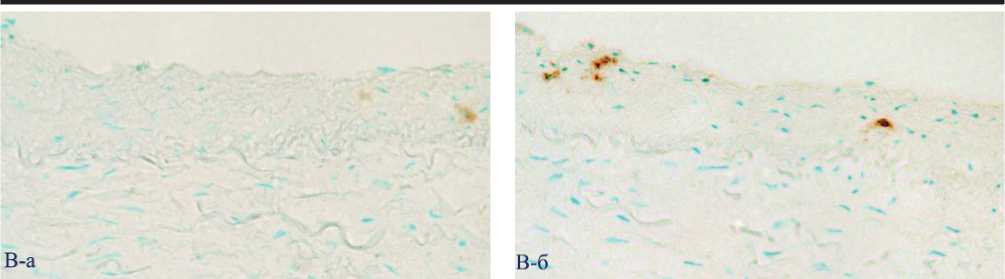
Рис. 1В-а.
Рис. 1В-б.

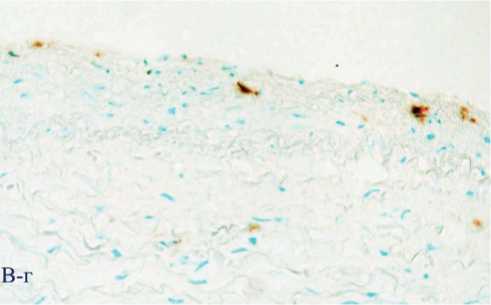
Рис. 1В-г.
Рис. 1В-в.
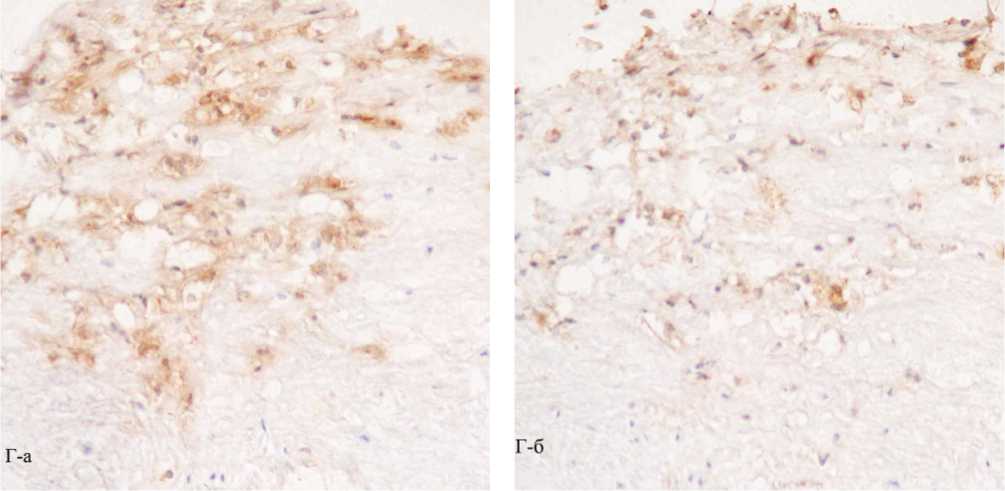
Рис. 1Г-а. Рис. 1Г-б.
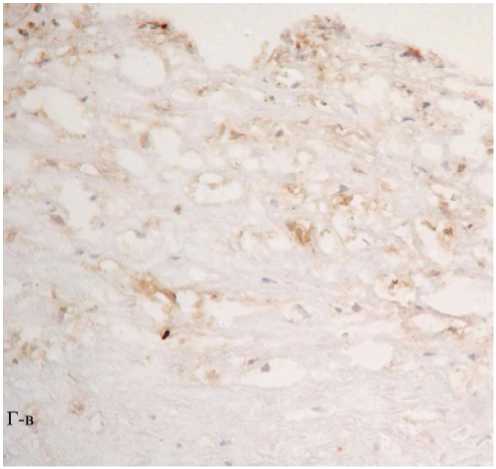
Рис. 1Г-в.
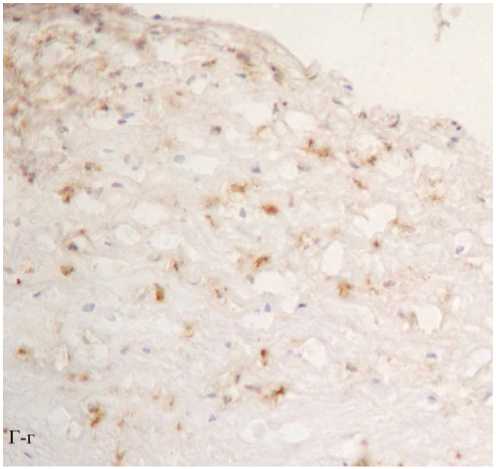
Рис. 1Г-г.
Статистическую обработку полученных цифровых значений проводили с помощью программы STATISTICA 7.0, используя двусторонний непараметрический критерий Манна-Уитни при статистической достоверности р <0,05.
Результаты исследования и их обсуждение. Гистологический анализ операционного материала позволил выявить следующие типы атеросклеротических поражений внутренних сонных артерий, которые были в дальнейшем подвергнуты иммуногистохимическому исследованию: липидные пятна/полоски – 4, атеромы – 3, фиброатеромы – 13, фиброзные поражения – 22, фиброкальцинозные – 7, осложненные – 13. Всего было исследовано 66 отдельных фрагмента сосудов, в том числе 4 участка неизмененной интимы.
После иммуногистохимического окрашивания срезов сонных артерий был проведен сравнительный анализ топографического распределения про- и антивоспалительных Мф в нормальной интиме и указанных выше типах атеросклеротических поражений. В неизмененной интиме были обнаружены лишь единичные Мц/ Мф, представленные CD14+, HAM56+ и CD206+-клетками, соответственно (рис. 1А, и В (а – г)). В липидных пятнах/полосах интима была значительно инфильтрирована Мц и Мф (рис. 1Б и Г (а - г)), имеющими как про- (MCP1+-клетки), так и антивоспалительный иммунофенотип (CD206+ и CD163+-клетки). При этом достоверного различия по количеству М1 и М2 Мф в липидной полосе выявлено не было (табл . 1).
Полученные нами данные согласуются с результатами ранее опубликованных работ. Показано, что в неизмененной артериальной стенке всегда присутствуют резидентные Мф, выполняющие гомеостатические функции, а в случае воспаления первыми реагирующие на изменившиеся условия. Проникновение в интиму модифицированных липопротеидов (модЛП) стимулирует местную воспалительную реакцию с интенсивной инфильтрацией Т-Лц и Мц и является начальной стадией развития поражения (липидное пятно/полоса) [5]. При этом в сосудах происходит поляризация активации Т-Лц и Мф по про- или антивоспалительному пути [12]. Нами было обнаружено, что в липидном пятне/полосе присутствуют Мф М1 и М2, что указывает на существенную роль обеих субпопуляций в развитии этой стадии поражения. Этот факт подтверждают экспериментальные данные других исследователей, показавших в условиях in vitro, что Мф М1 необходимы для активного фагоцитоза модЛП и стимуляции воспалительной реакции [3], а Мф М2 – для клиренса апоптотических клеток и секреции цитокинов и ферментов, участвующих в реорганизации матрикса и стимулирующих фиброз [12, 13]. В нашем исследовании в липидном пятне/полосе CD206+ и CD163+ Мф М2 были представлены в равных долях. А суммарное количество Мф М2 в липидном пятне/полосе по сравнению с Мф М1 (MCP1+- клетки) было в 2,3 раза больше (табл. 1). Следует отметить, что эти данные отличаются от тех, что получены в модели атеросклероза у мышей, у которых ранние липидные бляшки в стенке аорты были инфильтрированы только Мф М2 [8].
Таблица 1.
Распределение субпопуляций Мф М1 и М2 в липидных пятнах/полосках (M ± m).
|
Макрофаги |
М1 |
М2 |
P |
||
|
Маркер |
(1) MCP1 |
(2) CD206 |
(3) CD163 |
p1-2 |
p1-3 |
|
Количество маркированных клеток/мм2 ткани |
|||||
|
Липидное пят-но/полоса |
117,8 ± 30,5 |
155,3 ± 39,4 |
115,6 ± 28,1 |
р> 0,05 |
р> 0,05 |
Примечание: MCP1 – моноцитарный хемотаксический белок (маркер М1 Мф); CD206 – маннозный рецептор (маркер М2 Мф) и CD163 – рецептор к гемоглобину – гаптоглобину (маркер М2 регуляторных Мф).
Анализ результатов иммуногистохимического исследования последовательных срезов атеросклеротических поражений и их сопоставление с данными, полученными при окраске на липиды, показал, что про- и антивоспалительные Мф существенно отличаются по содержанию липидных включений и локализации внутри поражений. Подавляющее большинство пенистых клеток с липидными включениями несли маркер Мф НАМ56 (рис. 2. А, Б). При этом Мф М1 (MCP1+ – клетки) содержали значительные включения липидов (рис. 2 А, В) и были расположены в основном в типичных местах скопления пенистых клеток: в плечах бляшек, внутри липидных ядер, над ними или по их периферии, в то время как Мф М2 (CD206+– и CD163+– клетки) содержали незначительные липидные включения (рис. 2 А, Г и Д) и находились в наиболее стабильных областях поражений: фиброзных покрышках и/или в участках с высоким содержанием межклеточного матрикса. Можно отметить, что большинство Мф М1 (MCP1+ – клеток) солокализовались с HAM56+Мф (рис. 2 Б, В), а обе функциональные подгруппы Мф М2 (CD206+– и CD163+– клетки) – как с HAM56+ Мф (рис. 2 Б, Г, Д), так и с CD14+ Мц. Описанные результаты согласуются с данными, полученными группой исследователей ранее. Так была продемонстрирована солокализация MCP1+– и пенистых клеток [6], а также описано, что Мф M2 (CD68+CD206+– клетки) располагаются дальше от липидного ядра, чем Мф М1 (CD68+CD206-– клетки), и более слабо поглощают липиды [11].
Различия в локализации М1 и М2 субпопуляций Мф можно объяснить специфическими особенностями их функциональной активности, которая исследована в экспериментах in vitro [12]. В частности показано, что Мф М1 активно фагоцитирует окисленные ЛНП и секретирует ряд металлопротеаз (MMP1, 3 и 9) и провоспалитель-ных цитокинов (IL-1β, 6, 8, 12 и TNF-α), вследствие чего, по мнению ряда авторов, могут участвовать в формировании атеро-некротического ядра [2,
-
14, 15]. Эти факты вполне согласуются с тем, что в нашем исследовании Мф М1 мы обнаружили в основном вокруг атеронекротического ядра и других местах скопления липидов. Что касается Мф М2, то для них характерно участие в клиренсе апоптотирующих клеток, а также синтез антивоспалительных (IL-4, 10, 13; CCL18, 22, 24) и других факторов, в частности TGF-β, стимулирующих гладкомышечные клетки к пролиферации и синтезу внеклеточного матрикса, что способствует образованию фиброзной ткани [12]. Эти наблюдения могут объяснять факт расположения Мф М2 в основном в областях, обедненных липидами и в фиброзной ткани.
Следует отметить, что при исследовании следующих за липидной полосой прогрессирующих стадий развития АСБ, так называемых выраженных поражений – атером, фиброатером, фиброкальцинозных и осложненных поражений [10], наряду с уже описанной картиной распределения Мф были обнаружены специфические зоны локализации субпопуляции Мф М2. Значительные скопления Мф М2, как CD206+, так и CD163+, были выявлены в местах расположения новообразованных сосудов. Это можно объяснить участием Мф М2 в процессах ангиогенеза вследствие способности этих клеток синтезировать VEGF и эндотелин [16]. Кроме того, в участках с расположением геморрагий мы обнаружили Мф М2 преимущественно регуляторного типа (CD163+ – клетки), а в покрышках над пристеночными тромбами – CD206+ – клетки. Известно, что появление геморрагий в АСБ ведет к разрушению внеклеточного матрикса и дестабилизации поражения, поэтому присутствие скоплений CD163+ – клеток в этих областях можно объяснить наряду с их участием в утилизации гемоглобина, также секрецией атеропротекторного IL-10, который является участником негативной регуляции воспалительного процесса [16]. Выявленный нами факт преимущественного скопления CD206+ - клеток в покрышках поражений с пристеночными тромба- ми можно объяснить синтезом ими факторов (IL-4, 10 и 13), активность которых направлена, прежде всего, на ингибирование активации эндотелия и стимуляцию гладкомышечных клеток к синтезу матрикса [12].
В выраженных атеросклеротических поражениях была проведена количественная оценка распределения Т-Лц, Мц и субпопуляций Мф М1 и М2 в наиболее значимых, т.е. предрасположенных к разрыву, тромбозу, возникновению геморрагий участках АСБ – фиброзной покрышке и плечах, левом и правом. Мы показали, что как в плечах, так и в покрышках всех типов АСБ присутствовали обе субпопуляции Мф, т.е. М1 (MCP1+) и М2 (CD206+ и CD163+). В участках плеч наиболее сильная ин- фильтрация М1 и М2 Мф была выявлена в фибро-атеромах и осложненных поражениях, однако и в плечах остальных типов поражений содержание обеих субпопуляций было высоким и достоверной разницы между разными типами поражений по М1 и М2 Мф выявлено не было. Полученные результаты свидетельствуют о высокой воспалительной активности таких участков для всех типов поражений. Что касается фиброзных покрышек атером, фиброатером и осложненных поражений, то они были инфильтрированы достоверно большим количеством Т-Лц, Мц и Мф по сравнению с фиброзной тканью поверхностных (адлюминальных) слоев фиброзных и фиброкальцинозных бляшек, что соответствует ранее опубликованным данным
Рис. 2. Распределение субпопуляций Мф на последовательных поперечных гистологических срезах атеромы внутренней сонной артерии, сопоставление с локализацией липидов. А – окраска на липиды масляным красным О, ядра окрашены гематоксилином; рамка ограничивает область, представленную далее (Б – Д, соответственно). Б – Д – распределение Мф М1 и М2 на последовательных поперечных срезах того же фрагмента АСБ. Иммунопероксидазный (АВС-kit) метод окрашивания с помощью моноклональных антител против специфических клеточных маркеров: Б – HAM56 (Мф человека), В – MCP1 (Мф М1), Г – CD206 (Мф М2) и Д – CD163 (Мф М2 регуляторного типа). Клетки, содержащие перечисленные антигены, имеют коричневое окрашивание. Буквенные обозначения: Пк – пенистые клетки. А, Б, В, Г Ув. 200.
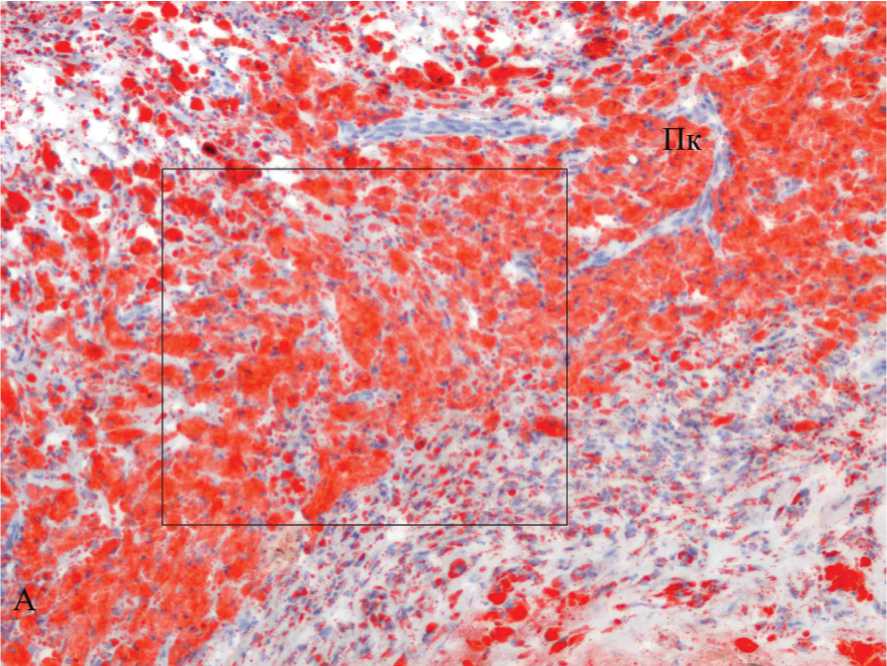
Рис. 2А.
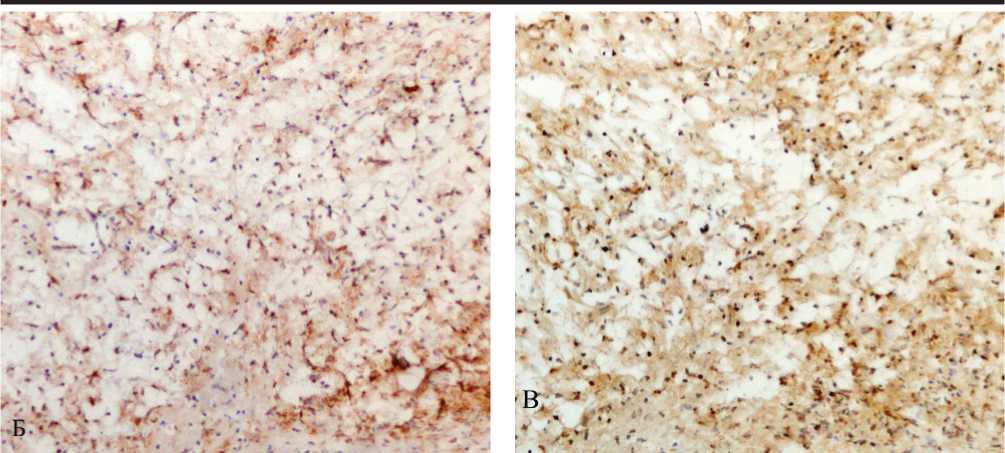
Рис. 2Б.
Рис. 2В.
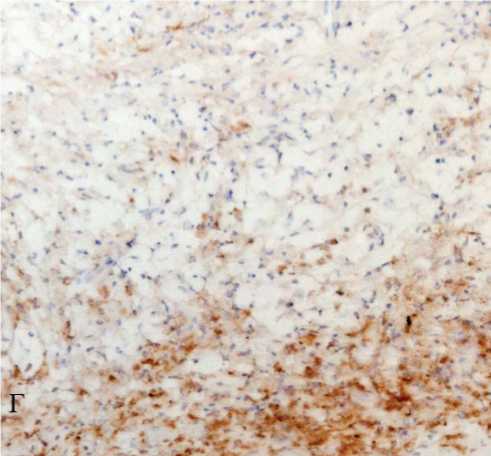
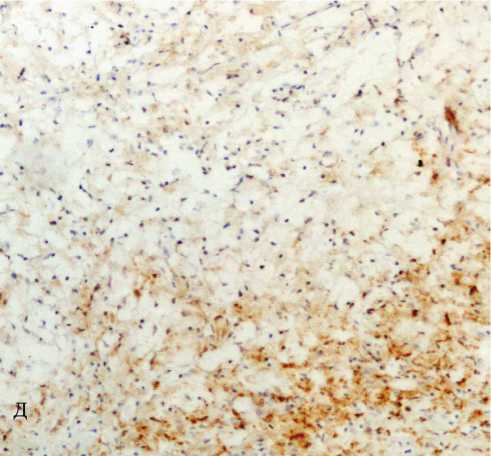
Рис. 2Г.
Рис. 2Д.
-
[5 ]. Однако в литературе на сегодняшний день отсутствуют сведения о распределении субпопуляций Мф М1 и М2 в адлюминальных областях разных типов поражений. Результаты подсчетов содержания Мф М1 и М2 в этих областях разных типов поражений представлены в таблице 1. Достоверно самое низкое содержание Мф М1 обнаружено в адлюминальных фиброзных слоях фиброкальцинозных поражений. В аналогичных структурах фиброзных поражений содержание таких клеток также было низким и достоверно отличалось от содержания их в покрышках фи-броатером и осложненных поражениий – в 2,5 и
-
2 раза, соответственно. Содержание же Мф М1 в фиброзных покрышках атером было высоким, однако достоверных различий с остальными типами поражений кроме фиброкальцинозных выявлено не было.
Исследование распределения функциональных подтипов антивоспалительных Мф М2 (CD206+ и CD163+ - клеток) в адлюминальных фиброзных слоях АСБ разных типов выявило ряд специфических особенностей (табл. 2). Так, в фиброзных и фиброкальцинозных поражениях содержание Мф CD206+ в этих областях было достоверно ниже по сравнению с покрышками фиброатером
Таблица 2.
Распределение субпопуляций Мф М1 и М2 в покрышках (адлюминальных фиброзных слоях) атеросклеротических поражений разных типов (M ± m).
|
Макрофаги |
Маркер |
Типы поражений по Stary (2000), (n = 58) |
р< 0,05 |
||||
|
1. Атерома (n=3) |
2. Фиброа-тер. (n=13) |
3. Фиброзн. (n=22) |
4. Фибро-кальц. (n=7) |
5. Осложнен. (n=13) |
|||
|
Кол-во маркированных клеток/мм2 ткани |
|||||||
|
М1 |
MCP1 |
194,1 ± 116,4 |
163,9 ±38,0 |
66,9 ± 13,1 |
27,4 ± 4,2 |
131,3 ± 28,0 |
3 – 2, 5 4 – 1, 2, 3, 5 |
|
М2 |
CD206 |
141,4 ± 56,8 |
218,6 ± 27,7 |
82,1 ± 9,9 |
76,8 ± 24,0 |
201,1 ± 26,0 |
3 – 2 ,5 4 – 2, 5 |
|
CD163 |
195,2 ± 93,4 |
204,5 ± 37,9 |
56,1 ± 7,6 |
110,9 ± 49,5 |
182,2 ± 32,9 |
3 – 1, 2, 5 4 – 2 |
|
Примечание: MCP1 – моноцитарный хемотаксический белок (маркер М1 Мф), CD206 – маннозный рецептор (маркер М2 Мф) и CD163 – рецептор к гемоглобину – гаптоглобину (маркер М2 регуляторных Мф).
(в 2,7 и 2,9 раз, соответственно) и осложненных поражений (в 2,5 и 2,6 раза, соответственно). Достоверно более низкое количество антивоспа-лительных CD163+- Мф было также выявлено в адлюминальных слоях фиброзных поражений по сравнению с покрышками атером, фиброатером и осложненных поражений, соответственно в 3,5, 3,6 и 3,3 раза. Средние значения содержания этих клеток были характерны для аналогичных областей фиброкальцинозных поражений, где их число в 1,8 раза было ниже, чем в покрышках фиброатером. Фиброзные и фиброкальцинозные поражения не отличались по содержанию в их поверхностных фиброзных слоях М2 Мф (CD206+ – клеток), однако различались по количеству Мф регуляторного типа CD163+ - М2, а также прово-спалительных MCP1+- М1. Так, в адлюминальных областях фиброзных поражений по сравнению с фиброкальцинозными наблюдалось более низкое содержание CD163+-Мф и более высокое – провоспалительных MCP1+- клеток. Эти различия могут отражать более высокую степень провоспалительной активности в адлюминальных слоях фиброзных бляшек по сравнению с фибро-кальцинозными. Интенсивная инфильтрация как про- так и антивоспалительными Мф покрышек нестабильных поражений – фиброатером и осложненных поражений, по сравнению со стабильными, т.е. фиброзными и фиброкальцинозными, свидетельствует об идущих в них более активных воспалительных процессах, которые способствуют дестабилизации АСБ вследствие деградации внеклеточного матрикса, ведущей к возможному истончению и разрыву фиброзных покрышек – наиболее опасному в клиническом отношении осложнению при атеросклерозе.
Выводы:
-
1) Во всех типах атеросклеротических поражений обнаружены Мф как про- (MCP1+), так и ан-тивоспалительного фенотипа (CD206+ и CD163+);
-
2) на ранней стадии развития поражения (липидное пятно/полоса) Мф М1 и М2 присутствуют в равном соотношении, что указывает на существенную роль обеих субпопуляций в инициации процесса атерогенеза в интиме;
-
3) в выраженных атеросклеротических поражениях (атерома, фиброатерома, осложненное поражение) в областях, богатых липидными включениями или инфильтрированных клетками воспаления, локализуются в основном провоспа-лительного типа Мф М1 (MCP1+ – клетки);
-
4) в стабильных поражениях (фиброзных и фиброкальцинозных), а также в фиброзных областях атером и фиброатером преимущественно локализуются Мф антивоспалительного фенотипа М2 (CD206+ и CD163+ – клетки);
-
5) достоверной разницы по содержанию Мф М1 и М2 в плечах АСБ разных типов выявлено не было;
-
6) обнаружена достоверно более интенсивная инфильтрация Мф обеих субпопуляций адлюминальных фиброзных слоев (фиброзных покрышек) в атеромах, фиброатеромах и осложненных поражениях по сравнению с фиброзными и фиброкальцинозными.
Полученные в работе результаты позволяют сделать заключение, что баланс сил между про- и антивоспалительной субпопуляциями Мф М1 и М2 существенно влияет на процессы формирования атеросклеротического поражения и развитие осложнений при атеросклерозе.
Работа выполнена при финансовой поддержке Правительства г. Москвы, Госконтракт №
8/3-280н-10 от 27 мая 2010 г. и гранта РФФИ № 13-04-00463 А от 2013 г.
Список литературы Топографическое распределение и возможная роль про- и антивоспалительных субпопуляций макрофагов в разных типах атеросклеротических поражений
- Geissmann F., Manz M.G., et al. Development of monocytes, macrophages and dendritic cells//Science. 2010. № 327. P. 656-661.
- Ley K., Miller Y.I., Hedrick C.C. Monocyte and macrophage dynamics during atherogenesis//Arterioscler. Thromb. Vasc. Biol. 2011. № 31. P. 1506-1516.
- Wolfs I.M., Donners M.M., de Winther M.P. Differentiation factors and cytokines in the atherosclerotic plaque micro-environment as a trigger for macrophage polarization//Thromb Haemost. 2011. Т. 106, № 5. P. 763-771.
- Wynn T.A., Fibrotic disease and the T(H)1/T(H)2 paradigm//Nat. Rev. Immunol. 2004. № 4. P. 583-594.
- Libby P., Lichtman A.H., Hansson G.K. Immune effector mechanisms implicated in atherosclerosis: from mice to humans//Immunity. 2013. Т. 38, № 6. P. 1092-1104.
- Bouhlel M.A., Derudas B., et al. PARg activation primes human monocytes into alternative M2 macrophages with anti-inflammatory properties//Cell Metabolism. 2007. № 6. P. 137-143.
- Wilson H.M., Macrophages heterogeneity in atherosclerosis -implications for therapy//J Cell Mol Med. 2010. Т. 14, № 8. P. 2055-2065.
- Khallou-Laschet J., Varthaman A., et al. Macrophage plasticity in experimental atherosclerosis//PLoS ONE. 2010. № 5.
- Shaikh S., Brittenden J. et al. Macrophage subtypes in symptomatic carotid artery and femoral artery plaques//Eur. J. Vasc. Endovasc. Surg. 2012. № 44. P. 491-497.
- Stary H.C. Natural history and histological classification of atherosclerotic lesions: an update//Arterioscler. Thromb. Vasc. Biol. 2000. T 20, № 5. P. 1177-1178.
- Chinetti-Gbaguidi G., Baron M., et al. Human atherosclerotic plaque alternative macrophages display cholesterol handling but phagocytosis because of distinct activities of the PARy and LXRa pathways//Circ Res. 2011. Т. 108, № 8. P. 985-995.
- Butcher M.J., Galkina E.V. Phenotypic and functional heterogeneity of macrophages and dendritic cell subsets in the healthy and atherosclerosis-prone aorta//Frontiers in Physiology. 2012. Т. 3, № 44. P. 1-13
- Thorp E., Subramanian M., Tabas I. The role of macrophages and dendritic cells in the clearance of apoptotic cells in advanced atherosclerosis//Eur. J. Immunol. 2011. Т. 41, № 9. P. 2515-2518.
- Moore K.J., Tabas I. Macrophages in the pathogenesis of atherosclerosis//Cell. 2011. № 145. P. 341-355.
- Murray P.J., Wynn T.A. Protective and pathogenic functions of macrophage subsets//Nat. Rev. Immunol. 2011. № 11. P. 723-737.
- Mantovani A., Garlanda C., Locati M. Macrophage diversity and polarization in atherosclerosis: a question of balance//Arterioscler. Thromb. Vasc. Biol. 2009. № 29. P. 1419 -1423.


