Торможение прогрессирования хронической болезни почек при гиперурикемии
Автор: Муркамилов Илхом Торобекович, Сабиров Ибрагим Самижонович, Райимжанов Зафарбек Рахимович, Юсупова Зулхумор, Юсупова Турсуной, Закиров О. Т., Юсупов Фуркат Абдулахатович
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 1 т.10, 2024 года.
Бесплатный доступ
Конечным продуктом катаболизма пуриновых соединений у человека является мочевая кислота (МК), являющаяся слабой органической кислотой, свыше 98% которой ионизируется в мононатриевый урат. МК выделяется почками, примерно 99% реабсорбируется в проксимальных канальцах почек. Около 20% МК выводится через кишечник, где она разрушается микрофлорой до диоксида углерода и воды. Референсные значения МК в плазме крови составляют 6,5-7 мг/дл (≥420 мкмоль/л) у мужчин и 6-6,5 мг/дл (≥360 мкмоль/л) - у женщин. Содержание МК в пределах 360-400 мкмоль/л или 6-6,8 мг/дл, повышает риск кристаллизации в физиологических условиях, причем независимо от пола. Уровень МК более 7,0 мг/дл связан с повышенным риском развития подагры или нефролитиаза. Гиперурикемия может возникать вследствие повышенной продукции и/или снижения почечной экскреции МК. В общей популяции распространенность гиперурикемии высокая, и она ассоциируется прогрессированием хронической болезни почек (ХБП). В настоящее время с целью коррекции гиперурикемии применяются аллопуринол и фебуксостат. Применение аллопуринола следует начинать с низкой дозы (50-100 мг/день) и постепенно титровать до достижения целевого уровня МК в крови. При необходимости дозу аллопуринола увеличивают на 100 мг каждые 2-4 недели до достижения целевого сывороточного уровня МК. Согласно рекомендациям EULAR (The European Alliance of Associations for Rheumatology / European League Against Rheumatism) по лечению подагры, если целевой уровень МК не может быть достигнут с помощью адекватной дозы аллопуринола, то следует заменить его на фебуксостат либо комбинацию фебуксостата с аллопуринолом. Фебуксостат также показан при непереносимости аллопуринола. Фебуксостат в дозах 80 и 120 мг/день оказался более эффективным препаратом, чем аллопуринол в дозе 300 мг/день. При ХБП с С2 или С3а стадиях, а также у пожилых лиц не требуется корректировать дозу фебуксостата. Вероятность достижения целевого уровня МК в крови при снижении скорости клубочковой фильтрации ниже 60 мл/мин выше у фебуксостата. Если у пациента нет декомпенсированного сердечно-сосудистого заболевания, то пациента можно перевести на фебуксостат, начиная с дозы 40 мг/день, и постепенно титровать, особенно в случае ХБП.
Мочевая кислота, гиперурикемия, факторы риска, распространенность, дисфункция почек, ксантиноксидаза, аллопуринол, фебуксостат
Короткий адрес: https://sciup.org/14129304
IDR: 14129304 | УДК: 616-06, | DOI: 10.33619/2414-2948/98/26
Текст обзорной статьи Торможение прогрессирования хронической болезни почек при гиперурикемии
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616-06;616-08
Конечными продуктами катаболизма пуриновых соединений у человека являются мочевая кислота (МК) и гипоксантин. В почках, печени и тонком кишечнике происходит активный катаболизм пуриновых соединений. Биосинтез МК осуществляется в селезенке, затем она поступает в системный кровоток, где около 4% МК связывается с белком плазмы. С биохимической точки зрения МК является слабой органической кислотой, свыше 98% которой ионизируется в мононатриевый урат, т.е. соли МК [1].
В физиологических условиях МК выделяется из организма преимущественно почками, при этом примерно 99% реабсорбируется в проксимальных канальцах почек. Небольшой процент МК удаляется через кишечник, где она разрушается микрофлорой до диоксида углерода и воды [2].
Вследствие стойкого нарушения обмена пуриновых соединений развивается гиперурикемия, которая по современным представлениям делится на бессимптомную и симптомную. Оптимальный уровень МК в плазме крови составляет 6,5–7 мг/дл (≥420 мкмоль/л) у мужчин и 6–6,5 мг/дл (≥360 мкмоль/л) — у женщин [1].
Бессимптомная гиперурикемия — это повышение уровня МК выше физиологической нормы при отсутствии симптомов и/или признаков осаждения кристаллов уратов. По последним данным, бессимптомная гиперурикемия значимо увеличивает риск развития рено-кардио-метаболических заболеваний. Нужно помнить, что содержание МК в пределах 360– 400 мкмоль/л или 6–6,8 мг/дл, значимо повышает риск кристаллизации в физиологических условиях, причем независимо от пола [3]. Гиперурикемия — повышение уровня мочевой кислоты в сыворотке крови более 6 мг/дл (360 мкмоль/л).
Таблица 1 ФАКТОРЫ, СПОСОБСТВУЮЩИЕ РАЗВИТИЮ ГИПЕРУРИКЕМИИ
|
Факторы |
Увеличение биосинтеза пуринов |
|
|
Генетические факторы |
Синдром Леша-Нихана (снижение активности фосфорибозилтрансферазы) |
гипоксантин-гуанин- |
|
Высокая активность фосфорибозилтрансферазы |
||
|
Болезнь Гирке (дефицит глюкозо-6-фосфатазы) |
||
|
Семейная аномалия пуринового обмена, детерминированная несколькими генами |
||
|
Синдром Келли-Сигмиллера |
||
|
Приобретенные |
Ожирение |
|
|
заболевания |
ВИЧ-инфекция |
|
|
Эпилепсия |
||
|
Синдром распада опухоли |
||
|
Гипотиреоз |
||
|
Гиперпаратиреоз |
||
|
Лимфо- и миелопролиферативные заболевания |
||
|
Полицитемия |
||
|
Вторичные эритроцитозы |
||
|
Гемолитическая анемия |
||
|
Гемоглобинопатии |
||
|
Псориаз |
||
|
Системная склеродермия |
||
|
Инфекционный мононуклеоз |
||
|
Системная красная волчанка |
||
|
Факторы |
Увеличение биосинтеза пуринов |
|
Пищевые |
Рыбные продукты (сельдь, масляная рыба, тунец) |
|
агенты |
Мясные продукты (печень, почки, желудок, тушенка) |
|
Сыр |
|
|
Фисташки, кедровые орехи, фундук, семена тыквы |
|
|
Вишня, малина, груша, абрикос, чернослив, слива, финики, апельсин, грейпфрут, клубника, шпинат, цветная капуста, спаржа, шампиньоны, грибы, аспарагус, ячмень, пшено, кукуруза, гречка, рис, кофе, крепкий чай, зеленый чай, крепкий шоколад, газированные напитки, фруктовые соки |
|
|
Пиво, вино, виски, коньяк |
|
|
Этанол |
|
|
Фруктоза |
|
|
Лекарственные |
Фуросемид |
|
средства |
Панкреатин |
|
Хлорталидон |
|
|
Гидрохлортиазид |
|
|
Ацетилсалициловая кислота (низкие дозы) |
|
|
Варфарин |
|
|
Антиретровирусные препараты |
|
|
Пиразинкарбоновая кислота |
|
|
Циклоспорин |
|
|
Такролимус |
|
|
Никотиновая кислота |
|
|
Ритуксимаб |
|
|
Бортезомиб |
|
|
Талидомид |
|
|
Ибрутиниб |
|
|
Тестостерон энантат |
|
|
Замедление выведения МК почками |
|
|
Приобретенные |
Хроническая болезнь почек |
|
заболевания и |
Обезбоживание |
|
состояния |
Кетоацидоз |
|
Гиперпродукция молочной кислоты |
|
|
Преэклампсия |
|
|
Саркоидоз |
|
|
Токсины |
|
Стойкая гиперурикемия является необходимым условиям для развития подагры, распространенность подагры существенно ниже, чем гиперурикемия. Известно, что имеется зависимость выраженности гиперурикемии от возраста, которая увеличивается от 14,7% в молодом возрасте до 20,5% в возрасте 55–64 лет. Уровень МК более 7,0 мг/дл связан с повышенным риском развития подагры или нефролитиаза [1].
Появление уратных камней в почках у человека свидетельствует об выведении избыточных количествах малорастворимой МК с мочой. Гиперурикемия может возникать вследствие повышенной продукции и/или снижения почечной экскреции МК (Рисунок).
Повышенная продукция МК связана с увеличением потребления безалкогольных напитков с фруктозой, продуктов богатых пуринами, а также злоупотреблением алкоголя [4].
Многочисленные исследования свидетельствуют о том, что глобальное распространение ожирения, сахарного диабета (СД), артериальной гипертензии (АГ), хронической сердечной недостаточности и хронической болезни почек (ХБП) также способствуют «эпидемии» гиперурикемии [5, 6].
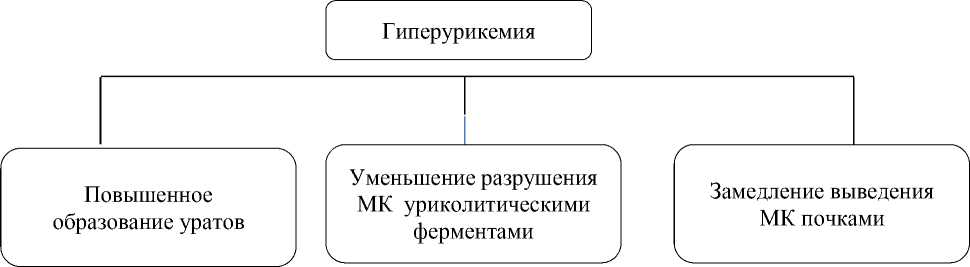
Рисунок. Основные причины гиперурикемии
С другой стороны, широкое применение диуретиков, ацетилсалициловой кислоты, панкреатина, циклоспорина также способствует гиперурикемии (Таблица1). Отмечено, что гипертриглицеридемия может стимулировать синтез пуринов, увеличивая продукцию МК [7].
В последующем накопление кристаллов МК в суставах и околосуставных тканях приводит к клиническим проявлениям подагры (приступы острого и рецидивирующего артрита), происходит хроническое системное воспаление, формирование тофусов различной локализации, а также кристаллизация солей (уратов) МК в тубулоинтерстициальной ткани почек [4].
По имеющимся сведениям, гиперурикемия вызывает вазоконстрикцию в почках посредством активации ренин-ангиотензин- альдостероновой системы и эндотелиальной дисфункции, усиливая интерстициальное воспаление и нефрофиброз [8].
Гиперурикемия и последующее отложение кристаллов в паренхиме почек могут приводить к снижению интраренального кровотока, гломеруло- и тубулосклерозу, уратной нефропатии и мочекаменной болезни [8].
Распространенность гиперурикемии в общей популяции в ассоциации с другими факторами риска ХБП
N. Ali et al. (2019) проанализировали содержание МК и параметры липидного спектра крови у 280 взрослых участников (мужчины, n=150 и женщины, n=130). Показали, что распространенность гиперурикемии составила 9,2% у мужчин и 10,4% — у женщин [9].
Средний уровень МК был значительно выше у мужчин (317±90 мкмоль/л), чем у женщин (255±65 мкмоль/л) (р<0,001). Как отмечают исследователи [9] тенденция к увеличению содержания липидов крови наблюдалась у лиц обоих полов с повышением уровня МК в квартилях (р<0,05). Кроме того, по результатам регрессионного анализа была обнаружена значительная положительная корреляция между уровнем МК и концентрациями триглицеридов, общего холестерина и холестерина липопротеинов низкой плотности (p<0,01), в то время как обратная корреляция наблюдалась между МК и содержанием холестерина липопротеинов высокой плотности (p<0,01). Предполагается, что ранняя диагностика и профилактика гиперурикемии и дислипидемии полезна для снижения частоты сердечно-сосудистых заболеваний (ССЗ) в будущем [9].
В перекрестном секционном исследовании S. Raja et al. (2019) с участием 375 человек (208 (55,5%) мужчин и 167 (44,5%) женщин) средний уровень МК крови составил 5,92±1,73 мг/дл [10].
В частности, среди обследованных лиц 83 (39,9%) мужчин и 30 (17,9%) женщин имели повышенные уровни МК. В целом, общая распространенность гиперурикемии составила 30,1% [10].
Предыдущие исследования, проведенные на территории Индии, показали, что распространенность гиперурикемии в 2018 году, составила 25,8%, при этом ее частота возрастала среди пациентов с СД и АГ [11]. По данным И. В. Мадянова снижение почечной экскреции уратов при гиперурикемии фиксируется у 95,7% пациентов СД 1 типа и 68,9% — у пациентов с СД 2 типа [12].
При СД 1 типа развитие гиперурикемии в большей мере обусловлено низкой почечной фильтрацией МК, тогда как при СД 2типа преимущественное значение имеет угнетение канальцевой секреции уратов [12].
В публикации W.Qidwai и M. Jawaid (2017) продемонстрировано, что при среднем уровне МК крови 6,11±1,7 мг/дл, распространенность гиперурикемии в целом составила 39% [11]. При этом, среди мужчин гиперурикемия выявлялась 27,9% и 49,3% у женщин. Если говорить о других азиатских регионах мира, то гиперурикемия имеет различную распространенность. Так, в Китае распространенность гиперурикемии составляет от 6 до 25%, на Тайване — от 10 до 52%, а в Индонезии — 18% [13].
В настоящее время активно изучается взаимосвязь между характером питания и уровнем МК крови. Так, в исследовании G. Mena-Sánchez et al. (2020) были проанализированы данные 6329 мужчин и женщин (средний возраст 65 лет) с избыточной массой тела или ожирением. Показано, что высокое потребление молочных продуктов, нежирных молочных продуктов, молока с низким содержанием жира, йогурта с низким содержанием жира и сыра были связаны с более низким риском гиперурикемии [14].
Повышенные уровни МК крови часто выявляются у пациентов с избыточной массой тела, ожирением и дисфункцией почек. Заслуживает отдельного внимания результат исследования S. Islam et al. (2020), где авторы проанализировали в общей сложности 450 взрослых женщин в возрасте ≥18 лет из сельских (n=210) и городских (n=240) районов, четырех административных районов (Чаттаграм, Дакка и Раджшахи и Силхет) Бангладеша [15]. В этом исследовании распространенность общего и абдоминального ожирения составила 28% и 49%, соответственно. Участники исследования из городских районов имели значительно более высокую распространенность как общего, так и абдоминального ожирения (30,9% и 58,6% соответственно), чем среди сельских женщин (26,6% и 38,1% соответственно) (р<0,05 и р<0,01 соответственно) [15].
Сердечно-сосудистые события в популяции лиц с гиперурикемией и оценка риска сердечно-сосудистых преимуществ урат-снижающей терапии была рассмотрена в систематическом мета-анализе L. Zhao et al. (2020). В исследование были включены данные 7 проспективных когортных и 17 рандомизированных клинических исследований (РКИ). Риск основных неблагоприятных сердечно-сосудистых событий (относительный риск (ОР) = 1,72, 95% доверительный интервал (ДИ) = 1,28–2,33) и ССЗ (ОР = 1,35, 95% ДИ = 1,12–1,62) был выше в группе с гиперурикемией, чем без гиперурикемии [16].
T. Shirasawa et al. (2020) проанализировали данные, полученные от 96 863 участников (69 241 мужчин и 27 622 женщин). Распространенность гиперурикемии у мужчин и женщин составила соответственно 21,4% и 11,0%, а среди участников с нормальной массой тела и центральным ожирением соответственно 15,6% и 30,0% [17].
Как сообщают авторы, ОР для гиперурикемии был значительно увеличен при ожирении по сравнению с лицами с нормальной массой тела, независимо от пола (мужчины: ОР = 2,12;
95% ДИ = 2,03–2,21; женщины: OР = 3,54; 95% ДИ = 3,21–3,90) и были статистически значимыми [17].
В публикации R. Barata, F. Cardoso и T.A. Pereira отмечено, что между гиперурикемией и АГ существует сильная взаимосвязь [18].
В мета-анализе показано, что гиперурикемия вызывает повышение риска развития АГ на 41%, причем эта связь более выражена у женщин и молодых людей [19].
Ранее в проспективном исследовании в течение 7 лет с участием 21 475 пациентов с незначительным или умеренным повышением уровня МК крови (от 7,0 до 8,9 мг/дл) были связаны с почти удвоенным риском дисфункции почек (отношение шансов (ОШ) 1,74, с 95% ДИ от 1,45 до 2,09) [20]. Пациенты с очень высоким уровнем МК (≥9,0 мг/дл) были связаны с тройным риском заболевания почек (ОШ 3,12, с 95% ДИ от 2,29 до 4,25) [20].
Мета-анализ, проведенный с L. Li et al. (2014) с участием 190 718 пациентов показал, что гиперурикемия является независимым предиктором возникновения ХБП как в когорте в целом (ОШ 2,35; 95% ДИ = 1,59–3,46), так и в подгруппах, вне зависимости от пола, наличия или отсутствия СД и места жительства [21].
В ретроспективном исследовании Guo L.P. et al. (2020) среди 663 пациентов с ХБП наличие гиперурикемии выявлялась примерно в 52% случаев. У пациентов с ХБП и гиперурикемией отмечались более низкие концентрации гемоглобина (Hb) и величины скорости клубочковой фильтрации (СКФ) с одной стороны, и повышение уровня мочевины, остаточного азота, креатинина и фосфатов сыворотки – с другой, по сравнению с пациентами без гиперурикемии. По мере снижения СКФ распространенность гиперурикемии увеличивается, что подтверждает необходимость использования урат-снижающей терапии у пациентов с ХБП 1–4 стадии [22].
Терапевтические стратегии при гиперурикемии
Как показывают результаты исследований [2, 4], урат-снижающие препараты влияют на продукцию МК посредством воздействия на ксантиноксидазу, участвующую в расщеплении пуринов. В дополнение к контролю гиперурикемии ингибирование ксантиноксидазы может уменьшать количество свободных радикалов, которые генерируются при метаболизме МК [4].
Фермент, который катализирует преобразование ксантина и гипоксантина в МК является ксантиноксидаза. Следовательно, при подавлении активности фермента ксантиноксидазы в организме снижается продукция МК. Арсенал урат-снижающих препаратов невелик, а популяция людей имеющие гиперурикемию увеличивается ежегодно. На протяжении многих лет в клинической практике в качестве урат-снижающей терапии используется аллопуринол, терапевтическая эффективность которого зависит от множества факторов. Все это побудило исследователей провести поиск и разработать новые безопасные и эффективные урат-снижающие агенты, альтернативному аллопуринолу. В конце XX века на базе химической лаборатории Teйдзин в Японии был синтезирован новый урат-снижающий препарат — фебуксостат, который одобрен экспертами EULAR в 2008 году, а в 2017 зарегистрирован в Российской Федерации.
Фебуксостат угнетает активность как окисленной, так и восстановленной форм ксантиноксидазы [4]. Что касается аллопуринола, то он ингибирует лишь восстановленную форму ксантиноксидазы. Как отмечают исследователи, фебуксостат обладает некоторыми важными отличиями от аллопуринола: он стабильно и длительно ингибирует обе изоформы фермента, что определяет его эффективность [2].
Препарат выделяется с мочой преимущественно в конъюгированном виде, что не приводит к увеличению других нежелательных явлений и делает возможным его использование у пациентов с С2 и С3а стадией ХБП без коррекции дозы. Применение аллопуринола обычно начинают с дозы 50–100 мг/день и постепенно титруют до достижения целевого уровня МК в крови [23].
При необходимости дозу аллопуринола увеличивают на 100 мг каждые 2–4 недели до достижения целевого сывороточного уровня МК [24]. Согласно рекомендациям EULAR (The European Alliance of Associations for Rheumatology / European League Against Rheumatism) по лечению подагры, если целевой уровень МК не может быть достигнут с помощью адекватной дозы аллопуринола, он должен быть заменен на фебуксостат или урикозурик либо комбинацию фебукостата с урикозуриком. Фебуксостат также показан при непереносимости аллопуринола [25].
Фебуксостат в дозах 80 и 120 мг/день оказался более эффективным препаратом, чем аллопуринол в дозе 300 мг/день [23]. Следует подчеркнуть, что примерно 80% аллопуринола выводится с мочой, большая часть в виде оксипуринола [26], который накапливается у пациентов с ХБП. Около 49% введенной дозы фебуксостата выводится с мочой и 45% — с калом [27].
И. Ю. Головач и Е. Д. Егудина (2019) подчеркивают, что это позволяет не корректировать дозу фебуксостата для пожилых пациентов или пациентов с С2 или С3а категорией дисфункции почек или при легкой и умеренной печеночной недостаточности (Чайлда - Пью, класс A или B), в отличии от аллопуринола, для которого необходима тщательная оценка назначаемой дозы при наличии вышеперечисленных коморбидных состояний, что значительно ограничивает его гипоурикемический эффект [23].
Для фебуксостата характерна значительно меньшая вероятность подобных ограничений. Вероятность достижения целевого уровня МК в крови при сниженной функции почек, напротив, выше у фебуксостата [28].
В проспективном рандомизированном исследовании K. Tanaka et al. (2015) продемонстрировано, что терапия фебуксостатом в течение 12 недель привела к значительно большему снижению МК в сыворотке, чем традиционная терапия [29].
Параллельно в другом исследовании, при котором обследовались 93 пациента с ХБП, показано, что шестимесячная терапия фебуксостатом в дозе 40 мг/сутки привела к увеличению средней расчетной СКФ на 10% по сравнению с исходной (с 31,5±13,6 до 34,7±13,6 мл/мин), в случае приема плацебо СКФ, напротив, снижалась (с 32,6±11,6 до 28,2±11,5 мл/мин) [30].
Позже в 2017 году опубликованы результаты исследований P.A. Juge et al., где пациенты с подагрой и ХБП в пожилом возрасте принимали препарат фебуксостат в дозе от 40 до 120 мг (большинство обследуемых (75%) принимали препарат в дозе 80 мг/сутки) в течение трех месяцев [31]. Примечательно, что в этом исследовании снижение содержания МК крови коррелировало с увеличением СКФ и уменьшением протеинурии [31].
В мета-анализе A. Chewcharat et al. (2020) проведена оценка эффективности и безопасности профилей фебуксостата при лечении гиперурикемии у пациентов с трансплантацией почек, n=367 [32].
Авторы провели электронный поиск в Центральном регистре контролируемых исследований PubMed, Embase и Cochrane с января 1960 года по июль 2019 года, чтобы выявить исследования, в которых изучалось влияние фебуксостата у пациентов, перенесших пересадку почки [32].
Учитывался уровень МК, профиль безопасности, СКФ, уровень Hb, количество лейкоцитов, печеночные ферменты и минимальный уровень такролимуса [32]. Установлено, что по сравнению с аллопуринолом группа фебуксостата продемонстрировала более высокие шансы достижения целевых уровней МК ниже 6 мг/дл в течение 12 месяцев (OР = 2,9, р = 0,004) [32].
Что касается профилей безопасности, не было статистических различий в СКФ, Hb, числа лейкоцитов, активности печеночных трансаминаз при минимальном уровне такролимуса между исходным уровнем и в конце наблюдения. Стоит отметить, что только в одном исследовании сообщалось о предполагаемой потере трансплантата в группе фебуксостата. Среди пациентов с трансплантацией почек лечение гиперурикемии фебуксостатом показало более высокие шансы достижения целевого уровня сывороточной МК < 6 мг/дл по сравнению с аллопуринолом, не вызывая значительных побочных эффектов, включая изменение уровня такролимуса, функцию печени, снижение функции почечного трансплантата и функции костного мозга [32].
В рандомизированном, двойном слепом, плацебо-контролируемом пилотном исследовании Y.Y. Huang et al. (2020) участвовали 156 пациентов с подагрой и гиперурикемией (МК ≥ 8 мг/дл), из которых группа лиц получавших плацебо (n=78) и группа фебуксостата (n=78) [33]. Пациенты были рандомизированы для приема фебуксостата 80 мг или плацебо один раз в день в течение 24 недель. Уровни МК, интерлейкина (IL) -6, IL-17 и фактор некроза опухолей альфа (TNF-α) в сыворотке крови были измерены в начале (исходный уровень), в динамике и к концу исследования. Было установлено, что в группе пациентов, получавших фебуксостат, наблюдалось значительно большее снижение МК крови по сравнению с группой, принимавшей плацебо. Концентрация МК в сыворотке была снижена ниже 8 мг/дл у 46 из 61 пациента (75,4%) к 24 неделе [33]. Немаловажным фактом является то, что в данном исследовании в группе лиц получавших фебуксостат также были снижены уровни IL-6, IL-17 и TNF-α в сыворотке крови. Что касается переносимости препарата, то в группе фебуксостата 10 пациентов из 78 (12,82%) прекратили лечение из-за побочных лекарственных реакций [33].
Рядом исследований установлено, что высокие концентрации IL-6 и TNF-α наблюдаются у пациентов с ХБП. К тому же, при отсутствии терапии у этой категории лиц наблюдается прогрессирование ХБП и присоединение сердечно-сосудистых осложнений [34, 35].
У лиц как с бессимптомной гиперурикемией, так и подагрой кристаллы моноурата натрия провоцируют изменение в сосудистой стенке, активацию иммунного ответа, что сопровождаются избыточной продукцией белков острой фазы воспаления и цитокинов. Прогрессирующая эндотелиальная дисфункция и пролиферация гладкомышечных клеток в сосудистой стенке значительно повышают риск системного атеросклероза, возникновения инфаркта миокарда, развития хронической сердечной недостаточности, инсульта и ХБП [24, 34, 35].
Есть свидетельство, что терапия фебуксостатом в течение 4, 12 и 24 недели снижает уровень МК, С-реактивного белка и повышает чувствительность к инсулину у пациентов с подагрой [36].
Исследователи X. Zhang et al. (2019) сравнивали эффективность нефропротективной терапии между фебуксостатом и аллопуринолом у пациентов с ХБП и гиперурикемией [37]. Всего было набрано 152 пациентов с ХБП 2–3 стадии, в ассоциации с гиперурикемией. В соответствии с терапией, снижающей уровень МК, 67 пациентов были включены в группу фебуксостата и 85 - в группу аллопуринола соответственно [37].
Были оценены значения СКФ, креатинина, МК сыворотки крови и суточной протеинурии исходно и в динамике исследования. Первичным исходом была доля пациентов со снижением СКФ ≥ 10% от исходного уровня [37]. Доля пациентов, у которых отмечалось снижение СКФ ≥ 10% от исходного уровня к концу периода наблюдения, было снижено в группе фебуксостата по сравнению с группой аллопуринола [37]. Исследователи сделали вывод, что фебуксостат оказывает нефропротективное влияние, снижает темпы прогрессирования почечной недостаточности по сравнению с аллопуринолом у пациентов с ХБП, в ассоциации гиперурикемией [37].
В дальнейшем, в клинических исследованиях, было отмечено, что у лиц с симптомной гиперурикемией при отсутствии эффекта от аллопуринола назначение фебуксостата обеспечивало существенное снижение сывороточного уровня МК [38]. Еще в 2010 году M. A. Becker et al. провели сравнительное исследование оценивавшее эффективность снижения уратов и безопасность ежедневного применения фебуксостата и аллопуринола у пациентов с подагрой и МК≥8,0 мг/дл в течение шестимесячной терапии [38].
Всего в исследовании принимали участие 2269 пациентов, которые были рандомизированы по приему фебуксостата 40 мг или 80 мг или аллопуринола 300 мг (200 мг при С3а ХБП). Нужно сказать, что среди участников исследования были лица с уровнем СКФ ≤ 60 мл/мин (65%), ожирением (64%), гиперлипидемией (42%) и АГ (53%). В качестве конечной точки были выбраны параметры МК крови (<6,0 мг/дл), доля лиц с С2/С3а категорией дисфункции почек [38]. В группах фебуксостата 40 мг, фебуксостата 80 мг и аллопуринола первичная конечная точка была достигнута в 45%, 67% и 42%, соответственно [38]. Показано, что фебуксостат в дозе 40 мг статистически не уступал аллопуринолу, фебуксостат 80 мг превосходил по результативности обе группы (р<0,001). Достижение целевого уровня МК крови у лиц с почечной недостаточностью также было лучше при использовании фебуксостата 80 мг (72%; р<0,001) по сравнению с фебуксостатом 40 мг (50%) или аллопуринолом (42%), фебуксостат 40 мг показал более высокую эффективность, чем аллопуринол (р=0,021) [38].
По данным многочисленных исследований, пациенты которым противопоказан прием аллопуринола, должны начинать лечение с урикозурического препарата или фебуксостата в соответствии с наличием сопутствующих состояний. Если у пациента нет серьезных ССЗ или факторов риска, а также перенесенного инсульта в анамнезе, можно перевести больного на прием фебуксостата, начиная с 40 мг/день, затем дозировку постепенно титровать, особенно при наличии ХБП. Между тем, самостоятельное назначение урикозурических препаратов противопоказано пациентам с мочекаменной болезнью в анамнезе [23].
В случаи непереносимости аллопуринола возможно назначение фебуксостата в дозе 4080 мг в сутки. Как указывают международные рекомендации, уровень МК < 6 мг/дл (360 мкмоль/л) должен поддерживаться на протяжении всей жизни. Более низкий целевой уровень, МК < 5 мг/дл (300 мкмоль/л), рекомендуется для более быстрого растворения кристаллов у пациентов с тяжелой подагрой (тофусы, хроническая артропатия, частые приступы) вплоть до полного растворения кристаллов и излечения подагры. Сывороточный уровень МК < 3 мг/дл (<180 мкмоль/л) в долгосрочной перспективе поддерживать не рекомендуется [24].
Так как, очень низкий уровень МК связан с эндотелиальной дисфункцией и когнитивных расстройств. Существует J-образное соотношение между сердечнососудистыми событиями и уровнем МК при популяционно-значимых заболеваниях.
Таблица 2
РЕКОМЕНДУЕМАЯ НАЧАЛЬНАЯ ДОЗА АЛЛОПУРИНОЛА
ПРИ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК
|
2 Уровень СКФ, мл/мин/1,73м |
Доза аллопуринола |
||
|
Незначительно сниженная СКФ |
60–89 |
мл/мин/1,73м2 |
100 мг 1 раз в день |
|
Умеренно сниженная СКФ |
45–59 |
мл/мин/1,73м2 |
50 мг 1 раз в день |
|
Существенно сниженная СКФ |
30–44 |
мл/мин/1,73м2 |
50 мг 1 раз в день |
|
Резко сниженная СКФ |
15–29 |
мл/мин/1,73м2 |
50 мг 1 раз через день |
|
Терминальная почечная недостаточность |
5–15 |
мл/мин/1,73м2 |
50 мг 2 раза в неделю |
|
Терминальная почечная недостаточность |
5 мл/мин/1,73м2 |
50 мг 1 раз в неделю |
|
Примечание. СКФ – скорость клубочковой фильтрации.
У пациентов с ХБП-С3 начальная доза аллопуринола составляет 50 мг в сутки с титрованием по 50 мг до 300 мг в сутки максимально. Следует помнить, что уратснижающая терапия на 58% уменьшает риск терминальной стадии ХБП по сравнению с ее отсутствием.
Заключение
Таким образом, в настоящее время дополняется база данных о безопасности и эффективности использования фебуксостата у пациентов с высоким риском развития и прогрессирования ХБП. Длительная терапия фебуксостатом у популяции пациентов с ХБП снижая сердечно-сосудистые риски, способно удлинять додиализный период заболевания. Вместе с тем в настоящий момент имеется достаточная научно-клиническая доказательная база позволяющая гиперурикемию считать как модифицируемый лабораторный фактор ренальной дисфункции у пациентов с высоким риском развития и прогрессирования ХБП.
Дальнейшие исследования возможностей лечения гиперурикемии для сохранения экскреторной функции у пациентов с ХБП при помощи фебуксостата могут привести к расширению терапевтических границ его клинического применения.
Список литературы Торможение прогрессирования хронической болезни почек при гиперурикемии
- Кобалава Ж. Д., Толкачева В. В., Караулова Ю. Л. Мочевая кислота-маркер и/или новый фактор риска развития сердечно-сосудистых осложнений // РМЖ. 2002. Т. 10. №10. С. 431-436.
- Елисеев М. С. Хроническая болезнь почек: роль гиперурикемии и возможности уратснижающей терапии // Современная ревматология. 2018. Т. 12. №1. С. 60-65. EDN: XPUTSP. https://doi.org/10.14412/1996-7012-2018-1-60-65
- Елисеева М. Е., Елисеев М. С. Значение гиперурикемии в развитии заболеваний человека и методы ее коррекции // Доктор. Ру. 2019. №2 (157). С. 47-54. EDN: ZDBFLV https://doi.org/10.31550/1727-2378-2019-157-2-47-54
- Петрова М. С., Мазуров В. И., Инамова О. В. Фебуксостат для лечения хронической гиперурикемии у пациентов, страдающих подагрой // Медицинский совет. 2017. №17. С. 114-122. EDN: ZRDTFF. https://doi.org/10.21518/2079-701X-2017-17-114-122
- Чазова И. Е., Жернакова Ю. В., Кисляк О. А., Недогода С. В., Подзолков В. И., Ощепкова Е. В., Блинова Н. В. Консенсус по ведению пациентов с гиперурикемией и высоким сердечно-сосудистым риском // Системные гипертензии. 2019. Т. 16. №4. С. 8-21. EDN: HSKPCZ. https://doi.org/10.26442/2075082X.2019.4.190686
- Небиеридзе Д. В. Гиперурикемия-как фактор сердечно-сосудистого риска // Рациональная фармакотерапия в кардиологии. 2020. Т. 16. №1. С. 156-157. EDN: XGECWM.
- Li C., Hsieh M. C., Chang S. J. Metabolic syndrome, diabetes, and hyperuricemia // Current opinion in rheumatology. 2013. V. 25. №2. P. 210-216. https://doi.org/10.1097/BOR.0b013e32835d951e
- Попов С. В., Стуров Н. В. Сравнительные исследования эффективности нефропротекции при антигиперури-кемической терапии у пациентов с хронической болезнью почек // Трудный пациент. 2019. Т. 17. №10. С. 48-51. EDN: HWNYQI. https://doi.org/10.24411/2074-1995-2019-10076
- Ali N., Rahman S., Islam S., Haque T., Molla N. H., Sumon A. H., Ahmed S. The relationship between serum uric acid and lipid profile in Bangladeshi adults // BMC cardiovascular disorders. 2019. V. 19. P. 1-7. https://doi.org/10.1186/s12872-019-1026-2
- Raja S. et al. Frequency of hyperuricemia and its risk factors in the adult population // Cureus. 2019. V. 11. №3. https://doi.org/10.7759/cureus.4198
- Qudwai W., Jawaid M. Frequency of uric acid levels symptomatic and asymptomatic hyperuricemia among the Pakistani population // Mid East J Fam Med. 2017. V. 15. P. 52-57.
- Мадянов И. В. Гиперурикемия и сахарный диабет // Русский медицинский журнал. Медицинское обозрение. 2019. Т. 3. №1-1. С. 20-24.
- Smith E., March L. Global prevalence of hyperuricemia: a systematic review of population-based epidemiological studies // Arthritis & Rheumatology. 2015. V. 67.
- Mena-Sánchez G., Babio N., Becerra-Tomás N., Martínez-González M. Á., Díaz-López A., Corella D., Salas-Salvadó J. Association between dairy product consumption and hyperuricemia in an elderly population with metabolic syndrome // Nutrition, Metabolism and Cardiovascular Diseases. 2020. V. 30. №2. P. 214-222. https://doi.org/10.1016/j.numecd.2019.09.023
- Islam S., Rahman S., Haque T., Sumon A. H., Ahmed A. M., Ali N. Prevalence of elevated liver enzymes and its association with type 2 diabetes: A cross‐sectional study in Bangladeshi adults//Endocrinology, diabetes & metabolism. 2020. V. 3. №2. P. e00116. https://doi.org/10.1002/edm2.116
- Zhao L., Cao L., Zhao T. Y., Yang X., Zhu X. X., Zou H. J., Xue Y. Cardiovascular events in hyperuricemia population and a cardiovascular benefit-risk assessment of urate-lowering therapies: a systematic review and meta-analysis // Chinese Medical Journal. 2020. V. 133. №08. P. 982-993. https://doi.org/10.1097/CM9.0000000000002148
- Shirasawa T., Ochiai H., Yoshimoto T., Nagahama S., Watanabe A., Yoshida R., Kokaze A. Cross-sectional study of associations between normal body weight with central obesity and hyperuricemia in Japan // BMC Endocrine Disorders. 2020. V. 20. P. 1-8. https://doi.org/10.1186/s12902-019-0481-1
- Barata R., Cardoso F., Pereira T. Hyperuricemia in Chronic Kidney Disease: a role yet to be explained // Port J Nephrol Hypertens. 2020. V. 34. №1. P. 30-5.
- Grayson P. C., Kim S. Y., LaValley M., Choi H. K. Hyperuricemia and incident hypertension: a systematic review and meta‐analysis // Arthritis care & research. 2011. V. 63. №1. P. 102-110. https://doi.org/10.1002/acr.20344
- Obermayr R. P., Temml C., Gutjahr G., Knechtelsdorfer M., Oberbauer R., Klauser-Braun R. Elevated uric acid increases the risk for kidney disease // Journal of the American Society of Nephrology: JASN. 2008. V. 19. №12. P. 2407. https://doi.org/10.1681%2FASN.2008010080
- Li L., Yang C., Zhao Y., Zeng X., Liu F., Fu P. Is hyperuricemia an independent risk factor for new-onset chronic kidney disease?: a systematic review and meta-analysis based on observational cohort studies // BMC nephrology. 2014. V. 15. P. 1-12. https://doi.org/10.1186/1471-2369-15-122
- Guo L. P., Wang Q., Pan Y., Wang Y. L., Zhang Z. J., Hu C., Liu J. Y. A retrospective cross-sectional study of the associated factors of hyperuricemia in patients with chronic kidney disease // Journal of International Medical Research. 2020. V. 48. №6. P. 0300060520919224. https://doi.org/10.1177/0300060520919224
- Головач И. Ю., Егудина Е. Д. Расширение границ уратснижающей терапии: место фебуксостата в лечении подагры // Травма. 2019. Т. 20. №2. С. 20-31. EDN: EYGEEG. https://doi.org/10.22141/1608-1706.2.20.2019.168017
- Орлова Е. В. Гиперурикемия в терапевтической практике–лечить или наблюдать // Трудный пациент. 2018. Т. 16. №10. С. 16-23. EDN: YROEPR. https://doi.org/10.24411/2074-1995-2018-10015
- Richette P., Doherty M., Pascual E., Barskova V., Becce F., Coyfish M., Bardin T. 2018 updated European League Against Rheumatism evidence-based recommendations for the diagnosis of gout //Annals of the rheumatic diseases. 2019. P. https://doi.org/annrheumdis-2019-215315.10.1136/annrheumdis-2019-215315
- Murrell G. A. C., Rapeport W. G. Clinical pharmacokinetics of allopurinol // Clinical pharmacokinetics. 1986. V. 11. №5. P. 343-353. https://doi.org/10.2165/00003088-198611050-00001
- Schrama R. Expert network interaction in the European Medicines Agency // Regulation & Governance. 2023. V. 17. №2. С. 491-511. https://doi.org/10.1111/rego.12466
- Van Echteld I. A., van Durme C., Falzon L., Landewé R. B., van der Heijde D. M., Aletaha D. Treatment of gout patients with impairment of renal function: a systematic literature review // The Journal of Rheumatology Supplement. 2014. V. 92. P. 48-54. https://doi.org/10.3899/jrheum.140462
- Tanaka K., Nakayama M., Kanno M., Kimura H., Watanabe K., Tani Y., Watanabe T.Renoprotective effects of febuxostat in hyperuricemic patients with chronic kidney disease: a parallel-group, randomized, controlled trial // Clinical and experimental nephrology. 2015. V. 19. P. 1044-1053. https://doi.org/10.1007/s10157-015-1095-1
- Sircar D., Chatterjee S., Waikhom R., Golay V., Raychaudhury A., Chatterjee S., Pandey R. Efficacy of febuxostat for slowing the GFR decline in patients with CKD and asymptomatic hyperuricemia: a 6-month, double-blind, randomized, placebo-controlled trial // American Journal of Kidney Diseases. 2015. V. 66. №6. P. 945-950. https://doi.org/10.1053/j.ajkd.2015.05.017
- Juge P., Truchetet M. E., Pillebout E., Ottaviani S., Vigneau C., Loustau C., Ea H. K. Efficacy and safety of febuxostat in 73 gouty patients with stage 4/5 chronic kidney disease: A retrospective study of 10 centers // Joint Bone Spine. 2017. V. 84. №5. P. 595-598. https://doi.org/10.1016/j.jbspin.2016.09.020
- Chewcharat A., Chang Y. T., Thongprayoon C., Crisafio A., Bathini T., Mao M. A., Cheungpasitporn W. Efficacy and safety of febuxostat for treatment of asymptomatic hyperuricemia among kidney transplant patients: A meta‐analysis of observational studies // Clinical Transplantation. 2020. V. 34. №4. P. e13820. https://doi.org/10.1111/ctr.13820
- Huang Y. Y., Ye Z., Gu S. W., Jiang Z. Y., Zhao L. The efficacy and tolerability of febuxostat treatment in a cohort of Chinese Han population with history of gout // Journal of International Medical Research. 2020. V. 48. №5. P. 0300060520902950. https://doi.org/10.1177/0300060520902950
- Bai Y., Wang J., He Z., Yang M., Li L., Jiang H. Mesenchymal stem cells reverse diabetic nephropathy disease via lipoxin A4 by targeting transforming growth factor β (TGF-β)/smad pathway and pro-inflammatory cytokines // Medical science monitor: international medical journal of experimental and clinical research. 2019. V. 25. P. 3069. https://doi.org/10.12659%2FMSM.914860
- Weaver Jr D. J. Uric acid and progression of chronic kidney disease // Pediatric Nephrology. 2019. V. 34. №5. P. 801-809. https://doi.org/10.1007/s00467-018-3979-2
- Mizuno T., Hayashi T., Hikosaka S., Shimabukuro Y., Murase M., Takahashi K., Yamada S. Efficacy and safety of febuxostat in elderly female patients // Clinical interventions in aging. 2014. P. 1489-1493. https://doi.org/10.2147/CIA.S70855
- Zhang X., Wan D., Yang G., Peng Q., Wang X. Febuxostat is superior to allopurinol in delaying the progression of renal impairment in patients with chronic kidney disease and hyperuricemia // International urology and nephrology. 2019. V. 51. P. 2273-2283. https://doi.org/10.1007/s11255-019-02318-8
- Becker M. A., Schumacher H. R., Espinoza L. R., Wells A. F., MacDonald P., Lloyd E., Lademacher C. The urate-lowering efficacy and safety of febuxostat in the treatment of the hyperuricemia of gout: the CONFIRMS trial // Arthritis research & therapy. 2010. V. 12. №2. P. 1-12.. https://doi.org/10.1186/ar2978


