Тотальное эндопротезирование тазобедренного сустава после предшествовавшей декомпрессии очага некроза: эффективность и осложнения
Автор: Панин М. А., Загородний Н. В., Бойко А. В., Петросян А. С.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 6 т.13, 2023 года.
Бесплатный доступ
Актуальность. Наличие в анамнезе декомпрессии очага некроза с использованием пористых танталовых стержней оказывает негативное влияние на течение операции тотального эндопротезирования тазобедренного сустава, послеоперационного периода, на частоту и характер послеоперационных осложнений. В отношении влияния на тотальное эндопротезирование тазобедренного сустава других методик декомпрессии очага некроза мнения противоречивы.Цель исследования: оценка влияния предшествовавшей декомпрессии очага некроза на интраи послеоперационные показатели операции тотального эндопротезирования тазобедренного сустава.Объект и методы. В исследование включены 44 пациента с остеонекрозом головки бедренной кости, которым была произведена операция тотального эндопротезирования тазобедренного сустава. Первую группу составили 30 пациентов с остеонекрозом головки бедренной кости (II-IV ст. по ARCO), у которых в прошлом не было операций на тазобедренных суставах - первичное тотальное эндопротезирование тазобедренного сустава. Во вторую группу включено 14 пациентов с остеонекрозом, у которых 6-24 месяца назад при II стадии заболевания проводилась декомпрессия очага некроза на том же суставе (вторичное тотальное эндопротезирование тазобедренного сустава). Оценивали длительность операции, объём кровопотери, осложнения в послеоперационном периоде, динамику болевого синдрома, функцию тазобедренного сустава.Результаты. Сравнительный анализ показал отсутствие значимых технических интраоперационных сложностей при тотальном эндопротезировании тазобедренного сустава: длительность операций в I группе - 85 ± 25 минут, во II группе - 80 ± 20 минут, то есть практически одинаково; объём интраоперационной кровопотери: 300 ± 100 мл в обеих группах. Выживаемость эндопротеза тазобедренного сустава оказалась 100 %-й в обеих группах. Поверхностное воспаление операционной раны было диагностировано у 3,3 % пациентов I группы и у 7,1 % пациентов II группы (%). Вывих эндопротеза отмечен у одного пациента из I группы (первичное тотальное эндопротезирование тазобедренного сустава). Через 12 месяцев после тотального эндопротезирования тазобедренного сустава у 6,7 % пациентов I группы при рентгенографии был выявлен остеолизис вокруг элемента эндопротеза.Выводы. Тотальное эндопротезирование тазобедренного сустава у пациентов с декомпрессией очага некроза в анамнезе не сопровождается интраоперационными техническими трудностями и является относительно безопасным хирургическим вмешательством. Предшествующая декомпрессия очага некроза не является дополнительным фактором риска интраи послеоперационных осложнений тотального эндопротезирования тазобедренного сустава.
Тазобедренный сустав, остеонекроз головки бедра, декомпрессия очага некроза, эндопротезирование тазобедренного сустава
Короткий адрес: https://sciup.org/143181104
IDR: 143181104 | УДК: 616.34-089 | DOI: 10.20340/vmi-rvz.2023.6.CLIN.3
Текст научной статьи Тотальное эндопротезирование тазобедренного сустава после предшествовавшей декомпрессии очага некроза: эффективность и осложнения
ОРИГИНАЛЬНАЯ СТАТЬЯ ORIGINAL ARTICLE УДК 616.728.3-089.28
Безальтернативным методом лечения поздних стадий остеонекроза головки бедренной кости является тотальное эндопротезирование тазобедренного сустава (ТЭТС). ТЭТС также нередко производится у пациентов с остеонекрозом после неэффективных операций декомпрессии очага некроза.
В литературе обсуждаются вопросы относительно влияния предшествующих суставосохраняющих хирургических вмешательств на течение операции ТЭТС, послеоперационного периода, на частоту и характер послеоперационных осложнений [1, 2].
Не вызывает сомнения, что ТЭТС после неэффективной декомпрессии очага некроза приносит желаемый результат с точки зрения восстановления функции тазобедренного сустава. Согласно результатам исследований, послеоперационные оценки по шкале Harris’а имели высокие значения – 85–97 баллов, достигая у ряда пациентов 100 баллов [3, 4]. В то же время C.E. Scott и соавт. указывают на то, что около 1/3 пациентов не совсем удовлетворены результатами ТЭТС [5, 6].
Известно, что использование танталовых пористых стержней в процессе декомпрессии очага некроза негативно влияет на течение последующей операции ТЭТС, удлиняя её продолжительность, увеличивая риск интраоперационного перелома и обнаруживаемого при дальнейшем наблюдении за пациентами остеолизиса [7]. Так, Y. Boachie-Adjei и соавт. указали на частоту интраопераци- онного перелома в 2,7 % случаев при ТЭТС после применении танталового стержня при декомпрессии очага некроза [8]. По данным Q. Cheng и соавт., частота остеолизиса варьирует от 7,1 до 35,7 % в зависимости от расположения обломков танталового стержня [9]. Наличие данного рода осложнений в процессе вторичного ТЭТС обусловлено тем, что танталовый стержень уже интегрирован в костную ткань [10, 11]. Предлагаемые технологии удаления пористого танталового стержня частоты осложнений не снижают [9, 12].
В отношении влияния декомпрессии очага некроза в других модификациях (без применения танталовых пористых стержней) на последующее ТЭТС мнения исследователей различаются. По мнению T.P. Pierce и соавт., предшествующая декомпрессия очага некроза не оказывает влияния на «выживаемость» тазобедренного сустава после вторичного ТЭТС [13]. Не было выявлено взаимосвязи симптома скрипа в тазобедренном суставе после вторичного ТЭТС (декомпрессия очага некроза в анамнезе) [14, 15]. В то же время другие авторы указывают, что перфорационные каналы, выполненные с целью декомпрессии очага некроза, нарушают остеоархитектонику проксимального отдела бедренной кости и ухудшают результаты эндопротезирования [16]. По данным B.M. Stronach и со-авт., перфорационные каналы могут нарушать целостность костного ложа бедренного компонента эндопротеза и ухудшать показатели «выживаемости» сустава [17].
Цель исследования
В связи с наличием различных мнений нами предпринято собственное исследование, целью которого явилась оценка влияния предшествовавшей декомпрессии очага некроза на интра- и послеоперационные показатели операции ТЭТС.
Объект и методы
В исследование были включены 44 пациента с остеонекрозом головки бедренной кости, которым была произведена операция тотального эндопротезирования тазобедренного сустава.
Проведение исследования было одобрено локальным этическим комитетом ГБУЗ ГКБ № 17 ДЗ г. Москвы; всеми пациентами было подписано информированное согласие на участие в исследовании.
Критерием включения являлось выполнение операции ТЭТС из хирургического доступа Hardinge, а также использование эндопротеза бесцементной фиксации (компания DePuySynthes: ножка Corail, чашка Pinnacle) с парой трения металл-полиэтилен. Также критерием включения являлась возможность оценки интра- и послеоперационных осложнений эндопротезирования.
В рамках исследования у пациентов проводилась оценка интенсивности боли по ВАШ (визуально-аналоговая шкала) и функции тазобедренного сустава по шкале Harris’а до операции, через 3, 6 и 12 месяцев после ТЭТС. Динамическое наблюдение за пациентами (через 3, 6, 12 месяцев) включало клиническую оценку, рентгенографическое исследование тазобедренных суставов в прямой и боковой проекциях. При рентгенографии особое внимание уделяли наличию признаков околоимплантного остеолизиса (рис. 1), миграции элементов эндопротеза.
Согласно разработанному дизайну исследования, нами были проанализированы длительность операций, объём интраоперационной кровопотери, выживаемость эндопротеза и его компонентов, а также наличие осложнений: воспаление, вывих эндопротеза, параимплантный остеолизис у всех прооперированных пациентов.
Когорта из 44 пациентов была разделена на две группы. Первую группу составили 30 пациентов с остеонекрозом головки бедренной кости (II–IV ст. по ARCO), у которых не было операций на тазобедренных суставах – первичное ТЭТС.
У 25 из 30 пациентов был выявлен коллапс головки бедренной кости – III или IV ст. (рис. 2).
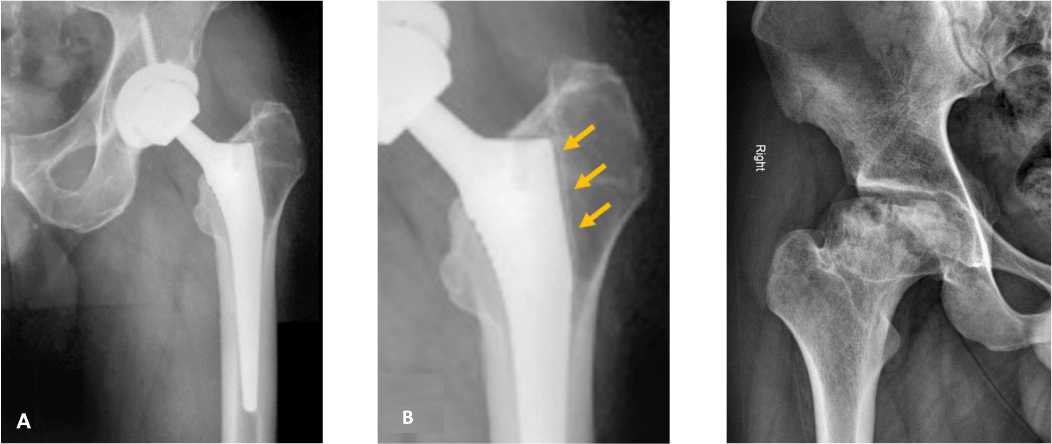
Рисунок 1. А. Рентгенограмма тазобедренного сустава через 24 месяца после ТЭТС. В. Зона остеолизиса вокруг проксимального отдела ножки эндопротеза (указано стрелками)
Figure 1. A. Radiograph of the hip joint 24 months after knee endoprosthetics.
B. Area of osteolysis around the proximal endoprosthesis stem (indicated by arrows)
Рисунок 2. Коллапс головки бедренной кости, остеонекроз IV ст. (рентгенограмма) Figure 2 . Collapse of the femoral head, stage IV osteonecrosis (radiograph)
У 5 пациентов формально выявлялась II ст. остеонекроза (отсутствие коллапса головки бедренной кости), но отмечались стойкий выраженный болевой синдром и нарушение функции тазобедренного сустава. По данным МРТ у данных пациентов визуализировался выраженный синовит и/или отёк костного мозга (рис . 3). На протяжении 4–12 месяцев проводилось консервативное лечение без эффекта; от предложенного суставосохраняющего хирургического вмешательства пациенты отказались. Произведено ТЭТС.
Возраст пациентов I группы в среднем составил 41,12 ± 8,2 года, варьируя от 28 до 60 лет. По гендерному составу превалировали мужчины – 22 (73,3 %) человека, женщин было 8 (26,7 %). Двусторонним был остеонекроз у 20 (66,6 %) из 30 пациентов.
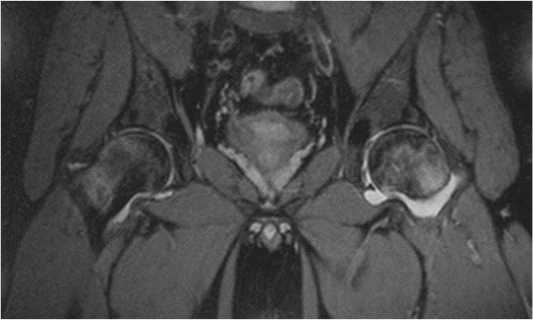
Рисунок 3. II стадия остеонекроза головки бедренной кости, синовит и отёк костного мозга (МР-томограмма)
Figure 3. Stage II osteonecrosis of the femoral head, synovitis and bone marrow edema (MR tomogram)
До операции интенсивность болевого синдрома у пациентов I группы в среднем оценена в 6,61 ± 1,8 балла по ВАШ боли, оценка по шкале Harris’а в среднем составляла 58,03 ± 5,9 балла.
Во вторую группу включено 14 пациентов с остеонекрозом головки бедренной кости, у которых 6–24 месяца назад при II стадии заболевания проводилась декомпрессия очага некроза на том же суставе (вторичное ТЭТС). Произведены следующие варианты операций: у 4 из 14 пациентов – классическая декомпрессия (тунне-лизация) очага, в 3 случаях – декомпрессия очага некроза с костной аутопластикой, у остальных 7 пациентов – декомпрессия с костной аутопластикой и введением PRGF.
Возраст пациентов II группы в среднем составлял 44,64 ± 7,9 года с вариациями от 29 до 69 лет; мужчин было 10 (71,4 %), женщин – 4 (28,6 %). Остеонекроз головки бедренной кости был двусторонним у 85,7 % (у 10 из 14 пациентов).
Дооперационная оценка интенсивности болевого синдрома (по ВАШ боли) во II группе в среднем составляла 5,82 ± 0,8 балла, оценка функционального состояния тазобедренного сустава – 64,70 ± 6,5 балла по шкале Harris’а.
В таблице 1 представлены сравнительные данные по двум группам пациентов.
Из таблицы следует, что клинические характеристики пациентов двух групп практически не различались.
После хирургического вмешательства (ТЭТС) все пациенты в течение первых суток находились в отделении реанимации и интенсивной терапии, затем переводились в отделение ортопедии. Профилактика тромботических осложнений осуществлялась путём ношения компрессионных чулок и назначения антикоагулянтов. На протяжении первых трёх суток, начиная с интраоперационного введения, проводилась антибиотикотерапия для профилактики послеоперационных инфекционных осложнений. Активизация пациентов после операции проводилась через 24–36 часов с использованием костылей; обеспечивалась дозированная, постепенно нарастающая нагрузка на оперированную конечность, проводились занятия с инструктором по лечебной физкультуре.
Результаты
Сравнительный анализ течения операции у пациентов с первичным ТЭТС (I группа) и у пациентов с предшествующей декомпрессией очага некроза (II группа) показал отсутствие значимых технических интраоперационных сложностей. В I группе ТЭТС продолжалась в среднем 85 ± 25 минут, во II группе – 80 ± 20 минут, то есть практически одинаковое время. Различия между группами отсутствовали также и в отношении объёма интраоперационной кровопотери: 300 ± 100 мл и 300 ± 100 мл соответственно, причём ни у одного из пациентов общая кровопотеря не была свыше 500 мл.
Выживаемость эндопротеза тазобедренного сустава оказалась 100 %-й в обеих группах; ни в одном из 44 наблюдений не потребовалось ревизионного вмешательства.
Осложнения в послеоперационном периоде были выявлены у 4 пациентов I группы (первичное ТЭТС) и у 1 пациента II группы (вторичное ТЭТС). Структура осложнений отражена в таблице 2.
Поверхностное воспаление операционной раны было диагностировано у 1 (3,3 %) пациента I группы и у 1 (7,1 %) пациента II группы. Различия статистически недостоверны: критерий χ 2 Пирсона был равен 0,573, критерий Фишера – 0,54017. Следует отметить, что данное осложнение не потребовало дополнительных хирургических вмешательств и было купировано пероральной антибио-тикотерапией.
Таблица 1. Сравнительная клиническая характеристика пациентов двух групп
Table 1. Comparative clinical characteristics of the patients of two groups
|
Клинический параметр |
I группа (первичное ТЭТС), n = 30 |
II группа (вторичное ТЭТС), n = 14 |
|
Возраст, лет |
41,12 ± 8,2 |
44,64 ± 7,9 |
|
Мужчины/женщины, % |
73,3 / 26,7 |
71,4 / 28,6 |
|
Двусторонний процесс, % |
66,6 |
85,7 |
|
Оценка по ВАШ боли, баллы |
6,61 ± 1,8 |
5,82 ± 0,8 |
|
Оценка по шкале Harris’а, баллы |
58,03 ± 5,9 |
64,70 ± 6,5 |
Таблица 2. Осложнения после ТЭТС в двух группах пациентов Table 2. Complications after knee endoprosthetics in two groups of patients
|
Осложнение |
I группа (первичное ТЭТС), n = 30 |
II группа (вторичное ТЭТС), n = 14 |
|
Поверхностная инфекция, n (%) |
1 (3,3) |
1 (7,1) |
|
Вывихи эндопротеза, n (%) |
1 (3,3) |
0 (0) |
|
Параимплантный остеолизис, n (%) |
2 (6,6) |
0 (0) |
|
Всего, n (%) |
4 (13,3) |
1 (7,1) |
Вывих эндопротеза отмечен у одного пациента из I группы (первичное ТЭТС) через 2 месяца после операции вследствие нарушений рекомендаций относительно физической активности. После закрытого вправления вывиха и подтверждённой конкретной топографией эндопротеза в дальнейшем послеоперационный период протекал без осложнений.
Через 12 месяцев после ТЭТС у двух (6,7 %) пациентов I группы при рентгенографии был выявлен остеолизис вокруг элемента эндопротеза в области вертлужной впадины. Во II группе данное осложнение ни у одного из пациентов выявлено не было.
Что касается динамики болевого синдрома, то у пациентов обеих групп после ТЭТС отмечена положительная динамика. И в I, и во II группах установлено значительное снижение оценки по ВАШ боли (рис. 4).
В I группе (первичное ТЭТС) интенсивность боли снизилась с дооперационных 6,61 ± 1,8 до 1,01 ± 0,3 баллов через год после операции. Во II группе (вторичное ТЭТС) динамика также была удовлетворительной: отмечено снижение оценки по ВАШ боли с 5,82 ± 0,8 баллов до операции до 0,86 ± 0,2 баллов через 12 месяцев после операции.
Согласно динамике оценки по шкале Harris’а ТЭТС было в равной степени эффективной у пациентов двух групп (рис. 5).
В I группе (первичное ТЭТС) оценка по шкале Harris’а до операции была равна 58,03 ± 5,9 балла, после операции: через 3 месяца – 71,24 ± 6,9 балла, через 6 месяцев – 80,65 ± 10,2 балла, через год – 87,85 ± 9,9 балла. Во II группе средняя оценка по шкале Harris’а прогрессивно росла с 64,70 ± 6,5 баллов до операции до 80,21 ± 9,2 баллов через 3 месяца после операции, 88,57 ± 10,8 баллов через 6 месяца после операции и 94,07 ± 10,2 баллов через12 месяцев после операции. Повышение оценки в I группе произошло в 1,51 раза, во II группе – в 1,45 раза.
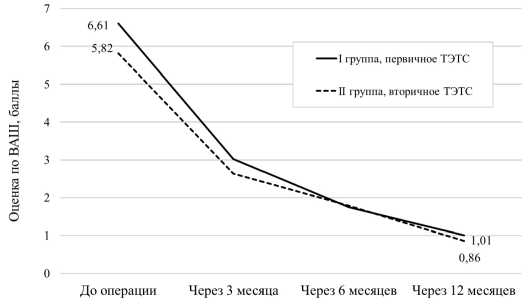
Рисунок 4. До- и послеоперационные оценки по ВАШ боли у пациентов двух групп
Figure 4. Pre- and postoperative VAS pain scores in patients of the two groups of patients
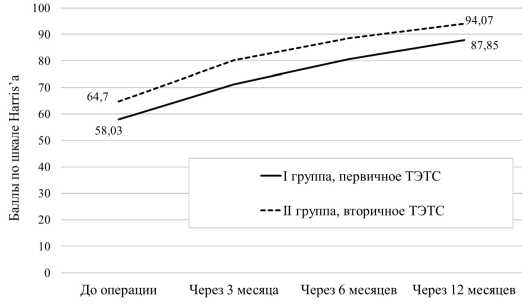
Рисунок 5. До- и послеоперационные оценки по шкале Harris’а у пациентов двух групп
Figure 5. Pre- and postoperative Harris scale scores in two groups of patients
Обсуждение
В настоящей работе проведён сравнительный анализ осложнений ТЭТС у двух категорий пациентов с остеонекрозом головки бедренной кости: пациенты с поздними стадиями заболевания (первичное ТЭТС) и пациенты с неэффективной декомпрессией очага некроза в анамнезе (вторичное ТЭТС). Нами рассматривалась частота следующих осложнений: воспаление операционной раны, вывих головки эндопротеза, наличие рентгенологических признаков остеолизиса вокруг компонентов эндопротеза.
По данным литературы, в конце ХХ века выживаемость сустава после ТЭТС составляла около 80 % и значительно выросла – до 100 % в ХХI веке [18–20]. Вероятно, это связано с улучшением качества эндопротезов и совершенствованием техники операций. В нашем исследовании выживаемость эндопротеза составила 100 % в обеих группах.
Поверхностное воспаление операционной раны было диагностировано нами у 3,3 % пациентов I группы и у 7,1 % пациентов II группы. Различия статистически недостоверны. Наши результаты согласуются с литературными данными, где также отмечается низкая частота воспалительных осложнений после ТЭТС [21, 22].
В настоящем исследовании вывих эндопротеза отмечен в одном наблюдении у молодого пациента 32 лет (первичное ТЭТС). По данным литературы, вывихи эндопротеза после ТЭТС чаще отмечаются у пациентов с остеонекрозом, чем с остеоартритом, вследствие более молодого возраста пациентов и их стремления к скорейшему восстановлению двигательной активности [18, 21].
Остеолизис, как проявление неадекватной остеоинтеграции эндопротеза, считается неблагоприятным признаком [24, 25]. По результатам исследования D. Wang и соавт. (мета-анализ), остеолизис чаще диагностируется после ТЭТС при декомпрессии очага некроза в анамнезе (11,1 %), чем после первичного ТЭТС (3 %) [7]. Данное осложнение (остеолизис вокруг компонента эндопротеза) было выявлено нами у 6,7 % пациентов I группы (первичное ТЭТС). Соответственно, мнение D. Wang и соавт. нашим исследованием не подтверждается.
В настоящем исследовании в обеих группах выявлена удовлетворительная положительная динамика восстанов- ления функции тазобедренного сустава. В I группе (первичное ТЭТС) оценка по шкале Harris’а до операции была равна 58,03 ± 5,9 балла, через год после операции – 87,85 ± 9,9 балла. Во II группе средняя дооперационная оценка по шкале Harris’а была 64,70 ± 6,5 балла и достигла 94,07 ± 10,2 балла через 12 месяцев после ТЭТС. Улучшение функции тазобедренного сустава после ТЭТС отмечено многими исследователями. По мнению K.E. Wamper и соавт., высокие оценки по шкале Harris’а, от 85 до 97 баллов, после операции являются свидетельством эффективности ТЭТС [3, 6]. Наше мнение согласуется с приведёнными выше. Также, как и нами, было показано, что функциональные результаты после ТЭТС не зависят от показаний к операции [26].
Заключение
Проведённое исследование продемонстрировало высокую эффективность ТЭТС при остеонекрозе головки бедренной кости как в отсутствие предшествующих операций на суставе, так и при наличии декомпрессии очага некроза в анамнезе.
Установлено достоверное значимое снижение интенсивности болевого синдрома (по ВАШ боли), а также улуч- шение функционального состояния тазобедренного сустава (по шкале Harris’а) пациентов как после первичного ТЭТС, так и после вторичного ТЭТС.
Операция ТЭТС после предшествующей декомпрессии очага некроза не сопровождается дополнительными интраоперационными техническими трудностями: длительность оперативного вмешательства и объём интраоперационной кровопотери не различались у двух категорий пациентов.
Характер и частота осложнений после ТЭТС не зависела от наличия в анамнезе декомпрессии очага некроза. Соответственно следует признать, что вторичное ТЭТС является эффективным и относительно безопасным хирургическим вмешательством.
Выводы
ТЭТС у пациентов с декомпрессией очага некроза в анамнезе является эффективным методом лечения остеонекроза головки бедренной кости, не сопровождается интраоперационными техническими трудностями и характеризуется низкой частотой осложнений. Предшествующая декомпрессия очага некроза не является дополнительным фактором риска интра- и послеоперационных осложнений ТЭТС.
Список литературы Тотальное эндопротезирование тазобедренного сустава после предшествовавшей декомпрессии очага некроза: эффективность и осложнения
- Shigemura T, Yamamoto Y, Murata Y, Sato T, Tsuchiya R, Mizuki N, et al. Total hip arthroplasty after failed transtrochanteric rotational osteotomy for osteonecrosis of the femoral head: A systematic review and meta-analysis. Orthop Traumatol Surg Res. 2018;104:1163-70.
- Shigemura T, Yamamoto Y, Murata Y, Sato T, Tsuchiya R, Wada Y. Total hip arthroplasty after a previous pelvic osteotomy: A systematic review and metaanalysis. Orthop Traumatol Surg Res. 2018;104:455-63.
- Wamper KE, Sierevelt IN, Poolman RW, Bhandari M, Haverkamp D. The harris hip score: Do ceiling effects limit its usefulness in orthopedics? Acta Orthop. 2010;81:703-7.
- Tilbury C, Haanstra TM, Leichtenberg CS, Verdegaal SH, Ostelo RW, de Vet HC, et al. Unfulfilled expectations after total hip and knee arthroplasty surgery: There is a need for better preoperative patient information and education. J Arthroplasty. 2016;31:2139-45.
- Scott CE, Bugler KE, Clement ND, MacDonald D, Howie CR, Biant LC. Patient expectations of arthroplasty of the hip and knee. J Bone Joint Surg Br. 2012;94:974-81.
- Jain D, Bendich I, Nguyen LL, Nguyen LL, Lewis CG, Huddleston JI, et al. Do patient expectations influence patient-reported outcomes and satisfaction in total hip arthroplasty? A prospective, multicenter study. J Arthroplasty. 2017;32:3322-7.
- Wang Deng , Zhaolun Wang , Yixin Zhou, Hongyi Shao , Dejin Yang , Hua Li. Does prior core decompression have detrimental effect on subsequent total hip arthroplasty for osteonecrosis of the femoral head: A systematic review and meta-analysis. Orthopaedics & Traumatology: Surgery & Research. 2020; 106:1553-1560.
- Boachie-Adjei Y, Ko JWK, Cui Q. Total hip arthroplasty after failed operative treatment for osteonecrosis of the femoral head. Semin Arthroplasty. 2008;19:267-73.
- Cheng Q, Tang JL, Gu JJ, Guo KJ, Guo WS, Wang BL et al. Total hip arthroplasty following failure of tantalum rod implantation for osteonecrosis of the femoral head with 5- to 10-year follow-up. BMC Musculoskelet Disord. 2018;19:289.
- Lee GW, Park KS, Kim DY, Lee YM, Eshnazarov KE, Yoon TR. Results of total hip arthroplasty after core decompression with tantalum rod for osteonecrosis of the femoral head. Clin Orthop Surg. 2016;8:38-44.
- Owens JB, Ely EE, Guilliani NM, Suarez JC, Patel PD. Removal of trabecular metal osteonecrosis intervention implant and conversion to primary total hip arthroplasty. J Arthroplasty. 2012;27:1251-3.
- Olsen M, Lewis PM, Morrison Z, McKee MD, Waddell JP, Schemitsch EH. Total hip arthroplasty following failure of core decompression and tantalum rodimplantation. Bone Joint J . 2016;98:1175-9.
- Pierce TP, Elmallah RK, Jauregui JJ, Verna DF, Mont MA. Outcomes of total hip arthroplasty in patients with osteonecrosis of the femoral head-a current review. Curr Rev Musculoskelet Med. 2015;8:246-51.
- Kim YH, Park JW, Kim JS. Alumina delta-on-alumina delta bearing in cementless total hip arthroplasty in patients aged < 50 years. J Arthroplasty. 2016;31:2209-14.
- Kim YH, Park JW, Kim JS. Long-term results of third-generation ceramic-on-ceramic bearing cementless total hip arthroplasty in young patients. J Arthroplasty. 2016;31:2520-4.
- Aluisio FV, Urbaniak JR. Proximal femur fractures after free vascularized fibular grafting to the hip. Clin Orthop Relat Res. 1998;356:192-201.
- Stronach BM, Duke JN, Rozensweig SD, Stewart RL. Subtrochanteric femur fracture after core decompression and placement of a tantalum strut for osteonecrosis of the femoral head. J Arthroplasty. 2010;25, doi.org/10.1016/j.arth.2009.08.008
- Ortiguera CJ, Pulliam IT, Cabanela ME (1999) Total hip arthroplasty for osteonecrosis: matched-pair analysis of 188 hips with long-term follow-up. J Arthroplast. 14:21-28.
- Johnson A.J., Mont M.A., Tsao A.K., Jones L.C. Treatment of femoral head osteonecrosis in the United States: 16-year analysis of the nationwide inpatient sample. Clin Orthop RelatRes. 2014;472:617-623.
- Matthias J, Bostrom MP, Lane JM. A Comparison of Risks and Benefits Regarding Hip Arthroplasty Fixation. J Am Acad Orthop Surg Glob Res Rev. 2021 Nov 1;5(11):e21.00014. https://doi.org/10.5435/JAAOSGlobal-D-21-00014
- Ancelin D, Reina N, Cavaignac E, Delclaux S, Chiron P Total hip arthroplasty survival in femoral head avascular necrosis versus primary hip osteoarthritis: case-control study with a mean 10-year follow-up after anatomical cementless metal-on-metal 28- mm replacement. Orthop Traumatol Surg Res. 2016;102:1029-1034.
- Erivan R, Caputo T, Riouach H, Villatte G, Perreira B, Descamps S, Boisgard S. Primary total hip replacement in Ficat-Arlet stage 3 and 4 osteonecrosis: a retrospective study at a minimum 12-year follow-up. Eur J Orthop Surg Traumatol. 2020 Jul;30(5):845-850. https://doi.org/10.1007/s00590-020-02644-z
- Ollivere B., Wimhurst J.A., Clark I.M., Donell S.T. Current concepts in osteolysis. J Bone Joint Surg Br. 2012;94:10-15.
- Howie D.W., Neale S.D., Haynes D.R., Holubowycz O.T., McGee M.A., Solomon L.B. et al. Periprosthetic osteolysis after total hip replacement: Molecular pathology and clinical management. Inflammopharmacology. 2013;21:389-396.
- Osawa Y, Seki T, Takegami Y, Kasai T, Higuchi Y, Ishiguro N Do femoral head collapse and contralateral condition affect patient-reported quality of life and referral pain in patients with osteonecrosis of the femoral head? Int Orthop. 2018 Mar 9. https://doi. org/10.1007/s00264-018-3867-1


