Трансформация биохимических процессов в почве при загрязнении лекарственными препаратами
Автор: Трегубова П.Н., Аброськин Д.П., Волкова Е.А., Жеребкер А.Я., Николаев Е.Н.
Журнал: Бюллетень Почвенного института им. В.В. Докучаева @byulleten-esoil
Рубрика: Спецвыпуск по результатам молодежной конференции
Статья в выпуске: S1, 2024 года.
Бесплатный доступ
Лекарственные препараты и средства для личной гигиены (ЛППГ) являются новым типом загрязняющих веществ, регулярно детектируемых в природных средах, в первую очередь, в пресноводных источниках и сточных водах. В настоящее время собрана обширная база случаев обнаружения ЛППГ и в почвах, и проблема загрязнения данными эмерджентными веществами особенно актуальна для агроландшафтов. Целью исследования была оценка влияния ряда ЛППГ на процессы, протекающие в ризосфере на примере тестового растения. При проведении исследования предполагали, что попадание выбранных ЛППГ в почву может изменять биохимические процессы в ризосфере, влияя на активность микробного сообщества, в связи с чем могут изменяться характеристики лабильного пула органического вещества. В краткосрочном инкубационном эксперименте на гумусовом горизонте чернозема миграционно-мицелярного, исследовали влияние от ЛППГ, относящихся к наиболее актуальным терапевтическим группам и обнаруженных в природных средах: ципрофлоксацин (антибиотик), кетопрофен (анальгетик), атенолол (бета-блокатор), клотримазол (антигрибковое средство). Препараты вносили в почву в градиенте концентраций; в качестве модельного растения использовали салат латук (Lactúca satíva). По окончании эксперимента значимым образом отличались от контроля биомасса побегов и корней, показатели ферментативной активности. Преимущественно отличия от контрольных образцов выражались в ингибирующем эффекте, в то же время в ряде случаев наблюдалось повышение показателей. Отмечено изменение состава растворенного органического вещества почвы ризосферы: по общему набору показателей от контрольного образца отличались варианты со вносом препаратов даже в низких концентрациях для ципрофлоксацина, кетопрофена и атенолола. Наблюдаемый эффект от внесения лекарственных препаратов можно объяснить как буферной емкостью исследованной почвы, так и биологической активностью почв, в частности, ризосферного сообщества, в то время как изменения носили нерегулярный характер.
Загрязнение почв, эмерджентные загрязняющие вещества, растворенное органическое вещество, ферментативная активность, масс-спектрометрия
Короткий адрес: https://sciup.org/143183579
IDR: 143183579 | УДК: 631.4 | DOI: 10.19047/0136-1694-2024-SPYC-126-163
Текст статьи Трансформация биохимических процессов в почве при загрязнении лекарственными препаратами
Исследование выполнено за счет гранта Российского научного фонда № 22-24-01103,
The research was supported by the Russian Science Foundation grant No. 22-24-01103,
Потребление лекарственных препаратов и продуктов личной гигиены (ЛППГ) возрастает вместе с ростом населения, увеличением ожидаемой продолжительности жизни и изменением образа жизни, что приводит к значительным инвестициям в производство медикаментов и продуктов ухода за собой и увеличению объема их производства (McKinsey, Company, 2021; González et al., 2021).
Спектр обсуждаемых проблем в контексте ЛППГ сегодня вышел далеко за пределы вопросов производства, эффективности и доступности препаратов, и в последние годы включает в себя также возрастающую обеспокоенность относительно попадания ЛППГ и их производных в природные среды, что привело к появлению новой концепции загрязнения эмерджентными загрязняющими веществами (Водяницкий, Кириллова, 2016). В то время как долгосрочные последствия загрязнения биосферы ЛППГ в целом являются предметом научного исследования, феномен антибиоти-корезистентности, обусловленный широким и слабо контролируемым распространением антибиотиков, уже сейчас понимается как глобальная проблема с высокой вероятностью катастрофических последствий (Daughton, Ternes, 1999; World Health Organization, 2014; Zheng et al., 2020; Chinemerem Nwobodo et al., 2022; Li et al., 2022).
Изучение влияния загрязнения ЛППГ природных сред изначально и до настоящего времени во многом сфокусировано на их присутствии в акваториях, включая оценку изменения качества воды, состава донных отложений и изменения физиологии биоты (Ebele et al., 2017). В то же время в большом количестве случаев почвы являются самым первым барьером на пути распространения загрязняющих веществ по ландшафтам и по звеньям пищевых цепочек.
Устойчивость почв к внешним воздействиям и их способность поддерживать функционирование сопредельных экосистем определяется характеристиками “здоровья” почв, включающими в себя в первую очередь характеристики континуума почвенного органического вещества (ПОВ), физических свойств почв, в том числе, гранулометрический состав и агрегированность, показатели биоразнообразия (Lehmann et al., 2020). В этой связи особенный интерес представляют почвы агроландшафтов, находящиеся под воздействием высокой антропогенной нагрузки, сопровождаемой, в частности, воздействием биодоступных и мобильных загрязняющих веществ. Таким образом, почвы сельскохозяйственных территорий, как правило, высоко деградированы и характеризуются ухудшением перечисленных показателей (Saleem et al., 2019). В то же время почвы сельскохозяйственных ландшафтов выполняют важнейшие обеспечивающие услуги, являясь средой и источником производства продовольствия, сырья, топлива, а также естественным источником веществ, входящих в состав многих ЛППГ. Следовательно, проблема деградации сельскохозяйственных почв затрагивает одновременно как вопросы продовольственной безопасности, так и защиты окружающей среды (Rodriguez-Eugenio et al., 2018; Hossain et al., 2020; Lehmann et al., 2020).
Объединенные в рамках одного понятия ЛППГ представляют собой большое количество веществ с весьма отличающимися физико-химическими и биологическими свойствами. По обобщенным данным, собранным в открытых источниках (Graumnitz, Jungmann, 2021), в почвах обнаружены сотни уникальных веществ, относящихся к ЛППГ. Исследования взаимодействия часто встречающихся ЛППГ с компонентами почвенных экосистем важны, поскольку результаты таких исследований являются основой для устойчивого управления ресурсами в свете растущих темпов загрязнения. В то же время знания сообщества в этой области ограничены существующими данными, относящимися к небольшим площадям территорий исследования, периодам времени сбора данных и избирательности анализа обнаружения веществ в комплексных средах, таких как почвы.
Согласно исследованиям, концентрации ЛППГ, обнаруженных в почвах, чаще всего относительно невелики и редко превышают микрограммы на килограмм сухого вещества (Graumnitz, Jungmann, 2021). Однако к настоящему моменту уже описаны случаи загрязнения антибактериальными и противомикробными средствами в количествах вещества препаратов, достигающих десятки и даже сотни миллиграмм на сухое вещество почвы. Случаи такого высокого уровня загрязнения обычно связаны с территориями свалок, животноводческих угодий или участков обработки почв органическими удобрениями на основе отходов животноводства и осадков сточных вод (Leal et al., 2012; Hou et al., 2015; Arun et al., 2020).
В то время как вопросам устойчивости и потенциалу транслокации веществ по элементам ландшафтов, в том числе, в живые организмы, посвящено большое количество исследований, большой интерес также представляет изучение динамики изменения процессов трансформации почвенного органического вещества (ПОВ) и элементов питания под воздействием загрязнения, как в контексте воздействия малых доз, так и высоких. В настоящее время показано, что ЛППГ, их производные и метаболиты, будучи биологически активными веществами, могут влиять на активность почвенных микроорганизмов и на их разнообразие (Drzymala, Kalka, 2023; Frkova et al., 2020; Gallego et al., 2021; Lagos et al., 2023). Поскольку почва является крупнейшим наземным резервуаром углерода на планете (Lehmann et al., 2020; Wiesmeier et al., 2019), исследовательский интерес представляют вопросы трансформации процессов, напрямую влияющих на динамику компонентов ПОВ.
С учетом вышеобозначенных проблем целью настоящего исследования являлось изучение влияния ЛППГ на свойства почв на примере продуктов фармацевтической промышленности, а именно – выявление особенностей взаимодействий поллютантов с системой почва–микроорганизмы–растения на примере выбранных веществ с фокусом на процессы, протекающие в ризосфере. При проведении эксперимента сформулировали следующую рабочую гипотезу: внесение лекарственных препаратов выше определенного порога изменяет биохимические процессы в почвах, влияя на активность микробного сообщества, в том числе на данные характеристики микробного сообщества ризосферы. Изменяются характеристики лабильного пула органического вещества. Предполагаемый эффект от препаратов изменяется линейно. Эффект для почвы, относящейся к ризосфере, отличается от эффекта для почвы без корней. Таким образом в задачи исследования входило:
-
1) оценка влияния выбранных лекарственных препаратов на химические и биологические свойства почв и состояние растений; 2) оценка изменения активности микробного сообщества ризосферы выбранного тест-растения.
ОБЪЕКТЫ И МЕТОДЫ
Объект исследования – почва, отобранная из гумусового горизонта чернозема миграционно-мицелярного среднемощного тяжелосуглинистого на лёссовидном карбонатном суглинке. Перед началом эксперимента почву измельчили, просеяли через сито 2 мм. Навески воздушно-сухой почвы (450 г) распределили по тарам объемом 750 мл и довели влажность в почве до уровня 55% наименьшей влагоемкости (данный уровень влаги поддерживался на протяжении всего эксперимента).
В качестве загрязняющих веществ были использованы лекарственные препараты из разных, часто используемых терапевтических групп: кетопрофен, ципрофлоксацин, клотримазол и атенолол.
-
1. Кетопрофен (Ci 6 Hi 4 O3 ) - нестероидное противовоспалительное средство. Механизм действия связан с ингибированием циклоксигеназы, что приводит к уменьшению синтеза простагландинов и, следовательно, к снижению воспаления, боли и лихорадки. Относится к одним из наиболее часто потребляемых препаратов. Практически нерастворим в воде, хорошо растворим в органических растворителях (DMSO).
-
2. Ципрофлоксацин (Ci 7 Hi 8 FN3 O3 ) - антибиотик группы фторхинолонов – наиболее часто встречающихся веществ при исследовании загрязнения ЛППГ окружающей среды. Механизм действия основан на ингибировании бактериального фермента ДНК-гиразы, что приводит к нарушению синтеза ДНК бактерий, остановке их роста и размножения. Легко растворяется в воде.
-
3. Атенолол (Ci 4 H2 2 N2 Оз ) — бета-блокатор. Механизм действия основан на блокировке бета-адренорецепторов в организме. Относится к одним из наиболее часто прописываемых препаратов, также часто встречается в окружающей среде несмотря на малое время периода разложения. Легко растворяется в воде.
-
4. Клотримазол (C2 2 Hi 7 CIN2 ) — противогрибковое средство. Механизм действия основан на ингибировании синтеза эргостерола, важного компонента клеточных мембран грибков, что приводит к изменению структуры мембраны и гибели клеток. Малорастворим в воде.
Препараты вносили в почву, уже распределенную по тарам, в виде водных растворов или суспензий в градиенте концентраций: атенолол и ципрофлоксацин от 0.01 до 10 мг/кг, клотримазол – от 0.001 до 1 мг/кг, кетопрофен от 0.005 до 5 мг/кг. Концентрации подбирали согласно данным из открытых источников об обнаруженных уровнях выбранных препаратов в сельскохозяйственных почвах (Graumnitz, Jungmann, 2021) так, чтобы градиент включал в себя как минимальные и средние встречающиеся концентрации, так и повышенные, что характерно для разных сценариев загрязнения и накопления загрязняющих веществ. Варианты эксперимента закладывали в трехкратной повторности.
В результате каждый тип загрязняющего вещества был представлен 12 образцами (табл. 1). Препараты вносили дважды – в начале и в середине инкубации в выбранных концентрациях. В эксперименте использовали чистые препараты веществ производства Tokyo Chemical Industry (TCI).
На следующий день после внесения лекарственных препаратов начинали проращивание модельного растения, салата латук ( Lactúca satíva L.). Салат латук – распространенный выбор для экспериментов, ориентированных на проведение токсикологических исследований.
При достижении технической спелости салата растения были извлечены из тары и взвешены, а почва, находящаяся на их корнях, была аккуратно отобрана для исследования биологических и химических свойств почвы (ферментативная активность; углерод микробной биомассы – C micro ) и характеристик растворенного органического вещества (РОВ) почвы. Каждое растение было разделено на органы надземной и подземной фитомассы. Высушенные листья и стебли салата взвешивались отдельно от высушенных корней.
Таблица 1. Варианты внесения препаратов с выбранными дозировками и соответствующими шифрами, используемыми при описании результатов экспериментов
Table 1. Variants of soil treatment with pharmaceuticals at selected dozes and corresponding codes used when describing the results of experiments
|
Препарат |
Дозировка (мг/кг почвы) |
Шифр |
|
Кетопрофен |
0.005 |
KETO-1 |
|
0.05 |
KETO-10 |
|
|
0.5 |
KETO-100 |
|
|
5.0 |
KETO-1000 |
|
|
Ципрофлоксацин |
0.01 |
CPR-1 |
|
0.1 |
CPR-10 |
|
|
1.0 |
CPR-100 |
|
|
10.0 |
CPR-1000 |
|
|
Клотримазол |
0.001 |
CLO-1 |
|
0.01 |
CLO-10 |
|
|
0.1 |
CLO-100 |
|
|
1.0 |
CLO-1000 |
|
|
Атенолол |
0.01 |
ATL-1 |
|
0.1 |
ATL-10 |
|
|
1.0 |
ATL-100 |
|
|
10.0 |
ATL-1000 |
Продолжение таблицы 1
Table 1 continued
|
Препарат |
Дозировка (мг/кг почвы) |
Шифр |
|
Контрольный образец (без растения) |
- |
control-bulk |
|
Контрольный образец (ризосфера) |
- |
control-plant |
Ферментативную активность микробного сообщества охарактеризовали активностью трех ферментов: фосфатазы, N-Ацетил-β-D-глюкозаминидазы и уреазы, участвующих в циклах углерода и элементов питания в почвах. Активность ферментов определяли колориметрически в 3 аналитических повторностях для каждой повторности варианта эксперимента, на фоне контро-лей, проанализированных в 2-кратной повторности (Schinner et al., 1996; Parham and Deng, 2000).
Фосфатаза – фермент, преобразующий органический фосфор в фосфаты. В качестве субстрата использовали гексагидрат п-нитрофенилфосфата натрия, образцы инкубировали в течение часа при температуре 37 °C. Интенсивность окраски определялась при длине волны 400 нм по концентрации 4-нитрофенола (его же использовали для построения калибровочной кривой).
N-Ацетил-β-D-глюкозаминидаза – фермент, отвечающий за расщепление олигосахаридов. Активность определяли с использованием 4-нитрофенил-n-ацетил-бета-d-глюкозаминида в качестве субстрата. Интенсивность окраски определялась при длине волны 405 нм по концентрации 4-нитрофенола (его же использовали для построения калибровочной кривой).
Уреаза – фермент, катализирующий гидролиз мочевины. Мочевину использовали в роли субстрата, инкубация протекала два часа при температуре 37 °C. Интенсивность окраски определяли при длине волны 660 нм по концентрации иона аммония (для построения калибровочной кривой использовали растворы, содержащие NH4+).
Концентрацию углерода микробной биомассы определяли методом фумигации-экстракции (Schinner et al., 1996; Макаров и др., 2016). Почву помещали в пробирки и оставляли в вакуумном эксикаторе на 24 часа для обработки парами хлороформа. Экстракцию проводили 0.05 М K 2 SO 4 . После получасового встряхивания на качалке суспензии фильтровали через фильтр “синяя лента”, полученные вытяжки разбавляли дистиллированной водой в соотношении 1 : 6 и анализировали на автоматическом анализаторе TOC-VCPN (Shimadzu). Расчет проводили по формуле:
Cмикр = (Cфумигированный–Cнефумигированный)/Kрастворения, где Kрастворения
0.45.
Структуру растворенного органического вещества исследовали методом масс-спектрометрии ионно-циклотронного резонанса. Предварительно получали водные вытяжки из свежих образцов, отобранных в конце эксперимента, при соотношении почва : раствор равном 1 : 10 и фильтрацией через мембранный фильтр с диаметром пор 0.45 мкм. Фильтраты декантировали с помощью 20 мл полипропиленового шприца и фильтровали через шприцевой фильтр с гидрофильной ПТФЭ мембраной 0.45 мкм. Раствор доводили до pH = 2 с помощью 0.1 M HCl. Затем проводили твердофазную экстракцию (Жеребкер и др., 2016) с помощью картриджей PPL (Bond Elut PPL, 1 мл 50 мг), которые активировали 1 мл метанола, затем 1 мл 0.01 М HCl. После этого через картридж пропускали ранее отфильтрованный и доведенный до pH = 2 почвенный раствор, а затем 2 мл 0.01 M HCl. Картриджи высушивали и элюировали 1 мл метанола. Полученные образцы использовали для получения спектров методом масс-спектрометрии ионно-циклотронного резонанса (ИЦР-МС) с преобразованием Фурье.
Получение спектров проводили на приборе Apex Ultra FT MS (Bruker Daltonics, Гамбург, Германия). Образцы в 10–20 раз разбавляли 50%-ным водно-метанольным раствором и с помощью микролитового насоса при скорости потока 90–120 мкл/мин непосредственно вводили в источник ионизации (электроспрей – ESI), работающий в режиме отрицательных ионов. Спектры получали в диапазоне масс m/z 200–1 000, для каждого спектра накапливали 200 сканов, использовали разрешение 1 000 000. Полученные CHONS формулы были скорректированы установкой ограничений, типичных для органических веществ природных сред: соотношение O/C ≤ 1, соотношение H/C в диапазоне от 0.3 до 2.2, количества элементов (C ≤50, 4< H ≤100, 2< O ≤25, N ≤2, S ≤1) и окно точности массы <0.5 ppm.
Полученные данные анализировали с помощью открытого языка программирования Python для получения описательных статистик: рассчитывали средние и 95% доверительные интервалы, значимость различий средних оценивали согласно критерию Краскела–Уоллиса для уровня значимости 0.05. Для выделения различий между вариантами эксперимента и контрольными образцами использовали метод снижения размерности – метод главных компонент, МГК с помощью библиотек scikit-learn, maths. Данные ИЦР-МС обрабатывали с помощью модифицированных скриптов пакета NOMspectra (Volikov et al., 2023) и scikit-learn.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты анализов позволяют как подтвердить, так и опровергнуть ряд из сформулированных исследовательских гипотез. По окончании эксперимента наблюдали изменения характеристик – однако изменения не демонстрировали линейность в соответствии с градиентами концентраций препаратов. Рассмотрим подробнее исследованные показатели.
Биомасса тест-культуры. Влияние поступления ЛППГ на физиологические процессы высших растений представляет большой интерес, поскольку транслокация и накопление загрязняющих веществ в растениях может оказывать воздействие на пищевые цепи, что важно как для здоровья человека, так и для функционирования природных экосистем. В то же время в контексте экономики замкнутого цикла, предусматривающей оптимизирован- ное использование и переиспользование ресурсов, поиск изменений в растениях в условиях загрязнения ЛППГ необходим для оценки безопасности использования органических и водных отходов, зачастую содержащих в себе различные количества лекарственных препаратов и их производных (Navrátilová et al., 2020; Meffe et al,. 2021; Gallego et al., 2022).
По окончании эксперимента суммарная фитомасса тест-культуры в чистых контрольных вариантах составляла порядка 89 ± 8 г (среднее и стандартное отклонение) сухого вещества, собранного с тары, использованной для проращивания. Для вариантов эксперимента с внесением ЛППГ в ряде случаев наблюдался значимо выраженный ингибирующий эффект, по сравнению с контролем, как для корней, так и побегов, наиболее заметный для корней (рис 1.). Для атенолола и клотримазола не наблюдалось снижение продуктивности растений, при этом в ряде вариантов отмечен высокий разброс между повторностями эксперимента.
По сравнению с контролем значимо снижена фитомасса корней салата в вариантах с внесением ципрофлоксацина в максимальной концентрации и кетопрофена в концентрациях на уровне 100. Фитомасса побегов при этом снижена для варианта CPR 100 и KETO 100, 1 000.
Изменение химических и биологических свойств почв ризосферы . Важнейшие биохимические процессы в системе почва–растение происходят в ризосфере, что определяет исследовательский интерес к прикорневой зоне почвы в целом, и при изучении влияния загрязняющих веществ, в частности. Микробное сообщество ризосферы регулирует циклы углерода и азота, элементов питания и напрямую влияет на рост и здоровье растений (Mendes et al., 2018; Li et al., 2021).
Фитомасса побегов, г
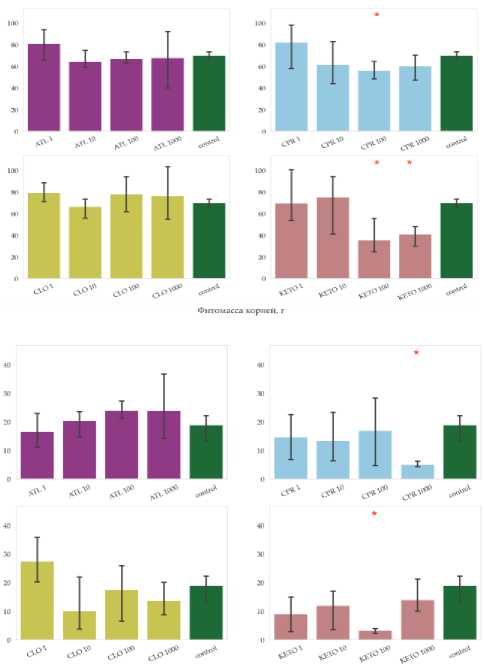
Рис. 1. Фитомасса корней и побегов тест-культуры, Lactúca satíva , в конце эксперимента. На графике показаны средние (n = 3) и 95% доверительные интервалы, красными звездами отмечены значимые различия средних согласно критерию Краскела–Уоллиса (p-value = 0.05). Расшифровка вариантов эксперимента приведена в таблице 1.
Fig. 1. Phytomass of roots and shoots of the test culture, Lactúca satíva , at the end of the experiment. Plots show means (n = 3) and 95% confidence intervals; red stars indicate significant differences in means according to the Kruskal–Wallis test (p-value = 0.05). Designations of variants of experiment are given in table 1.
Из-за высокой микробной активности ризосфера относится к горячим точкам (“hot-spot”) почвенных экосистем (Kuzyakov, Blagodatskaya, 2015). При этом авторами отмечается, что микробное сообщество ризосферы существенным образом отличается от сообщества почвы без корней и характеризуется сниженным видовым разнообразием (Sokol et al., 2022). В ряде работ показано, что в ризосфере может происходить ускоренное разложение органических субстратов, к которым могут относиться и некоторые классы загрязняющих веществ (Blagodatskaya, Kuzyakov, 2013; Grossberger et al., 2014). Однако в силу того, что ЛППГ являются вместе с тем биологически активными агентами, влияние ЛППГ на процессы, протекающие в ризосфере, остается в значительной степени неизвестным, а взаимодействие с ЛППГ может отличаться от ожидаемого ускорения скорости биологической деградации органических субстратов, к которым по своей сути относятся и лекарственные вещества.
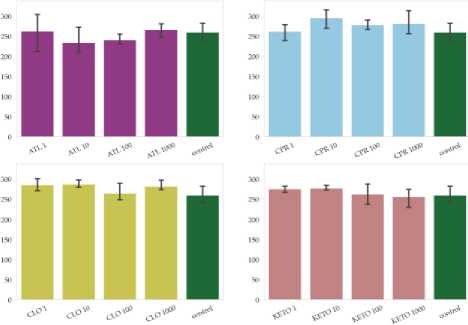
В рамках эксперимента были оценены показатели биологической активности на примере активности ферментов и углерода микробной биомассы. Из выбранного ряда ферментов, для фосфатазы и бетаглюкозаминидазы не было отмечено значимых изменений по отношению к чистому контролю почвы ризосферы (рис. 2). В то же время, по всей видимости, чувствительными ферментами могут быть уреазы, в чьей активности наблюдались значимые колебания как в сторону ингибирующего эффекта, так и в сторону небольшого повышения (рис. 3). Отмечено значимое снижение активности уреазы в вариантах с внесением атенолола на уровне концентраций 100, ципрофлоксацина на уровне концентраций 1 и 100, клотримазола и кетопрофена на уровне концентраций 10 и 1000. Значимо увеличивалась активность уреаз в варианте с внесением клотримазола на уровне, равном 100 частям.
В исследованиях по тематике показано, что ЛППГ могут влиять на цикл азота в почвах и связанные с этим процессы: в частности, отмечалось ингибирование нитрификации и снижение численности соответствующих бактерий, в то время как бактерии-нитрификаторы могут служить биологическими индикаторами потенциального токсического стресса (Lagos et al., 2023).
Активность бетггклюкоиминндил, мкгЫР/г/ч
Активность фосфотаз, mktNP/г/ч
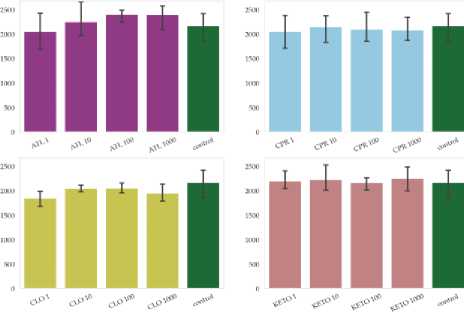
Рис. 2. Уровни ферментативной активности – бетаглюкозаминидазы и фосфатазы – почвы ризосферы по окончании эксперимента. На графике показаны средние (n = 3) и 95% доверительные интервалы. Расшифровка вариантов эксперимента приведена в таблице 1.
Fig. 2. Levels of enzymatic activity – betaglucosaminidase and phosphatase – in the rhizosphere soil at the end of the experiment. Plots show mean values (n = 3) and 95% confidence intervals. Designations of variants of the experiment are given in table 1.
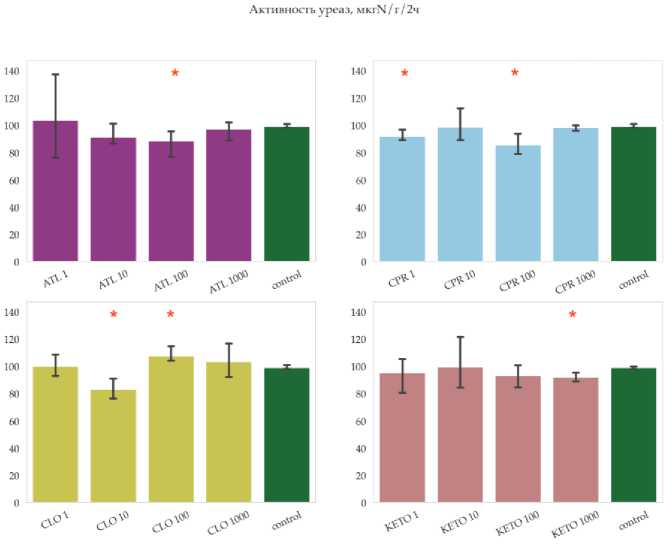
Рис. 3. Уровни активности уреаз почвы ризосферы по окончании эксперимента. На графике показаны средние (n = 3) и 95% доверительные интервалы, красными звездами отмечены значимые различия средних согласно критерию Краскела–Уоллиса (p-value = 0.05). Расшифровка вариантов эксперимента приведена в таблице 1.
Fig. 3. Levels of urease activity in the rhizosphere soil at the end of the experiment. Plots show means (n = 3) and 95% confidence intervals; red stars indicate significant differences in means according to the Kruskal–Wallis test (p-value = 0.05). Designations of variants of experiment are given in table 1.
На примере изучения влияния загрязнения тетрациклиновыми антибиотиками, с аналогичным набором изучаемых ферментов, не было отмечено негативного эффекта (или даже описан небольшой положительный эффект) на активность фосфомоноэстеразы и β-глюкозидазы, в то время как отрицательный эффект описывался для уреазы, особенно при повышении доз на фоне низкого содержания органического вещества (Santás-Miguel et al., 2021).
По окончании эксперимента значение углерода микробной биомассы в контрольных образцах составляло порядка 50 мг/кг, что существенно ниже значений по литературным данным, полученным при анализе образцов гумусовых горизонтов чернозема (Макаров и др., 2013; Семенов и др., 2016). Это можно объяснить предварительной подготовкой почвы к эксперименту, в процессе которой отобранные образцы высушивали и просеивали перед последующим инкубированием в лабораторных условиях.
В рамках эксперимента в некоторых вариантах отмечаются значимые отличия величин содержания углерода микробной биомассы от контроля (рис. 4).
Для атенолола отмечено повышение концентрации углерода микробной биомассы в вариантах эксперимента со значимыми различиями при минимальной и максимальной дозах внесения препарата, в то время как для ципрофлоксацина и кетопрофена отмечается ее снижение при повышении дозировки препаратов.
Динамика углерода микробной биомассы может свидетельствовать о способности сообщества к биологической деградации ксенобиотиков. В то же время попадание в почву новых биологически активных веществ может повлечь за собой смещения в экологическом профиле сообществ.
В исследованиях отмечается разное воздействие загрязнения ЛППГ на почвенный микробиом, включая отсутствие эффекта, ингибирующие и стимулирующие эффекты, проявляющиеся как при увеличении количеств загрязняющих веществ, так и в отсутствии четких закономерностей (Frkova et al., 2020; Drzymala, Kalka, 2023; Lagos et al., 2023). Например, было показано, что попадание ЛППГ может способствовать как увеличению углерода микробной биомассы (Ma et al., 2016), так и его снижению (Frkova et al., 2020). Неоднородную динамику показателей биологической активности почвы можно объяснить тем, что при попадании ЛППГ в почвы эффекты отклика – токсический эффект, состояние покоя и стимулирующий эффект – могут сменять друг друга на разных горизонтах времени.
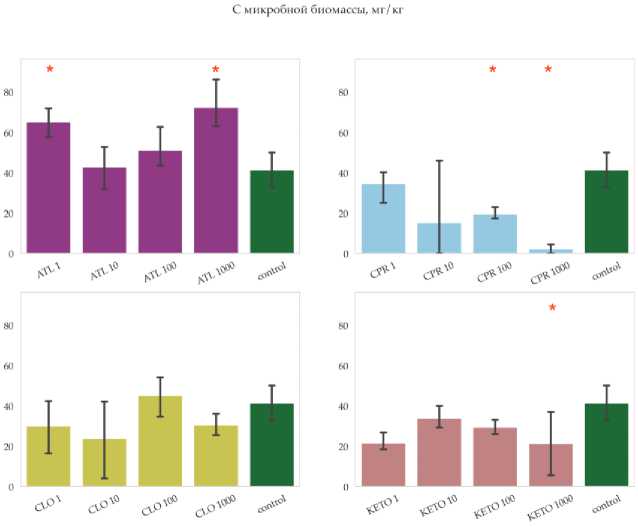
Рис. 4. Углерод микробной биомассы в почвах ризосферы в вариантах в конце эксперимента . На графике показаны средние (n = 3) и 95% доверительные интервалы, красными звездами отмечены значимые различия средних согласно критерию Краскела–Уоллиса (p-value = 0.05). Расшифровка вариантов эксперимента приведена в таблице 1.
Fig. 4. Carbon of microbial biomass in rhizosphere soils in variants at the end of the experiment. Plots show mean values (n = 3) and 95% confidence intervals; red stars indicate significant differences in means according to the Kruskal–Wallis test (p-value = 0.05). Designations of variants of experiment are given in table 1.
Молекулярные характеристики растворенного органического вещества. Из-за разнообразия молекулярных компонентов, входящих в состав органического вещества почв, любой метод экстракции будет направлен только на определенную фрак- цию (Bahureksa et al., 2021). В качестве такой фракции мы выбрали РОВ. РОВ составляет лишь небольшую долю от общего количества ПОВ, однако является наиболее мобильной и активной фракцией, оказывающей влияние на целый спектр биохимических процессов почв (Tfaily et al., 2017), в том числе на взаимодействие почвенных микроорганизмов и ЛППГ (Chen et al., 2015). Кроме того, РОВ играет важную роль во влиянии на динамику и взаимодействие питательных веществ и контаминантов с почвой и друг другом, а также на функции микроорганизмов, являясь чувствительным индикатором сдвигов в экологических процессах (Bolan et al., 2011).
Поскольку для РОВ характерен сложный состав, гетерогенная структура и нестехиометрическое строение (Холодов и др., 2023), для его анализа требуются высокочувствительные методы. Метод ИЦР-МС позволяет получить спектры с ультравысоким разрешением, и в настоящее время это единственный аналитический метод, способный определять отдельные молекулы в сложных смесях РОВ (Tremblay et al., 2007). Использование электроспрея (ESI) в качестве “мягкого” метода ионизации позволяет получать ионы, избегая фрагментации крупных молекул (Banerjee, Mazumdar, 2012).
В результате анализа образцов были получены масс-спектры ультравысокого разрешения с десятками тысяч индивидуальных пиков (рис. 5).
Последующий анализ данных включал в себя сравнение массового распределения молекул по косинусу, соотнесение молекул с классами органических веществ и анализ вклада этих классов в молекулярный ансамбль РОВ с помощью метода главных компонент (МГК).
Согласно сравнению по косинусу, в общем составе РОВ (рис. 6) отличия от контролей и между концентрациями заметны для ципрофлоксацина (CPR-100), также вариант с самой низкой концентрацией препарата (1) значительно отличался от контрольного образца.
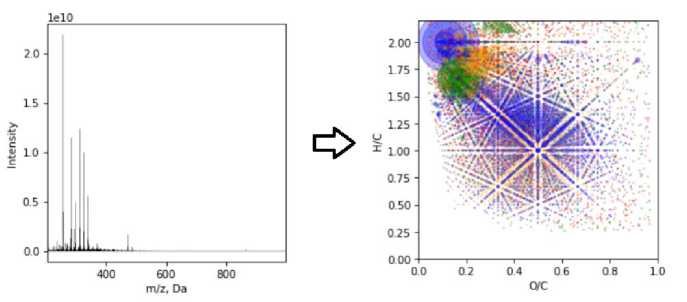
Рис. 5. Масс-спектр (19 803 пиков), диаграмма ван Кревелена (10 148 индивидуальных формул), образец ATL-1000.
Fig. 5. Mass spectrum (19 803 peaks), van Krevelen diagram (10 148 individual formulae), sample ATL-1000.
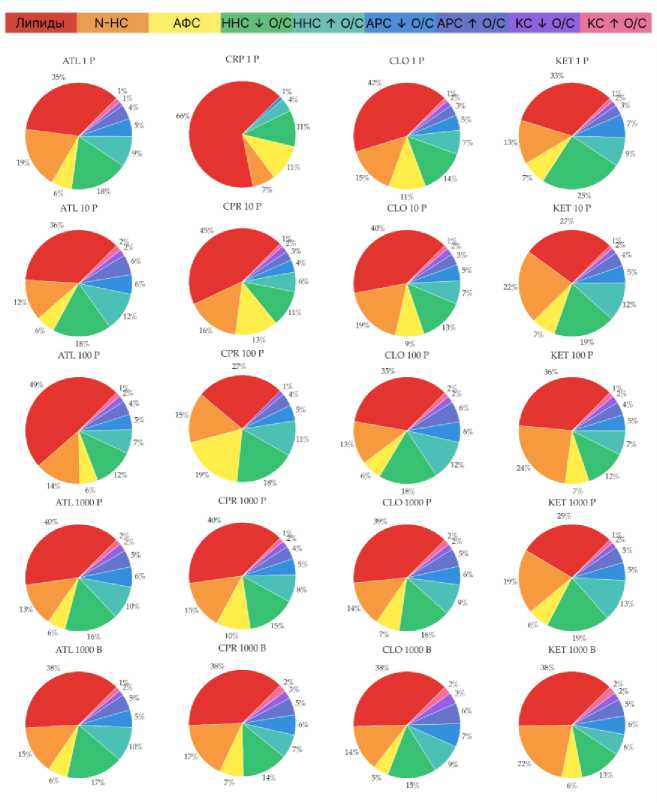
Анализ распределения классов органических веществ в составе РОВ показал, что контрольные варианты с растениями и без сходны по составу и существенно отличаются от остальных образцов (табл. 2, рис. 7).
В контрольном РОВ, выделенном из почвы без корней и ризосферы, соответственно, преобладают липиды (38.4 и 34.1%), насыщенные азотсодержащие соединения (16 и 17.9%) и ненасыщенные соединения с низким O/C (14.7 и 16.5%).
Относительно контроля в вариантах с добавлением кетопрофена можно отметить значительное снижение содержания липидов для KET-10 и KET-1000, снижение насыщенных азотсодержащих соединений (N-НС) в варианте KET-1, но повышение в остальных, а также общее снижение содержания алифатических соединений (АФС). В целом стоит отметить схожий молекулярный состав KET-10 и KET-1000.
При сравнении образцов ризосферного РОВ с контролем KET-1000-bulk зарегистрировано повышенное содержание в контроле всех фракций, кроме алифатических и ненасыщенных со- единений (ННС) с низким и высоким О/С – содержание данных фракций ниже или остается на том же уровне.
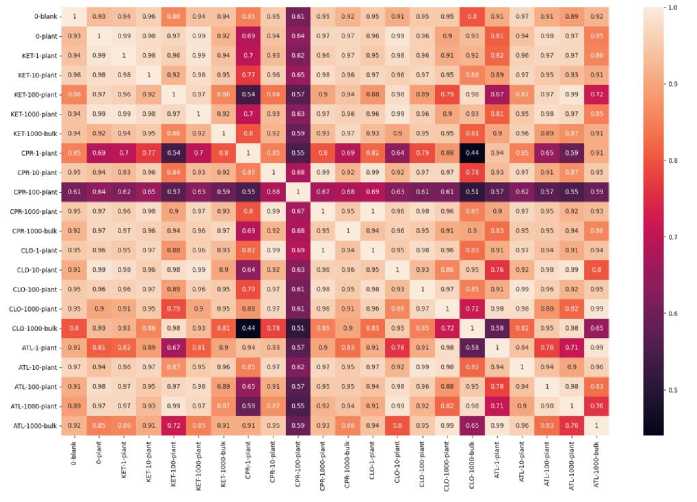
Рис. 6. Тепловая карта схожести молекулярного состава РОВ по косинусу. Центроидный вектор получен на основе данных о процентном содержании классов веществ в РОВ.
Fig. 6. Heat map of the similarity of the DOM molecular composition by cosine. The centroid vector is obtained based on the data on the percentage content of substance classes in DOM.
Таблица 2. Распределение основных классов органических соединений в
РОВ контрольных образцов почвы без корней и с корнями
Table 2. Distribution of the main classes of organic substances in the DOM of control soil samples without roots and with roots
|
Класс вещества |
Контроль, почва без корней |
Контроль, почва ризосферы |
|
Липиды |
38.37 |
34.12 |
|
N-НС |
16.04 |
17.87 |
|
АФС |
9.74 |
10.1 |
|
ННС с низким О/С |
14.71 |
16.53 |
|
ННС с высоким О/С |
7.68 |
9.55 |
|
АРС с низким О/С |
5.51 |
4.93 |
|
АРС с высоким О/С |
4.39 |
4.17 |
|
К/С с низким О/С |
2.15 |
1.6 |
|
К/С с высоким О/С |
1.45 |
1.15 |
Примечание. Обозначение О/С соответствует соотношению количества атомов кислорода к количеству атомов углерода в молекуле. Здесь и далее N-НС – насыщенные азотсодержащие соединения, АФС – алифатические соединения, ННС с низким О/С – ненасыщенные соединения с низким O/C, ННС с высоким О/С – ненасыщенные соединения с высоким O/C, АРС с низким О/С – ароматические соединения с низким O/C, АРС с высоким О/С – ароматические соединения с высоким O/C, К/С с низким О/С – конденсированные соединения с низким O/C, К/С с высоким О/С – конденсированные соединения с высоким O/C.
Note. Designation O/C corresponds to the ratio of the oxygen atoms number to the carbon atoms number in the molecule. Hereinafter N-NS – saturated nitrogen-containing compounds, AFS – aliphatic compounds, NNS with low O/C – unsaturated compounds with low O/C, NNS with high O/C – unsaturated compounds with high O/C, ARS with low O/C – aromatic compounds with low O/C, ARS with high O/C – aromatic compounds with high O/C, K/C with low O/C – condensed compounds with low O/C, K/C with high O/C – condensed compounds with high O/C.
Липиды N-HC АФС ННС Ф О/СННС Ф О/САРС Ф О/САРС Ф 0/С КС Ф 0/С кс ф о/с
Рис. 7. Молекулярный состав РОВ, %. На рисунках обозначения “P” и “B” относятся к образцам, отобранным из ризосферы и из почвы без корней.
Fig. 7. DOM molecular composition, %. Designation “P” denotes soil from rhizosphere and “B” – bulk soil samples.
В вариантах с добавлением ципрофлоксацина содержание всех классов соединений растет с повышением концентрации от 1 до 100, но слегка падает при достижении 1000. Исключением является липидная фракция, содержание которой, наоборот, понижается. Так же, как и в вариантах с кетопрофеном, наблюдается сходство молекулярного состава при концентрации препарата 100 и 1000. В целом состав образцов ризосферного РОВ при концентрации препарата 1000 схож с контролем CPR-1000-bulk, за исключением конденсированных соединений (К/С).
В вариантах с добавлением клотримазола молекулярный состав в меньшей степени зависит от концентрации ЛППГ. При повышении концентрации препарата наблюдается тенденция снижения содержания АФС и повышения содержания ароматических соединений. При сравнении образцов ризосферного РОВ с высокой концентрацией и контроля CLO-1000-bulk наблюдается сходство состава. Отличия заключаются в меньшем содержании АФС и большем – фракций ароматических соединений (АРС) и К/С.
В вариантах с добавлением атенолола содержание фракций липидов, N-НС, АФС и ННС между концентрациями значительно не меняется. Исключение – большее содержание N-НС в ATL-1, а также повышенное содержание липидов и пониженное ННС в образце ATL-100. Контроль ATL-1000-bulk в целом схож по составу с образцами ризосферного РОВ, особенно ATL-1, но имеет меньшее содержание ароматических и конденсированных соединений по сравнению с остальными вариантами.
В целом, как и в случае с ферментативной активностью и углеродом микробной биомассы, изменения вклада классов веществ в состав РОВ носят нерегулярный характер. Наиболее подвержены изменениям липиды и алифатические соединения. Как и предполагалось, содержание конденсированных и ароматических соединений изменяется в меньшей степени.
Стоит отметить, что изменения в большей степени зависят от типа вещества, а не от концентрации. CPR-1 и CPR-100 содержат наибольшее количество алифатических соединений и наиболее существенно отличаются от остальных образцов по составу.
С помощью МГК оценили совокупную разницу между характеристиками РОВ образцов почв по данным распределения классов органических веществ (рис. 8).
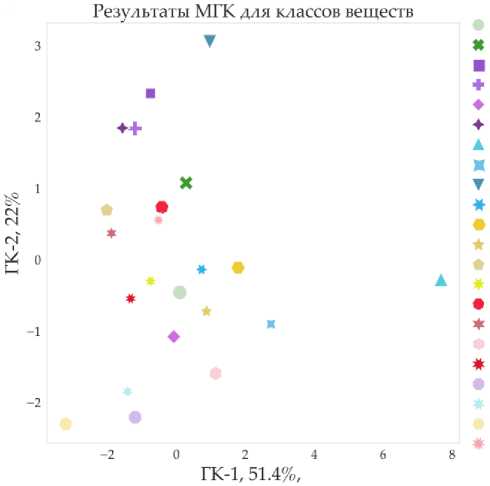
control bulk control plant KET1 P KET10 P KET 100 P KET 1000 P CRP 1 P CPR 10 P CPR 100 P CPR 1000 P CLO1P CLO 10 P CLO 100 P CLO 1000 P ATL 1 P ATL10 P ATL 100 P ATL 1000 P KET 1000 Б CPR 1000 В CLO 1000 В ATL 1000 В
Рис. 8. Результаты анализа методом главных компонент распределения основных классов органических веществ в вариантах эксперимента. Fig. 8. Results of principal component analysis of the distribution of the main classes of organic substances between experimental variants.
Первые две компоненты объясняют порядка 73% общей дисперсии данных. Заметно, что по отношению к контрольному образцу ризосферы ближе всего находятся варианты с внесением атенолола и кетопрофена. Варианты с внесением атенолола достаточно сгруппированы в пространстве двух первых компонент, как и образцы с внесением кетопрофена в концентрациях 1, 10 и 1000. Для ципрофлоксацина и клотримазола характерны большие раз- бросы между вариантами; все образцы почвы без корней с внесением ЛППГ существенно отличаются от контрольных образцов, особенно от образца ризосферы.
ВЫВОДЫ
Данная работа была направлена на оценку влияния загрязнения ЛППГ на примере атенолола, ципрофлоксацина, клотрима-зола и кетопрофена в градиентах концентраций на процессы в системе почва-растения на примере почвы гумусового горизонта чернозема и тест-культуры Lactúca satíva . В фокусе исследования была оценка изменения биологической активности почвы – активности ферментов фосфатазы, бетаглюкозаминидазы, уреазы, углерода микробной биомассы и изменения характеристик растворимого органического вещества (РОВ) почвы. Согласно полученным результатам, можно отметить влияние исследованных ЛППГ на показатели биологической активности почв и характеристики растворенного органического вещества, а также состояние тест-культуры, однако, проявленность эффектов не зависит линейно от концентраций внесения веществ в выбранной схеме эксперимента.
Ферментативная активность почвы существенным образом не изменялась, хотя было отмечено значимое снижение активности уреазы в вариантах с внесением атенолола на уровне концентраций 1 мг/кг, ципрофлоксацина на уровне концентраций 0.01 и 1 мг/кг, клотримазола и кетопрофена на уровне концентраций 0.01 и 1 мг/кг. Также наблюдали повышение ферментативной активности. В результате анализа молекулярного состава растворенного органического вещества было выявлено, что пептидные соединения, а также вещества из класса липидов наиболее подвержены изменениям. По общему набору показателей от контрольного образца отличались даже те варианты, в которые были внесены наименьшие концентрации препаратов ципрофлоксацина, кетопрофена и атенолола. Изменения вклада классов веществ в состав РОВ носит нерегулярный характер – наблюдалось как снижение вклада отдельных классов, так и увеличение.
Таким образом, наблюдаемый эффект от внесения ЛППГ нельзя охарактеризовать однозначно. Отсутствие закономерностей в отношении концентраций веществ можно объяснить динамичностью процессов в ризосфере и сложностью экологических процессов в соответствующем микробном сообществе, а также неоднородностью воздействия вносимых малых дозировок, – что согласуется с результатами зарубежных исследований по данной тематике. В целом, согласно полученным данным, можно заключить, что искусственное попадание ЛППГ в почвы даже в низких концентрациях может влиять на характеристики углеродного цикла и циклов элементов питания, а также сопровождаться ухудшением физиологических характеристик растений. Необходимо дальнейшее более подробное исследование характеристик микробного сообщества, а также оценка изменений во временной динамике.
Список литературы Трансформация биохимических процессов в почве при загрязнении лекарственными препаратами
- Водяницкий Ю.Н., Кириллова Н.П. Загрязнение почв и растений эмерджентными микрополлютантами // Агрохимия. 2016. № 5. С. 86-94.
- Жеребкер А.Я., Перминова И.В., Константинов А.И., Воликов А.Б., Костюкевич Ю.И., Кононихин А.С., Николаев Е.Н. Выделение гуминовых веществ из пресных вод на твердофазных картриджах и их исследование методом масс-спектрометрии ионно-циклотронного резонанса с преобразованием Фурье // Журнал аналитической химии. 2016. Т. 71. № 4(71). С. 390-396.
- Макаров М.И., Малышева Т.И., Маслов М.Н., Кузнецова Е.Ю., Меняйло О.В. Углерод и азот микробной биомассы в почвах южной тайги при определении разными методами // Почвоведение. 2016. № 6. С. 733- 744.
- Макаров М.И., Шулева М.С., Малышева Т.И., Меняйло О.В. Растворимость лабильных форм углерода и азота почв в K2SO4 разной концентрации // Почвоведение. 2013. № 4. С. 408-413.
- Семенов М.В., Манучарова Н.А., Степанов А.Л. Распределение метаболически активных представителей прокариот (архей и бактерий) по профилям чернозема и бурой полупустынной почвы // Почвоведение. 2016. № 2. С. 239-248.
- Холодов В.А., Рогова О.Б., Лебедева М.П., Варламов Е.Б., Волков Д.С., Зиганшина А.Р., Ярославцева Н.В. Органическое вещество и минеральная матрица почв: современные подходы, определения терминов и методы изучения (обзор) // Бюллетень Почвенного института им. В.В. Докучаева. 2023. Вып. 117. С. 52-100. https://doi.org/10.19047/0136-1694-2023-117-52-100.
- Arun S., Kumar R.M., Ruppa J., Mukhopadhyay M., Ilango K., Chakraborty P. Occurrence, sources and risk assessment of fluoroquinolones in dumpsite soil and sewage sludge from Chennai, India // Environmental Toxicology and Pharmacology. 2020. Vol. 79. https://doi.org/10.1016/j.etap.2020.103410.
- Bahureksa W., Tfaily M.M., Boiteau R.M., Young R.B., Logan M.N., McKenna A.M., Borch T. Soil Organic Matter Characterization by Fourier Transform Ion Cyclotron Resonance Mass Spectrometry (FTICR MS): A Critical Review of Sample Preparation, Analysis, and Data Interpretation // Environmental Science and Technology. 2021. Vol. 55(14). P. 9637-9656. https://doi.org/10.1021/acs.est.1c01135.
- Banerjee S., Mazumdar S. Electrospray ionization mass spectrometry: a technique to access the information beyond the molecular weight of the analyte // International Journal of Analytical Chemistry. 2012. Vol. 2012. https://doi.org/10.1155/2012/282574.
- Blagodatskaya E., Kuzyakov Y. Active microorganisms in soil: critical review of estimation criteria and approaches // Soil Biology and Biochemistry. 2013. Vol. 67. P. 192-211. https://doi.org/10.1016/j.soilbio.2013.08.024.
- Bolan N.S. Adriano D.C., Kunhikrishnan A., James T., Mcdowell R., Senesi N. Dissolved organic matter: biogeochemistry, dynamics, and environmental significance in soils // Advances in Agronomy. 2011. Vol. 110. P. 1-75. https://doi.org/10.1016/B978-0-12-385531-2.00001-3.
- Chen Z., Zhang Y., Gao Y., Boyd S.A., Zhu D., Li H. Influence of Dissolved Organic Matter on Tetracycline Bioavailability to an Antibiotic-Resistant Bacterium // Environmental Science and Technology. 2015. Vol. 49(18). P. 10903-10910. https://doi.org/10.1021/acs.est.5b02158.
- Chinemerem Nwobodo D., Ugwu M.C., Oliseloke Anie C., Al-Ouqaili M.T., Chinedu Ikem J., Victor Chigozie U., Saki M. Antibiotic resistance: The challenges and some emerging strategies for tackling a global menace // Journal of clinical laboratory analysis. 2022. Vol. 36(9). https://doi.org/10.1002/jcla.24655.
- Daughton C.G., Ternes T.A. Pharmaceuticals and personal care products in the environment: agents of subtle change? // Environmental health perspectives. 1999. Vol. 107(6). P. 907-938. https://doi.org/10.1289/ehp.99107s6907.
- Drzymala J., Kalka J. Assessment of genotoxicity, mutagenicity, and cytotoxicity of diclofenac and sulfamethoxazole at environmental concentrations on Vicia faba // International Journal of Environmental Science and Technology. 2024. Vol. 21. P. 3633-3648. https://doi.org/10.1007/s13762-02305238-4.
- Ebele A.J., Abdallah M.A.-E., Harrad S. Pharmaceuticals and personal care products (PPCPs) in the freshwater aquatic environment // Emerging Contaminants. 2017. Vol. 3(1). P. 1-16. https://doi.org/10.1016/j.emcon.2016.12.004.
- Frkova Z., Vystavna Y., Koubová A., Kotas P., Grabicová K., Grabic R., Kodešová R., Chroňáková A. Microbial responses to selected pharmaceuticals in agricultural soils: Microcosm study on the roles of soil, treatment and time // Soil Biology and Biochemistry. 2020. Vol. 149. https://doi.org/10.1016/j.soilbio.2020.107924.
- Gallego S., Brienza M., Béguet J., Chiron S., Martin-Laurent F. Impact of repeated irrigation of lettuce cultures with municipal wastewater on soil bacterial community diversity and composition // Environmental Science and Pollution Research. 2022. Vol. 29(20). P. 29236-29243. https://doi.org/10.1007/s11356-021-14734-4.
- Gallego S., Montemurro N., Béguet J., Rouard N., Philippot L., Pérez S., Martin-Laurent F. Ecotoxicological risk assessment of wastewater irrigation on soil microorganisms: Fate and impact of wastewater-borne micropollutants in lettuce-soil system // Ecotoxicology and Environmental Safety. 2021. Vol. 223. https://doi.org/10.1016/j.ecoenv.2021.112595.
- González Peña O.I., López Zavala M.A., Cabral Ruelas H. Pharmaceuticals Market, Consumption Trends and Disease Incidence Are Not Driving the Pharmaceutical Research on Water and Wastewater // International Journal of Environmental Research and Public Health. 2021. Vol. 18(5). https://doi.org/10.3390/ijerph18052532.
- Graumnitz S., Jungmann D. The database “pharmaceuticals in the environment” - update and new analysis. GWT-TUD GmbH, Dresden, 2021.
- Grossberger A., Hadar Y., Borch T., Chefetz B. Biodegradability of pharmaceutical compounds in agricultural soils irrigated with treated wastewater // Environmental pollution. 2014. Vol. 185. P. 168-177. https://doi.org/10.1016/j.envpol.2013.10.038.
- Hossain A., Krupnik T.J., Timsina J., Mahboob M.G., Chaki A.K., Farooq M., Hasanuzzaman M. Chapter - 2 Agricultural Land Degradation: Processes and Problems Undermining Future Food Security, In: Environment, Climate, Plant and Vegetation Growth (First Edition). Springer, 2020. P. 17- 61.
- Hou J., Wan W., Mao D., Wang C., Mu Q., Qin S., Luo Y. Occurrence and distribution of sulfonamides, tetracyclines, quinolones, macrolides, and nitrofurans in livestock manure and amended soils of Northern China // Environmental Science and Pollution Research. 2015. Vol. 22(6). P. 4545- 4554. https://doi.org/10.1007/s11356-014-3632-y.
- Kuzyakov Y., Blagodatskaya E. Microbial hotspots and hot moments in soil: concept & review // Soil Biology and Biochemistry. 2015. Vol. 83. P. 184-199. https://doi.org/10.1016/j.soilbio.2015.01.025.
- Lagos S., Tsetsekos G., Mastrogianopoulos S., Tyligada M., Diamanti L., Vasileiadis S., Sotiraki S., Karpouzas D.G. Interactions of anthelmintic veterinary drugs with the soil microbiota: Toxicity or enhanced biodegradation? // Environmental Pollution. 2023. Vol. 334. https://doi.org/10.1016/j.envpol.2023.122135.
- Leal R.M.P., Figueira R.F., Tornisielo V.L., Regitano J.B. Occurrence and sorption of fluoroquinolones in poultry litters and soils from São Paulo State, Brazil // The Science of The Total Environment. 2012. Vol. 432. P. 344-349. https://doi.org/10.1016/j.scitotenv.2012.06.002.
- Lehmann, J., Bossio, D.A., Kögel-Knabner, I., Rillig, M.C. The concept and future prospects of soil health // Nature Reviews. Earth & Environment. 2020. Vol. 1(10). P. 544-553. https://doi.org/10.1038/s43017-020-0080-8.
- Li, X., He, F., Wang, Z., Xing, B. Roadmap of environmental health research on emerging contaminants: Inspiration from the studies on engineered nanomaterials // Eco-Environment & Health. 2022. Vol. 1(3). P. 181-197. https://doi.org/10.1016/j.eehl.2022.10.001.
- Li, J., Wang, C., Liang, W., Liu, S. Rhizosphere Microbiome: The Emerging Barrier in Plant-Pathogen Interactions // Frontiers in Microbiology. 2021. Vol. 12. https://doi.org/10.3389/fmicb.2021.772420.
- Ma, T., Pan, X., Liu, W., Christie, P., Luo, Y., Wu, L., et al. Effects of different concentrations and application frequencies of oxytetracycline on soil enzyme activities and microbial community diversity // European Journal of Soil Biology. 2016. Vol. 76. P. 53-60. https://doi.org/10.1016/j.ejsobi.2016.07.004.
- McKinsey & Company. The future of wellness: Connected and customized, 2021.
- Meffe, R., de Santiago-Martín, A., Teijon, G., Hernandez, V.M., Lopez-Heras, I., Nozal, L., de Bustamante, I. Pharmaceutical and transformation products during unplanned water reuse: Insights into natural attenuation, plant uptake and human health impact under field conditions // Environment International. 2021. Vol. 157. https://doi.org/10.1016/j.envint.2021.106835.
- Mendes, L.W., Raaijmakers, J.M., de Hollander, M., Mendes, R., Tsai, S.M. Influence of resistance breeding in common bean on rhizosphere microbiome composition and function // The ISME journal. 2018. Vol. 12(1). P. 212-224. https://doi.org/10.1038/ismej.2017.158.
- Navrátilová M., Raisova Stuchlíková, L., Moťková, K., Szotáková, B., Skálová, L., Langhansová, L., Podlipná, R. The uptake of ivermectin and its effects in roots, leaves and seeds of soybean (glycine max) // Molecules. 2020. Vol. 25(16). https://doi.org/10.3390/molecules25163655.
- Parham J. A., Deng S. P. Detection, quantification and characterization of β-glucosaminidase activity in soil // Soil biology and biochemistry. 2000. Vol. 32(8-9). P. 1183-1190. https://doi.org/10.1016/S0038-0717(00)00034-1.
- Rodríguez Eugenio, N., McLaughlin, M., Pennock, D. Soil pollution: a hidden reality. Rome: FAO, 2018. 142 p.
- Saleem, M., Hu, J., Jousset, A. More Than the Sum of Its Parts: Microbiome Biodiversity as a Driver of Plant Growth and Soil Health // Annual Review of Ecology, Evolution, and Systematics. 2019. Vol. 50(1). P. 145-168. https://doi.org/10.1146/annurev-ecolsys-110617-062605.
- Santás-Miguel V., Díaz-Raviña M., Martín A. García-Campos E., Barreiro A., Núñez-Delgado A., Álvarez-Rodríguez E., Arias-Estévez M., Fernández-Calviño D. Soil Enzymatic Activities and Microbial Community Structure in Soils Polluted with Tetracycline Antibiotics // Agronomy. 2021. Vol. 11(5). https://doi.org/10.3390/agronomy11050906.
- Schinner F., Öhlinger R., Kandeler E., Margesin R. Methods in Soil Biology. Springer Berlin, Heidelberg, 1996. 426 p.
- Sokol N.W., Slessarev E., Marschmann G.L., Nicolas A., Blazewicz S.J., Brodie E.L., Firestone M.K., Foley M.M., Hestrin R., Hungate B.A., Koch B.J., Stone B.W., Sullivan M.B., Zablocki O. LLNL Soil Microbiome Consortium, Pett-Ridge J. Life and death in the soil microbiome: How ecological processes influence biogeochemistry // Nature Reviews Microbiology. 2022. Vol. 20(7). P. 415-430. https://doi.org/10.1038/s41579-02200695-z.
- Tfaily M.M., Chu R.K., Toyoda J., Tolić N., Robinson E.W., Paša-Tolić L., Hess N.J. Sequential extraction protocol for organic matter from soils and sediments using high resolution mass spectrometry // Analytica Chimica Acta. 2017. Vol. 972. P. 54-61. https://doi.org/10.1016/j.aca.2017.03.031.
- Tremblay L.B., Dittmar T., Marshall A.G. Cooper W.J., Cooper W.T. Molecular characterization of dissolved organic matter in a North Brazilian mangrove porewater and mangrove-fringed estuaries by ultrahigh resolution Fourier Transform-Ion Cyclotron Resonance mass spectrometry and excitation/emission spectroscopy // Marine Chemistry. 2007. Vol. 105(1-2). P. 15-29. https://doi.org/10.1016/J.Marchem.2006.12.015.
- Volikov A., Rukhovich G., Perminova I. NOMspectra: An Open-Source Python Package for Processing High Resolution Mass Spectrometry Data on Natural Organic Matter // Journal of the American Society for Mass Spectrometry. 2023. Vol. 34(7). https://doi.org/10.1021/jasms.3c00003.
- Wiesmeier M., Urbanski L., Hobley E., Lang B., Lützow M., Marin-Spiotta E., Wesemael B., Rabot E., Ließ M., Garcia-Franco N., Wollschläger U., Vogel H., Kögel‐ Knabner I. Soil Organic Carbon Storage as a Key Function of Soils: A Review of Drivers and Indicators at Various Scales // Geoderma. 2019. Vol. 333. P. 149-162. https://doi.org/10.1016/j.geoderma.2018.07.026.
- World Health Organization. Antimicrobial resistance: global report on surveillance. World Health Organization, 2014. 256 p.
- Zheng J., Zhang J., Gao L., Kong F., Shen G., Wang R., Gao J., Zhang J. The Effects of Tetracycline Residues on the Microbial Community Structure of Tobacco Soil in Pot Experiment // Scientific Reports. 2020. Vol. 10(1). https://doi.org/10.1038/s41598-020-65203-w.


