Трансформация модифицированных полихлорбифенилов штаммом Rhodococcus wratisla viensis КТ112-7 в условиях засоления
Автор: Егорова Д.О.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 3, 2018 года.
Бесплатный доступ
Показано, что штамм Rhodococcus wratislaviensis КТ112-7 способен разлагать смесь соединений, образованную после химической модификации коммерческой смеси полихлорированных бифени-лов марки Совол, в условиях засоления. Смесь состоит из тетра- и пентахлорированных бифени-лов, гидрокси-полихлорированных бифенилов, аминоэтокси-полихлорированных бифенилов и гидроксиаминоэтокси-полихлорированных бифенилов. Установлено, что величина деструкции данной смеси штаммом R. wratislaviensis КТ112-7 в присутствии в среде 60 г/л хлорида натрия составляет 73.8%. В условиях засоления среды штамм КТ112-7 проявляет деградативную активность ко всем модифицированным и не модифицированным конгенерам полихлорбифенилов, представленных в смеси. Разложение данных соединений происходило с образованием и накоплением в среде хлорированных и гидроксилированных бензойных кислот, а также катехола.
Полихлорированные бифенилы, соз, штаммы-деструкторы, химическая модификация
Короткий адрес: https://sciup.org/147227029
IDR: 147227029 | УДК: 5
Текст научной статьи Трансформация модифицированных полихлорбифенилов штаммом Rhodococcus wratisla viensis КТ112-7 в условиях засоления
Полихлорированные бифенилы (ПХБ) – группа искусственно синтезированных хлорароматиче-ских соединений, обладающих высоким уровнем стабильности к физическому, химическому и биологическому воздействию [Трегер, 2013]. ПХБ производили в ХХ в. в виде коммерческих смесей, содержащих в своем составе 40–60 конгенеров [Erikson, Kaley, 2011]. Широкое применение смесей полихлорбифенилов в промышленности привело к значительному загрязнению данными соединениями различных объектов окружающей среды [Ross, 2004; Murugan, Vasudevan, 2018]. Согласно Стокгольмской конвенции, ратифицированной РФ в 2011 г., полихлорированные бифенилы должны быть уничтожены к 2028 г. [ ; ]. При этом территории, загрязненные ПХБ, должны быть восстановлены.
ПХБ состоят из двух ароматических колец, соединенных С-С связью, и ионов хлора, расположенных в качестве заместителей в количестве от 1 до 10 [Erikson, Kaley, 2011]. По результатам многочисленных исследований установлено, что био-
доступность ПХБ находится в обратной зависимости от степени хлорирования их молекулы, а реакционная способность при химическом воздействии – в прямой зависимости от степени хлорирования молекулы [Pieper, 2005; Field, Sierra-Alvarez, 2008; Горбунова и др., 2011]. При химической переработке коммерческих смесей ПХБ образуются различные варианты модифицированных конгенеров, содержащих в составе молекулы в качестве заместителей гидрокси-, аминоэтокси-, полигликолок-си-группы и ряд других [Егорова и др., 2011, 2013; Горбунова и др., 2014]. Кроме того, известно, что в процессе трансформации хлорбифенилов высшими растениями в окружающей среде образуются производные, содержащие гидрокси-группы в составе молекулы полихлорбифенилов [Tehrani, Van Aken, 2014]. Таким образом, в окружающей среде присутствуют не только ранее синтезированные конгенеры ПХБ, но и их модифицированные производные, содержащие в своем составе различные химические группы.
В настоящее время известно значительное количество штаммов аэробных бактерий, способных разлагать хлорированные бифенилы [Pieper, 2005; Field, Sierra-Alvarez, 2008; Agullo et al., 2017]. Однако штаммов, способных трансформировать модифицированные конгенеры ПХБ, изучено ограниченное количество [Francova et al., 2004; Tehrani et al., 2012; Егорова и др., 2013; Горбунова и др., 2014; Mizukami-Murata et al., 2016]. Стоит учитывать, что трансформация ПХБ и их производных в естественных условиях осложняется присутствием ряда негативных экологических факторов, таких как высокие или низкие температуры, низкая влажность, высокая соленость среды [Margesin, Schinner, 2001]. Однако примеров бактериальной деструкции модифицированных ПХБ в условиях, отличных от оптимальных, в литературе не найдено.
Цель настоящей работы – изучение особенностей трансформации смеси химически модифицированных полихлорбифенилов штаммом Rhodococcus wratislaviensi s КТ112-7 в условиях засоления.
Материалы и методы исследования
Штамм-деструктор . В работе использован штамм Rhodococcus wratislaviensi s КТ112-7, выделенный ранее из отходов соледобывающего предприятия [Егорова и др., 2013]. Штамм R. wratisla-viensi s КТ112-7 осуществляет разложение хлорированных бифенилов, бензоата и орто -фталата в условиях засоления среды [Егорова и др., 2013, 2018].
Модифицированные полихлорбифенилы. Смесь модифицированных полихлорированных бифенилов, обозначенная как GTI-2013, предоставлена для исследования сотрудниками Института органического синтеза им. И.Я. Постовского УрO РАН. Смесь GTI-2013 образована в результате взаимодействия коммерческой смеси ПХБ марки Совол (35 конгенеров, содержащих от 4 до 6 заместителей) с 2-аминоэтанолом в присутствии KOH при 110–115°С в течение 7.5 ч. [Горбунова и др., 2014]. Смесь GTI-2013 содержит тетра- и пентахлорбифенилы, не вступившие в реакцию, а также хлорбифенилы с гидрокси- и аминоэтоксигруппами в качестве заместителей.
Деструкция модифицированных ПХБ . Деструкцию проводили в эксперименте с отмытыми клетками. Бактериальную культуру штамма КТ112-7 предварительно выращивали в МСР [Raimond, 1961] с бифенилом (1 г/л) и хлоридом натрия в концентрации 60 г/л до ОП 600 =1.0. Оптическую плотность измеряли на BioSpec-mini (“Shimadzu”, Япония) при длине волны 600 нм. Культивирование осуществляли в колбах Эрленмейера объемом 250 мл в 100 мл жидкой среды при 28ºС и аэрации на круговой качалке Environmental Shaker-Incubator ES-20/60 (“BioSan”, Латвия) со скоростью 180 об/мин. Отмытые дважды в МСР, содержащей 6% NaCl, клетки (1 мл, ОП 600 =2.0) переносили во флаконы с тефлоновыми крышками. Смесь модифицированных полихлорбифенилов GTI-2013 вносили в виде ацетонового раствора до конечной концентрации 0.47 мг/мл. Флаконы встряхивали на круговой качалке Environmental Shaker-Incubator ES-20/60 (“BioSan”, Латвия) (180 об/мин) при 28ºС. Эффективность деструкции смеси GTI-2013 оценивали через 2, 4 и 6 сут.
Анализ количества компонентов смеси GTI-2013 проводили методом ГХ-МСД и ГХ-ПИД в гексановых экстрактах [Горбунова и др., 2014].
Идентификацию компонентов проводили на основании базы масс-спектров NIST05 и калибровочных хроматограмм ГСО 7821-2000 «Совол».
Анализ продуктов деструкции . Продукты деструкции определяли в культуральной жидкости, освобожденной от бактериальных клеток центрифугированием (9660g, 3 мин., центрифуга miniSpin (“Eppendorf”, Германия)), методом ВЭЖХ. ВЭЖХ-анализ проводили на жидкостном хроматографе LC-20AD Prominence (“Shimadzu”, Япония) с УФ-детектором SPD-20A при 205 нм и колонкой Supelco C18 (150 x 4.6 мм) (“Sigma-Aldrich”, США) в системе ацетонитрил – 0.1%-ный H 3 PO 4 (70:30). Идентификацию проводили на основании сравнения времени удержания на колонке исследуемых и стандартных соединений.
Кинетические параметры деструкции . Эффективность деструкции смеси модифицированных хлорбифенилов оценивали в процентах согласно формуле
Д (%)=(С t ×100)/C 0 , где Д – эффективность деструкции, %; С t – концентрация смеси GTI-2013 через определенный промежуток времени (2, 4, 6 сут.); C 0 – концентрация смеси GTI-2013 в начальный момент времени.
Удельную скорость деструкции смеси GTI-2013 рассчитывали по формуле
V t = (C 0 -C t )/t , где С 0 – концентрация смеси GTI-2013 в начальной момент времени, C t – концентрация смеси GTI-2013 через 6 сут. эксперимента, t –время деструкции, ч.
Статистическая обработка результатов . Все эксперименты проводили в трехкратной повторности. Полученные данные обрабатывали с использованием стандартных пакетов компьютерных программ Microsoft Excel.
Результаты и их обсуждение
В результате ранее проведенных исследований установлено, что штамм Rhodococcus wratislavien-si s КТ112-7 осуществляет трансформацию моно- и дихлорированных бифенилов при концентрации хлорида натрия в среде в диапазоне от 0 до 50 г/л, а незамещенного бифенила при концентрации NaCl в среде до 100 г/л [Егорова и др., 2013, 2018]. При этом уровень деструкции хлорированных бифенилов был выше, чем у известных штаммов-деструкторов родов Rhodococcus , Aquami-crobium , Bacillus и Pseudomonas [Pieper, 2005; Field, Sierra-Alvarez, 2008; Agullo et al., 2017]. Также ранее показано, что штамм R. wratislavien-si s КТ112-7 разлагает модифицированные хлорированные бифенилы при физиологическом уровне солености среды [Егорова и др., 2013; Горбунова и др., 2014].
В настоящем исследовании установлено, что штамм R. wratislaviensi s КТ112-7 осуществляет трансформацию смеси GTI-2013, состоящую из тетра- и пента-хлорбифенилов, а также из модифицированных хлорбифенилов, содержащих в молекуле гидрокси- и аминоэтокси-группы в присутствии в среде 60 г/л NaCl (рис. 1, 2). Деструкция смеси за 6 сут. составила 73.8% (рис. 1), что на 5% ниже, чем аналогичный показатель в условиях отсутствия засоления среды. Рядом работ показано, что повышение уровня засоленности среды негативно сказывается на деградативной активности аэробных штаммов [Margesin R., Schinner, 2001; Плотникова и др., 2006; Егорова и др., 2018]. Таким образом, полученный результат согласуется с известной закономерностью.
Динамика убыли смеси GTI-2013 под действием культуры штамма R. wratislaviensis КТ112-7 имеет вид вогнутой кривой и описывается степенным уравнением y = -0.0043x3 + 0.042x2 – 0.1542x + 0.47, c величиной достоверности аппроксимации R2=1.0.
При отсутствии солевого стресса, характер кривой, описывающей убыль данной смеси штаммом КТ112-7, имеет аналогичный вид и описывается также уравнением третьей степени [Горбунова и др., 2014]. Анализ кинетических параметров деструкции смеси GTI-2013 показал, что при культивировании в присутствии 6%-ного хлорида натрия удельная скорость деструкции составила 0.056 (мг/л)/сут., тогда как, при разложении в изотонических условиях, данный показатель, в пересчете за первые 6 сут. культивирования, составлял 0.067 (мг/л)/сут. По-видимому, гипертоническая среда оказывает влияние на активность ферментов деструкции, но не на принцип их работы.
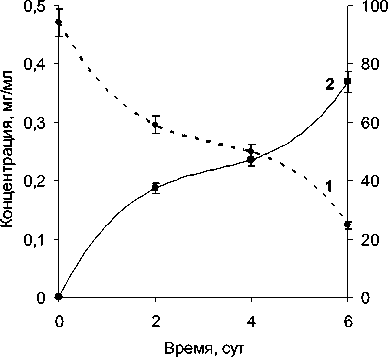
Рис. 1 . Динамика разложения смеси GTI-2013 штаммом R. wratislaviensi s КТ112-7:
1 – изменение концентрации смеси в культуральной среде, 2 – уровень деструкции
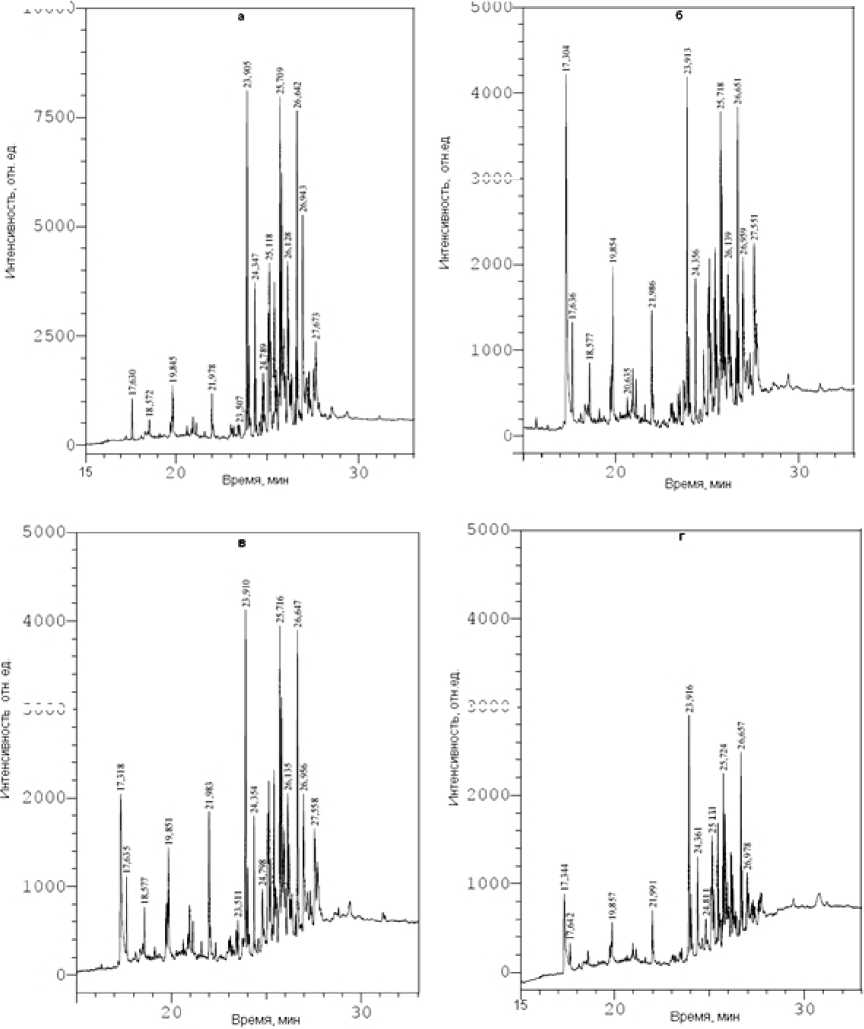
Методом газовой хроматографии с пламенноионизационным и масс-спектрометрическим детектированием установлено, что штамм R. wra-tislaviensi s КТ112-7 разлагает все соединения, представленные в смеси GTI-2013, а именно тетра-и пентахлорбифенилы, гидроксиполихлор-бифенилы, аминоэтоксиполихлорбифенилы и гидроксиа-миноэтоксиполихлорбифенилы (рис. 2). Ранее было показано, что при разложении данной смеси в изотонических условиях, штамм КТ112-7 в первую очередь трансформирует производные ПХБ с аминоэтоксигруппой [Горбунова и др., 2014]. Однако при культивировании в гипертонических условиях подобной закономерности не выявлено.
Основную долю смеси GTI-2013 составляют гидроксилированные полихлорированные бифенилы [Горбунова и др., 2014]. На рисунке 2 им соответствует ряд наиболее высоких пиков с временем удержания 23.5–27.5 мин. Анализ профиля хроматограмм показывает, что штамм R. wratislaviensis КТ112-7 проявляет разную активность к гидрокси- лированным три-, тетра- и пента-хлорбифенилам. При этом на доступность субстрата, по-видимому, влияет не только количество атомов хлора в молекуле гидрокси-ПХБ, но и их расположение. Известно, что штаммы Burkholderia xenovorans LB400 и Comamonas testosteroni B-356 предпочтительнее окисляют гидроксихлорбифенилы, содержащие заместителей в одном кольце молекулы 10000
3000-
3000-
3000-1
Рис. 2. Хроматограмма смеси GTI-2013 до начала бактериальной деструкции (а) и через 2 сут. (б), 4 сут. (в) и 6 сут. (г) разложения штаммом КТ112-7
Аналогичная закономерность отмечена для штамма Sphingomonas sp. N-9, однако данный штамм проявлял высокую ферментативную активность к (моно-тетра)хлорированным моногидроксибифенилам, и в меньшей степени трансформи-
[Francova et al., 2004; Mackova et al., 2007]. Штамм B. xenovorans LB400 эффективно разлагает монохлорированные гидроксибифенилы, проявляет меньшую активность в отношении дихлориро-ваных моногидроксибифенилов и не трансформирует трихлорированные моногидроксибифенилы [Tehrani et al., 2012, 2014].
ровал пента- и гексахлорированные моногидроксибифенилы [Mizukami-Murata et al., 2016]. Расположение гидрокси-группы также влияет на эффективность бактериальной трансформации гидрокси-ПХБ. В работе Bhalla с коллегами [2016]
показано, что наиболее токсичными являются дии три-хлорированные гидроксибифенилы, содержащие гидрокси-группу во втором или четвертом положении на кольце молекулы бифенила.
Бактериальная трансформация бифенила и его модифицированных производных протекает под действием ферментативного комплекса, обусловливающего окисление молекулы через стадии гидроксипроизводных до формирования (хлор)бен-зойных и (хлор)пентадиеновых кислот [Sondossi et al., 1991; Pieper, 2005]. При дальнейшем разложе-
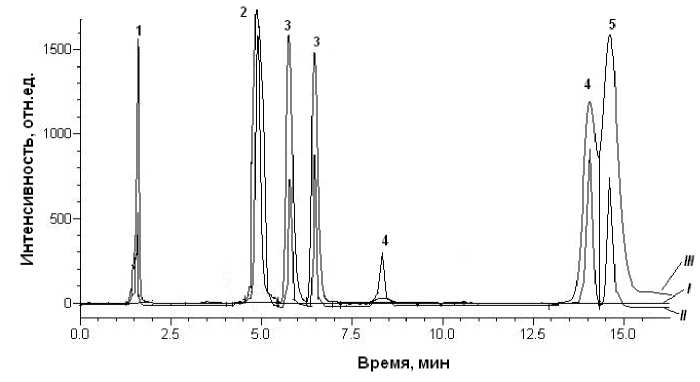
Рис. 3 . Хроматограмма (условия ВЭЖХ) смеси промежуточных продуктов, образовавшихся в результате бактериальной деструкции смеси GTI-2013 штаммом R. wratislaviensis КТ112-7:
0 сут. ( I ), 2 сут. ( II ), 6 сут. ( III ): 1 – катехол, 2 – гидроксибензойная кислота, 3 – моно-хлорбензойные кислоты, 4 – ди-хлорбензойные кислоты, 5 – три-хлорбензойные кислоты
Аналогичные результаты были получены при разложении данной смеси модифицированных ПХБ в изотонических условиях [Горбунова и др., 2014]. Однако известно, что повышение уровня осмолярности среды приводит к снижению скорости трансформации хлорированных бензойных кислот – метаболитов ПХБ [Егорова и др., 2018]. Количественный анализ показал, что в настоящем исследовании происходит накопление метаболитов (хлор- и гидроксибензойных кислот), образующихся при трансформации модифицированных ПХБ. Однако наличие гидроксибензойных кислот, являющихся предшественниками соединений основного обмена клетки, позволяет предположить, что при разложении смеси гидрокси- и амноэтокси-полихлорированных бифенилов штаммом R. wra-tislaviensi s КТ112-7 в присутствии 60 г/л хлорида натрия не накапливаются соединения, токсичные для окружающей среды.
Заключение
В результате проведенных исследований изучены особенности трансформации химически моди-фицирвоанных полихлорированных бифенилов штаммом R. wratislaviensi s КТ112-7 в условиях засоления среды.
нии (хлор)бензойных кислот в качестве метаболитов образуются гидроксибензойные кислоты и (хлор)катехолы [Егорова и др., 2013].
При анализе культуральной жидкости методом высокоэффективной жидкостной хроматографии установлено, что при разложении смеси GTI-2013 штаммом R. wratislaviensi s КТ112-7 в условиях засоления образуются хлорированные и гидроксилированные бензойные кислоты, а также катехол (рис. 3).
Показано, что содержание в среде 60 г/л хлорида натрия приводит к незначительному снижению эффективности разложения смеси гидрокси- и аминоэтокси-полихлорированных бифенилов. Установлено, что штамм КТ112-7 эффективно разлагает все модифицированные конгенеры ПХБ, представленные в смеси, а также не модифицированные тетра- и пентахлорбифенилы. Основными метаболитами являются хлорированные и гидроксилированные бензойные кислоты, а также катехол. При этом высокое содержание хлорида натрия в среде приводит к накоплению метаболитов в культуральной жидкости.
Таким образом, полученные результаты свидетельствуют об эффективной деструкции смеси химически модифицированных полихлорбифенилов штаммом R. wratislaviensi s КТ112-7 в условиях засоления и позволяют рекомендовать данный штамм для использования в разработках биотехнологий, направленных на переработку полихлорированных бифенилов в различных условиях среды.
Работа выполнена в рамках государственного задания. Номер госрегистрации темы: 01201353249. Тема: «Молекулярные механизмы адаптации микроорганизмов к факторам среды».
Список литературы Трансформация модифицированных полихлорбифенилов штаммом Rhodococcus wratisla viensis КТ112-7 в условиях засоления
- Горбунова Т.И. и др. Пример междисциплинарного подхода к проблеме обезвреживания техногенных полихлорбифенилов // Доклады Академии наук. 2014. Т. 454, № 4. С.411-416. DOI: 10.7868/S086956521404015X
- Горбунова Т.И. и др. Полихлорирбифенилы. Проблемы экологии, анализа и химической утилизации. М.: Красанд, 2011. 400 с.
- Егорова Д. О. и др. Деструкция ароматических углеводородов штаммом Rhodococcus wratis-lavensis KT112-7, выделенным из отходов соледобывающего предприятия // Прикладная биохимия и микробиология. 2013. Т. 49, № 3. С. 267-278. DOI: 10.7868/S0555109913030070
- Егорова Д.О. и др. Бактериальная деструкция смеси, полученной при химической модификации поли-хлорированных бифенилов полиэтиленгликолями // Биотехнология. 2013. № 4. С. 56-64.
- Егорова Д.О. и др. Особенности разложения хлорированных бифенилов штаммом Rhodococcus wratislaviensis КТ112-7 в условиях засоления // Прикладная биохимия и микробиология. 2018. Т. 54, № 3. С. 253-263. 10.7868/ S0555109918030042. DOI: 10.7868/S0555109918030042
- Егорова Д.О. и др. Утилизация полихлорбифе-нилов с использованием химических и биологических процессов // Доклады Академии наук. 2011. Т. 441, № 3. С. 328-331.
- Трегер Ю. СОЗ - стойкие и очень опасные // The Chemical Journal. 2013. № 1. С. 30-34.
- Agullo L., Pieper D.H., Seeger M. Handbook of Hydrocarbon and lipid Microbiology / ed. N.T. Kenneth. Berlin; Heidelberg: Springer, 2017. P. 1-28.
- Bhalla R., Tehrani R., Van Aken B. Toxicity of hy-droxylated polychlorinated biphenyls (HO-PCBs) using the bioluminescent assay Microtox // Ecotoxicology. 2016. Vol. 25. P. 1438-1444.
- Erikson M.D., Kaley II R.G. Applications of poly-chlorinated biphenyls // Environmental Science Pollution Reserch. 2011. Vol. 18(2). P. 135-151.
- DOI: 10.1007/s11356-010-0392-1
- Field J.A., Sierra-Alvarez R. Microbial transformation and degradation of polychlorinated biphenyls // Environmental Pollution. 2008. Vol. 155, № 1. P. 1-12.
- Frankova K. et al. Ability of bacterial biphenyl di-oxygenases from Burkholderia sp. LB400 and Co-mamonas testosteroni B-356 to catalyse oxygenation of ortho-hydroxychlorobiphenyla formed from PCBs by plants // Environmental Pollution. 2004. Vol. 127. P. 41-48.
- Makova M. et al. Biotransformation of PCBs by plants and bacteria - consequences of plant-microbe interactions // European Journal of Soil Biology. 2007. Vol. 43. P. 233-241.
- Margesin R., Schinner F. Biodegradation and bioreme-diation of hydrocarbons in extreme environments // Applied Microbiology Biotechnology. 2001. Vol. 56. P. 650-663.
- DOI: 10.1007/s002530100701
- Mizukami-Murata S. et al. Detoxification of hydroxy-lated polychlorobiphenyls by Sphingomonas sp. strain N-9 isolated from forest soil // Chemosphere. 2016. Vol. 165. P. 173-182.
- Murugan K., Vasudevan N. Intracellular toxicity by PCBs and role of VBNC bacterial strains in biodegradation // Ecotoxicology Environmental Safety. 2018. Vol. 157. P. 40-60.
- DOI: 10.1016/j.ecoenv.2018.03.014
- Pieper D.H. Aerobic degradation of polychlorinated biphenyls. // Applied Microbiology Biotechnology. 2005. Vol. 67, № 2. P. 170-191.
- DOI: 10.1007/s00253-004-1810-4
- Raymond R.L. Microbial oxidation of n-paraffinic hydrocarbons // Developments in Industrial Microbiology. 1961. Vol. 2. P. 23-32.
- Ross G. The public health implications of polychlori-nated biphenyls (PCBs) in the environment // Ecotoxicology Environmental Safety. 2004. Vol. 59. P. 275-291.
- DOI: 10.1016/j.ecoenv.2004.06.003
- Sandossi M. et al. Metabolism of hydroxibiphenyl and chloro-hydroxybiphenyl by biphenyl/chlorobiphe-nyl degrading Pseudomonas testosteroni, strain B-356 // Journal of Industrial Microbiology. 1991. Vol. 7. P. 77-88.
- Tehrani R. et al. Biodegradation of mono-hydro-xylated PCBs by Burkholderia xenovorans // Biotechnology Letters. 2012. Vol. 34. P. 2247-2252.
- Tehrani R., Lyv M.M., Van Aken B. Transformation of hydroxylated derivatives of 2,5-dichlorobiphenyl and 2,4,6-trichlorobiphenyl by Burkholderia xenovorans LB400 // Environmental Science Pollution Reserch. 2014. Vol. 21. P. 6346-6353.
- Tehrani R., Van Aken B. Hydroxylated polychlori-nated biphenyls in the environment: sources, fate, and toxicities // Environmental Science Pollution Reserch 2014. Vol. 21. P. 6330-6345.
- DOI: 10.1007/s11356-013-1742-6


