Транскраниальная электроимпульсная терапия в лечении хронического болевого синдрома
Автор: Крайнюков П.Е., Ким Е.А., Гудантов Р.Б., Мезникова А.В., Борисова А.В., Зыкова В.А.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Обзоры литературы
Статья в выпуске: 4 т.19, 2024 года.
Бесплатный доступ
Обоснование: хронический болевой синдром у пациентов с комбинированными минно-взрывными травмами, травматическими ампутациями конечностей, обширными ожогами и пр. в настоящее время особенно актуален. Представлен анализ современных литературных данных по электрофизиотерапии хронической боли, который позволит выбрать оптимальный метод лечения данной категории пациентов.Цель: изучить литературные данные и провести сравнительный анализ используемых в настоящее время методов транскраниальной электрофизиотерапии болевого синдрома, что позволит улучшить результаты лечения пациентов с хроническим болевым синдромом.Материалы и методы: выполнен анализ статей, обзоров, исследований в современной научной медицинской литературе по проблеме. Сбор материалов проводился в электронных библиотеках ВМедА им. С.М.Кирова, Первого МГМУ им. И.М.Сеченова, использованы статьи информационных ресурсов: NCBI, PCM; Springer; Elsevier, EMBASE, Web of Science и PsychINFO, Elibrary и др.Результаты: в литературе выявлено большое многообразие методов транскраниальной электрофизиотерапии, используемых в клинической практике в терапии хронического болевого синдрома. Методы систематизируются на основании: характера вмешательства (инвазивные, неинвазивные), параметров электрического тока (постоянный, переменный, непрерывный или импульсный).Заключение: методы неинвазивной транскраниальной электрофизиотерапии могут быть более эффективными и предпочтительными для лечения хронического болевого синдрома по сравнению с другими методами по ряду причин: неинвазивность, безопасность, простота, снижение боли за счет регуляции нейропластичности, регуляция эмоционального состояния.
Транскраниальная электроимпульсная терапия, электрофизиотерапия, электросон, транскраниальная электростимуляция, болевой синдром, ноцицепторы, нейропластичност
Короткий адрес: https://sciup.org/140308705
IDR: 140308705 | DOI: 10.25881/20728255_2024_19_4_125
Текст обзорной статьи Транскраниальная электроимпульсная терапия в лечении хронического болевого синдрома
электричестве и физиологии в 1902 г. объединили экспериментальные исследования французского физика S.A.N. Leduc (1853–1939 гг.) с воздействием электричества на головной мозг. Опытным путем он определил наиболее эффективный импульсный ток частотой 100 ГЦ, с интервальным межимпульсным соотношением прямоугольной формы 1:10. При апробации действия электронаркоза на себе он позже охарактеризовал состояние «как во сне – ни двигаться, ни говорить не мог». Исторически это явление «электросна» получило название «ток Ледюка». Изыскания S.A.N. Leduc исходят из теории отечественного физиолога, создателя науки о высшей нервной деятельности, «отца» отечественной физиологической школы – И.П. Павлова, который считал, что внутреннее

торможение и сон являются единым процессом по своей организации, с разницей, что внутреннее торможение охватывает лишь отдельные группы клеток головного мозга, а при развитии сна торможение распространяется по коре головного мозга и спускается в подкорковые образования [4]. И.П. Павлов назвал активным сон, развивающийся при воздействии тормозных условных раздражителей, противоположным ему является пассивный сон, возникающий в результате прекращения или резкого ограничения афферентных импульсов в кору больших полушарий [5]. Вплоть до 50-х гг. прошлого столетия исследование электроимпульсной стимуляцией головного мозга человека продолжалось в основном отечественными учеными: А.Т. Болотовым, А.Е. Щербаком, Ф. Белявским, О. Ковалевским, А.Н. Обросовым, В.Г. Ясногородскими др. В 1967 г. в г. Граце (Австрия), состоялся первый симпозиум по электросну и электроанестезии, где было высказано мнение, что электросон на самом деле не вызывает сон, а является побочным действием тормозного эффекта электростимуляции. Поэтому название электросна было изменено на краниальную электростимуляционную терапию (CET). В 1969 г. был принят термин – трансцеребральная электротерапия (TCET), которую впоследствии переименовали в краниальную электротерапию Cranial Electrotherapy Stimulation (CES).
В результате двадцатилетних исследований на базе Института физиологии им. И.П. Павлова РАН, в начале 1980-х гг. группа отечественных ученых (Ковалевский А.В., Газеева И.В., Гайсина А.В. и др.) под руководством профессора В.П. Лебедева, совершили прорыв в мировой электрофизиологии, открыв селективную активацию антиноцицептивных систем головного мозга под влиянием электрического тока.
Используемые методики электрофизиотерапии в мире при лечении болевого синдрома.
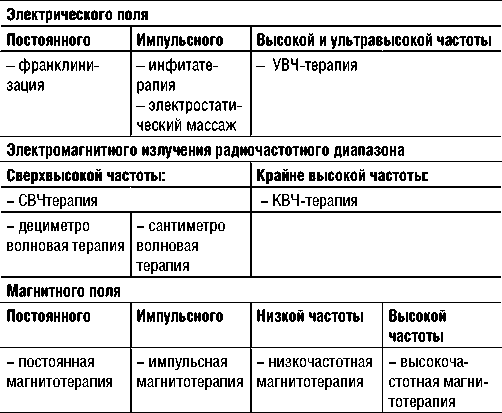
В современной медицине реформация методик электротерапии болевого синдрома происходит параллельно с учением о патофизиологии боли, и определяет направленность терапии, исходя из важнейших параметров электрического тока (постоянный, переменный, непрерывный или импульсный) [6; 7], табл. 1:
К примеру, супрессия возбудимости ноцицепторов, в т.ч. и их проводников, реализуется с помощью методики электрофореза локальных анестетиков, ультразвука (при определенных условиях). Подавление возбудимости ноцицептивных волокон происходит при помощи лазеротерапии, анодной гальванизации и др. [8]. Обезболивающие действия вторичного характера, отчетливо наблюдаются при использовании лечебных физических факторов (локальный холод, инфракрасное излучение, тепло, сверхвысокочастотные электромагнитные потоки и др.), с влиянием на звенья патогенеза физических причин болевой реакции – увеличение чувствительности ноцицепторов, развитие периневрального отека с локализацией алгоген-ных медиаторов (гистамин, серотонин, ацетилхолин, про-
Табл. 1. Методы применения электрического тока в клинической физиотерапии [7]
Постоянный электрический ток
Непрерывного действия: Импульсного действия:
– гальванизация
– лекарственный электрофорез
– электросонтерапия
– транскраниальная электроанальгезия
– электростимуляция
– диадинамотерапия
– короткоимпульсная электроанальгезия
Переменного электрического тока
Низкой частоты:
Средней частоты:
– местная дарсонвализация
– амплипульстерапия
– интерференцтерапия
– флюктуоризация
– ультратонотерапия
стагландины, субстанция Р, нейрокинин А и др.). В 1965 г. Р. Мезлак (с соавт.) представили теорию «входных ворот», где отмечается система контроля афферентных входов через обратные связи; как механизм, реализующего обезболивающее действие. Через влияние на «входной блок,» предложены методики: диадинамического тока, акупунктурная анальгезия, короткоимпульсная электроаналгезия (чрескожная электронейростимуляция, и др.) [9].
Стимуляция электроимпульсами головного мозга или транскраниальная электроимпульсная стимуляция представлены, исходя из инвазивного и неинвазивного характера вмешательства.
Инвазивные методы предусматривают электродную имплантацию в ткань головного мозга:
-
• Глубокая стимуляция мозга (DBS) – воздействие на активирующие нейроны центров боли перивен-трикулярное и периакведуктальное серое вещество (PVG/PAG) и ростральную переднюю поясную кору (ACC) высокочастотными электрическими импульсами [10]. В терапии фантомной боли, при ампутациях конечностей, описаны положительные результаты при электростимуляции таламической области (DBS), Abreu et al. указывают на снижение болевого синдрома

у пациентов в диапазоне от 50,6 до 76,4%, участвовавших в исследовании [11].
-
• Стимуляция моторной коры (MCS) – электронейростимуляция, путем расположения активного электрода в прецентральной извилине или центральной борозде. В зависимости от расположения электрода в анатомическом пространстве головного мозга выделяют два метода MCS – субдуральная MCS и эпидуральная MCS. Первые сообщения об успешном клиническом использовании MCS при хронической боли датируются началом 1990-х гг. [12]. И хотя точный механизм анальгетического действия остается не до конца понятными, метод MCS хорошо описан в терапии хронических болевых состояний (центральную постинсультная боль (CPSP), тройничная невралгия, спинальная посттравматическая боль и пр. [13].
Ряд исследований, связанных с инвазивными методиками в терапии болевого синдрома, показали неблагополучные результаты или даже были остановлены до полного сбора данных [14]. Инвазивность в структуры головного мозга предполагает определённый риск осложнений, негативных эффектов: судорожный синдром (18%), раневые инфекции (12%), кровотечения, эпидуральные гематомы и дуральные рубцы [6].
По данным анализа зарубежных источников Xiong H.Y. еt al. (2022) показательна прогрессия за последние 20 лет актуальности и востребованности проблем по исследованию неинвазивных транскраниальных мето-дик(NIBS) в терапии хронической боли (Рис. 1).
Развитие анальгетического эффекта электростимуляции NIBS многоуровневое: с активацией на нейрональном уровне нейрогуморальных связей – синаптических нейромедиаторов, на сетевом межклеточном уровне нейронных цепей, изменяется нейропластичность, дисбаланс возбуждения и торможения нервных центров при передаче и обработке болевого импульса[10]. Perocheau D., и соавт. (2014) в своем исследовании по нейровизуализации боли показали взаимосвязь хронической боли с изменениями в нейронных сетях, включая пути восприятия, сенсибилизации и регуляции боли.
Неинвазивные методы опосредованы чрескожной электростимуляцией:
-
• транскраниальная стимуляция постоянным током (tDCS). Основа метода –электромодуляция нейрональных центров под воздействием импульсов постоянного тока низкой амплитуды (от 0,5 до 2 мА). Импульсы постоянного тока подаются через кожные электроды (анодный, катодный) [16]. В tDCS используется слабый ток, не вызывая потенциалов действия, но меняя потенциал покоя мембраны нейронов. При анодной стимуляции возникает деполяризация клеточной мембраны, увеличивая возбудимость коры головного мозга, катодная – гиперполяризует мембрану нейрона и подавляет возбудимость [17]. Однако, описанные изменения в мембранном потенциале окончательно не объясняют наблюдаемый стойкий анальгетический эффект [18]. В работе Lefaucheur J.P. и соавт. (2017) описывается tDCS влияние на межнейрональном уровне. Авторы отметили фоновую медиаторную активность серотонина, дофамина, ацетилхолина, клеточных мембранных каналов, натрия и кальция с возникновением tDCS зависимой аналгезии на уровне межсинаптических связей «кора-кора» и «кора-подкорка» при воздействии на таламические центры [19].
-
• Транскраниальная стимуляция переменным током (tACS). Особенность переменного тока – изменение направления и величины в единицу времени, по закону синуса графически отображается как синусоида Возможность синусоидальной стимуляции с фиксированной амплитудой и частотой методологически описывается в регуляции интенсивности болевого синдрома [20]. В межнейрональном взаимодействии направленные ионные токи через синапсы происходят в определенных ритмических электроимпульсных колебаниях, (мозговые волны) с параметрами частоты от 0,02 до 600 Гц. Альфа-активность (8–12 Гц), дельта (1–4 Гц), тета (4–8 Гц), мю (8–13 Гц), бета (13–30 Гц), гамма (30–150 Гц). Arendsen L.J. и соавт. (2018) в исследовании по взаимосвязи между альфа-активностью и
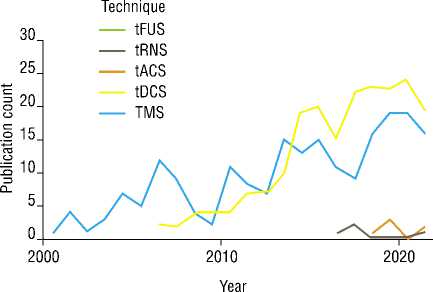
Рис. 1. Количество исследований за последние 20 лет по изучению NIBS в терапии хронической боли [15].

болью, определили возможность tACS в подавлении боли и подтвердили, что супрессия нейронных колебаний в альфа– и гамма – диапазонах при болевой стимуляции могут регулировать восприятие боли, но только когда интенсивность и вероятность предстоящего болевого стимула была в эксперименте неизвестна [20]. Метод tACS пока представлен в экспериментальной медицине.
Повторная транскраниальная магнитная стимуля-ция(rTMS) основана на способности динамических магнитных полей индуцировать электрическую активность, и позволяет воздействовать на определенные нейрональные локусы и группы коры головного мозга и межнейронных сетях. При этом магнитная стимуляция может в достаточной степени деполяризовать нейроны вызывая потенциалы действия. Такая эффективность импульсной магнитной рестимуляции имеет накопительный характер. Посредством регулярного, повторного воздействия активизируется большее количество нейронов, развиваются кумулятивные изменения нейропластичности с повышением уровня эндогенных опиоидов. В настоящее время оказываемый анальгетический эффект rTMS указан многими авторами в качестве дополнительного метода лечения у пациентов с хроническими рефрактерными болевыми синдромами, после инсульта (таламическая/стволовая), при травмах и невропатиях периферического генеза [21]. Перспективное значение rTMS описывается во множестве представленных источниках.
Краниальная электротерапия (CES) – метод с минимальным уровнем побочных эффектов, одобрен международными сообществами для лечения боли, депрессии, тревожного расстройства и бессонницы. CES до сих пор называют электросном в некоторых регионах мира. В настоящее время большинство устройств CES ограничивают интенсивность стимула до менее 1,0 миллиампера при 0,5 или 100 Гц от источника 9 вольт. CES не обеспечивает достижения глубокого сна, но положительная эффективность описывается в независимости от бодрствования пациентов. Чрескожное воздействие импульсного электрического напряжения низкой амплитуды (<1 мА), в одних методиках выполнялось через электроды, наложенные на мочки ушей [22]. Другими авторами транскраниальная стимуляция осуществлялось с помощью постоянного импульсного тока низкой частоты (1–150 Гц) и малой силы (до 10 мА) при глазнично-сосцевидном или лобно-сосцевидном расположении электродов [23]. Исследования показали, что CESповышает уровни нейромедиаторов в крови (бета-эндорфин, серотонин), и действует через подкорково-стволовые образования, расположенные вблизи основания мозга, а именно: таламус, гипоталамус, гипофиз, ретикулярная формация ствола, лимбическая система [24]. Результаты такого муль- тилокального действия в виде седативного, обезболивающего эффекта, снижение поведенческих реакций на хроническую боль (эмоциональная лабильность, депрессия, улучшение когнитивных функций) указаны в терапии хронической боли (фибромиалгия, нейропатическая боль после травмы спинного мозга и др.) [25]. Также CES импульсные токи оказывают нормализующее действие на сердечно-сосудистую систему в целом, улучшая центральную гемодинамику, микроциркуляцию, благоприятно воздействует на психологический и неврологический статус больных, перенесших церебральный инсульт. Выделяют 3 эффективных диапазона частот CES [26]: малые (5–12 Гц) оказывают седативное, успокаивающее действие, с восстановлением баланса процессов торможения/возбуждения, и влияют на выработку серотонина; средние (70–80 Гц) оказывают анальгези-рующее действие при хронических болях, повышают уровень эндогенных опиатов, дофамина, адреналина, норадреналина; высокие (90–120 Гц) оказывают транквилизирующий, гипотензивный и седативный результаты. На частотах 90–120 Гц электроимпульсы стимулируют работу гипофиза, вызывая повышение секреции адренокортикотропного гормона. Taylor A.G. и соавт. (2013) в рандомизированных, двойных слепых, контролируемых клинических исследованиях указали эффективную анальгезию CES у пациентов с фибромиалгией [27], Tan G. и соавт. (2011) – при травматической невропатической боли спинного мозга [28], Barclay T.H. и соавт. (2014) – у пациентов с тревожным расстройством и коморбидной депрессией [29].
-
• Транскраниальный фокусированный ультразвук (tFUS). Сравнительно новая методика описывается в двух режимах – высокоинтенсивный (HIFU) (с энергией более 5 Вт/см2) и низкоинтенсивный (LIFU) (с энергией 0,125–3,0 Вт/см2) фокусированный ультразвук [30]. HUFI описан в терапии болевого синдрома радикального или паллиативного лечения больных с опухолевыми новообразованиями различной локализации. Действие HUFI основано на 2 интерстициальных механизмах в фокусированной зоне действия: термическая абляция (превращение механической энергии в тепловую) и акустическая кавитация [31]. По характеру действия на клетки ультразвук низких интенсивностей обладает энергетическим влиянием в меньшей степени, чем высокой, однако такая ультразвуковая энергия (1–3 МГц; 0,2–0,6 Вт/см2; 0,5–5 мин.) усиливает скорости циркуляции крови в тканях, повышает температуру тела на 0,5–1,5 °С, увеличивает проницаемость клеточных мембран с эффектом до 6–10 час. Tyler W.J. (2011) также отметил влияние низкоинтенсивного ультразвукового излучения на акустически зависимую проницаемость мембранных ионных (кальциевых, натриевых и калиевых) каналов нейронов [32]. Высокая пространственная точность
LIFU позволяет использовать акустическую энергию для обратимой модуляции активности глубоких структур мозга [33]. Badran B.W. и соавт. (2020) продемонстрировали возможность методом LIFU влиять на болевую чувствительность при воздействии на таламус под контролем МРТ, с точкой фокуса на правую переднюю часть таламуса у 19 добровольцев, и отметили, что два 10-минутных сеанса оказывали антиноцицептивный эффект на болевую стимуляцию по сравнению c плацебо [34].
-
• Неинвазивная кортикальная электростимуляция со сниженным сопротивлением (RINCE). Основное отличие от других методов состоит в том, что используются определенные частоты тока, которые, за счет пониженного сопротивления кожи и свода черепа, обеспечивают более глубокое проникновение в кору головного мозга [35] для низкочастотной кортикальной модуляции, и как полагают, повышает передачу сигнала и эффективность стимуляции [36]. Неинвазивная кортикальная электростимуляция у пациентов с фибромиалгией обеспечивала умеренное улучшение боли, утомляемости и сна и лечение хорошо переносилось [37]. При наблюдении за пациентами с фибромиалгией, прошедших курс RINCE, в отдаленном периоде отмечалось значительное улучшение [38].
-
• Транскраниальная случайная шумовая стимуляция (tRNS). Принцип стохастического резонанса в переменном токе, используемый в методике tRNS [39] активизирует процессы возбуждения коры головного мозга, где случайная генерация частот от 0 до 640 Гц повышает возбудимость моторных отделов коры головного мозга [40; 41]. Доказательства, подтверждающие эффективность tRNS как единственного вмешательства для лечения хронической боли в настоящее время ограничены [42].
Основное направление в настоящее время занимают методы транскраниальной электростимуляции с преимущественным низкочастотной импульсной сложномоду-лируемой модуляцией, исходя из ее преимущественных характеристик: близость к физиологичной электро-импульсной активности головного мозга, сниженным сопротивлением тканей, отсутствием раздражения кожи, доминирующая эффективность анальгезии за счет ритмичности и упорядоченности импульсов.
Сохраняющаяся актуальность старейшего метода электросна (CES) объясняется его простотой и безопасной результативностью. Использование импульсации П-образной формы, малой силы (до 10 мА), с длительностью импульсов (0,8–0,5 мс), низкой частоты (от 1 до 160 Гц) признано безопасным и близким к электрофизиологическим параметрам человеческого головного мозга [43]. Применение электро-сонтерапии в лечении больных эпилепсией, обеспечивало вегетативный и гуморальный гомеостаз с нормализацией возбуждающих– тормозных процессов ЦНС, увеличением секреции эндорфинов лимбической системой, с анальгези-рующим и седативным эффектами [44].
Близкие по эффективности результаты электросон-терапии на эндорфиновый профиль больных ревматоидным артритом, описывается в работе Кошуковой Г.Н. и др. (2016), где отмечено высокое анальгезирующее действие электросна [45].
Изучение вариаций электрического импульса (величина, направление, форма, длительность импульса, период действия, скважность и др.), локуса действия в структуре ЦНС, механизмов формирования хронического болевого синдрома, а также селективное влияние на систему процессов антиноцицепции, явилось основой в разработке и внедрению отечественными учеными метода транскраниальной электростимуляции (ТЭС) эндорфинэргических механизмов головного мозга [46].
При ТЭС в отличие от электросна используются биполярные импульсы П-образной или синусоидальной формы до 150 Гц со среднечастотным заполнением (5–10 кГц), либо однополярные импульсы прямоугольной формы частотой до 3 кГц. При этом отмечены изменения биоэлектрической активности мозга с селективной активизацией опиоидной системы, подкорковых структур [47].
Схожим с ТЭС механизмом действия обладает ме-зодиэнцефальная модуляция (МДМ) [48]. Как и в предыдущих методиках здесь используется слабоинтенсивное электрическое потенцирование с точкой приложения на срединные структуры головного мозга. МДМ выгодно отличает от прочих транскраниальных электростимуляций используемая широта в низкочастотном диапазоне от 20 до 100 Гц, возможность генерировать как прямоугольные, так и треугольные, М-образные, полукруглые, трапециевидные импульсы, имеющие свои особенности. Для П – образной модуляции преобладающее значение имеют анальгетические, бронхолитические и репаративные эффекты, треугольная модуляция вызывает транквилизирующие, седативное влияние [49]. В настоящее время описаны методики МДМ с вариацией различных форм с целью достижения большей эффективности. С целью наибольшего влияния на мезодиэнцефальную зону и усиления седативного эффекта при МДМ анодный электрод располагают на область лба, акатодный электрод на затылочную область.
Выводы
Методики NIBS могут быть более эффективными и предпочтительными для лечения фантомной и нейропатической боли по сравнению с другими методами по ряду причин:
-
1. Неинвазивность, безопасность, простота. Электросон, ТЭС, МДМ, в отличие от инвазивных методов, таких как глубокая стимуляция мозга, или электростимуляция периферических нервов, не требует хирургического вмешательства. Это снижает риск осложнений, таких как инфекции, кровоизлияния и эпидуральные гематомы, которые могут возникать при инвазивных методах. К тому же, электросон имеет минимальные
-
2. Снижение боли за счет регуляции нейропластичности. Влияя на нейропластичность головного мозга, изменяя активность нейрональной сети, транскраниальная электростимуляция активирует эндогенные механизмы подавления боли через регуляцию системы антиноцицепции нейромедиаторов, таких как эндорфины и серотонин и др.
-
3. Широта диапазона частот и форм электроимпульсов. Использование различных частот и форм импульсов для достижения конкретных терапевтических эффектов – низкие частоты (5–12 Гц) оказывают седативное действие, помогая при эмоциональной лабильности и тревоге, которые могут сопутствовать фантомной боли, в то время как более высокие частоты (70–80 Гц) эффективно подавляют хроническую боль, способствуя высвобождению эндогенных опиоидов. Это особенно важно при лечении фантомной боли, где нейропластичность и нарушение работы нейромедиаторных систем играют ключевую роль в поддержании болевых ощущений.
-
4. Регуляция эмоционального состояния. Хроническая боль зачастую сопровождается тревогой и депрессией, что отягощает и усложняет лечение. Электросон одновременно воздействует на эмоциональные и болевые компоненты, улучшая психоэмоциональный паттерн пациентов. Это комплексное действие делает методику предпочтительной для пациентов с хроническими болевыми синдромами.
побочные эффекты, по сравнению с медикаментозными методами лечения. Медикаментозная терапия, особенно при хронической боли, может приводить к множеству нежелательных последствий, тогда как NIBS является неинвазивным методом и может применяться на регулярной основе без значительного риска для пациента, что доказано безопасным длительным использованием в терапии, не требующим каких – то особых, дополнительных условий.
Представленные клинические исследования показывают эффективность электроимпульсной терапии в лечении хронической боли, в том числе фантомной боли, особенно у пациентов, перенёсших травматические ампутации. Исследования подтверждают значительное снижение болевых ощущений при использовании этих методик, что делают их предпочтительными и доступными для долгосрочного контроля болевого синдрома.
Список литературы Транскраниальная электроимпульсная терапия в лечении хронического болевого синдрома
- Yong RJ, Mullins PM, Bhattacharyya N. Prevalence of chronic pain among adults in the United States. Pain. 2022. 163(2): e328-e332. doi: 10.1097/j.pain.0000000000002291.
- Юдин В.Е., Ярошенко В.П., Косухин Е.С. и др. Фантомно-болевой синдром: клиника, диагностика, лечение // Вестник Медицинского института непрерывного образования. – 2023. – Т.3. – №1. – С.39-43. doi: 10.36107/2782-1714_2023-3-1-39-43.
- Энциклопедический Словарь Ф.А. Брокгауза и И.А. Ефрона: В 86 полутомах с иллюстрациями и дополнительными материалами. – С.-Петербург, 1890-1907.
- Кершбаум Х., Чугунова Е.И. Учение И.П. Павлова о высшей нервной деятельности // Рос. мед.-биол. вестн. им. акад. И.П. Павлова. – 2014. – №3.
- Федоров В.К. Учение И.П. Павлова о сне и его целебной роли. Архивная копия от 13.07.2020 на Wayback Machine: стенограмма публичной лекции из цикла «И.П. Павлов и его учение». Ленинград, 1951. – 40 с.
- Henssen D, Kurt E, van Walsum A, et al. Motor cortex stimulation in chronic neuropathic orofacial pain syndromes: a systematic review and meta-analysis. SciRep. 2020; 10(1): 7195. doi: 10.1038/s41598-020-64177-z.
- Сорокин C.A. Использование электрических токов и электромагнитных полей в терапии. Владимир: Изд-во Владим.гос.ун-та, 2006. – 36 с.
- Абрамович С.Г. Физиотерапия боли. Иркутск: Курортная медицина, 2021. – С.5-18.
- Разумова А.Н, Стародубова В.И., Пономаренко Г.Н. Санаторно- курортное лечение: национальное руководство. – Москва: ГЭОТАР-Медиа, 2021. – 752 с.
- Knotkova H, Hamani C, Sivanesan E, et al. Neuromodulationforchronicpain. Lancet. 2021; 397(10289): 2111-2124. doi: 10.1016/S0140-6736(21) 00794-7.
- Abreu V, Vaz R, Chamadoira C, et al. Thalamic deep brain stimulation for post-traumatic neuropathic limb pain: Efficacy at five years’ follow-up and effective volume of activated brain tissue. Neurochirurgie. 2022; 68(1): 52-60. doi: 10.1016/j.neuchi.2021.06.006.
- Ramos-Fresnedo A, Perez-Vega C, Domingo RA, et al. Motor Cortex Stimulation for Pain: A Narrative Review of Indications, Techniques, and Outcomes. Neuromodulation. 2022; 25(2): 211-221. doi: 10.1016/j. neurom.2021.10.025.
- Lopes PSS, Campos ACP, Fonoff ET, et al. Motor cortex and pain control: exploring the descending relay analgesic pathways and spinal nociceptive neurons in healthy conscious rats. BehavBrainFunct. 2019; 15(1): 5. doi: 10.1186/s12993-019-0156-0.
- Radic JA, Beauprie I, Chiasson P, et al. Motor Cortex Stimulation for Neuropathic Pain: A Randomized Cross-over Trial. Can J Neurol Sci. 2015; 42(6): 401-9. doi: 10.1017/cjn.2015.292.
- Xiong HY, Zheng JJ, Wang XQ. Non-invasive Brain Stimulation for Chronic Pain: State of the Art and Future Directions. Front Mol Neurosci. 2022; 15: 888716. doi: 10.3389/fnmol.2022.888716.
- Nitsche MA, Paulus W. Excitability changes induced in the human motor cortex by weak transcranial directcurrent stimulation. J Physiol. 2000; 527(3): 633-9. doi: 10.1111/j.1469-7793.2000.t01-1-00633.x.
- Lefaucheur JP, Wendling F. Mechanisms of action of tDCS: A brief and practical overview. NeurophysiolClin. 2019; 49(4): 269-275. doi: 10.1016/j.neucli.2019.07.013.
- Navarro-López V, Del-Valle-Gratacós M, Fernández-Vázquez D, et al. Transcranial direct current stimulation in the management of phantom limb pain: a systematic review of randomized controlled trials. Eur J Phys Rehabil Med. 2022; 58(5): 738-748. doi: 10.23736/S1973-9087.22.07439-1.
- Lefaucheur JP, Antal A, Ayache SS, et al. Evidence-based guidelineson the therapeuticuse of trans cranial direct current stimulation (tDCS). Clin Neurophysiol. 2017; 128(1): 56-92. doi: 10.1016/j.clinph.2016.10.087.
- Arendsen LJ, Hugh-Jones S, Lloyd DM. Transcranial Alternating Current Stimulation at Alpha Frequency Reduces Pain When the Intensity of Pain is Uncertain. JPain. 2018; 19(7): 807-818. doi: 10.1016/j.jpain.2018.02.014.
- Sonmez AI, Camsari DD, Nandakumar AL, et al. Accelerated TMS for Depression: A systematic review and meta-analysis. Psychiatry Res. 2019; 273: 770-781. doi: 10.1016/j.psychres.2018.12.041.
- Annalena P, Till H, Jan L, et al. Efficacy of cranial electrotherapy stimulation in patients with burning mouth syndrome: a randomized, controlled, double-blind pilot study. Front Neurol. 2024; 15: 1343093. doi: 10.3389/ fneur.2024.1343093.
- Суюндуков Р.Р., Полетаев В.С., Кузина О.В. Влияние электросна на показатели активности вегетативного отдела нервной системы. Молодежь и современная наука: Междунар. междисциплинар. науч.-практ. конф., г. Самара, 15 июня 2021 г. – Самара: Инсома-пресс, 2021. – С.98-112.
- Barclay TH, Barclay RD. A clinical trial of cranial electrotherapy stimulation for anxiety and comorbid depression. J Affect Disord. 2014; 164: 171-7. doi: 10.1016/j.jad.2014.04.029.
- Ching PY, Hsu TW, Chen GW, et al. Efficacy and Tolerability of Cranial Electrotherapy Stimulation in the Treatment of Anxiety: A Systemic Review and Meta-Analysis. Front Psychiatry. 2022; 13: 899040. doi: 10.3389/ fpsyt.2022.899040.
- Савченкова А.В., Войткевич Е.Г., Погонышев В.А. Электросонтерапия. Молодой исследователь 2024: сборник статей IV Международной научно-практической конференции, Пенза, 30 января 2024 года. – Пенза: Наука и Просвещение, 2024. – С.28-31.
- Taylor AG, Anderson JG, Riedel SL, et al. A randomized, controlled, double-blind pilot study of the effects of cranial electrical stimulation on activity in brain pain processing regions in individuals with fibromyalgia. Explore. 2013; 9: 32-40. doi: 10.1016/j.explore.2012.10.006.
- Tan G, Rintala DH, Jensen MP, et al. Efficacy of cranial electrotherapy stimulation for neuropathic pain following spinal cord injury: a multi-site randomized controlled trial with a secondary 6-month open-label phase. J Spinal Cord Med. 2011; 34(3): 285-96. doi: 10.1179/2045772311Y.0000000008.
- Barclay TH, Barclay RD. A clinical trial of cranial electrotherapy stimulation for anxiety and comorbid depression. J Affect Disord. 2014; 164: 171-7. doi: 10.1016/j.jad.2014.04.029.
- Amanda R, et al. Low Intensity Focused Ultrasound for Non-invasive and Reversible Deep Brain Neuromodulation-A Paradigm Shift in Psychiatric Research. Front Psychiatry. 2022; 13: 825802. doi: 10.3389/fpsyt.2022. 825802.
- Bachu VS, Kedda J, Suk I, et al. High-Intensity Focused Ultrasound: A Review of Mechanisms and Clinical Applications. Ann Biomed Eng. 2021; 49(9): 1975-1991. doi: 10.1007/s10439-021-02833-9.
- Tyler WJ. Noninvasive neuromodulation with ultrasound? A continuum mechanics hypothesis. Neuroscientist. 2011; 17: 25-36. doi: 10.1177/ 1073858409348066.
- Folloni D, Verhagen L, Mars RB, et al. Manipulation of subcortical and deep cortical activity in the primate brain using transcranial focused ultrasound stimulation. Neuron. 2019; 101: 1109.e5–16.e5. doi: 10.1016/j.neuron. 2019.01.019.
- Badran BW, Caulfield KA, Stomberg-Firestein S, et al. Sonication of the anterior thalamus with MRI-guided transcranial focused ultrasound, (tFUS) alters pain thresholds in healthy adults: a double-blind, sham-controlled study. Brain Stimul. 2020; 13: 1805-12. doi: 10.1016/j.brs.2020.10.007.
- Szymoniuk M, Chin JH, Domagalski Ł, et al. Brain stimulation for chronic pain management: a narrative review of analgesic mechanisms and clinical evidence. Neurosurg Rev. 2023; 46(1): 127. doi: 10.1007/ s10143-023-02032-1.
- O’Connell NE, Marston L, Spencer S, et al. Non-invasive brain stimulation techniques for chronic pain. Cochrane Database Syst Rev. 2018; 4(4): CD008208. doi: 10.1002/14651858.CD008208.pub5.
- Hargrove JB, Bennett RM, Simons DG, et al. A randomized placebo-controlled study of noninvasive cortical electrostimulation in the treatment of fibromyalgia patients. PainMed, 2012; 13(1): 115-24. doi: 10.1111/ j. 1526-4637.2011.01292.x.
- Hargrove JB, Bennett RM, Clauw DJ. Long-term outcomes in fibromyalgia patients treated with noninvasive cortical electrostimulation. Arch Phys Med Rehabil. 2012; 93(10): 1868-71. doi: 10.1016/j.apmr.2012.04.006.
- Маляев В.С., Вадивасова Т.Е., Анищенко В.С. Стохастический резонанс, стохастическая синхронизация и индуцированный шумом хаос в осцилляторе Дуффинга // Известия вузов. ПНД. – 2007. – №5.
- Moret B, Donato R, Nucci M, Cona G, Campana G. Transcranial randomnoise stimulation (tRNS): a wide range of frequencies is needed for increasing cortical excitability.Sci Rep. 2019; 9(1): 15150. doi: 10.1038/ s41598-019-51553-7.
- Paulus W. Transcranial electrical stimulation (tES – tDCS; tRNS, tACS) methods. NeuropsycholRehabil. 2011; 21(5): 602-17. doi: 10.1080/ 09602011.2011.557292.
- Xiong HY, Zheng JJ, Wang XQ. Non-invasive Brain Stimulation for Chronic Pain: State of the Art and Future Directions. Front MolNeurosci. 2022; 15: 888716. doi: 10.3389/fnmol.2022.888716.
- Ишков А.С., Солодимова Г.А., Тимонина Е.А., Колдов А.C. Повышение качества физиотерапии импульсным электрическим током. – Пенза: Труды Международного симпозиума «Надежность и качество». 2015. Т.2.
- Шалькевич Л.В., Кудач А.И., Волотовская А.В. и др. Физические методы в лечении и реабилитации пациентов с эпилепсией // Здравоохранение. – 2017. – №12. – С.3-12.
- Кошукова Г.Н., Буглак Н.П. Влияние электросон-терапии на эндорфиновый профиль больных ревматоидным артритом // Вестник физиотерапии и курортологии. – 2016. – №1.
- Липатова А.С., Поляков П.П., Каде А.Х. и др. Влияние транскраниальной электростимуляции на выносливость крыс с разной устойчивостью к стрессу // Биомедицина. – 2018. –№1.
- Красильникова Р.Г., Черепахина Н.Л., Романовская С.В. Основы общей физиотерапии. Москва: ГБОУ ВПО РНИМУ им. Н.И.Пирогова, 2015. – С.24-27.
- Пономаренко Г.Н. Медицинская реабилитация: учебник. Москва: ГЭОТАР-Медиа, 2021. – 368 с.
- Волотовская А.В., Войченко Н.В., Сущеня Е.А. и др. Мезодиэнцефальная модуляция – современный метод транскраниальной электротерапии: учеб-метод. пособие. Минск: БелМАПО, 2022. – 23 с.


