Транскрипционная активность CSPG4/ NG2 как прогностический маркер послеоперационного течения глиобластом
Автор: Цидулко Александра Юрьевна, Кобозев Вячеслав Витальевич, Волков Александр Михайлович, Костромская Диана Владимировна, Айдагулова Светлана Владимировна, Киселв Роман Сергеевич, Прудникова Татьяна Юрьевна, Кривошапкин Алексей Леонидович
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Нейрохирургия
Статья в выпуске: 3 т.19, 2015 года.
Бесплатный доступ
Введение Глиобластома - злокачественная опухоль головного мозга, характеризующаяся выраженным инвазивным ростом и неблагоприятным прогнозом. В опухолях происходит изменение экспрессии многих генов, в частности гена CSPG4/NG2, играющего значительную роль в пролиферации опухолевых клеток глиобластомы и неоваскуляризации опухоли. До сих пор остается неясной возможность его использования как маркера прогноза лечения новообразования. Материал и методы Проведено клиническое и молекулярно-биологическое исследование 8 пациентов с диагнозом «Глиоблас тома». Образцы опухолей фиксировали в растворе RNA-later (LifeTechnologies, США). Экспрессии CSPG4/ NG2 и CD44 оценивали с помощью метода полимеразной цепной реакции с обратной транскрипцией в реальном времени; в качестве контрольного гена использовали GAPDH. Пациентов разделили на две группы по показателю постоперационной выживаемости: группа 1 - выживаемость менее 1 года, группа 2 - выживаемость более 1 года после удаления опухоли. Результаты Молекулярно-биологические исследования показали значительное увеличение уровня экспрессии CSPG4/ NG2 в опухолях пациентов 1-й группы (в среднем в 4 раза) по сравнению с уровнем экспрессии в опухолях 2-й группы. Также продемонстрировано, что повышение экспрессии CSPG4/NG2 в опухолях с плохим прогнозом положительно коррелирует (коэффициент Пирсона 0,9514) с увеличением уровня маркера раковых стволовых клеток CD44 в тех же клинических образцах. Выводы Полученные данные демонстрируют перспективу использования CSPG4/NG2 для определения оптимального постоперационного лечения пациентов с глиобластомой.
Глиобластома, ген cspg4/ng2, хондроитинсульфат протеогликан, прогноз заболевания
Короткий адрес: https://sciup.org/142140676
IDR: 142140676 | УДК: 616.8-089
Текст научной статьи Транскрипционная активность CSPG4/ NG2 как прогностический маркер послеоперационного течения глиобластом
Глиобластома – злокачественная опухоль головного мозга, характеризующаяся выраженным инвазивным ростом и неблагоприятным прогнозом. В опухолях происходит изменение экспрессии многих генов, в частности гена CSPG4/NG2 , играющего значительную роль в пролиферации опухолевых клеток глиобластомы и неоваскуляризации опухоли. До сих пор остается неясной возможность его использования как маркера прогноза лечения новообразования.
Материал и методы
Проведено клиническое и молекулярно-биологическое исследование 8 пациентов с диагнозом «Глиобластома». Образцы опухолей фиксировали в растворе RNA-later (LifeTechnologies, США). Экспрессии CSPG4/ NG2 и CD44 оценивали с помощью метода полимеразной цепной реакции с обратной транскрипцией в реальном времени; в качестве контрольного гена использовали GAPDH . Пациентов разделили на две группы по показателю постоперационной выживаемости: группа 1 – выживаемость менее 1 года, группа 2 – выживаемость более 1 года после удаления опухоли.
Результаты
Молекулярно-биологические исследования показали значительное увеличение уровня экспрессии CSPG4/ NG2 в опухолях пациентов 1-й группы (в среднем в 4 раза) по сравнению с уровнем экспрессии в опухолях 2-й группы. Также продемонстрировано, что повышение экспрессии CSPG4/NG2 в опухолях с плохим прогнозом положительно коррелирует (коэффициент Пирсона 0,9514) с увеличением уровня маркера раковых стволовых клеток CD44 в тех же клинических образцах.
Выводы
Полученные данные демонстрируют перспективу использования CSPG4/NG2 для определения оптимального постоперационного лечения пациентов с глиобластомой.
Глиобластома – наиболее злокачественная из глиальных опухолей головного мозга со средней продолжительностью жизни после оперативного лечения 4–12 мес. [1, 4]. В злокачественных опухолях головного мозга происходит изменение экспрессии большого числа генов. Ранее исследователи продемонстрировали использование CSPG4/NG2 для прогноза течения заболевания других видов злокачественных новообразований. Установлено, что CSPG4/NG2 ассоциирован с плохим прогнозом острого миелоидного лейкоза [5], рака молочной железы [3] и меланомы [7]. Однако для опухолей мозга этот вопрос остается малоизученным.
Для различных видов рака известно, что агрессивность опухоли зачастую определяется содержанием в ее составе опухолевых стволовых клеток. Авторы высказывали гипотезу, что и для глиобластом повышенная агрессивность также может быть связана с содержанием стволовых клеток в опухоли [6]. Известный молекулярный маркер стволовых клеток различных опухолей – хондроитинсульфат протеогликан CD44 – рецептор
Таблица 1 Праймеры, использованные для полимеразной цепной реакции
Целью исследования являлось изучение уровня экспрессии гена CSPG4/NG2 в глиобластоме на транскрипционном уровне, его взаимосвязи с содержанием CD44 , тяжестью течения заболевания и возможности использования в качестве прогностического маркера для оптимизации послеоперационного лечения пациентов с такой патологией.
Материал и методы
В центре ангионеврологии и нейрохирургии фгбу «Новосибирский научно-исследовательский институт имени академика Е.Н. Мешалкина» Минздрава России прооперировали 8 пациентов по поводу глиобластомы головного мозга – Gr.4. Пациентов разделили на две группы по показателю постоперационной выживаемости: 5 пациентов (группа 1) – выживаемость менее 1 года и 3 пациента (группа 2) с выживаемостью более 1 года после удаления опухоли [4]. От каждого пациента получено по одному образцу ткани опухоли. Образцы фиксировали в растворе RNA-later (LifeTechnologies, США) согласно инструкции производителя и хранили при температуре –20 °C.
Для выделения суммарной РНК образцы замораживали в жидком азоте и гомогенизировали. Выделение РНК проводили с использованием реагента TRIzol (LifeTechnologies, США) с дальнейшей дополнительной очисткой с помощью набора PureLink (Invitrogen, США) согласно прилагаемому протоколу. кДНК получали из 1–2 мкг РНК при помощи First Strand cDNA Synthesis kit (Fermentas, США) и в дальнейшем анализировали методом полимеразной цепной реакции (ПЦР).
Для ПЦР использовали праймеры, представленные в табл. 1.
Количественную ПЦР в реальном времени с использованием красителя SYBR Green I (Biolink, Москва) и Taq-полимеразы (Институт цитологии и генетики СО РАН, Новосибирск) проводили при помощи амплификатора CFX96 (BioRad, США) в режиме: 3 мин 95 °C, 20 с 95 °C, 15 с 59 °C, 50 с 72 °C. Общий объем реакции составил 25 мкл. Амплификацию проводили в течение 40 циклов. В качестве контрольного гена выбрали ген GAPDH. Продукты ПЦР проверяли на специфичность методом кривой плавления. Анализ результатов проводили методом определения относительной экспрессии с использованием программного обеспечения Origin 8.5 (OriginLab, США).
Статистический анализ
Данные экспрессии генов представляли как среднее арифметическое и стандартное отклонение. Различия
Таблица 2 Характеристика образцов глиобластом
|
Образец |
Пол |
Возраст, лет |
Клинический диагноз |
Длительность жизни после операции, мес. |
|
GB17 |
Ж |
57 |
4 |
|
|
GB18 |
М |
55 |
13 |
|
|
GB36 |
М |
52 |
36 |
|
|
GB37 |
Ж |
36 |
Глиобластома |
13 |
|
GB40 |
М |
28 |
7 |
|
|
GB43 |
М |
42 |
9 |
|
|
GB45 |
М |
53 |
8 |
|
|
GB46 |
Ж |
53 |
10 |
|
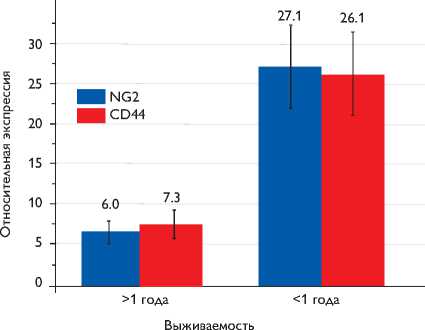
Относительная экспрессия CSPG4/NG2 и CD44 в клинических образцах глиобластомы сравниваемых параметров считали значимыми, если вероятность ошибки р была меньше 0,05. Для оценки корреляции уровня экспрессии генов использовали коэффициент Пирсона. Статистическую обработку результатов проводили с использованием программного обеспечения Origin 8.5 (OriginLab, США).
Результаты
С учетом катамнеза заболевания пациентов образцы опухоли разделили на две группы. В первую группу вошли образцы глиобластом пациентов с выживаемостью менее 1 года после операции, во вторую – более 1 года (табл. 2).
При помощи метода ОТ-ПЦР в реальном времени с использованием GAPDH в качестве контрольного гена оценивали уровень экспрессии CSPG4/NG2 в клинических образцах глиобластомы пациентов с различной выживаемостью после операции ( рисунок ).
Обнаружено, что уровень экспрессии CSPG4/NG2 достоверно различается в группах пациентов с выживаемостью до года и после и составляет 27,1±4,8 и 6,0±1,1. Такая ассоциация уровня экспрессии CSPG4/NG2 с выживаемостью пациентов позволяет предположить о возможности его использования в качестве прогностического маркера агрессивности опухолей головного мозга.
Уровень экспрессии CD44 , определенный в тех же образцах опухолей, для которых проанализировали экспрессию CSPG4/NG2 , показан на рисунке. В опухолях пациентов с выживаемостью до года уровень экспрессии CD44 выше по сравнению с опухолями пациентов с выживаемостью более 1 года и составляет 26,1±5,1 и 7,3±1,9. Это коррелирует с экспрессией CSPG4/NG2 в этих же клинических образцах (коэффициент Пирсона
0,9514) и подтверждает высказанное предположение, что низкая выживаемость может быть связана с высоким содержанием стволовых клеток, экспрессирующих CSPG4/NG2 и CD44 .
Обсуждение
Полученные результаты свидетельствуют о достоверной разнице в уровне экспрессии CSPG4/NG2 в глиобластомах пациентов с продолжительностью жизни после операции до года и более. Аналогичные показатели получили авторы, показавшие, что высокий уровень CSPG4/NG2 играет роль в пролиферации опухолевых клеток глиобластомы [8]. На фоне повышения экспрессии этого гена также происходит усиление пролиферативной активности элементов сосудистого русла опухоли, уровень которой характеризует степень ее агрессивности, что было показано при совместном изучении ангиогенеза в глиобластомах и меланомах на доклинических моделях [10].
Авторы немногочисленных работ показали, что повышенное содержание CSPG4/NG2 в опухоли способно приводить к возникновению лекарственной устойчивости [2] или устойчивости к радиотерапии [9]. В исследовании мы продемонстрировали повышение в опухолях пациентов с плохим прогнозом выживаемости уровня хондроитинсульфат протеогликана CD44 – маркера стволовых клеток. При различных видах рака агрессивность опухоли зачастую определяется содержанием в ее составе стволовых клеток [6], поэтому увеличение экспрессии CD44 также может быть сопряжено с высокой толерантностью глиобластом к химио- и радиотерапии.
В совокупности полученные результаты открывают перспективу для использования CSPG4/NG2 как прогностического маркера при выборе стратегии постоперационного лечения пациентов. В частности, могут быть пересмотрены очередность применения методов химио- и радиотерапии, а также соотношение времени их воздействия и дозы под контролем возможного рецидива методами нейровизуализации.
Несомненно, конкретные предложения могут быть сформулированы только после проведения дополнительных уточняющих исследований с привлечением иммуногистохимических методов и распространения данного подхода на другие глиальные новообразования.
Заключение
Низкая выживаемость больных в постоперационном периоде может быть связана с повышенным уровнем экспрессии гена CSPG4/NG2 и высоким содержанием в опухоли стволовых клеток, экспрессирующих CSPG4/NG2 и CD44 .
Оценки экспрессии гена CSPG4/NG2 в качестве прогностического маркера агрессивности опухоли в стандартную процедуру гистоморфологического анализа глиальных новообразований позволит оптимизировать ведение пациентов с глиобластомой в постоперационном периоде.
Список литературы Транскрипционная активность CSPG4/ NG2 как прогностический маркер послеоперационного течения глиобластом
- Гайтан А.С., Кривошапкин А.Л., Каныгин В.В. Результаты резекции глиобластом головного мозга с применением комбинированной флуоресцентной навигации//Патология кровообращения и кардиохирургия. 2014. Т. 2. С. 37-41.
- Chekenya M., Krakstad C., Svendsen A. et al.//Oncogene. 2008. Vol. 27. № 39. P. 5182-5194.
- Hsu N.C., Nien P.Y., Yokoyama K.K. et al.//Biochem. Biophys. Res. Commun. 2013. Vol. 441. № 2. P. 514-518.
- Karsy M., Neil J.A., Guan J. et al.//Neurosurg. Focus. 2015. Vol. 38. № 3. P. E4 DOI: 10.3171/2015.1.FOCUS14755
- Petrovici K., Graf M., Hecht K. et al.//Cancer Genomics Proteomics. 2010. Vol. 7. № 4. P. 173-180.
- Pointer K.B., Clark P.A., Zorniak M. et al.//Neurochem. Int. 2014. Vol. 71. P. 1-7.
- Price M.A., Colvin Wanshura L.E., Yang J. et al.//Pigment Cell Melanoma Res. 2011. Vol. 24. № 6. P. 1148-1157.
- Stallcup W.B., Huang F-J.//Cell Adh. Migr. 2008. Vol. 2. № 3. P. 192-201.
- Svendsen A., Verhoeff J.J., Immervoll H. et al.//Acta Neuropathol. 2011. Vol. 122. № 4. P. 495-510.
- Wang J., Svendsen A., Kmiecik J. et al.//PLoS One. 2011. Vol. 6. № 7. P. e23062 DOI: 10.1371/journal.pone.0023062


