Транскрипционная активность генов клеточного цикла и апоптоза у хронически облучённых лиц, имеющих повышенную частоту TCR-мутантных лимфоцитов
Автор: Никифоров В.С., Блинова Е.А., Аклеев А.В.
Рубрика: Научные статьи
Статья в выпуске: 2 т.29, 2020 года.
Бесплатный доступ
Количественная оценка экспрессии генов клеточного цикла (ATM, TP53, MDM2, CDKN1A) и апоптоза (BAX, BCL-2) была изучена у 163 хронически облучённых жителей прибрежных сёл реки Течи. Кумулятивные дозы облучения красного костного мозга (ККМ) в исследуемой группе находились в диапазоне от 80 до 3510 мЗв (среднее значение - 720 мЗв). Контрольная группа включала 146 человек, проживающих в тех же населённых пунктах (в сходных социально-экономических условиях) с интенсивностью облучения ККМ, не превышавшей 1 мЗв/год, и накопленной дозой менее 70 мЗв за весь период своей жизни. Оценка профиля активности генов проводилась методом ПЦР в реальном времени. Данные анализировали с использованием метода сравнения порогового цикла амплификации с нормализацией по экспрессии гена «домашнего хозяйства» в каждом образце. Наиболее выраженные изменения со стороны транскриптома у облучённых лиц были отмечены для генов BCL-2 и BAX. Активность гена CDKN1A была достоверно понижена у облучённых лиц с дозами облучения ККМ, превышающими 1000 мЗв. Отмечено, что у хронически облучённых людей с повышенной частотой мутаций в генах Т-клеточного рецептора регистрировались изменения в уровне мРНК генов BCL-2 и BAX, регулирующих апоптоз. Полученные данные свидетельствуют о важной роли апоптоза как механизма поддержания генетической стабильности клеток после облучения. Аберрантная экспрессия генов апоптоза у лиц с повышенной частотой лимфоцитов с мутациями в генах T-клеточного рецептора может являться одной из причин повышения эффективности этого процесса через 60-70 лет после начала хронического радиационного воздействия.
Жители прибрежных сёл реки течи, хроническое радиационное воздействие, малые дозы, экспрессия генов, транскрипционная активность, т-клеточный рецептор, апоптоз, частота tcr-мутантных лимфоцитов
Короткий адрес: https://sciup.org/170171534
IDR: 170171534 | УДК: 616-001.28/.29:616.155.32:577.21 | DOI: 10.21870/0131-3878-2020-29-2-89-100
Текст научной статьи Транскрипционная активность генов клеточного цикла и апоптоза у хронически облучённых лиц, имеющих повышенную частоту TCR-мутантных лимфоцитов
Одним из чувствительных индикаторов воздействия ионизирующего излучения является оценка мутабильности соматических клеток, в частности, регистрация TCR-мутантных лимфоцитов. В ряде работ показано, что даже в отдалённые сроки после облучения у некоторых лиц регистрируется повышенная частота клеток с мутациями в генах Т-клеточного рецептора. Так, у ликвидаторов ЧАЭС уровень TCR мутаций повышен в 2-3 раза по сравнению с необлучёнными людьми. Примечательно, что через 9-17 лет после аварии их частота снижалась до фоновых значений у большинства облучённых людей, однако у 17% лиц частота клеток с мутациями по TCR-локусу продолжала оставаться значимо повышенной [1]. Аналогичные результаты отмечались спустя 40 лет после начала облучения у людей, проживающих рядом с Семипалатинским ядерным полигоном [2], и спустя 60 лет у жителей прибрежных сёл реки Течи [3]. Эти исследования свидетельствуют о том, что образование соматических мутаций может быть обусловлено возникновением радиационно-индуцированной нестабильности генома у некоторых облучённых лиц, которая способна проявляться в отдалённом периоде после радиационного воздействия.
Исследования транскрипционной активности генов, регулирующих защитные механизмы клетки у людей с повышенной частотой TCR-мутантных клеток, позволят дополнить знания о механизмах радиационно-индуцированного мутагенеза в лимфоцитах периферической крови. Основываясь на некоторых литературных данных о степени эффективности репарационных процессов ДНК [4] и частоте апоптотической гибели клеток [5] у лиц, подвергшихся хроническому радиационному воздействию в отдалённые сроки, можно предположить, что одной из причин таких изменений является аберрантная активность некоторых генов.
В связи с этим, целью данного исследования явилось изучение уровня мРНК генов ATM, TP53, MDM2, CDKN1A, BCL-2 и BAX у жителей прибрежных сёл реки Течи, имеющих повышенный уровень мутаций в генах Т-клеточного рецептора лимфоцитов.
Материалы и методы
Исследования проводили у 309 жителей прибрежных сёл реки Течи, имеющих реконструированную дозу облучения красного костного мозга (ККМ) по дозиметрической системе TRDS (Techa River Dosimetry System, версия 2016) [6]. В группу облучённых лиц вошли 163 человека, кумулятивные дозы облучения ККМ которых находились в диапазоне от 80 до 3510 мЗв (720 ± 60 мЗв). Следует отметить, что образцы были получены через 60-70 лет после начала хронического радиационного воздействия. Контрольная группа включала 146 человек, проживающих в тех же населённых пунктах (в сходных социально-экономических условиях), но с интенсивностью облучения ККМ, не превышавшей 1 мЗв/год, и накопленной дозой менее 70 мЗв за весь период своей жизни.
Группы были сопоставимы по полу и состояли из двух этнических групп: 1 – тюрки, в основном татары, а также башкиры; 2 – славяне, в основном русские, а также украинцы и белорусы. Характеристика обследованных лиц представлена в табл. 1.
Таблица 1 Общая характеристика обследованных лиц по возрасту, полу и этническому фактору
|
Характеристика групп |
Облучённые |
Группа сравнения |
|
Число обследованных лиц |
163 |
146 |
|
Возраст на время обследования, лет M±SE (диапазон) |
70,92±5,59 (60-87) |
62,4±6,43 (57-81) |
|
Пол, % Мужчины Женщины |
38,6 (63)* 61,4 (100) |
30,8 (45) 69,2 (101) |
|
Славяне Этническая группа, % |
52,8 (86) 47,2 (77) |
66,4 (97) 33,6 (49) |
Примечание: * – число обследованных лиц.
В соответствии с действующими международными нормами (Хельсинкская декларация 1964 г.) и с разрешения этического комитета ФГБУН УНПЦ РМ у всех пациентов, принимавших участие в данном исследовании, было получено информированное согласие на взятие образца крови и проведение дальнейшего исследования.
В связи с тем, что наличие заболеваний и других факторов, сопровождающих человека на протяжении его жизни, могут оказывать влияние на паттерн экспрессии генов, был разработан ряд критериев исключения из исследования. Из выборки были исключены пациенты, имеющие онкологические и хронические заболевания в фазе обострения, принимающие цитостати- ческие и гормональные препараты, антибиотики, имеющие или имевшие ранее контакт с вредными генотоксическими (химическими и биологическими) агентами в процессе профессиональной деятельности, а также проходившие медицинское диагностическое облучение в течение 6 предшествующих месяцев до момента взятия крови для обследования.
Определения частоты клеток с мутациями Т-клеточного рецептора . Анализ мутации Т-клеточного рецептора в лимфоцитах периферической крови проводился методом проточной цитофлуориметрии [7, 8] с некоторыми модификациями. Лимфоциты периферической крови человека, выделенные на градиенте плотности фиколл-урографина. После отмывки клетки распределяли по 100 мкл в пробирки, содержащие 10 мкл моноклональных антител CD3-FITC/CD4-PE и 10 мкл моноклональных антител IgG1-PE/ IgG1-FITC (BeckmanCoulter, США), выступающих в качестве изотопического контроля. Клетки, попадающие в область негативных клеток по экспрессии CD3-комплекса, относились к мутантным по генам TCR.
Определение транскрипционной активности генов . Для исследования содержания мРНК генов ATM, MDM2, TP53, CDKN1A, BCL-2 и BAX, тотальную РНК экстрагировали колоночным методом с использованием набора Tempus™ Spin RNA Isolation Kit (Applied Biosystems, США) в соответствии с протоколом фирмы производителя. Количественную и качественную оценку полученных образцов РНК проверяли с помощью спектрофотометра NanoDrop2000 (Thermo Scientific, США). Соотношение оптических плотностей, измеренных при 260 и 280 нм (A260/A280), для очищенной РНК, выделенной из всех образцов, составляло 2,01 ± 0,05. Реакции обратной транскрипции для синтеза комплементарной ДНК (кДНК) проводили с использованием коммерческого набора реактивов (OOO «ТестГен», Россия), содержащего обратную транскриптазу MMLV и случайные гексануклеотидные праймеры, согласно протоколу фирмы производителя. Полученные образцы кДНК использовали в качестве матрицы для проведения ПЦР в реальном времени.
Таблица 2
Информация о праймерах, использованных в работе
|
Ген |
Локализация |
Tm |
GC, % |
Размер продукта |
Ссылки на мишени (транскрипты) из ресурса NCBI |
|
|
ATM |
F R Probe |
Ex15-ex16 Ex16-ex17 Ex16 |
60,16 58,61 57,43 |
45,45 36,00 50,00 |
130 |
NM_000051.3 |
|
TP53 |
F R Probe |
Ex8-ex 9 Ex10- ex11 Ex10 |
61,08 60,04 59,89 |
60,00 60,00 70,00 |
206 |
NM_001126112.2 |
|
MDM2 |
F R Probe |
Ex8 Ex10- ex11 Ex10 |
59,86 59,12 58,61 |
57,89 41,67 54,17 |
271 |
NM_002392.5 |
|
CDKN1A |
F R Probe |
Ex3 Ex3-ex4 Ex3 |
59,31 59,61 59,98 |
55,00 45,83 65,00 |
140 |
NM_001291549.1 |
|
BCL-2 |
F R Probe |
Ex2 Ex3 Ex3 |
60,11 60,96 59,69 |
60,00 60,00 65,00 |
143 |
NM_000633.2 |
|
BAX |
F R Probe |
Ex4-ex5 Ex5 Ex5 |
61,81 60,03 59,12 |
60,00 55,00 60,00 |
73 |
NM_017027077.1 |
|
COMT |
F R Probe |
Ex2-ex3 Ex3-ex4 Ex3 |
59,93 59,64 59,97 |
57,89 61,11 70,00 |
162 |
NM_007310.2 |
Примечание: Ex-ex – экзон-экзонный переход; Ex – экзон.
Для анализа содержания мРНК исследуемых генов применяли метод полимеразной цепной реакции в реальном времени (ПЦР-ВР) с использованием тест-систем фирмы ООО «Тест-Ген» (Россия). Следует отметить, что принцип действия тест-системы аналогичен технологии разрушаемых олигонуклеотидных проб «TaqMan»®. Информация о праймерах и зондах представлена в табл. 2.
Для получения достоверных результатов каждую реакцию проводили в трёх повторах с использованием отрицательного контроля на амплификаторе Real-time CFX96 Touch (BioRad, США). Температурный режим: 1 цикл предварительная денатурация 95 °С/10 мин, далее 50 циклов: 94 °С/10 с, 65 °С/50 c. Данные анализировали с использованием метода 2-ΔΔCt [9] с нормализацией по экспрессии гена «домашнего хозяйства» COMT в каждом образце.
Статистическую обработку полученных результатов проводили, используя программное обеспечение Statistica 10.0, SPSS. Предварительный анализ с помощью теста Колмогорова-Смирнова в большинстве случаев демонстрировал несоответствие распределений этих показателей нормальному закону, в связи с чем применялся непараметрический U-тест Манна-Уитни. Связь показателей экспрессии генов с накопленной дозой облучения и уровнем ТCR-мутантных лимфоцитов проводили методом корреляционного анализа по Спирману. При оценке достоверности результатов был принят 5% уровень значимости.
Результаты и обсуждение
При анализе содержания мРНК исследуемых генов были выявлены статистически значимые отличия для генов BCL-2 и BAX (табл. 3). Так, в группе облучённых лиц относительное содержание мРНК гена BCL-2 было значимо снижено (p=0,003), в то время как количество транскриптов гена BAX повышено (p=0,012) относительно группы сравнения.
Таблица 3 Содержание мРНК исследуемых генов в клетках периферической крови у лиц, подвергшихся хроническому радиационному воздействию
|
Ген |
Группа сравнения медиана (25-75%) |
Облучённые люди медиана (25-75%) |
|
ATM |
0,99 (0,86-1,20) |
0,96 (0,85-1,12) |
|
TP53 |
1,09 (0,89-1,28) |
1,06 (0,85-1,27) |
|
MDM2 |
1,05 (0,78-1,39) |
0,95 (0,77-1,24) |
|
CDKN1A |
0,88 (0,76-1,01) |
0,92 (0,75-1,14) |
|
BAX |
1,09 (0,86-1,44) |
1,26* (1,04-1,39); p=0,012 |
|
BCL-2 |
1,07 (0,71-1,43) |
0,91* (0,67-1,11); p=0,003 |
Примечание: * – достоверное различие по критерию Манна-Уитни для двух независимых выборок; p – значимые различия с группой сравнения.
Полученные результаты свидетельствуют об изменении состояния внутриклеточных защитных механизмов, в частности, активации процесса апоптоза клеток у хронически облучённых индивидуумов. В связи с тем, что изменение экспрессии генов на транскрипционном уровне не всегда отражает процессы, регулируемые на белковом уровне, наши данные могут только косвенно подтверждать гипотезу о повышении частоты апоптоза лимфоцитов периферической крови (ЛПК) в отдалённые сроки у облучённых людей [5, 10]. Тем не менее, ранее нами было показано, что у жителей прибрежных сёл реки Течи прослеживается статистически значимое повышение исходного уровня апоптоза на ранней стадии по сравнению с необлучённым контролем [11].
Поскольку в условиях радиационного воздействия апоптотические гены демонстрируют изменение своей активности, которая, как правило, пропорциональна дозе облучения [12-14], облучённые лица, принимавшие участие в обследовании, были поделены на три дозовых подгруппы (облучённые в диапазоне средних (100-490 мЗв и 500-990 мЗв) и высоких доз (превышающих 1000 мЗв)).
Примечательно, что экспрессия гена BCL-2 была снижена у лиц, имеющих промежуточные значения доз облучения ККМ от 100 до 490 мЗв (p=0,002). В то время как активность гена BAX была статистически значимо повышена у людей с кумулятивными дозами облучения ККМ, превышающими 500 мЗв, что согласуется с результатами других исследований. M. Katsura et al. [15] показывают, что порог, при котором регистрируется модуляция экспрессии апоптотических генов, также находится в диапазоне средних и высоких доз (более 500 мЗв (0,11 мЗв/мин)). В свою очередь, I.N. Ilienko et al. [16] описывают дозозависимую дерегуляцию процесса апоптоза на уровне транскрипции для генов TP53, BAX и FasL, указывая на разницу в экспрессии этих генов у лиц с поглощёнными дозами более 500 мГр.
Таблица 4
Содержание мРНК исследуемых генов в подгруппах лиц, имеющих разные накопленные дозы облучения ККМ
|
Наименование гена |
Дозовые подгруппы |
|||
|
< 70 мЗв медиана (25-75%) N=146 |
100-490 мЗв медиана (25-75%) N=78 |
500-990 мЗв медиана (25-75%) N=49 |
>1000 мЗв медиана (25-75%) N=36 |
|
|
ATM |
0,99 (0,86-1,20) |
0,97 (0,88-1,16) |
0,98 (0,84-1,19) |
0,93* (0,84-1,07); p1=0,05 |
|
TP53 |
1,10 (0,89-1,28) |
1,09 (0,96-1,26) |
1,03 (0,76-1,29) |
1,07 (0,79-1,30) |
|
MDM2 |
1,05 (0,78-1,39) |
1,01 (0,75-1,32) |
0,92 (0,81-1,20) |
0,88 (0,74-1,05) |
|
CDKN1A |
0,98 (0,76-1,21) |
0,97 (0,81-1,16) |
0,97 (0,73-1,16) |
0,79* (0,71-0,97); p2=0,01 |
|
BAX |
1,09 (0,86-1,44) |
1,18 (0,92-1,40) |
1,27* (1,09-1,41); p1=0,01 |
1,25* (1,10-1,38); p1=0,03 |
|
BCL-2 |
1,07 (0,71-1,42) |
0,88* (0,68-1,08); p1=0,002 |
0,84 (0,71-1,17) |
0,98 (0,74-1,14) |
Примечание: * – достоверное различие по критерию Манна-Уитни для двух независимых выборок; p1 – статистически значимые различия с группой сравнения (дозы облучения ККМ до 70 мГр); p2 – статистически значимые различия с подгруппой облучённых лиц, имеющих кумулятивные дозы облучения ККМ 80-490 мЗв.
При сравнении разных дозовых подгрупп мы отмечаем, что для жителей прибрежных сёл реки Течи с кумулятивными дозами облучения ККМ, превышающими 1000 мЗв, характерно достоверно низкое содержание мРНК генов ATM (p=0,05) и CDKN1A (p=0,01) по сравнению с контрольной группой (табл. 4). При этом, согласно результатам корреляционного анализа, в группе облучённых людей обнаружены статистически значимые слабые отрицательные корреляционные связи содержания мРНК гена CDKN1A (S=-0,19; p=0,02) и ATM (S=-0,16; p=0,05) от поглощённой дозы облучения ККМ (табл. 5).
Таблица 5
Коэффициенты корреляции содержания мРНК исследуемых генов и дозы облучения ККМ
|
Ген |
Кумулятивная доза облучения ККМ |
|
TP53 ATM MDM2 CDKN1A BCL-2 BAX |
-0,07R; p=0,41 -0,16*; p=0,05 -0,02; p=0,75 -0,19*; p=0,02 0,13;p=0,12 0,09; p=0,26 |
Примечание: R – коэффициент ранговой корреляции Спирмена; * – статистически значимые коэффициенты корреляции.
Полученные данные являются крайне важными, поскольку продукты генов ATM и CDKN1A играют центральную роль в реализации ответа клетки на повреждение клеточных структур [17]. Помимо того, что они способны регулировать остановку клеточного цикла с целью предотвращения процессинга повреждённой ДНК, они активируют сигнальные внутриклеточные пути, индуцируя апоптоз, в случае неточной или невозможной репарации ДНК [18].
Согласно результатам последних исследований дисфункция гена ATM является причиной развития нестабильности генома, которая проявляется в увеличении частоты хромосомных аберраций (ХА) и генных мутаций [19]. Так, периферические лимфоциты с пониженной экспрессией ATM демонстрируют хромосомные аномалии, которые преимущественно включают хромосомные точки разрыва в генах TCR, главным образом в 14q11 (TCRa и δ), 7q14 (TCRy) и 7q35 (TCRß) [20]. В свою очередь, доказано, что потеря функции CDKN1A приводит к избыточной дублированности центриолей и образует аберрантное число центросом, нарушая тем самым процесс формирования веретена деления [21], что может являться одной из причин повышения частоты клеток с блоком клеточного цикла, который ранее был зафиксирован у некоторых жителей прибрежных сёл реки Течи [22].
Основываясь на положении, что повышенная частота мутантных клеток в отдалённые сроки после облучения может быть обусловлена нарушением репарационных механизмов и элиминации клеток с повреждённой ДНК, нами был проведён анализ содержания мРНК исследуемых генов у облучённых лиц с повышенной частотой TCR-мутантных лимфоцитов.
Облучённые лица были разделены по принципу превышения критического значения TCR-мутантных Т-лимфоцитов в крови, который был рассчитан в группе сравнения по формуле 1:
TCR =
Z( x i - x ) n - 1
где
Z x
n
– среднее значение частоты TCR-мутантных клеток;
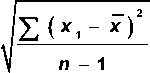
– стандартное
отклонение.
Среднее значение частоты TCR-мутантных клеток в группе необлучённых людей равнялось 0,1%, стандартное отклонение составило 0,11. Таким образом, критическое значение для формирования группы лиц с повышенным уровнем TCR-мутантных лимфоцитов составило: 0,1 ± 2 x 0,11=0,32%. Лица, у которых наблюдалось значение выше 0,32%, попадали в группу людей с повышенным уровнем TCR-мутантных клеток. Характеристика исследуемых групп представлена в табл. 6.
Таблица 6
Характеристика облучённых лиц с нормальной и повышенной частотой TCR-мутантных лимфоцитов и группы сравнения
|
Показатели M±SE (диапазон) |
Группы |
||
|
группа сравнения |
облучённые лица с нормальной частотой TCR-мутантных лимфоцитов |
облучённые лица с повышенной частотой TCR-мутантных лимфоцитов |
|
|
Число обследованных лиц Возраст на время проведения обследования, лет Кумулятивная доза облучения ККМ, мЗв Частота TCR-мутантных клеток, % |
24 65,2±1,8 (56-81)1 20±4 (0-50)2 0,11±0,02 (0,01-0,25)3 |
25 72,7±1,4 (62-87) 700±90 (90-1870) 0,14±0,02 (0,01-0,30) |
16 71,5±1,4 (63-81) 760±130 (100-1760) 0,79±0,11 (0,33-1,75) |
Примечание: ККМ – красный костный мозг; 1 – возрастной диапазон; 2 – диапазон индивидуальных значений доз; 3 – диапазон частоты TCR-мутантных клеток.
Несмотря на то, что мы не обнаружили статистически значимых корреляционных связей между содержанием мРНК исследуемых генов и частотой клеток с мутациями в генах T-клеточного рецептора, мы отмечаем снижение содержания мРНК гена BCL-2 (медиана 0,65 отн. ед.) в группе облучённых лиц с повышенной частотой TCR-мутантных лимфоцитов по сравнению с контрольной группой (медиана 0,89 отн. ед., p=0,05) и группой облучённых лиц, имеющих нормальную частоту TCR-мутаций (медиана 0,86 отн ед., p=0,047) (рис. 1А). Более того, у облучённых людей с повышенной частотой TCR-мутантных клеток также отмечалась тенденция к повышению содержания мРНК гена BAX (1,29 отн. ед.) по сравнению с контрольной группой (1,14 отн. ед., p=0,09) (рис. 1 Б).
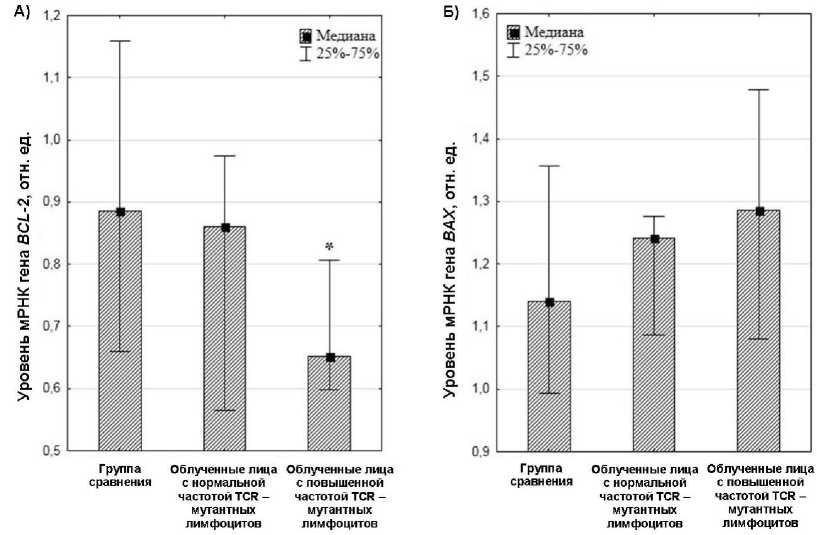
Рис. 1. Содержание мРНК гена BCL-2 (А) и
BAX (Б) у облучённых лиц с нормальной и повышенной частотой TCR-мутантных лимфоцитов.
Доказано, что клетки, лишённые экспрессии комплекса TCR/CD3 на своей поверхности, подвергаются моментальному апоптозу [23]. Наши данные, в какой-то степени, согласуются с текущими представлениями активации механизма гибели клеток, несущих потенциально опасные структурные нарушения ДНК. Несмотря на это, в отдалённые сроки у части облучённых лиц сохраняется повышенная частота TCR-мутантных лимфоцитов, что свидетельствует о нарушении механизма их элиминации.
Примечательно то, что при исследовании медико-биологических последствий хронического радиационного воздействия у жителей прибрежных сёл реки Течи было показано линейное увеличение TCR-мутантных лимфоцитов у лиц, имеющих кумулятивные дозы облучения ККМ в диапазоне от 200 до 1000 мЗв, с последующим выходом на плато в диапазоне доз от 1000 до 1500 мЗв [11]. В рамках нашего исследования мы отмечаем, что модуляция активности апопто-тических генов также регистрируется в диапазоне доз, имеющих промежуточные и высокие значения (более 500 мЗв).
Равновесие между экспрессией генов апоптоза является одним из факторов, определяющих восприимчивость клеток к действию генотоксического агента. Нарушение этого баланса лежит в основе развития воспалительных реакций и является серьёзным препятствием для эффективного лечения. Мы предполагаем, что изменение экспрессии генов BCl-2 и BAX может приводить к активации апоптотической гибели клеток в отдалённые сроки после облучения.
Таким образом, результаты, полученные в ходе исследования, могут свидетельствовать о сложном системном ответе облучённого организма со стороны модификации его транскриптома, затрагивая в большей степени гены, принимающие участие в поддержании гомеостаза клетки.
Выводы
-
1. В отдалённые сроки (спустя более 60 лет) после начала хронического радиационного воздействия у жителей прибрежных сёл реки Течи (диапазон доз облучения ККМ от 80 до 3500 мЗв) показана аберрантная экспрессия апоптотических генов. Отмечено статистически значимое снижение уровня мРНК гена BCL-2 и увеличение уровня мРНК гена BAX.
-
2. У лиц с кумулятивными дозами облучения ККМ, превышающими 1000 мЗв, отмечено достоверно низкое содержание мРНК генов ATM и CDKN1A.
-
3. У облучённых лиц, имеющих повышенную частоту TCR-мутантных лимфоцитов, наблюдается достоверно пониженное содержание мРНК гена BCL-2.
Список литературы Транскрипционная активность генов клеточного цикла и апоптоза у хронически облучённых лиц, имеющих повышенную частоту TCR-мутантных лимфоцитов
- Замулаева А.И., Орлова Н.В., Смирнова С.Г., Селиванова Е.И., Ткаченко Н.П., Саенко А.С. Закономерности соматического мутагенеза у ликвидаторов аварии на ЧАЭС в отдалённые сроки после радиационного воздействия //Радиация и риск. 2006. Т. 15, № 1-2. С. 68-76.
- Мухаметжанов А.М. Влияние малых доз облучения на здоровье населения, проживающего на территории семипалатинского полигона //Медицина и экология. 2008. № 2. С. 31-35.
- Веремеева Г.А., Блинова Е.А., Аклеев А.В., Маркина Т.Н. Блок клеточного цикла и активность апоптоза лимфоцитов периферической крови (ЛПК), частота мутаций в генах TCR в отдалённые сроки у людей, подвергшихся хроническому радиационному воздействию //Вопросы радиационной безопасности. 2011. Т. 1, № 61. С. 41-49.
- Жижина Г.П. Влияние малых доз низкоинтенсивной ионизирующей радиации на структуру и функции ДНК //Радиационная биология. Радиоэкология. 2011. Т. 51, № 2. С. 218-228.
- Блинова А.В., Веремеева Г.А., Маркина Т.Н., Аклеев А.В. Апоптоз лимфоцитов периферической крови и мутации в гене Т-клеточного рецептора у лиц, перенесших хроническое радиационное воздействие //Вопросы радиационной безопасности. 2011. № 4. С. 38-44.
- Дегтева М.О., Напье Б.А., Толстых Е.И., Шишкина Е.А., Бугров Н.Г., Крестинина Л.Ю., Аклеев А.В. Распределение индивидуальных доз в когорте людей в результате радиоактивного загрязнения реки Течи //Медицинская радиология и радиационная безопасность. 2019. Т. 64, № 3. P. 46-53.
- Kunugita N., Mei N., Goncharova T., Norimura T. Measurement of mutant frequency in T-cell receptor (TCR) gene by flow cytometry after X-irradiation on EL-4 mice lymphoma cells //J. Toxicol. Sci. 2007. V. 32, N 4. P. 377-386.
- Kyoizumi S., Akiyama M., Hirai Y., Kusunoki Y., Tanabe K., Umeki S. Spontaneous loss and alteration of antigen receptor expression in mature CD4+ T cells //J. Exp. Med. 1990. V. 171, N 6. P. 1981-1999.
- Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method //Methods. 2001. V. 25, N 4. P. 402-408.
- Никифоров В.С., Блинова Е.А., Аклеев А.В. Влияние комплекса факторов радиационной и нерадиационной на профиль транскрипционной активности у лиц, подвергшихся хроническому радиационному воздействию //Вопросы радиационной безопасности. 2019. Т. 2, № 94. С. 64-70.
- Blinova E.A., Veremeyeva G.A., Akleyev A.V. Apoptosis of peripheral blood lymphocytes and mutations in the gene of the t-cell receptor in survivors of chronic radiation exposure //Health Phys. 2012. V. 103, N 1. P. 58-60.
- Kulkarni R., Thomas R.A., Tucker J.D. Expression of DNA repair and apoptosis genes in mitochondrial mutant and normal cells following exposure to ionizing radiation //Environ. Mol. Mutagen. 2011. V. 52, N 3. P. 229-237.
- Li J.F., Xie L.J., Qin L., Liu Y.F., Zhang T.J., Huang Y., Cheng M.H. Apoptosis gene reprograming of human peripheral blood mononuclear cells induced by radioiodine-131 (131I) irradiation //Indian J. Med. Res. 2019. V. 149, N 5. P. 627-632.
- Kitada S., Krajewski S., Miyashita T., Krajewska M., Reed J.C. Gamma-radiation induces upregulation of Bax protein and apoptosis in radiosensitive cells in vivo //Oncogene. 1996. V.12, N 1. P. 187-192.
- Katsura M., Cyou-Nakamine H., Zen Q., Zen Y., Nansai H., Amagasa S., Kanki Y., Inoue T., Kaneki K., Taguchi A., Kobayashi M., Kaji T., Kodama T., Miyagawa K., Wada Y., Akimitsu N., Sone H. Effects of chronic low-dose radiation on human neural progenitor cells //Sci. Rep. 2016. V. 6. P. 20027.
- Ilienko I.N., Bazyka D.A. Overexpression of TP53, TP53I3 and BIRC5, alterations of gene regulation of apoptosis and aging of human immune cells in a remote period after radiation exposure //Probl. Radiat. Med. Radiobiol. 2016. V. 21. P. 238-246.
- Li M.J., Wang W.W., Chen S.W., Shen Q., Min R. Radiation dose effect of DNA repair-related gene ex-pression in mouse white blood cells //Med. Sci. Monit. 2011. V. 17, N 10. P. 290-297.
- Gregory D.J., Garcia-Wilson E., Poole J.C., Snowden A.W., Roninson I.B., Perkins N.D. Induction of transcription through the CRD1 motif by p21WAF1/CIP1 is core promoter specific and cyclin dependent kinase independent //Cell Cycle. 2002. V. 1, N 5. P. 343-350.
- Hahn W.C., Weinberg R.A. Modelling the molecular circuitry of cancer //Nat. Rev. Cancer. 2002. V. 2, N 5. P. 331-341.
- Song H., Hollstein M., Xu Y. p53 gain-of-function cancer mutants induce genetic instability by inactivating ATM //Nat. Cell Biol. 2007. V. 9, N 5. P. 573-580.
- Mantel C., Braun S.E., Reid S., Henegariu O., Liu L., Hangoc G., Broxmeyer H.E. p21(cip-1/waf-1) deficiency causes deformed nuclear architecture, centriole overduplication, polyploidy, and relaxed microtubule damage checkpoints in human hematopoietic cells //Blood. 1999. V. 93, N 4. P. 1390-1398.
- Маркина Т.Н., Аклеев А.В., Веремеева Г.П. Пролиферативная активность и клеточный цикл лимфоцитов периферической крови (ЛПК) человека в отдалённые сроки после хронического радиационного воздействия //Радиация и риск. 2011. T. 20, № 1. C. 50-58.
- Winoto A. Genes involved in T-cell receptor-mediated apoptosis of thymocytes and T-cell hybridomas //Semin. Immunol. 1997. V. 9, N 1. P. 51-58.


