Транскрипционная активность генов, регулирующих дифференцировку Т-хелперов в отдалённые сроки у хронически облучённых людей
Автор: Никифоров В.С., Котикова А.И., Блинова Е.А., Аклеев А.В.
Рубрика: Научные статьи
Статья в выпуске: 3 т.32, 2023 года.
Бесплатный доступ
Целью настоящей работы явилось изучение экспрессии генов TBX21, RORC, GATA3, NFKB1, MAPK8 и STAT3, ответственных за регуляцию дифференцировки различных субполуляций Т-хелперов, у лиц, подвергшихся хроническому радиационному воздействию. Объектом исследования служили клетки периферической крови, полученные от 120 человек, подвергшихся хроническому облучению в широком диапазоне доз на реке Тече. Средняя накопленная поглощённая доза облучения красного костного мозга у обследованных облучённых лиц, составила 742,7±78,6 мГр (диапазон доз: 73,5-3516,1 мГр), в группе сравнения 17,4±2,2 мГр (диапазон доз: 0,0-55,5 мГр). Анализ субпопуляционного состава Т-хелперов (Th1, Th2, Th17) проводился методом проточной цитофлуориметрии. Оценка относительного содержания мРНК генов TBX21, RORC, GATA3, NFKB1, MAPK8 и STAT3 была осуществлена при помощи ПЦР-ВР. Проведённое исследование позволило отметить снижение относительного количества Т-хелперов 2 типа в популяциях Т-хелперов центральной памяти в группе хронически облучённых людей по сравнению с группой сравнения. В составе популяции Т-хелперов центральной памяти показано статистически значимое увеличение относительного количества Т-хелперов 1 типа в зависимости от накопленной поглощённой дозы облучения красного костного мозга. Изменений со стороны экспрессии мРНК исследуемых генов отмечено не было. Анализ связи экспрессии мРНК GATA3, MAPK8, STAT3, RORC, TBX21 и относительного количества клеток в субпопуляциях Т-хелперов 1, 2 и 17 типов у обследованных людей статистически значимых закономерностей не выявил.
Экспрессия генов, транскрипционная активность, транскрипционные регуляторы дифференцировки т-хелперов, т-хелперы, th1, th2, th17, хроническое радиационное воздействие, малые и средние дозы
Короткий адрес: https://sciup.org/170200555
IDR: 170200555 | УДК: 616-001.28:575 | DOI: 10.21870/0131-3878-2023-32-3-14-25
Текст научной статьи Транскрипционная активность генов, регулирующих дифференцировку Т-хелперов в отдалённые сроки у хронически облучённых людей
Многочисленные данные свидетельствуют об иммуномодулирующем эффекте ионизирующего излучения, выражающемся в количественных и функциональных изменениях Т-клеточного звена, формировании воспалительного иммунного профиля, нарушении баланса в содержании субпопуляции Т-лимфоцитов, изменении экспрессии генов сигнальных молекул, в том числе ци-токинового профиля [1], что, в свою очередь, может вносить вклад в развитие отдалённых соматико-стохастических последствий радиационного воздействия, прежде всего, лейкозов и злокачественных опухолей.
В ранее проведённых исследованиях у жителей прибрежных сёл реки Течи, подвергшихся низкоинтенсивному хроническому радиационному воздействию вследствие сбросов жидких радиоактивных отходов ПО «Маяк» в реку Течу, в отдалённом периоде регистрировались изменения в иммунной системе, выражавшиеся в снижении количества лейкоцитов (главным образом, за счёт нейтрофилов и лимфоцитов) в крови, повышении лизосомальной активности нейтрофилов, некоторой супрессии внутриклеточного кислородзависимого метаболизма моноцитов и смещении баланса системы цитокинов в сторону провоспалительного ответа [2, 3].
Популяция Т-хелперов является высоко гетерогенной и динамичной. Благодаря внешним и внутренним стимулам происходит активация сигнальных внутриклеточных путей, обуславливающих дифференцировку наивных CD4+ Т-клеток в различные подмножества Т-хелперных клеток.
Под воздействием ионизирующего излучения может дифференциально изменяться экспрессия транскрипционных факторов, что отражается на соотношении различных субпопуляций Т-хелперов [4]. В свою очередь, дисбаланс различных субпопуляций Т-хелперов (Th1, Th2, Th17) является одной из причин развития воспалительного процесса.
На сегодняшний день молекулярно-генетические изменения в Т-клеточном звене иммунной системы, а также роль этих изменений в патогенезе отдалённых эффектов облучения (в частности, онкологических заболеваний) наряду с другими механизмами изучено недостаточно [5].
В связи с этим, цель исследования заключалась в оценке транскрипционной активность генов TBX21, RORC, NFKB1, GATA3, MAPK8 и STAT3, ответственных за дифференцировку субпопуляций Т-хелперов 1, 2 и 17 типов у лиц, подвергшихся хроническому радиационному воздействию.
Материалы и методы
Предмет и объект исследования. Исследование субпопуляционного состава Т-хелперов (Th1, Th2 и Th17) и транскрипционной активности генов у облучённых людей было проведено в отдалённые сроки (спустя более 60 лет) после начала хронического радиационного воздействия.
Материалом для исследования служили образцы периферической крови, собранные в стерильные вакуумные пробирки Tempus Blood RNA Collection Tubes (Applied Biosystem, США), содержащие транспортную среду для стабилизации РНК в биопробах. Взятие крови осуществлялось из локтевой вены утром натощак. Образцы хранились в биобанке лаборатории молекулярно-клеточной радиобиологии ФГБУН УНПЦ РМ ФМБА России при температуре минус 80 °С.
Кровь была получена от 120 жителей прибрежных сёл реки Течи, подвергшихся хроническому радиационному воздействию вследствие сбросов жидких радиоактивных отходов ПО «Маяк». Нарушение технологического процесса переработки и хранения радиоактивных отходов явилось причиной загрязнения окружающей среды радионуклидами (90Sr, 89Sr, 137Cs, 95Zr, 95Nb, 144 Ce, 104Ru): в 1949-1956 гг. было сброшено в реку Течу 1,15 x 10 17 Бк жидких радиоактивных отходов), в связи с чем население загрязнённых территорий подверглось внутреннему и внешнему облучению.
В результате защитных мероприятий и распада короткоживущих радионуклидов мощность дозы внешнего облучения, а также внутреннего облучения мягких тканей, тимуса и периферических лимфоидных органов существенно снизилась и после 1960 г. не превышала 0,01 мГр/год для всех, кто проживал на прибрежных территориях. Иная картина облучения была у красного костного мозга (ККМ), поскольку главный вклад в формирование дозы вносил долгоживущий остео-тропный 90Sr, обеспечивающий хроническое облучение с монотонно снижающейся мощностью дозы, которая к 1985 г. у всех облучённых была менее 0,01 мГр/год [6]. Таким образом, у облучённых людей значительно преобладали поглощённые дозы на ККМ, тогда как дозы на тимус и периферические лимфоидные органы были на порядок ниже (табл. 1).
При формировании обследованной группы были использованы следующие критерии включения в исследование:
-
1) облучённые лица из когорты реки Течи – проживавшие в одном из 41 сёл, расположенных на побережье реки Течи, в период с 01.01.1950 по 31.12.1960 гг.;
-
2) наличие рассчитанной индивидуальной поглощённой накопленной дозы облучения ККМ, тимуса и периферических лимфоидных органов.
Критерии исключения:
-
1) наличие у обследованных лиц онкологических, аутоиммунных, острых или хронических (период обострения) воспалительных заболеваний на период обследования;
-
2) приём противоопухолевых препаратов, антибиотиков, стероидных гормонов из подкласса кортикостероидов в течение последних 6 мес. до исследования;
-
3) рентгенологическое обследование в течение последних 6 мес.
На основании сформулированных критериев были выделены две основные группы обследуемых лиц:
-
1) группа облучённых лиц с индивидуальными накопленными дозами облучения ККМ 70 мГр и более (далее – основная группа) – 66 человек;
-
2) группа сравнения – лица, проживающие в сходных социально-экономических условиях, но с интенсивностью облучения ККМ, не превышавшей 1 мГр/год, и накопленной дозой менее 70 мГр за весь период жизни – 54 человека.
Основные характеристики исследуемых групп представлены в табл. 1. Исследуемые группы включали лиц пожилого возраста: среднее значение возраста для хронически облучённых лиц составило 73,2 ± 0,5 год (диапазон: 67,0-84,0 лет), для группы сравнения – 68,8 ± 0,9 лет (диапазон: 60,0-87,0 лет). В двух группах подавляющее большинство образцов крови было получено от женщин. Обследуемые группы состояли из лиц, принадлежавших к двум этническим группам: славяне (в основном русские, а также украинцы и белорусы) и тюрки (в основном татары и башкиры).
Таблица 1 Характеристика исследуемых групп
|
Показатель |
Основная группа |
Группа сравнения |
|
Объём выборки |
N=66 |
N=54 |
|
N (%) |
||
|
мужчины ол женщины славяне Этническая группа тюрки |
17 (30,6) 37 (69,4) 26 (47,0) 28 (51,0) |
24 (42,0) 42 (58,0) 20 (32,0) 46 (64,0) |
|
M±SE (min-max) |
||
|
Возраст, лет Доза облучения ККМ, мГр Доза облучения тимуса и периферических лимфоидных органов, мГр |
73,2±0,5 (67,0-84,0) 742,7±78,6 (73,5-3716,1) 97,7±9,91 (5,1-355,3) |
68,8±0,9 (60,0-87,0) 17,4±2,2 (0-55,3) 7,5±1,3 (0-39,5) |
Все пациенты подписывали добровольное информированное согласие на проведение исследования, одобренное этическим комитетом УНПЦ РМ ФМБА России.
Количественная оценка экспрессии генов. Выделение РНК проводили на колонках с помощью набора GeneJET Stabilized and Fresh Whole Blood RNA Kit (Thermo Scientific™, США) по стандартной методике. Информацию о концентрации и чистоте выделенных образцов РНК получали с помощью спектрофотометра NanoDrop 2000С (Thermo Scientific, США). Отношение оптических плотностей, измеренных при A260/280 для РНК, выделенной из всех образцов крови, составило 2,0±0,05. Исходным количеством для анализа было 100 нг/мкл РНК каждого образца. Реакцию обратной транскрипции для синтеза кДНК проводили с использованием коммерческого набора реагентов High-Capacity cDNA Reverse Transcription Kit (Applied Biosystem, США). Относительное количественное содержания мРНК определяли с помощью ПЦР в режиме реального времени с использованием амплификатора CFX96 Touch (Bio-Rad Laboratories, США).
Количественную оценку экспрессии анализируемых генов проводили по методу 2-ΔΔСt [7]. Данные оценивали относительно уровней мРНК генов «домашнего хозяйства» (housekeeping genes) ACTB и B2M. Анализ кривых амплификации производили в программе Bio-Rad CFX Manager 2.1 (Bio-Rar Laboratories, США) методом пороговой линии. Расчёт проводился с учётом трёх повторов для каждого гена. В работе были использованы коммерческие наборы праймеров/зон-дов от Applied Biosystems, США: STAT3 (Hs00374280_m1), GATA3 (Hs00231122_m1), MAPK8 (Hs01548508_m1), NFKB1 (Hs00765730_m1), ACTB (4333762F), B2M (4333766F), часть праймеров были синтезированы ООО «ДНК-синтез» (Россия): TBX21 (Forward: 5'-GGCTCCAGATGTTCTTCGCTA-3', Reverse: 5'-GGATGGGCTTCCTCTTCTCA-3', Probe: FAM-BHQ1 – 5'-CACGACCAGGAATTTGACCCTCCA-3'), FOXP3 (Forward: 5'-CCTTCACGTTCAACATCAAGC-3', Reverse: 5'-GCTCTGGGTACAGGTCCTCATC-3', Probe: FAM-BHQ1 – 5'-CCAGTCCCGTGAAACGCCCA-3'), RORC (Forward: 5'-GAATCAAGGAAATACGAGAACAAGAC-3', Reverse: 5'-CTTCATCCCCTCGGTCTTTG-3', Probe: FAM-BHQ1 – 5'-CGACTCAGCCACCTCTGACTACTGCC-3').
Оценка субпопуляций Т-хелперов. Схема исследования субпопуляционного состава Т-хелперов периферической крови облучённых лиц методом проточной цитометрии подробно описана в статье [8].
Для анализа субпопуляций Т-хелперов применялась следующая тактика гейтирования: выявление Т-хелперов проводилось по наличию на поверхности клеток CD3 и CD4 маркеров. Далее популяция CD3+CD4+-клеток разделялась на субпопуляции Т-хелперов на разной стадии дифференцировки по наличию поверхностных маркеров CD45RA и CD62L, а именно Т-хелперов центральной памяти с фенотипом CD3+CD4+CD45RA-CD62L+ и Т-хелперов эффекторной памяти с фенотипом CD3+CD4+CD45RA-CD62L-. В популяциях Т-хелперов центральной памяти и Т-хелперов эффекторной памяти определялись субпопуляции различных Т-хелперов по наличию маркеров CCR4, CCR6, CXCR3 и CXCR5 [9]. Характеристика исследуемых субпопуляций Т-хелперов представлена в табл. 2.
Таблица 2
Фенотипы исследуемых субпопуляций Т-хелперов в периферической крови облучённых лиц
|
Фенотип клеток |
Наименование субпопуляции Т-хелперов |
|
CXCR5–CXCR3+CCR6–CCR4– |
Т-хелперы 1 (Th1) |
|
CXCR5–CXCR3–CCR6–CCR4+ |
Т-хелперы 2 (Th2) |
|
CXCR5–CXCR3–CCR6+CCR4– |
Т-хелперы 17 (Th17) |
Статистическая обработка результатов. Статистический анализ данных исследования проводили с применением стандартных методов математико-статистической обработки с использованием пакетов программ прикладного статистического анализа (Statistica v. 10.0 и SigmaPlоt v. 12.5). Для оценки межгрупповых различий значений признаков применяли U-критерий Манна-Уитни. Определение вида зависимости исследуемых показателей проводилось с использованием корреляционного анализа по Спирмену. Для всех критериев и тестов различия признавали статистически значимыми при p<0,05.
Результаты и обсуждение
Оценка представленности трёх субпопуляций Т-хелперов (Th1, Th2 и Th17) в популяциях Т-хелперов центральной памяти (Т ем ) и Т-хелперов эффекторной памяти (Т ем ) у обследуемых лиц представлены на рис. 1А и 1Б соответственно.
Как следует из рис. 1А, в группе облучённых лиц было обнаружено слабое статистически значимое снижение содержания относительного количества субпопуляций Т-хелперов 2 (р=0,04) в популяции Т-хелперов центральной памяти относительно группы сравнения. Для других популяций Т-хелперов различий выявлено не было. При этом не наблюдалось различий в общем относительном количестве Т-хелперов (СО3+СО4+-клетки): медиана в группе сравнения составила 40,45% (25-75% - 34,00 - 46,69), в основной группе - 36,41% (25-75% - 32,37 - 41,97), p=0,06, что скорее указывает на перераспределение клеточных субпопуляций внутри популяции Т-хелперов, без признаков иммунодефицитных состояний у облучённых лиц.
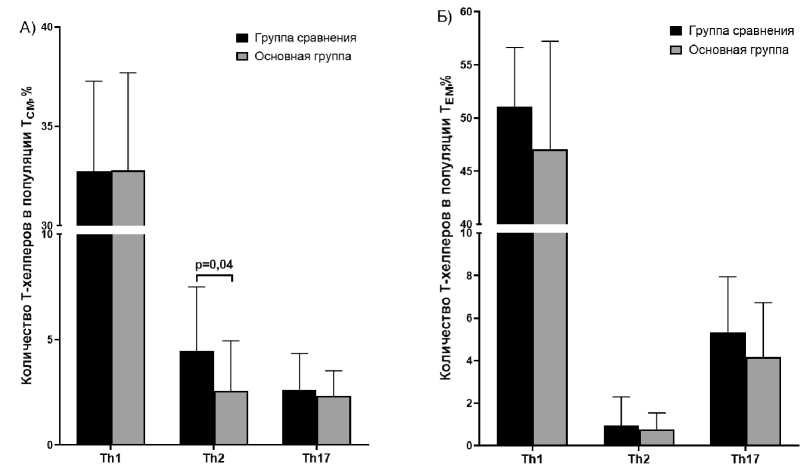
Рис. 1. Относительное количество субпопуляций Т-хелперов в популяциях Т-хелперов центральной памяти (Т ем ) (А) и Т-хелперов эффекторной памяти (Т ем ) (Б) у обследуемых лиц.
В результате корреляционного анализа было показано, что в составе популяции Т-хелперов центральной памяти статистически значимо увеличивалось относительное количество Т-хелперов 1 в зависимости от накопленной поглощённой дозы облучения ККМ (R=0,20, p=0,04). При этом, для указанной субпопуляции не было отмечено возрастных зависимостей в обеих исследуемых группах.
В составе популяции Т-хелперов эффекторной памяти не было выявлено статистически значимых дозовых зависимостей в содержании различных субпопуляций Т-хелперов периферической крови облучённых лиц.
Воздействие ионизирующего излучения вызывает изменение направления дифференцировки Т-хелперов, что приводит к дисбалансу клеточных подтипов Th1 и Th2, что в свою очередь может способствовать развитию иммуноопосредованных заболеваний: доминирующий Th2-от-вет связан с атопическими заболеваниями, а усиление Th1-ответа играет роль в развитии хронических воспалительных и аутоиммунных заболеваний, таких как ревматоидный артрит и сахарный диабет [10]. Сообщается, что облучение в высоких дозах ионизирующего излучения индуцирует стойкий иммунный ответ Th2, одновременно подавляя иммунный ответ Th1 у экспериментальных животных и выживших после атомной бомбардировки [11]. Однако эффекты, вызываемые воздействием малых и средних доз радиации, остаются спорными: ранее сообщалось, что облучение в дозе 50 мГр способствует повышению уровней мРНК цитокинов Th1 (IFN-γ) и Th2 (IL-4 и IL-5) в CD4+ T-клетках мышей [12]. В то же время в эксперименте показано, что облучение мышей в дозе 75 мГр приводит к ингибированию Th2 и активации Th1-ответа [13], а обследование иранских лаборантов-радиологов, получивших дозу облучения ниже 50 мЗв, также демонстрирует иммунологический сдвиг в сторону Th1-ответа и супрессию ответа Th2 [14].
Направление дифференцировки наивных Т-клеток в клетки Th1 или Th2 имеет решающее значение для Т-зависимого иммунного ответа. Так, например, одна из ведущих ролей в дифференцировке Th2 принадлежит цитокину IL-4, который заставляет наивные Т-клетки дифференцироваться в эффекторные клетки Th2 [15]. При этом ранее в исследованиях хронически облучённых жителей прибрежных сёл реки Течи было показано статистически значимое снижение концентрации данного цитокина в периферической крови [3], что может быть причиной снижения количества клеток Th2 у этих же облучённых лиц.
Однако не только цитокиновое окружение определяет направление дифференцировки Т-клеток. Изменение экспрессии транскрипционных факторов, участвующих в дифференцировке Т-хелперов, может существенно влиять на представленность различных субпопуляций. Например, сдвиг баланса Th1/Th2 может быть объяснён тем, что облучение в диапазоне малых доз приводит к активации транскрипционного фактора Stat4 в клетках Th1 и при этом ингибирует ключевой фактор транскрипции GATA3 в клетках Th2 [13].
Таким образом, в основе дисбаланса субпопуляций Th1/Th2 могут лежать изменения экспрессии транскрипционных факторов [13]. В связи с этим на втором этапе работы у обследованных лиц была проанализирована транскрипционная активность генов, участвующих в регуляции дифференцировки Т-хелперов. Результаты исследования представлены на рис. 2.
При сравнении двух выборок не было установлено статистически значимых различий в экспрессии мРНК исследуемых генов.
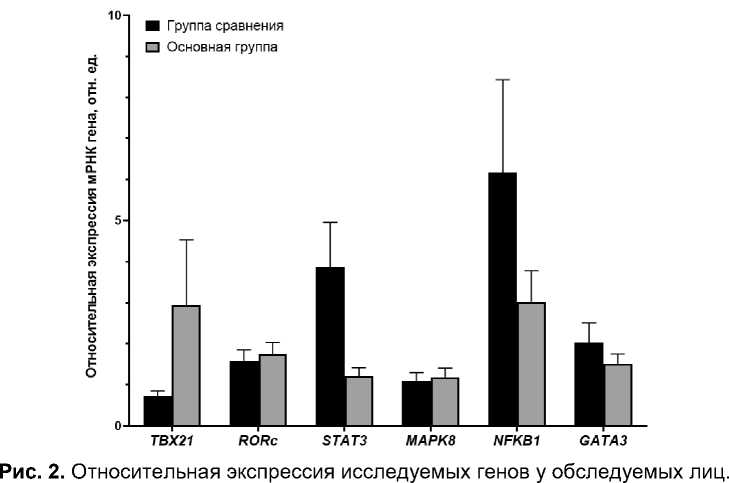
Необходимо отметить, что ранее полученные данные на расширенной выборке (264 человека) в исследовании, посвященном изучению кооперативной работе генов в отдалённые сроки после облучения, демонстрировали статистически значимое снижение транскрипционной активности гена NFKB1 в группе хронически облучённых людей [16].
Для изучения характера распределения показателей транскрипционной активности генов TBX21, STAT3 и NFKB1, подразумевающего оценку доли хронически облучённых людей, имеющих выраженные изменения в экспрессии мРНК, был проведён частотный анализ.
Результаты анализа представлены в табл. 3, где видно, что вариабельность индивидуальных значений относительного содержания мРНК генов TBX21, STAT3 и NFKB1 в двух группах была сопоставима.
Таблица 3
Частота отклонений от референтных значений (95% ДИ) относительного содержания мРНК генов TBX21, STAT3 и NFKB1 в обследованных группах
|
Ген |
Частота отклонений от референтных значений, абс. (%) |
||||
|
Группа сравнения N=54 |
Облучённые лица N=66 |
Уровень значимости, p |
|||
|
<2,5% |
>97,5% |
<2,5% |
>97,5% |
||
|
TBX21 |
1 (1,85) |
1 (1,85) |
1 (1,51) |
4 (6,06) |
0,252 |
|
STAT3 |
1 (1,85) |
1 (1,85) |
2 (3,03) |
0 (0) |
0,681 |
|
NFKB1 |
1 (1,85) |
1 (1,85) |
1 (1,51) |
1 (0,62) |
0,887 |
В рамках настоящей работы нами не было отмечено статистически значимых связей относительного содержания мРНК исследуемых генов с дозовыми характеристиками (накопленной поглощённой дозой облучения ККМ, тимуса и периферических лимфоидных органов).
Данные об изменении экспрессии генов вследствие воздействия малых доз ионизирующего излучения в клетках крови человека показывают высокую степень сложности транскрипционных изменений. В ряде работ показано нарушение регуляции сигнальных путей, находящихся под контролем транскрипционных факторов, регулирующих дифференцировку CD4+-клеток, в моделях как in vitro , так и in vivo после острого радиационного облучения в диапазоне малых и средних доз [17]. Однако, в литературе крайне мало сведений о функционировании внутриклеточных путей в отдалённые сроки после хронического радиационного воздействия.
Воздействие малых и высоких доз оказывает влияние на различные биологические процессы в иммунокомпетентных клетках. Так, уже при дозе в 5 мГр наблюдается активация цитокиновых и хемокиновых сигнальных путей, ответственных за иммунные и воспалительные процессы [18]. В работе, посвящённой изучению отдалённых последствий аварии на ЧАЭС, у облучённых людей [19] отмечается изменение экспрессии 116 генов, имеющих отношение к интерферонам, интерлейкинам, колониестимулирующим факторам и факторам роста, что напрямую свидетельствует о смещении иммунного баланса в сторону воспалительных ответов у данной категории лиц.
Ранее для этих же лиц была показана активация транскрипционного фактора NFkB1, которая имела высокую степень корреляции с содержанием ряда цитокинов, таких как IL-1 и IL-6 [20]. Примечательно, что подобные эффекты были характерны для лиц, имеющих различные клинические формы злокачественных новообразований. Так, повышенное содержание мРНК генов семейства NFkB, а именно NFκB1, NFκB2 и Rel, было зафиксировано спустя 20 лет при обследовании лиц, облучённых вследствие аварии на ЧАЭС, с раком предстательной железы [21], щитовидной железы [22], молочной железы и лейкозом [23].
Индуцированные ионизирующим излучением изменения в экспрессии генов характерны для различных подмножеств лимфоцитов у облучённых людей [24]. Ранний ответ клетки после облучения в диапазоне малых доз (5 мГр) заключался в репрессии генов, который был характерен в большей степени для клеток CD4+. Репрессированные гены были вовлечены, по большей части, в окислительное фосфорилирование и биосинтез белка.
Анализ связи экспрессии мРНК, исследуемых в рамках настоящей работы генов с относительным количеством клеток Th1, Th2 и Th17 в субпопуляциях Т-хелперов центральной и эффекторной памяти, не позволил отметить статистически значимых закономерностей.
Таким образом, в результате проведённого исследования, у облучённых лиц выявлено снижение относительного количества клеток Th2, однако изменений в количестве мРНК генов, кодирующих транскрипционные факторы дифференцировки Т-хелперов, на данном этапе работы обнаружено не было.
Заключение
Исследование, проведённое через 60-70 лет после начала хронического облучения, позволило отметить в лимфоцитах периферической крови снижение относительного количества Т-хелперов 2 типа в популяции Т-хелперов центральной памяти у лиц, с поглощённой дозой облучения красного костного мозга 742,7 ± 78,6 (диапазон: 73,5-3716,1 мГр), при этом не регистрировалось снижение общего количества Т-хелперов в исследуемой группе, что, вероятно, указывает на адаптационные механизмы, проявляющиеся в перераспределении различных субпопуляций Т-хелперов. Также наблюдалось дозозависимое увеличение количества Т-хелперов 1 типа в периферической крови облучённых лиц. Подобные изменения внутри популяции Т-хелперов могут служить маркером некоторого провоспалительного сдвига у облучённых лиц, однако для подтверждения данной гипотезы необходимы дальнейшие исследования.
Не было выявлено статистически значимых различий в транскрипционной активности генов-регуляторов дифференцировки Т-хелперов: GATA3, STAT3, TBX21, MAPK8 и RORC между обследуемыми группами людей.
Анализ связи экспрессии регуляторов транскрипции и относительного количества субпопуляций Т-хелперов у обследованных людей не позволил отметить статистически значимых закономерностей.
Список литературы Транскрипционная активность генов, регулирующих дифференцировку Т-хелперов в отдалённые сроки у хронически облучённых людей
- Li H.H., Wang Y.W., Chen R., Zhou B., Ashwell J.D., Fornace A.J.Jr. Ionizing radiation impairs T cell activation by affecting metabolic reprogramming //Int. J. Biol. Sci. 2015. V. 11, N 7. P. 726-736.
- Аклеев А.А. Иммунный статус человека в отдалённом периоде хронического радиационного воздействия //Медицинская радиология и радиационная безопасность. 2020. Т. 65, № 4. С. 29-35.
- Кодинцева Е.А., Аклев А.А., Блинова Е.А. Цитокиновый профиль лиц, подвергшихся хроническому радиационному воздействию, в отдалённые сроки после облучения //Радиационная биология. Радиоэкология. 2021. Т. 61, № 5. С. 506-514.
- Beauford S.S., Kumari A., Garnett-Benson C. Ionizing radiation modulates the phenotype and function of human CD4+ induced regulatory T cells //BMC Immunol. 2020. V. 21, N 1. P. 18. DOI: 10.1186/s12865-020-00349-w.
- ICRP, 2012. ICRP statement on tissue reactions and early and late effects of radiation in normal tissues and organs - threshold doses for tissue reactions in a radiation protection context. ICRP Publication 118 //Ann. ICRP. 2012. V. 41, N 1/2. P. 1-322.
- Дёгтева М.О., Напье Б.А., Толстых Е.И., Шишкина Е.А., Бугров Н.Г., Крестинина Л.Ю., Аклеев А.В. Распределение индивидуальных доз в когорте людей, облучённых в результате радиоактивного загрязнения реки Течи //Медицинская радиология и радиационная безопасность. 2019. Т. 64, № 3. С. 46-53.
- Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method //Methods. 2001. V. 25, N 4. P. 402-408.
- Котикова А.И., Блинова Е.А., Аклеев А.В. Субпопуляционный состав Т-хелперов в периферической крови хронически облучённых лиц в отдалённом периоде //Медицина экстремальных ситуаций. 2022. № 2. С. 65-73.
- Кудрявцев И.В., Борисов А.Г., Кробинец И.И., Савченко А.А., Серебрякова М.К., Тотолян А.А. Хемокиновые рецепторы на Т-хелперах различного уровня дифференцировки: основные субпопуляции //Медицинская иммунология. 2016. Т. 18, № 3. С. 239-250.
- Hirahara K., Nakayama T. CD4+ T-cell subsets in inflammatory diseases: beyond the Th1/Th2 paradigm //Int. Immunol. 2016. V. 28, N 4. P. 163-71.
- Park H.R., Jo S.K., Paik S.G. Factors effecting the Th2-like immune response after gamma-irradiation: low production of IL-12 heterodimer in antigen-presenting cells and small expression of the IL-12 receptor in T cells //Int. J. Radiat. Biol. 2005. V. 81, N 3. P. 221-231.
- Cho S.J., Kang H., Hong E.H., Kim J.Y., Nam S.Y. Transcriptome analysis of low-dose ionizing radiation-impacted genes in CD4+ T-cells undergoing activation and regulation of their expression of select cytokines //J. Immunotoxicol. 2018. V. 15, N 1. P. 137-146.
- Gao H., Dong Z., Gong X., Dong J., Zhang Y., Wei W., Wang R., Jin S. Effects of various radiation doses on induced T-helper cell differentiation and related cytokine secretion //J. Radiat. Res. 2018. V. 59, N 4. P. 395-403.
- Karimi G., Balali-Mood M., Alamdaran S.A., Badie-Bostan H., Mohammadi E., Ghorani-Azam A., Sadeghi M., Riahi-Zanjani B. Increase in the Th1-cell-based immune response in healthy workers exposed to low-dose radiation - immune system status of radiology staff //J. Pharmacopuncture. 2017. V. 20, N 2. P. 107-111.
- Dong C., Flavell R.A. Cell fate decision: T-helper 1 and 2 subsets in immune responses //Arthritis Res. 2000. V. 2, N 3. P. 179-188.
- Nikiforov V.S., Akleyev A.V. mRNA expression of GATA3, FOXP3, TBX21, STAT3, NFKB1, and MAPK8 transcription factors in humans and their cooperative interactions long-term after exposure to chronic radiation //Biology Bulletin. 2022. V. 49, N 6. P. 588-595.
- Bazyka D., Ilienko I., Golyarnik N., Belyaev O., Lyaskivska O. Gene expression and cellular markers of occupational radiation exposure in Chernobyl shelter construction workers //Health Phys. 2020. V. 119, N 1. P. 37-43.
- El-Saghire H., Thierens H., Monsieurs P., Michaux A., Vandevoorde C., Baatout S. Gene set enrichment analysis highlights different gene expression profiles in whole blood samples X-irradiated with low and high doses //Int. J. Radiat. Biol. 2013. V. 89, N 8. P. 628-638.
- Albanese J., Martens K., Karanitsa L.V., Schreyer S.K., Dainiak N. Multivariate analysis of low-dose radiation-associated changes in cytokine gene expression profiles using microarray technology //Exp. Hematol. 2007. V. 35, N 4. P. 47-54.
- Hosoi Y., Miyachi H., Matsumoto Y., Enomoto A., Nakagawa K., Suzuki N., Ono T. Induction of interleukin-1 beta and interleukin-6 mRNA by low doses of ionizing radiation in macrophages //Int. J. Cancer. 2001. V. 96, N 5. P. 270-276.
- Savli H., Szendroi A., Romics I., Nagy B. Gene network and canonical pathway analysis in prostate cancer: a microarray study //Exp. Mol. Med. 2008. V. 40, N 2. P. 176-185.
- Cine N., Tarkun I., Canturk N., Gunduz Y., Sunnetci D., Savli H. Whole genome expression, canonical pathway and gene network analysis in the cases of papillary thyroid cancer //European Society of Human Genetics Conference Proceedings. 2012. V. 20, N 1. P.192.
- Savli H., Akkoyunlu R.U., Cine N., Gluzman D.F., Zavelevich M.P., Sklyarenko L.M., Koval S.V., Sunnetci D. Deregulated levels of the NF-kB1, NF-kB2, and Rel genes in Ukrainian patients with leukemia and lymphoma in the post-Chernobyl period //Turk. J. Haematol. 2016. V. 33, N 1. P. 8-14.
- Gruel G., Voisin P., Vaurijoux A., Roch-Lefevre S., Gregoire E., Maltere P., Petat C., Gidrol X., Voisin P., Roy L. Broad modulation of gene expression in CD4+ lymphocyte subpopulations in response to low doses of ionizing radiation //Radiat. Res. 2008. V. 170, N 3. P. 335-344.


