Транскрипционный фактор BRN-3 и рак предстательной железы, связь с особенностями гормональной рецепции и с уровнем активации AKT/M-TOR сигнального пути
Автор: Спирина Людмила Викторовна, Горбунов Алексей Константинович, Кондакова Ирина Викторовна, Слонимская Евгений Анатольевич, Усынин Е.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.17, 2018 года.
Бесплатный доступ
Введение. Транскрипционные факторы POU4F1 (нейрогенные факторы Brn-3α) играют значимую роль в развитии злокачественных новообразований. Цель исследования - изучение экспрессии транскрипционного фактора Brn-3α, андрогеновых (AR) и эстрогеновых рецепторов (ER) в ткани доброкачественной гиперплазии и рака предстательной железы и определении связи с уровнем активации AKT/mTOR сигнального пути. Материал и методы. В исследование было включено 30 больных местнораспространенным раком предстательной железы (РПЖ) T2-3N0M0, 15 пациентов с доброкачественной гиперплазией предстательной железы (ДГПЖ). Определение уровня экспрессии генов Brn-3α, AR, ERα, а также компонентов AKT/m-TOR сигнального пути проводилось методом ПЦР в реальном времени. Результаты. Показано, что увеличение экспрессии гена ядерного белка Brn-3α сопровождалось ростом уровня мРНК ERα в ткани рака предстательной железы. Экспрессия AR была высока в обеих группах больных. Выявлена активация AKT/m-TOR сигнального каскада: отмечены высокие уровни экспрессии AKT, а также m-TOR в трансформированных клетках. Однако отмечено отсутствие изменений фосфатазы PTEN при развитии патологических процессов предстательной железы. Заключение. Транскрипционный фактор Brn-3α связан с развитием РПЖ, что сопровождается повышением экспрессии ERα, протеинкиназы AKT и m-TOR.
Транскрипционный фактор brn-3α, рак предстательной железы, сигнальный путь akt/m-tor
Короткий адрес: https://sciup.org/140254158
IDR: 140254158 | УДК: 616.65-006.6:576.3:577.2:577.1 | DOI: 10.21294/1814-4861-2018-17-1-26-31
Текст научной статьи Транскрипционный фактор BRN-3 и рак предстательной железы, связь с особенностями гормональной рецепции и с уровнем активации AKT/M-TOR сигнального пути
Введение . Транскрипционные факторы POU4F1 (нейрогенные факторы Brn-3 a ) играют значимую роль в развитии злокачественных новообразований. Цель исследования – изучение экспрессии транскрипционного фактора Brn-3 α , андрогеновых (AR) и эстрогеновых рецепторов (ER) в ткани доброкачественной гиперплазии и рака предстательной железы и определении связи с уровнем активации AKT/mTOR сигнального пути. Материал и методы . В исследование было включено 30 больных местнораспространенным раком предстательной железы (РПЖ) T2–3N0M0, 15 пациентов с доброкачественной гиперплазией предстательной железы (ДГПЖ). Определение уровня экспрессии генов Brn-3 α , AR, ER α , а также компонентов AKT/m-TOR сигнального пути проводилось методом ПЦР в реальном времени. Результаты. Показано, что увеличение экспрессии гена ядерного белка Brn-3 a сопровождалось ростом уровня мРНК ER α в ткани рака предстательной железы. Экспрессия AR была высока в обеих группах больных. Выявлена активация AKT/m-TOR сигнального каскада: отмечены высокие уровни экспрессии AKT, а также m-TOR в трансформированных клетках. Однако отмечено отсутствие изменений фосфатазы PTEN при развитии патологических процессов предстательной железы. Заключение. Транскрипционный фактор Brn-3 α связан с развитием РПЖ, что сопровождается повышением экспрессии ER α , протеинкиназы AKT и m-TOR.
В развитии гормонозависимых опухолей человека большое значение имеют транскрипционные факторы POU4F1, также известные как нейрогенные факторы Brn-3 α [1]. Они представляют собой важные ядерные белки, регулирующие процессы пролиферации и дифференцировки клетки. Полагают, что транскрипционный фактор Brn-3 α вовлечен в различные процессы онкогенеза, в частности, участвуя в проведении апоптотических сигналов и контролируя скорость клеточного цикла [2]. Кроме того, определено влияние данного показателя на уровень экспрессии рецепторов половых гормонов: эстрогенов (ER) и андрогенов (AR) [3].
Рецепторы стероидных гормонов входят в большое семейство внутриклеточных рецепторов, которые активируются под действием соответствующих лигандов. ER и AR являются их основными представителями. ER имеют 2 подтипа: ER α и ER β . Каждый из них кодируется отдельным геном, при этом имеются сведения о преимущественной экспрессии того или иного подтипа рецептора в разных тканях [3]. Известна роль ER α в качестве важного регулятора интенсивности процессов ангиогенеза гормонозависимых опухолей [4]. Изменение уровня и экспрессии стероидных гормонов найдено в злокачественных новообразованиях
различных локализаций [5]. В первую очередь к ним относят рак предстательной железы (РПЖ), рак молочной железы и др. Известно, что роль AR различается в разных типах опухоли. Например, рецепторы являются стимуляторами опухолевого роста при раке мочевого пузыря, предстательной железы, в то время как в печени они является супрессорами опухолевого роста [6].
Ключевым сигнальным каскадом, обеспечивающим регуляцию процессов пролиферации и апоптоза опухолевых клеток при действии AR и ER, является AKT/m-TOR путь [7–9]. К его значимым компонентам относят протеинкиназы AKT, m-TOR, PTEN и др. Известно, что мужчины с доброкачественной гиперплазией предстательной железы (ДГПЖ) имеют больший риск развития РПЖ [10]. В настоящее время превалирует точка зрения об общности патогенетических процессов, лежащих в основе развития ДГПЖ и РПЖ [11]. В частности, показано, что высокая экспрессия AR характерна для обоих видов патологий.
Цель исследования – изучение экспрессии транскрипционного фактора Brn-3 α , AR, ER α в ткани доброкачественной гиперплазии и рака предстательной железы, а также оценка уровня активации AKT/mTOR сигнального пути.
Материал и методы
В исследование было включено 30 больных местнораспространенным РПК T2–3N0M0 и 15 пациентов с доброкачественной гиперплазией предстательной железы, проходивших лечение в клиниках НИИ онкологии Томского НИМЦ. Объ- емы диагностики и лечения больных соответствовали рекомендуемым алгоритмам, утвержденным Министерством здравоохранения и социального развития РФ. Проведение данной работы одобрено этическим комитетом НИИ онкологии Томского НИМЦ.
Материалом для исследования являлись образцы гиперплазированной и опухолевой ткани, полученные при проведении диагностической биопсии, а также нормальная ткань простаты, которая была получена при оперативном вмешательстве у больных раком мочевого пузыря.
Для исследования экспрессии молекулярных показателей и выделения мРНК образцы тканей помещали в раствор RNAlater (Ambion, USA) и сохраняли при температуре –80ºС (после 24-часовой инкубации при +4ºС).
Определение уровня экспрессии генов Brn-3α, AR, ERα, а также компонентов AKT/m-TOR сигнального пути
РНК выделяли с помощью набора RNeasy mini Kit, содержащего ДНКазу I (Qiagen, Germany). Для оценки количества выделенной РНК на спектрофотометре NanoDrop-2000 (Thermo Scientific, USA) оценивали концентрацию и чистоту выделения РНК. Концентрация РНК составила от 80 до 250 нг/мкл, А260/А280=1,95–2,05; А260/ А230=1,90–2,31. Целостность РНК оценивалась при помощи капиллярного электрофореза на приборе TapeStation (Agilent Technologies, USA) и набора R6K ScreenTape (Agilent Technologies, USA). RIN составил 5,6–7,8.
Таблица 1 Последовательность праймеров исследованных генов Ген Ампликон Последовательность POU4F1 NM_006237 AR NM_000044 ER NM_000125 4E-BP1 294 п.н. 190 п.н. 386 п.н. 244 п.н. 181 п.н. 152 п.н. 267 п.н. 244 п.н. 160 п.н. F 5′- CACGCTCTCGCACAACAA-3′ R 5′- ATCCGCTTCTGCTTCTGTCT-3′ F 5′- GAGGGACAGCAGGCAGA-3′ R 5′- GCTATCAGAACACACACACACACT-3′ F 5′- TCCTGATGATTGGTCTCGTCT-3′ R 5′- GATGTGGGAGAGGATGAGGA-3′ F 5′- CAGCCCTTTCTCCCTCACT -3′ NM_004095.3 AKT1 NM_001014431.1 С-RAF NM_002880.3 GSK3b NM_001146156.1 70S kinase alpha NM_001272042.1 m-TOR NM_004958.3 R 5′- TTCCCAAGCACATCAACCT -3′ F 5′- CGAGGACGCCAAGGAGA -3′ R 5′- GTCATCTTGGTCAGGTGGTGT -3′ F 5′- TGGTGTGTCCTGCTCCCT -3′ R 5′- ACTGCCTGCTACCTTACTTCCT -3′ F 5′- AGACAAGGACGGCAGCAA -3′ R 5′- TGGAGTAGAAGAAATAACGCAAT -3′ F 5′- CAGCACAGCAAATCCTCAGA -3′ R 5′- ACACATCTCCCTCTCCACCTT -3′ F 5′- CCAAAGGCAACAAGCGAT-3′ R 5′- TTCACCAAACCGTCTCCAA -3′ PDK1 NM_001278549.1 187 п.н. F 5′- TCACCAGGACAGCCAATACA -3′ R 5′- CTCCTCGGTCACTCATCTTCA -3′ GAPDH NM_001256799.2 138 п.н. F 5′- GGAAGTCAGGTGGAGCGA-3′ R 5′-GCAACAATATCCACTTTACCAGA-3′ Примечание: NM – номер последовательности РНК в NCBI Nucleotide Database ; F – прямой праймер; R – обратный праймер. СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2018; 17(1): 26–31 27
Уровень экспрессии генов оценивали при помощи количественной обратно-транскриптазной ПЦР в режиме реального времени (RT-qPCR) с использованием красителя SYBR Green на ам-плификаторе iCycler (Bio-Rad, USA). Для получения кДНК на матрице РНК проводили реакцию обратной транскрипции с помощью набора OT m-MuLV-RH (БиоЛабмикс, Россия) со случайными гексануклеотидными праймерами в соответствии с инструкцией к набору. ПЦР ставили в трех репликах в объеме 25 мкл, содержащем 12,5 мкл БиоМастер HS-qPCR SYBR Blue (БиоЛабмикс, Россия), 300 нM прямого и обратного праймеров и 50 нг кДНК. Двухшаговая программа амплификации включала 1 цикл – 94ºС, 10 мин – предварительная денатурация; 40 циклов – 1-й шаг 94ºС, 10 сек и 2-й шаг, – 20 сек при температуре 60ºС. Праймеры были подобраны с использованием программы Vector NTI Advance 11,5 и базы данных NCBI (табл. 1). В качестве референсного гена использовали ген «домашнего хозяйства» фермента GAPDH (glyceraldehydes-3-phosphate dehydrogenase), и уровень экспрессии каждого целевого гена нормализовали по отношению к экспрессии GAPDH.
Статистическую обработку результатов проводили с применением пакета программ Statistica 8.0. Результаты определения экспрессии генов представлены как среднее значение ± ошибка среднего.
Результаты и обсуждение
Показано увеличение экспрессии мРНК транскрипционного фактора Brn-3 α в 4,13 раза в ткани РПЖ по сравнению с ДГПЖ (рис. 1). Это свидетельствует о том, что в трансформированных клетках простаты происходит увеличение экспрессии данного маркера, что влияет на уровень рецепторов стероидных гормонов. Этот факт подтверждается также экспериментальными данными, полученными D.C. Berwick et al. [2]. Авторами доказано влияние данного показателя на рост транскрипционной активности рецепторов ER и AR.
В ткани РПЖ отмечен рост экспрессии ER α в 30,33 раза по сравнению с тканью аденомы (табл. 2). При этом выявлено, что в обеих группах больных отмечен высокий уровень мРНК AR. Полученные данные свидетельствуют о том, что для злокачественных опухолей предстательной железы характерно повышение экспрессии как ER,
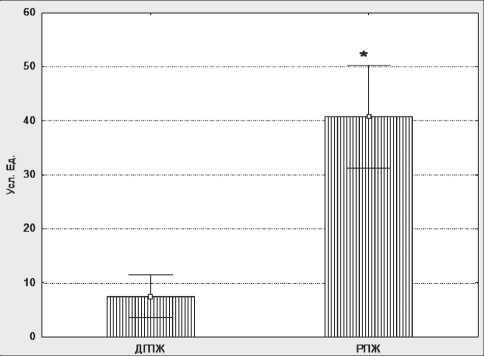
Рис. 1. Экспрессия гена транскрипционного фактора Brn-3 α в ткани ДГПЖ и РПЖ. Примечание: * – различия статистически значимы по сравнению с показателями у больных ДГПЖ (p<0,05)
так и AR в отличие от ДГПЖ. Имеются сведения, что пролиферация опухолевых клеток простаты в условиях in vitro происходит под влиянием активирующих сигналов ER α , определяя особенности течения заболевания [12, 13]. Выявленный факт является молекулярной особенностью трансформированных клеток, и его значимость еще предстоит оценить.
При сравнительном анализе экспрессии генов компонентов AKT/m-TOR сигнального пути в патологических процессах предстательной железы отмечена активация данного сигнального каскада, доказательством которой является повышенный уровень экспрессии протеинкиназы AKT (табл. 3). В ткани рака предстательной железы зафиксировано увеличение этого показателя в 4,9 раза по сравнению с ДГПЖ. Дополнительным доказательством высокой активности AKT/m-TOR сигнального пути при злокачественных новообразованиях явилось повышение уровня мРНК m-TOR в 8,4 раза. Стоит отметить, что сходные значения уровня фосфатазы PTEN наблюдались как при ДГПЖ, так и при раке предстательной железы.
Дополнительные сведения, подтверждающие связь молекулярных маркеров с наличием патологических изменений в ткани предстательной железы, были получены при проведении корреляционного анализа (рис. 2). Так, при изучении корреляционных зависимостей в ткани ДГПЖ выявлены связи молекулярных показателей с ядерным
Таблица 2
Экспрессия генов андрогеновых (AR) и эстрогеновых рецепторов (ER) при патологии предстательной железы
Показатель, усл. ед.
ДГПЖ
Рак предстательной железы
AR
173,0 ± 79,6
151,87 ± 23,0
ER
2,62 ± 1,19
79,47 ± 20,17*
Примечание: * – различия статистически значимы по сравнению с показателями у больных ДГПЖ (p<0,05).
Таблица 3
Экспрессия генов компонентов AKT-m-TOR сигнального пути при патологии предстательной железы
|
Показатель, усл. ед. |
ДГПЖ |
Рак предстательной железы |
|
PTEN |
Компоненты AKT/m-TOR сигнального пути 193,5 ± 75,9 |
234,01 ± 24,9 |
|
AKT |
2,15 ± 0,59 |
10,53 ± 3,3* |
|
GSK-3-beta |
0,95 ± 0,48 |
12,6 ± 5,69 |
|
PDK1 |
5,75 ± 3,78 |
2,9 ± 1,0 |
|
c-RAF |
13,63 ± 8,1 |
25,19 ± 8,28 |
|
m-TOR |
Протеинкиназа m-TOR и ее субстраты 3,69 ± 1,32 |
30,99 ± 13,8* |
|
70 S6 |
3,45 ± 1,74 |
18,35 ± 11,11 |
|
4E-BP1 |
1,48 ± 0,58 |
3,93 ± 1,94 |
Примечание: * – различия статистически значимы по сравнению с показателями у больных ДГПЖ (p<0,05).
фактором Brn-3 α . Уровень его экспрессии зависел от мРНК гена 4E-BP1 (r=0,9; p=0,001) и от мРНК m-TOR (r=0,8; p=0,001). Также подтверждена значимость AR в развитии предопухолевых заболеваний простаты. Отмечены корреляции между экспрессией AR, экспрессией c-Raf (r=0,7; p=0,001), 70 S6 киназой (r=0,95; p=0,001) и PTEN (r=0,8; p=0,014). Вероятно, повышение экспрессии AR, приводящее к активации AKT/m-TOR сигнального пути, сочетается с высоким уровнем мРНК PTEN.
При РПЖ отмечена прямая зависимость экспрессии Brn-3α от уровня мРНК 4EBP1 (r=0,4; p=0,01) и мРНК AR (r=0,28; p=0,018). При этом отмечены отрицательная зависимость между экспрессией AR и PDK1 при РПЖ (r=–0,42; p=0,001), а также положительные зависимости между AR, уровнем мРНК c-RAF (r=0,57; p=0,001) и 70 S6 киназой (r=0,5; p=0,001). Интересным является факт сопряженности между экспрессией PTEN и AR (r=0,66; p=0,001), а также Brn-3α (r=0,29 p=0,001). При корреляционном анализе выявлено влияние эстрогеновых рецепторов в ткани РПЖ на уровень активации AKT/m-TOR сигнального пути, что подтверждается связями между экспрес- сией ERα и AKT (r=0,57; p=0,01), а также с c-RAF (r=0,57; p=0,01), GSK-3β (r=0,40; p=0,015) и PDK1 (r=0,28; p=0,01).
Заключение
Развитие доброкачественной гиперплазии предстательной железы связано с увеличением экспрессии AR, что определяет в дальнейшем возникновение злокачественной патологии. Выявлено, что в трансформированных клетках железы в этих условиях возрастает экспрессия ядерного фактора Brn-3α, который способствует росту уровня мРНК ERα. Изменение гормональной рецепции при развитии опухолевой патологии сопровождается повышением активности AKT/m-TOR сигнального каскада на фоне исходных значений мРНК гена PTEN. Стоит отметить, что зафиксирован факт усиления связей между компонентами сигнального каскада, рецепторами гормонов и Brn-3 α в развитии патологических процессов предстательной железы. Резюмируя полученные данные, можно полагать, что изучаемые молекулярные маркеры ассоциированы с развитием злокачественных новообразований, определяя особенности их течения.
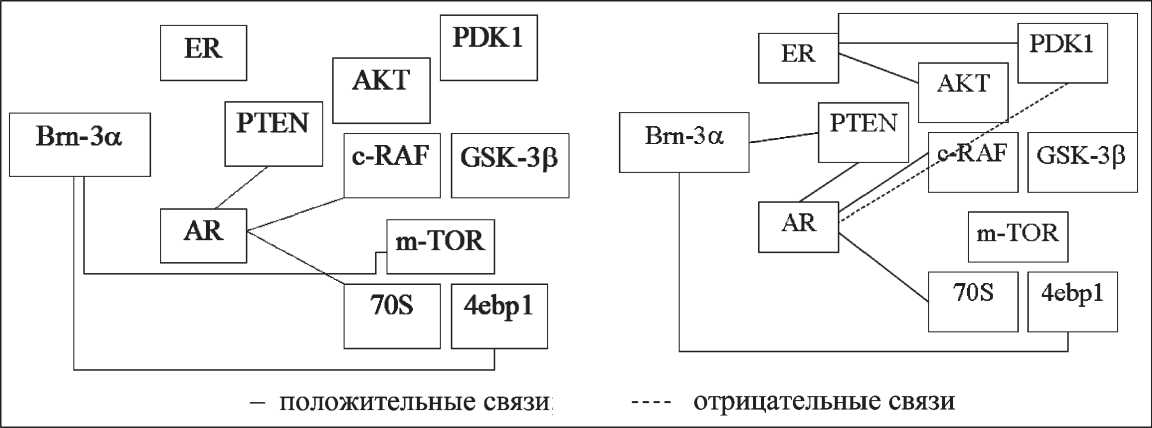
Рис. 2. Корреляционные связи между молекулярными маркерами в ткани ДГПЖ (А) и в ткани РПЖ (Б)
Список литературы Транскрипционный фактор BRN-3 и рак предстательной железы, связь с особенностями гормональной рецепции и с уровнем активации AKT/M-TOR сигнального пути
- Budhram-Mahadeo V., Fujita R., Bitsi S., Sicard P., Heads R. Co-expression of POU4F2/Brn-3b with p53 may be important for controlling expression of pro-apoptotic genes in cardiomyocytes following ischaemic/hypoxic insults. Cell Death Dis. 2014; 5: 1503. DOI: 10.1038/cddis.2014.452
- Berwick D.C., Diss J.K., Budhram-Mahadeo V.S., Latchman D.S. A simple technique for the prediction of interacting proteins reveals a direct Brn-3a-androgen receptor interaction. J Biol Chem. 2010 May 14; 285 (20): 15286-95. DOI: 10.1074/jbc.M109.071456
- Stoica J., Franke F.T., Wellstein A., Szubaiko F., List H.-J., Reiter R., Morgan E., Martin M.B., Stoica A. Estradiol Rapidly Activates Akt via the ErbB2 Signaling Pathway. J Biol Chem. 2010 May 14; 285 (20): 15286-95. DOI: 10.1074/jbc.M109.071456
- Vamesu S. Angiogenesis and ER/PR status in primary breast cancer patients: an analysis of 158 needle core biopsies. Rom J Morphol Embryol. 2007; 48 (1): 25-31.
- Ahmad N., Kumar R. Steroid hormone receptors in cancer development: A target for cancer therapeutics. Cancer Lett. 2011 Jan 1; 300 (1): 1-9. DOI: 10.1016/j.canlet.2010.09.008


