Транскриптомные характеристики макрофагов микроокружения опухоли у пациенток с трижды негативным раком молочной железы в зависимости от PD-L1 статуса опухоли
Автор: Калинчук А.Ю., Пацкан И.А., Вторушин С.В., Таширева Л.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 т.24, 2025 года.
Бесплатный доступ
Цель исследования – охарактеризовать транскриптомные особенности кластеров CD68+ и CD163+ макрофагов в опухолевом микроокружении у пациенток с трижды негативным раком молочной железы (ТНРМЖ) в зависимости от PD-L1 статуса опухоли. Материал и методы. В исследование включено 11 пациенток с ТНРМЖ. PD-L1 статус определяли методом иммуногистохимии. Пространственное транскриптомное профилирование выполняли с использованием платформы Visium 10x Genomics. Аннотацию CD68+ и CD163+ кластеров проводили в программе Loupe Browser 8.0.0. Дифференциальную экспрессию генов и обогащение биологических путей анализировали для CD68+ и CD163+ кластеров в группах с позитивным и негативным PD-L1 статусом. Результаты. В опухолях с позитивным PD-L1 статусом выявлен компенсаторный рекрутинг иммунных клеток при признаках их функционального истощения, в который вовлекаются CD68+ макрофаги. При негативном PD-L1 статусе микроокружение характеризовалось активным адаптивным иммунным ответом с участием CD68+ макрофагов как антиген-презентирующих клеток, но с выраженными элементами негативной регуляции воспаления, ассоциированной с CD163+ макрофагами. Заключение. Функциональное состояние макрофагов и клеточных компонентов микроокружения ТНРМЖ существенно различается в зависимости от PD-L1 статуса опухоли. Полученные данные могут способствовать идентификации биомаркеров ответа на иммунотерапию у данной категории пациенток.
Макрофаги, опухолевое микроокружение, пространственное профилирование транскриптома, Pd-l1, трижды негативный рак молочной железы
Короткий адрес: https://sciup.org/140312764
IDR: 140312764 | УДК: 618.19-006.6:612.017.1 | DOI: 10.21294/1814-4861-2025-24-5-64-71
Текст научной статьи Транскриптомные характеристики макрофагов микроокружения опухоли у пациенток с трижды негативным раком молочной железы в зависимости от PD-L1 статуса опухоли
Трижды негативный рак молочной железы (ТНРМЖ) составляет около 15–20 % всех случаев рака молочной железы и характеризуется агрессивным клиническим течением, высокой гетерогенностью и неблагоприятным прогнозом [1]. Для данной категории опухолей отсутствует экспрессия рецепторов эстрогена, прогестерона и HER2, что ограничивает возможности системной терапии и делает актуальным поиск новых молекулярных и иммунологических мишеней.
В последние годы значительное внимание уделяется иммунному микроокружению опухоли, в частности опухолеассоциированным макрофагам (tumor-associated macrophages, TAMs), которые могут составлять до 50 % клеточной массы инфильтрата [2]. Опухолеассоциированные макрофаги обладают выраженной пластичностью: их функциональное состояние варьирует от про-воспалительного (M1-подобного) фенотипа, способствующего противоопухолевому иммунному ответу, до иммуносупрессивного (M2-подобного), ассоциированного с прогрессированием и метастазированием опухоли [3].
Одним из перспективных направлений терапии ТНРМЖ является использование ингибиторов контрольных точек иммунного ответа, в частности PD-1/PD-L1 блокаторов. Взаимодействие лиганда PD-L1 с рецептором PD-1 подавляет функциональную активность PD-1-позитивных клеток, что проявляется в снижении секреции ими цитокинов и может индуцировать их апоптоз, в конечном счете блокируя иммунный ответ. Этот механизм позволяет PD-L1-позитивным опухолевым клеткам избегать узнавания иммунной системой [4]. При этом известно, что экспрессия PD-L1 может наблюдаться не только на опухолевых клетках, но и на клетках микроокружения, включая макрофаги, и может быть ассоциирована с прогнозом и чувствительностью к иммунотерапии [5]. Однако экспрессионные особенности TAM при ТНРМЖ в зависимости от PD-L1 статуса до настоящего времени изучены недостаточно.
Транскриптомный анализ, основанный на исследовании полного набора мРНК, экспрессируемых в клетке, позволяет проводить количественную оценку генной экспрессии, обеспечивая детальную характеристику функционального состояния клеток. Пространственное транскриптомное профилирование представляет собой современный метод, позволяющий одновременно оценивать экспрессию генов и учитывать топографический контекст клеточных популяций в опухоли. Данный подход открывает новые возможности для анализа функционального состояния макрофагов и их вклада в иммунные механизмы ТНРМЖ.
Цель исследования – охарактеризовать транскриптомные особенности кластеров CD68⁺ и CD163⁺ макрофагов в опухолевом микроокружении у пациенток с трижды негативным раком молочной железы (ТНРМЖ) в зависимости от PD-L1 статуса опухоли.
Материал и методы
В исследование включено 11 пациенток (T1– 4N0–2M0) с гистологически верифицированным тройным негативным раком молочной железы. Большинство пациенток (n=7, 64 %) были моложе 50 лет; 4 (36 %) – старше 50 лет. Распределение по критерию T: T1 – 4 (36 %), T2 – 2 (18 %), T3 – 2 (18 %), T4 – 3 (27 %); по критерию N: N0 – 7 (64 %), N1 – 3 (27 %), N2 – 1 (9 %) больная. Распределение по стадиям заболевания было следующим: I стадия – 4 (36 %), IIA – 2 (18 %), IIB – 1 (9 %), IIIA – 1 (9 %), IIIB – 3 (27 %) пациентки. Все образцы опухолевой ткани были получены до начала системного лечения. Гистологический диагноз устанавливался в соответствии с классификацией ВОЗ (5-е издание). Все случаи представлены инвазивной карциномой неспецифического типа. По степени злокачественности опухоли преобладала II степень – 7 (64 %); III степень выявлена у 4 (36 %) больных.
Определение статуса PD-L1 выполняли методом иммуногистохимии с использованием моноклонального антитела к PD-L1 (клон SP142, Ventana, Roche). Оценку экспрессии проводили в соответствии с действующими международными рекомендациями для трижды негативного рака молочной железы. PD-L1-позитивным считался статус при наличии окрашивания не менее чем в 1 % опухолеассоциированных иммунных клеток (IC≥1 %) в пределах опухолевой площади. В исследуемой группе PD-L1-позитивный статус зарегистрирован у 5 (45 %), отрицательный – у 6 (55 %) пациенток.
Для изучения экспрессии генов в опухолевой ткани использовалась технология Visium Spatial Gene Expression (10x Genomics, США). Исследование было выполнено по методу, описанному авторами ранее [6]. Пространственное распределение транскриптомных данных визуализировалось и аннотировалось с помощью Loupe Browser 8.0.0 (10x Genomics, США).
Для идентификации макрофагов применялись маркерные гены CD68 и CD163 с использованием следующих порогов нормализованной экспрессии: CD68 (LogNorm≥2) – отбор CD68⁺(CD163⁻) спотов; CD163 (LogNorm≥1,7) – отбор CD163⁺(CD68⁺/⁻) спотов. Выбранные значения соответствовали верхней трети распределения экспрессии и позволяли выделять споты со средней и высокой экспрессией маркерных генов. Стромальные споты определялись вручную на основании морфологических характеристик опухолевой ткани, окрашенной гематоксилином и эозином. Для дальнейшего анализа отобраны: 378 CD68⁺(CD163⁻) спотов (около 2 % от общего числа), 682 CD163⁺(CD68⁺/⁻) спота (около 3 % от общего числа). Все отобранные споты соответствовали клеткам микроокружения опухоли и были выявлены в образцах всех 11 пациенток, включенных в исследование (рис. 1).
Дифференциальный анализ экспрессии генов проводили отдельно для кластеров CD68⁺ и CD163⁺ у пациенток с положительным и отрицательным статусом PD-L1. Для идентификации маркерных генов применяли функцию FindAllMarkers пакета Seurat (R), используя тест Вилкоксона с коррекцией на множественные сравнения по методу
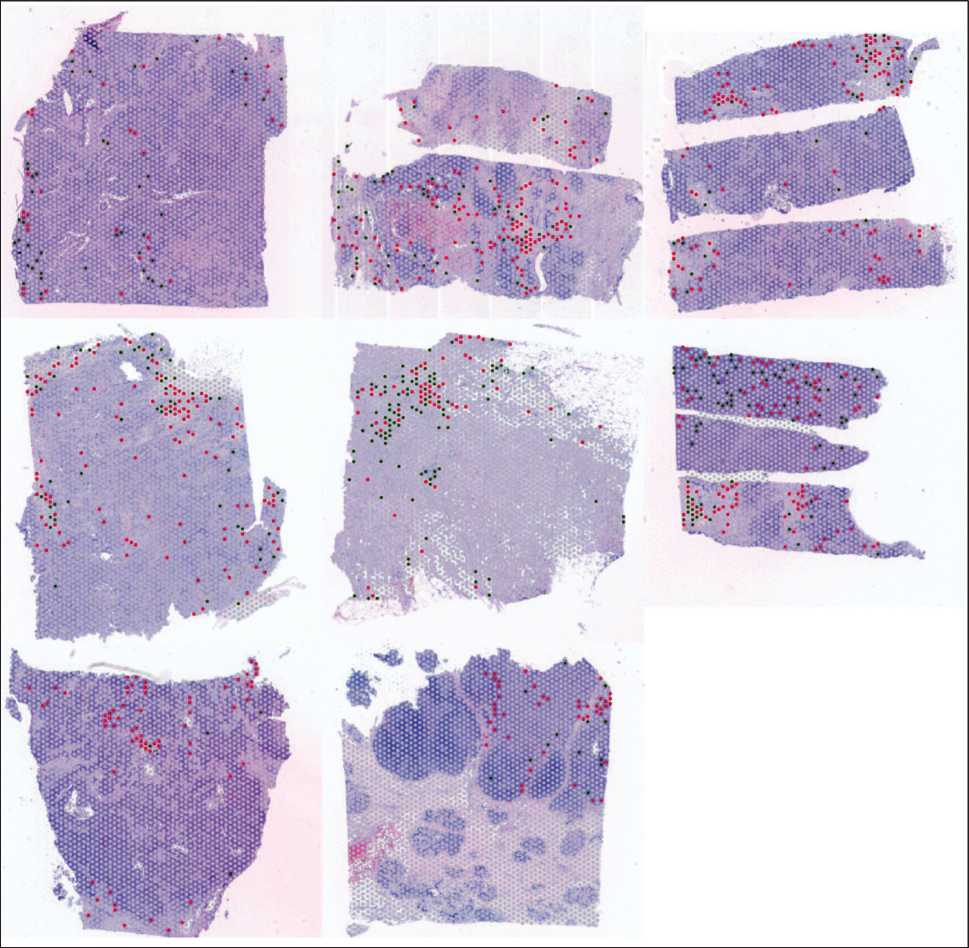
Рис. 1. Аннотация спотов в Loupe Browser (зеленые точки – стромальные CD68+ споты;
красные точки – стромальные CD163+ споты). Примечание: рисунок выполнен авторами
Fig 1. Spot annotation in Loupe Browser: green dots represent stromal CD68+ spots, red dots represent stromal CD163+ spots.
Note: created by the authors
Бенджамини–Хохберга. Гены считались дифференциально экспрессированными при следующих критериях: |LFC|>0,58 и padj<0,05 (LFC – log fold change, логарифмическое изменение кратности; padj – p adjusted, скорректированное значение p).
Визуализацию результатов выполняли с использованием встроенных инструментов пакета Seurat и пакета EnhancedVolcano (v1.24.0), что позволило формировать диаграммы рассеяния и «вулкан-плоты» для наглядного отображения профилей экспрессии. Анализ функционального обогащения биологических процессов выполняли с использованием пакета clusterProfiler (v4.16.0) в среде R. Проведенное исследование функционального обогащения позволило интерпретировать результат анализа дифференциально экспрессированных генов и показать, какие биологические процессы более активны в клетках опухолевой ткани одной группы пациенток в сравнении с другой. Для анализа применялись ранжированные списки генов, полученные по результатам дифференциальной экспрессии в кластерах CD68⁺ и CD163⁺ с учетом PD-L1 статуса опухоли. Оценку проводили по терминам онтологии генов (Gene Ontology, раздел Biological Process). Статистическую значимость различий определяли на уровне padj<0,05, что обеспечивало строгий контроль за множественными сравнениями.
Результаты
Для оценки экспрессионных особенностей макрофагов опухолевого микроокружения был проведен сравнительный анализ кластеров CD68⁺ и CD163⁺ у пациенток с ТНРМЖ в зависимости от PD-L1 статуса опухоли. При этом определяли количество дифференциально экспрессированных генов и проводили анализ обогащения биологических процессов, связанных с иммунным ответом, воспалением и ремоделированием стромы. На рис. 2 представлены результаты дифференциального анализа экспрессии генов в кластерах CD68⁺ и CD163⁺ при сравнении пациенток с положительным и отрицательным PD-L1 статусом. В кластере CD68⁺ обнаружено 324 гена со значимыми различиями в уровне экспрессии, в кластере CD163⁺ – 437 генов.
Биологические процессы, значимо обогащенные (padj<0,05) в кластерах CD68⁺ и CD163⁺ у пациенток с различным PD-L1 статусом, определялись на основе анализа дифференциально экспрессированных генов. В кластере CD68⁺ у больных с PD-L1-позитивными опухолями выявлено обогащение 84 процессов, тогда как при PD-L1-негативном статусе – 83 процессов. В кластере CD163⁺ у пациенток с положительным PD-L1 статусом идентифицирован 21 обогащенный процесс, а у пациенток с отрицательным PD-L1 статусом – 163 процесса.
Для последующего углубленного анализа были отобраны процессы, связанные с иммунным ответом и привлечением иммунных клеток, активацией и рекрутированием фибробластов, а также с механизмами неоангиогенеза (рис. 3). При детальном анализе CD68⁺ кластера у пациенток с PD-L1-позитивным статусом наблюдалось обогащение процессов, связанных с миграцией и хемотаксисом лимфоцитов (padj=0,0233), миелоидных клеток (padj=0,0254), а также с их регуляцией (padj=0,0309). У пациенток с отрицательным PD-L1 статусом в этом же кластере преимущественно обогащались процессы, связанные со сборкой молекул MHC-II (padj=0,0044), антиген-презентацией (padj=0,0063), активацией лимфоцитов, включая Т-клетки (padj=0,0272), функционированием сигнальных путей иммунных рецепторов (padj=0,0284), реализацией гуморального иммунного ответа (padj=0,0259), а также регуляцией воспалительных (padj=0,0131) и репаративных процессов (padj=0,0278). Для этой группы также отмечалось угнетение процессов, связанных с миграцией и хемотаксисом лейкоцитов.
Анализ CD163⁺ кластера показал, что у пациенток с позитивным PD-L1 статусом были обогащены только 4 значимых с точки зрения изучения иммунологических механизмов процесса: три из них связаны с ответом на хемокины (padj=0,0421; padj=0,0461; padj=0,0461) и один – с миграцией гранулоцитов (padj=0,0461). В CD163+ кластере у пациенток с негативным PD-L1 статусом были обогащены процессы, ассоциированные с гуморальным иммунным ответом (padj=0,0001), активацией (padj=0,0147) и супрессией иммунных клеток (padj=0,0a3j66), реакцией на TGF-β (padj=0,0349), TNF (padj=0,0365), регуляцией ангиогенеза (padj=0,0365) и пролиферацией фибробластов (padj=0,0378).
Обсуждение
Использование метода пространственного профилирования транскриптома Visium 10x позволило выбрать участки стромы опухоли, содержащие макрофаги, и сравнить функциональные особенности клеток, входящих в эти участки, в зависимости от PD-L1 статуса опухоли. В частности, были выявлены различия в иммунологических процессах, вовлекающих макрофаги, у пациенток с PD-L1-позитивным и PD-L1-негативным ТНРМЖ.
Позитивный PD-L1 статус предполагает, что в микроокружении опухоли активно функционирует иммунная контрольная точка PD-1/PD-L1, что приводит к истощению Т-клеток и других иммунных клеток и ограничению противоопухолевого иммунного ответа [7]. На этом фоне возможно усиление привлечения иммунных клеток в опухоль для поддержания иммунного ответа. CD68+ макрофаги в данном механизме могут быть задействованы как клетки, секретирующие провоспалительные цитокины и хемокины, привлекающие Т-клетки и гранулоциты. При негативном PD-L1 статусе механизм PD-1/PD-L1 не активен и не ограничивает иммунный ответ против опухоли. В нашем
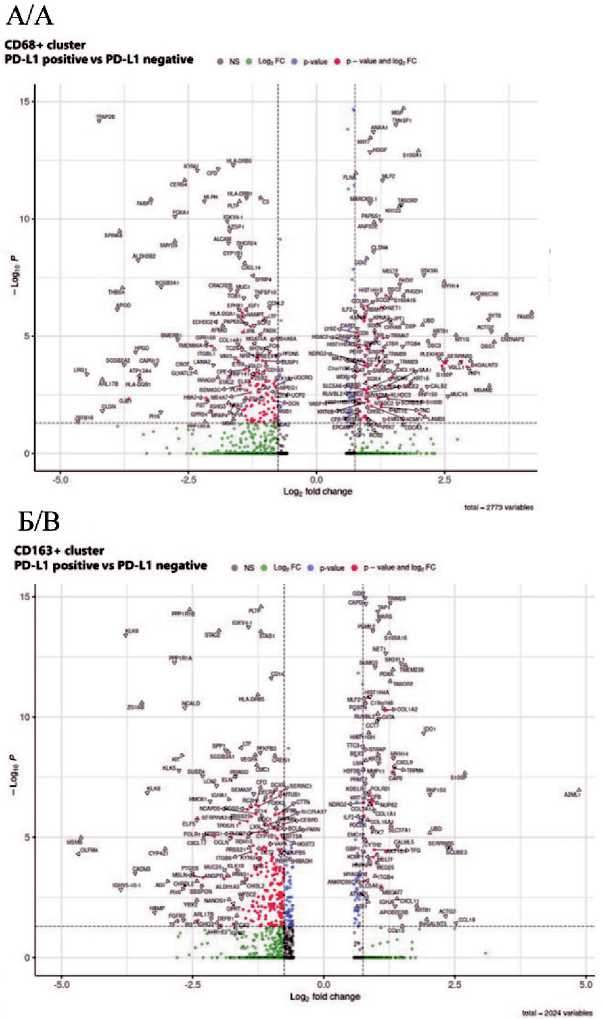
Рис. 2. Диаграмма рассеяния (volcano plot), иллюстрирующая результаты анализа дифференциальной экспрессии генов в кластере CD68+ клеток (А) и CD163+ кластере (Б) стромы опухоли у пациенток с положительным и отрицательным PD-L1 статусом.
Примечание: рисунок выполнен авторами Fig. 2. Volcano plot illustrating the results of differential gene expression analysis in the CD68+ cell cluster (A) and the CD163+ cell cluster (B) within the tumor stroma of patients with positive and negative PD-L1 status.
Note: created by the authors исследовании при негативном PD-L1 статусе наблюдаются процессы презентации антигенов с помощью MHC-II, активации иммунных клеток, присутствующих в опухоли, а также процессы, ограничивающие воспаление. CD68+ макрофаги в этих процессах могут участвовать как клетки, презентирующие антигены Т-клеткам, секретирующие провоспалительные цитокины и факторы, стимулирующие ангиогенез. В исследовании J.W. Polania et al. была изучена роль антиген-презентирующих макрофагов в мышиных моделях различных опухолей. Было обнаружено, что презентация антигена опухоль-ассоциированными макрофагами переводит Т-клетки из состояния истощения предшественников в состояние терминального истощения. При этом истощение ТАМ увеличивало количество истощенных предшественников Т-клеток в опухоли, уменьшая количество терминально истощенных Т-клеток, и усиливало чувствительность к анти-PD1 иммунотерапии [8]. Согласно нашим данным, при ТНРМЖ процесс презентации антигенов макрофагами более активен в PD-L1-негативных случаях, что указывает на то, что антиген-презентирующая функция макрофагов в данном контексте, вероятно, не приводит к эффективной активации Т-клеток, а скорее способствует их функциональному истощению, объясняя устойчивость таких опухолей к некоторым видам иммунотерапии.
Закономерности, обнаруженные нами в CD163+ кластере, имеют сходство с таковыми в CD68+ кластере. Однако, например, у PD-L1-негативных пациенток в CD163+ кластере не обнаруживалось
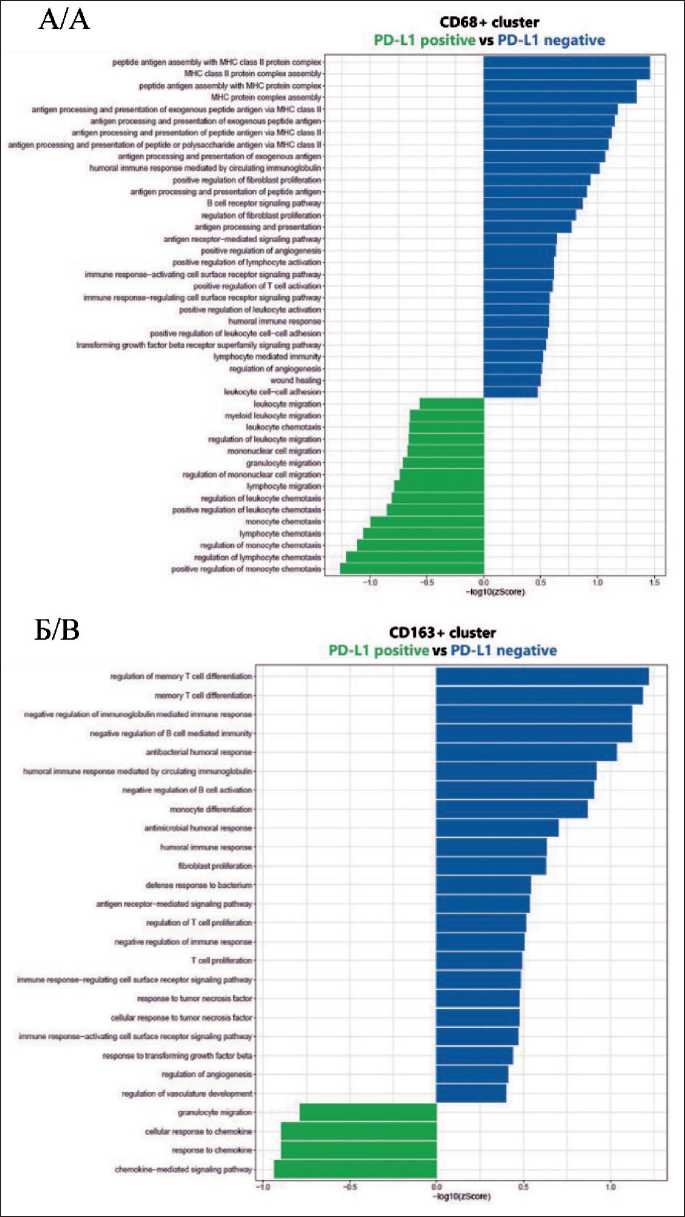
Рис. 3. Обогащенные биологические процессы в CD68+ кластере (А) и в CD163+ кластере (Б) в зависимости от PD-L1 статуса (зеленым цветом показаны процессы, обогащенные у пациенток с позитивным PD-L1 статусом, синим – у пациенток с негативным PD-L1 статусом).
Примечание: рисунок выполнен авторами Fig. 3. Enriched biological processes in the CD68+ cluster (A) and the CD163+ cluster (B) depending on PD-L1 status. Green indicates processes enriched in patients with positive PD-L1 status, blue – in patients with negative PD-L1 status.
Note: created by the authors активации процессов, связанных с презентацией антигенов. В то же время у PD-L1-позитивных пациенток в CD163+ кластере в меньшей степени были выражены процессы привлечения и хемотаксиса лейкоцитов, чем в CD68+ кластере. Полученные результаты согласуются с другими нашими данными – ранее мы показали, что PD-L1-позитивный ТНРМЖ демонстрирует сигнатуры клеточного ответа на цитокины, а PD-L1-негативный – сигнатуры презентации антигена [6]. При раке легкого, согласно результатам полнотранскриптомного анализа, в областях с высокой экспрессией PD-L1 иммунные клетки микроокружения демонстрировали больше признаков, указывающих на иммуносупрессию и истощение, чем иммунные клетки в областях с низкой экспрессией PD-L1 [9].
При немелкоклеточном раке легкого обогащение микроокружения макрофагами связано с резистентностью к иммунотерапии независимо от PD-L1 статуса, повышением экспрессии генов CD27, ITGAM и CCL5 в опухолевом компартменте [10]. Кроме того, известно, что низкая эффективность иммунотерапии может объясняться внутриопу-холевым накоплением PD-L1+ M2 макрофагов, у которых экспрессия PD-L1 была индуцирована через сигнальный путь IGFBP2-STAT3-PD-L1, и их существенным ингибирующим действием на пролиферацию и активацию Т-клеток [11]. Это может указывать на то, что блокада сигнальных путей макрофагов в опухоли может повысить эффективность ингибиторов PD-1/PD-L1.
Таким образом, изучение транскриптома макрофагов и соседних иммунных клеток микроокружения у пациенток с позитивным и негативным PD-L1 статусом – это шаг к системному пониманию иммунного ландшафта опухоли, что является ключом к преодолению резистентности к иммунотерапии и созданию персонализированных методов лечения рака.


