Транспетрозальное удаление опухоли эндолимфатического мешка с применением нейрофизиологического мониторинга
Автор: Молчанов И.П., Димерцев А.В., Зуев А.А.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Клинические наблюдения
Статья в выпуске: 1 т.20, 2025 года.
Бесплатный доступ
Одним из редких новообразований пирамиды височной кости является опухоль эндолимфатического мешка (ОЭМ). Прогрессирование заболевания характеризуется нарастанием неврологической симптоматики, включая нейросенсорную тугоухость, парез лицевого нерва, головную боль. Нейрохирургическая тактика имеет отличия от стандартных методов лечения опухолей вследствие особенностей гисто-анатомических характеристик ОЭМ. Микрохирургическое удаление ОЭМ является эффективным методом лечения, тогда как радиохирургия имеет ограниченные возможности и используется в послеоперационном периоде при остаточных объемах патологической ткани или рецидивах новообразования. При оперативном вмешательстве выполнялся ретролабиринтный доступ с субтотальной петрозэктомией с применением нейронавигации и нейрофизиологического мониторинга. Предварительная эмболизация питающих опухоль сосудов не проводилась, однако интраоперационно была использована аутогемотрансфузионная система Cell-Saver и гемостатические материалы. Метод показал свою безопасность и эффективность, обеспечив сравнительно небольшой объём кровопотери, полную декомпрессию прилежащих интракраниальных структур, включая бульбарную группу черепномозговых нервов, частичную - по VII и VIII парам, что сопровождалось регрессом неврологической симптоматики, а также удовлетворительной степенью резекции новообразования. Тем самым, подобный подход может быть рекомендован для лечения опухолей эндолимфатического мешка, так как несет меньшие риски рецидивов и операционных осложнений для пациента.
Опухоль эндолимфатического мешка, нейрофизиологический мониторинг, микрохирургическое лечение, петрозэктомия, гемостатические материалы
Короткий адрес: https://sciup.org/140309964
IDR: 140309964 | DOI: 10.25881/20728255_2025_20_1_151
Текст научной статьи Транспетрозальное удаление опухоли эндолимфатического мешка с применением нейрофизиологического мониторинга
Новообразования пирамиды височной кости являются гетерогенной группой заболеваний, включающей нейроэпителиальные, оболочечные, мезенхимальные и другие группы опухолей [1]. К наиболее часто встречающимся неоплазиям данной локализации относятся плоскоклеточный рак (65–71%), менингиомы – 8–19%, остеомы – 2,5%, другие гистологические типы объёмных образований (остеофибромы, эозинофильные гранулемы, фибромы) – менее 1% [2]. Так, опухоль эндолимфатического мешка (ОЭМ), представляющая собой аденокарциному низкой степени злокачественности, развивающуюся из эндолимфатического эпителия внутрикостной части эндолимфатического протока и мешка, является одним из самых редких новообразований пирамиды (в мировой литературе описано менее 260 случаев) [3–5]. Впервые данная патология была выявлена Hassard в 1984 г., сообщившем о красноватой дольковой опухоли, спаянной с эндолимфатическим мешком [5]. Как правило, ОЭМ ассоциирована с болезнью Гиппеля-Линдау (более 47% случаев) или с имеющейся мутацией зародышевого гена вне заболевания (33–42%), однако у ряда пациентов новообразование возникает спорадически. ОЭМ диагностируется у пациентов в возрасте 43–56 лет. Опухоль характеризуется медленным ростом, но высокой агрессивностью по отношению к костному компоненту пирамиды, хорошей васкуляризацией, осуществляемой за счет ветвей наружной сонной артерии и передних нижних мозжечковых. Случаи метастазирования не отмечены [4; 5]. Гистопатологически новообразование имеет папиллярно-аденоматозное строение, содержит небольшие железы в сочетании с фолликулярными структурами, точечными кровоизлияниями. Очаги некроза, клеточный плеоморфизм и митозы не наблюдаются у ОЭМ [6].
Ведущим клиническим проявлением ОЭМ является аудиовестибулярный симптомокоплекс [7]. Пациенты жалуются на потерю слуха, шум в ушах, головокружение, нарушения мимики лица. При неврологическом осмотре объективно наблюдается сенсоневральная тугоухость, атаксия, парез лицевого нерва, по мере прогрессирования заболевания присоединяется поражение тройничного нерва. Нейропатия лицевого нерва возникает в случае распространения новообразования до колена лицевого нерва, тогда как симптомы внутричерепной гипертензии, проявляющиеся выраженной диффузной головной болью, отмечаются при значительных размерах опухоли. Крайне редко встречается поражение IX, X, XI пар черепных нервов, называемое синдромом яремного отверстия (менее 5%) [6–8]. Для диагностики ОЭМ необходима компьютерная томография (КТ), позволяющая оценить степень остеодеструкции пирамиды височной кости. Характерными

признаками ОЭМ являются неоднородная структура патологии c географической исчерченностью краев пирамиды височной кости и периферическим ободком кальцификации (Рис. 1).
Исследованием выбора является магнитно-резонансная томография (МРТ). На Т1-взвешенных изображениях опухоль имеет гипоинтенсивный сигнал по типу «соль и перец», на Т2-взвешен-ных изображениях – гиперинтенсивный гетерогенный [5]. Постконтрастное усиление картины свидетельствует о хорошем кровоснабжении (Рис. 2).
Дифференциальной диагноз ОЭМ проводится с другими новообразованиями. Так, менингиомы вызывают преимущественно не деструктивные, а склеротические изменения, имеют гомогенный гиперинтенсивный сигнал. Яремно-барабанные параганглиомы локализуются инфралабиринтно, в отличии от ОЭМ, у которых основной объём патологической ткани расположен ретролабиринтно. Дополнительная деструкция трабекулярного отдела сосцевидного отростка является признаком эозинофильных гранулем [9].
Существуют разнообразные подходы к лечению пациентов с ОЭМ: микрохирургический, радиохирургический, эндоваскулярный. В литературе описаны различные мнения касаемо объёмов удаления, необходимости предоперационной эмболизации питающих новообразование сосудов, выборе доступа, и как следствие результатах хирургического лечения. Согласно исследованиям Wick C.C. лучевая терапия при ОЭМ малоприменима и допустима только при мультифокальных рецидивах после операции, что связано с плохим контролем новообразования в динамике [10]. Вариантом послеоперацион-
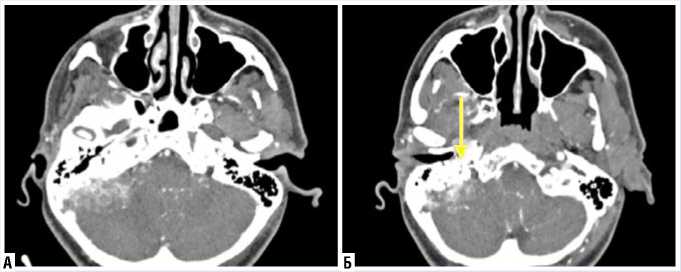
Рис. 1. КТ головного мозга коронарная проекция (стрелка – область остеодеструкции пирамиды правой височной кости).
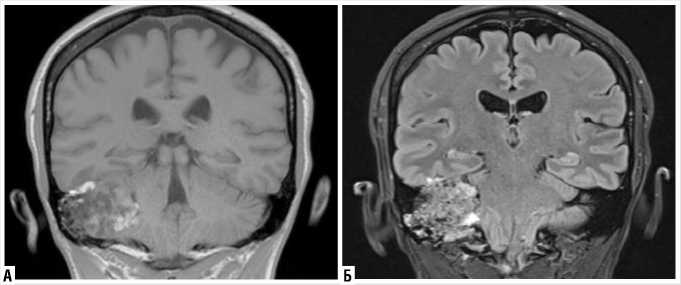
Рис. 2. МРТ головного мозга. Т1- и Т2-взвешенные изображения во фронтальной проекции.
ного ведения пациента при определенном остаточном объеме (более 25%) опухоли инфралабиринтно может быть назначение гамма-ножа. Также Balasubramanian S. описал случай успешного лечения постоперационного рецидива ОЭМ c применением гамма-ножа с достижением клинической и радиологической компенсации в течение 2,5 лет [11]. В работах Tang J.D. демонстрируется отсутствие различий прогрессирования и рецидивов опухоли эндолимфатического мешка с эмболизацией или без нее, однако автор рекомендует использование данного метода в случае больших нерезектабельных ОЭМ [3]. Оптимальным методом лечения опухолей эндолимфатического мешка является хирургический, заключающийся в резекции новообразования вплоть до здоровых тканей. Выбор доступа при краниотомии обосновывается классификациями Schipper J. и Bambakidis N.C. (Табл. 1) [12; 13].
Табл. 1. Клинико-анатомические классификации опухолей эндолимфатического мешка по Schipper J. и Bambakisis N.C.

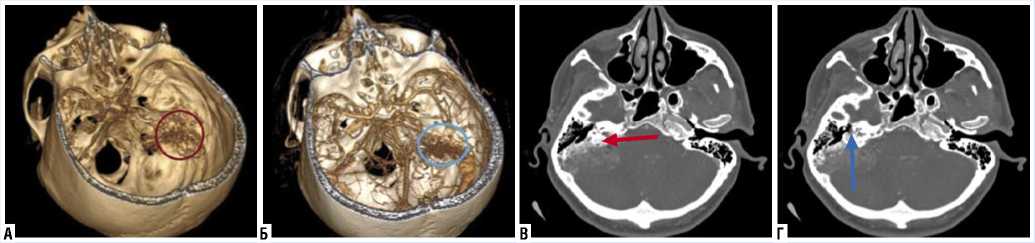
Рис. 3. КТ головного мозга. Мультиспиральная реконструкция: деструкция пирамиды правой височной кости (А); выраженный сосудистый клубок ОЭМ (Б). КТ в костном режиме, коронарная проекция: распространение опухоли в задний полукружный канал (В); компрессия канала лицевого нерва (Г).
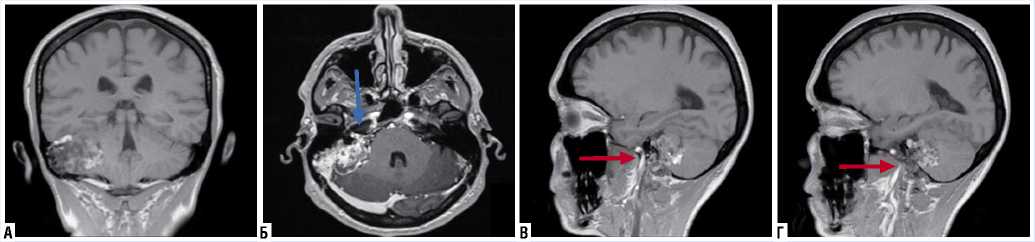
Рис. 4. МРТ головного мозга. Т1-взвешенное изображение с контрастным усилением во фронтальной (A); коронарной (Б); сагиттальной проекциях (В и Г): объемное образование правой пирамиды височной кости с распространением в мосто-мозжечковую цистерну (синяя стрелка – инвазия в канал лицевого нерва; красная стрелка – распространение в сонный канал).
Независимо от выбора доступа, целями хирургии является сохранение онко-функционального баланса и обеспечение длительного безрецидивного периода, предупреждение прогрессирования тугоухости, сохранение функции лицевого нерва. При вовлечении обоих листков ТМО эндолимфатического мешка в структуру опухоли выполняется резекция в пределах треугольника Траутманна, ограниченного сигмовидным синусом сзади, задним полукружным каналом спереди, верхним каменистым синусом сверху. Такое вмешательство может осложнится ликвореей, в связи с этим проводят пластику фистул. Полное удаление новообразования способствует благоприятному клиническому прогнозу, 5-летний безрецидивный период при радикальной резекции составляет 87–90%, в то время как при частичной наблюдается прогрессирование заболевания у 70% пациентов. Обязательным компонентом лечения при разрушении ОЭМ пирамиды височной кости является выполнение субтотальной петрозэктомии. У пациентов с выраженной инвазией в канал лицевого рекомендуется пересечение VII пары ЧМН и отсроченная невротизация подъязычным нервом. После резекции ОЭМ костный дефект должен быть заполнен височной фасцией или аутологичной жировой тканью [14]. От применения лу- чевой терапии в предоперационном периоде отказывается большинство авторов в связи с рисками образования спаек ОЭМ с окружающими структурами. Раннее тотальное удаление опухоли эндолимфатического мешка является лучшей стратегией лечения по показателю долгосрочной выживаемости без рецидивов. При субтотальной резекции и остаточных объемах патологической ткани лучевая терапия может оказать положительный эффект, что демонстрируется в работах Melone A.G., сообщившем о случае 10летнего безрецидивного периода при послеоперационной лучевой терапии в дозе 60 Грей [15; 16].
Пациентка М., 42 года, была госпитализирована в плановом порядке в Центр Нейрохирургии ФГБУ «НМХЦ им. Н. И. Пирогова» Минздрава России после амбулаторной консультации нейрохирурга. Со слов пациентки, снижение слуха на правое ухо беспокоит длительное время. К отоларингологу не обращалась. Около 2 лет назад стали беспокоить приступы непроизвольных сокращений мышц в правой половине лица. После консультации с неврологом назначена терапия вальпроевой кислотой. На фоне проводимого лечения симптомы регрессировали. Настоящее ухудшение около года назад, когда возобновились приступы непроизвольных со- кращений мышц в правой половине лица. Консервативная терапия без эффекта.
По данным КТ выявлено новообразование пирамиды височной кости справа с очагами деструкции костного компонента заднего полукружного канала и улитки (Рис. 3).
На МРТ – объемное образование пирамиды правой височной кости с компрессией правой гемисферы мозжечка, инвазией в канал лицевого нерва и прорастанием в правый сигмовидный синус, неоднородно накапливающее контрастное вещество, размером 4,2 х 3,1 х 3,3 см, объемом 25,4 см3 (Рис. 4).
Объективно при осмотре общее состояние удовлетворительное. Состояние пациентки по шкале Карновского – 90 баллов. Тестирование на болезнь Гиппеля-Линдау не выявило генетических отклонений. При неврологическом осмотре легкая асимметрия в правой половине лица, сила мышц в правой половине лица House-Brackman grade 1-2. Слух на правое ухо отсутствует. Фонация и глотание не нарушены.
Особенности операционной техники
Под общим наркозом, в положении пациентки лежа на левом боку, установлен люмбальный дренаж. Голова пациентки фиксирована в жесткой скобе Мейфилда. Произведена регистрация больной с по-
мощью нейронавигационной системы, спланирован доступ. После асептической обработки произведен подковообразный разрез мягких тканей в правой супрааури-кулярной области. Мягкие ткани разведены, подшиты. Высокоскоростным бором начато выпиливание чешуи и сосцевидного отростка височной кости. Отмечена инвазия костей черепа опухолевой тканью в области пирамиды правой височной кости, их выраженная кровоточивость, выделены поперечный и сигмовидный синусы, ТМО средней и задней черепных ямок. При освобождении новообразования в пирамиде височной кости получено обильное кровотечение в связи с чем, подключен аппарат для аутотрансфузии Cell-Saver. Вскрыта твердая мозговая оболочка задней черепной ямки, начато выделение образования по периферии, при этом отмечались участки плотной спаянности опухоли с оболочками мозжечка и ствола головного мозга. Опухоль отделена от тенториума, также определялась спаянность образования с ним. После отделения матрикса от височной кости, мозжечка, ствола и намета мозжечка выполнено удаление фрагмента образования. В нижних отделах идентифицирован добавочный нерв. Начато удаление опухоли из пирамиды височной кости. Новообразование получало питание из бассейна интропе-трозальных артерий (нижней барабанной – ветви восходящей глоточной артерии; шилососцевидной – ветви задней ушной артерии). Наличие коллатералей от нижней передней мозжечковой и задней менингеальной артерий не наблюдалось. При резекции пирамиды височной кости визуализирован задний и латеральный полукружный канал, выполнена частичная декомпрессия вертикально расположенной сосцевидной части канала лицевого нерва. Лицевой нерв в канале интактный. В связи с выраженным кровотечением, медиальный фрагмент опухоли оставлен. В остальных отделах опухоль удалена то- тально, в пределах видимых границ. Часть опухоли отправлена на гистологическое исследование. ТМО задней черепной ямки герметично ушита. В правой параумбили-кальной области выполнен разрез кожи 3 см, произведен забор жирового лоскута. Жир уложен в область дефекта средней черепной ямки и проведена герметизация дефекта ТМО при помощи аутоткани, гемостатической матрицы. Пластика костного дефекта титановой пластиной. Кровопотеря 1600 мл.
Послеоперационное состояние пациентки
В послеоперационном периоде отмечали жалобы на умеренную болезненность в области послеоперационной раны (визуально-аналоговая шкала 3–4 балла), наблюдалась легкая асимметрия в правой половине лица, сила мышц в правой половине лица House-Brackman grade 1-2. Слух на правое ухо отсутствует. Через три месяца после хирургического вмешательства общее состояние пациентки удовлетворительное (жалобы на подергивания в правой половине лица, болезненность в области раны не предъявляет; слух на правое ухо отсутствует).
По данным МРТ после операции признаков внутричерепных гематом и очагов ишемии головного мозга не выявлено, остаточная ткань опухоли в пирамиде правой височной кости, с распространением в сонный канал и канал лицевого нерва, размером 1,9 х 1,8 х 2,1 см, объемом 3,7 см3. (радикальность удаления составила 85%) (Рис. 5).
По результатам гистологических исследований, полученных через 2 недели после операции, имеются следующие данные: образование построено из фиброзной ткани и скоплений толстостенных сосудов с участками, представленными фиброваскулярными сосочками, выстланными одним слоем столбчатого или кубовидного эпителия, с четкими границами клеток; эпителиальные клетки имеют бледно-прозрачную цитоплазму, однородные ядра в центре или просвете. Встречаются кистозные участки, с кистозными железистыми пространствами, содержащими коллоидоподобный материал (похожие на щитовидную железу). Имеются очаги недавнего кровоизлияния с холестериновыми трещинами. Полиморфизм минимален. Митотические фигуры и некроз отсутствуют. Учитывая редкость полученного гистологического заключения блоки стекол пересмотрены независимой организацией, после коллегиального пересмотра и дополнительно проведённого иммуногистохимического исследования: в участках опухоли имеется диффузная позитивная экспрессия с Panck, PAX-8, EMA. Тем самым, по совокупности морфологических и иммуногистохимических данных имеет место опухоль эндолимфатического мешка.
Послеоперационные рекомендации
В послеоперационном периоде необходимо соблюдение охранительного режима с ограничением физических нагрузок. Согласно полученным результатам гистологического исследования и наличию остаточного объема патологической ткани новообразования (3,7 см3) пациентке рекомендуется консультация онколога для выбора режима лучевой терапии для продления безрецидивного периода, проведение МРТ головного мозга через 3 месяца после операции, а также повторная консультация нейрохирурга.
Обсуждение
Отсутствие конкретных клинических указаний и низкая встречаемость данной патологии порождает разнообразие взглядов на ведение пациентов с ОЭМ. Характерными неврологическими проявлениями, позволяющими заподозрить опухоль эндолимфатического мешка, являются постепенная односторонняя потеря слуха, головокружение в сочетании
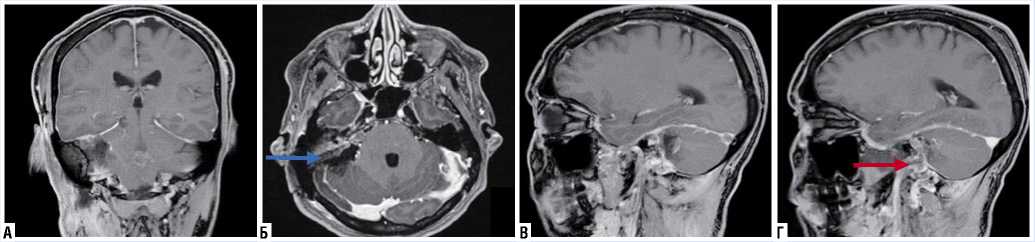
Рис. 5. МРТ головного мозга после операции. Т1-взвешенное изображение с контрастным усилением во фронтальной (A); коронарной (Б); сагиттальной проекциях (В и Г): освобожденное после резекции опухоли пространство с фрагментами аутоткани (синяя стрелка – мосто-мозжечковая цистерна с VII и VIII черепно-мозговыми нервами; красная стрелка – остаточный объём новообразования в труднодоступных участках пирамиды).
с шумом в ушах. Подобный аудиовести-булярный комплекс нарушений наблюдается также при синдроме Меньера, что приводит к неверной постановке диагноза. Важным моментом дифференциальной диагностики ОЭМ является наличие одностороннего поражения VII, IX, X пар черепно-мозговых нервов, чаще всего наблюдаемый ипсилатеральный парез лицевого нерва, а также данных нейро-визуализационных исследований (сигнал «соль и перец» на МРТ T1-взвешенных изображениях, географическая исчерчен-ность пирамиды височной кости на КТ) [14]. Часть авторов ссылается на необходимость использования классификации по Bambakidis N.C. при проведении краниотомии [13], однако высокая степень инвазии в костный компонент пирамиды и риск обильных интраоперационных кровотечений может потребовать расширения доступа. Целесообразным является выполнение субтотальной петрозэкто-мии, обеспечивающей оптимальную визуализацию интропетрозальных структур (для удаления инфралабиринтного матрикса ОЭМ), а также ствола головного мозга, мозжечка, поперечного, сигмовидного синусов в ходе операции. В работах V. Sykopetrites демонстрируются преимущества данного подхода, у 9 пациентов наблюдался регресс нарушений функции лицевого нерва вплоть до grade 1 по House -Brackman в послеоперационном периоде (grade 2–3 – до операции) [17]. Использование эффективного доступа к ОЭМ позволяет достигнуть полной резекции новообразования, что в данном клиническом примере было неосуществимо в связи с поздним обращением пациентки, как следствие большим объёмом опухолевой ткани (исходно – 25,4 см3; после операции – 3,7 см3), высокой степенью инвазии и хорошей васкуляризацией ОЭМ. Такие сложности описывает в своих работах Fangzou G., при этом отмечая степень резекции полную у 35,7% пациентов, и частичную – у 43%, а средний объём кровопотери – около 2,650 миллилитров [15]. Ряд исследователей склонны к неоправданной выжидательной тактике, проведении декомпрессионных операций, эмболизации опухоли [5]. Особого внимания заслуживает применение нейрофизиологического мониторинга в ходе операции, позволившего дифференцировать и отделить неповрежденную ОЭМ бульбарную группу черепно-мозговых нервов. Некоторые авторы ограничиваются только лишь нейронавигацией при ОЭМ [18]. Использование нейрофизиологического мониторинга в перспективе других операций, связанных с опухолью эндолимфатического мешка, может позволить определять лицевой, тройничный нерв для предупреждения повреждения и полной декомпрессии данных структур [15]. Некоторые ученые считают, что оправдана эмболизация питающих сосудов для снижения рисков обильных кровотечений [14]. Тогда как в других клинических случаях демонстрируются трудности эмболизации в связи с небольшим диаметром артерий, а при успешности манипуляции – сопоставимые или более негативные результаты (объём кровопотери более 3,000 миллилитров). Часть эмболов, попадающих в кистозный компонент опухоли осложняет процесс коагуляции. Тем самым, более перспективным является применение аутотрансфузионных систем и гемостатических материалов, используемых поэтапно в течение операции. Клиническими критериями оценки эффективности проведенного лечения выступили регресс неврологической симптоматики по VII паре черепных нервов справа (House-Brackman grade 1–2 с регрессом после операции), отсутствие постоперационного неврологического дефицита, сравнительно небольшой объем кровопотери и удовлетворительная степень резекции.
Заключение
Применение транспетрозальных доступов в сочетании с аутотрансфузионными системами и нейрофизиологическим мониторингом в хирургии опухолей эндолимфатического мешка позволяет добиться удовлетворительной степени резекции, компенсации неврологического дефицита и сравнительно небольшого объёма кровопотери без предоперационной эмболизации сосудов новообразования.


