Трансуретральная резекция стенки мочевого пузыря с опухолью единым блоком
Автор: Ульянин Михаил Юрьевич, Басиашвили Георгий Тариелович, Хасанов Рустем Шамильевич, Бурмистров Михаил Владимирович, Гатауллин Ильгиз Габдуллович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 5 (71), 2015 года.
Бесплатный доступ
Цель исследования: оценка непосредственных и отдаленных результатов лечения больных поверхностным раком мочевого пузыря путем трансуретральной резекции стенки мочевого пузыря с опухолью единым блоком. Материал и методы. Были оценены результаты хирургического лечения 270 пациентов с раком мочевого пузыря, в период с 2003 по 2012 г. Больные были разделены на 2 группы: основная группа - 94 пациента, которым проведена трансуретральная резекция стенки мочевого пузыря с опухолью единым блоком, и группа сравнения - 176 пациентов, получавших стандартную трансуретральную резекцию. Результаты. Методика операции влияет на частоту рецидивов, в основной группе число местных рецидивов было в 1,4 раза меньше, чем в группе сравнения, - 47,7 % и 34,0 % (p
Оверхностный рак мочевого пузыря, трансуретральная резекция мочевого пузыря единым блоком, результаты лечения
Короткий адрес: https://sciup.org/14056576
IDR: 14056576 | УДК: 616.62-006.6-089.87-036.8
Текст научной статьи Трансуретральная резекция стенки мочевого пузыря с опухолью единым блоком
В России на долю рака мочевого пузыря (РМП) в общей структуре онкологической заболеваемости приходится 2,7 %, что составляет 21,8 % от всех онкоурологических заболеваний [2]. Следует отметить, что большинство исследователей рассматривают РМП как заболевание всей слизистой оболочки, склонное к мультифокальному поражению органа. Этим можно объяснить частоту рецидивов, которые, по данным различных авторов, возникают примерно у каждого четвертого пациента в течение первого года после операции. У 70 % больных поверхностным РМП после трансуретральной резекции (ТУР) рецидивы возникают в течение 5 лет после лечения [1, 5]. Частота рецидивов снижается до 50 % и 70 % при проведении адъювантной внутрипузыр-ной химио- или иммунотерапии соответственно [4]. Важным является тот факт, что около 20–45 % поверхностных форм РМП перерождаются в мышечно-инвазивный рак [8, 11].
Несмотря на то, что в литературе сформировалась единая точка зрения о показаниях трансуретральной резекции при РМП, нет консенсуса относительно методик и объема данного оперативного вмешательства. Ряд авторов счита-
ют, что идеальная ТУР мочевого пузыря означает полное удаление видимой опухоли с резекцией окружающей здоровой слизистой оболочки на расстоянии 1 см от опухоли с последующим удалением мышечного слоя мочевого пузыря, прилежащего к опухоли [6, 7]. Существенным недостатком трансуретральной резекции является то обстоятельство, что опухоль в процессе операции подвергается фрагментации и опухолевые клетки могут обсеменять раневую поверхность. Таким образом, ТУР является единственной в онкологии операцией, которая, по сути, не соответствует онкологическим принципам. В связи с этим были предприняты попытки разработать и оценить эффективность выполнения трансуретральной резекции опухолей единым блоком, что позволяет иметь в препарате все слои стенки мочевого пузыря для адекватного патоморфологического исследования. Данная операция впервые была описана T. Kawada et al. в 1997 г. [9]. В литературе предлагаются различные методики ее выполнения, отличающиеся технологическим обеспечением (монополярная или биполярную резекция, лазер, водоструйный гибридный нож и др.) [12–15]. Большинство ав- торов отмечают определенные ограничения при выполнении подобных вмешательств, главным из которых является размер опухоли до 23–30 мм, новообразования большего размера невозможно эвакуировать из мочевого пузыря [3, 10]. Кроме того, при локализации опухоли вне пределов задней стенки мочевого пузыря существенно возрастает риск неконтролируемой перфорации органа [10].
Цель исследования: оценка непосредственных и отдаленных результатов лечения больных поверхностным раком мочевого пузыря путем трансуретральной резекции стенки мочевого пузыря с опухолью единым блоком.
Материал и методы
В исследование были включены 270 больных раком мочевого пузыря, проходивших лечение в ГАУЗ «Республиканский клинический онкологический диспансер» МЗ РТ с 2003 по 2012 г. Все пациенты были разделены на 2 группы, сопоставимые по основным параметрам (табл. 1):
-
- основная группа – 94 пациента, которым была проведена трансуретральная резекция стенки мочевого пузыря с опухолью единым блоком;
-
- группа сравнения – 176 пациентов, которым была проведена стандартная трансуретральная резекция.
Таблица 1
Характеристика групп больных
|
Показатель |
Основная группа (n=94) |
Группа сравнения (n=176) |
|
Средний возраст, лет |
69,13 ± 11,98 |
68,25 ± 10,85 |
|
Мужчины (n=206) |
70 (62,5 %) |
136 (66, %) |
|
Женщины (n=64) |
24 (37,5 %) |
40 (34/0 %) |
|
Среднее время наблюдения, мес |
31,5 ± 1,5 |
36,9 ± 1,7 |
Всем пациентам выполнялась флуоресцентная ТУР мочевого пузыря с применением в качестве фотосенсибилизатора раствора 5-АЛК (1,5 г препарата, растворенного в 50 мл 4 % раствора гидрокарбоната натрия), который вводился вну-трипузырно по уретральному катетеру за 2 ч до операции. Использовался стандартный набор для трансуретральной резекции мочевого пузыря и оптика для флуоресцентной диагностики.
Для выполнения ТУР стенки мочевого пузыря с опухолью единым блоком после обзорной цистоскопии, визуализации опухоли и планирования границ резекции стенки мочевого пузыря мы применяли собственные инструменты и метод операции, защищенные патентом на изобретение №2417775 «Способ трансуретральной резекции (ТУР) опухоли мочевого пузыря и инструмент для его осуществления». Суть метода заключается в том, что ТУР выполняется единым блоком – опухоль вместе со стенкой мочевого пузыря удаляется ретроградными движениями электрода-петли.
При этом резецируемая ткань поддерживается рамочным концом ветвей инструмента, обеспечивая визуальное наблюдение за положением электрода-петли. Осуществляли резекцию стенки мочевого пузыря до полного её окончания и последующую эвакуацию отсеченной ткани из мочевого пузыря через просвет тубуса резектоскопа или по уретре, захватывая щипцами для передачи на гистологическое исследование (рис. 1). При резекции опухолей большого размера предварительно производили электрорезекцию части экзофита для того, чтобы иметь возможность эвакуировать опухоль по уретре, а затем выполняли ТУР стенки мочевого пузыря с основанием опухоли единым блоком (рис. 2)
Для проведения стандартной ТУР стенки мочевого пузыря применяли обычную петлю для моно-полярной резекции. В этом случае производили поэтапную послойную электрорезекцию антеградными движениями электрода петли экзофитной части и основания опухоли (рис. 3).
Непосредственно после операции всем пациентам внутрипузырно вводили 40 мг митомицина, разведенного в 50 мл физиологического раствора, время экспозиции – 2 ч. Через 1 мес после операции все больные получали внутрипузырную иммунотерапию, которая включала 6 еженедельных внутрипузырных инстилляций 100 мг вакцины БЦЖ, разведенной в 50 мл физиологического раствора. Больных просили удерживать препарат в течение 2 ч.
Все данные о пациентах были формализованы с помощью специально разработанного кодификатора и внесены в базу данных, созданную на основе
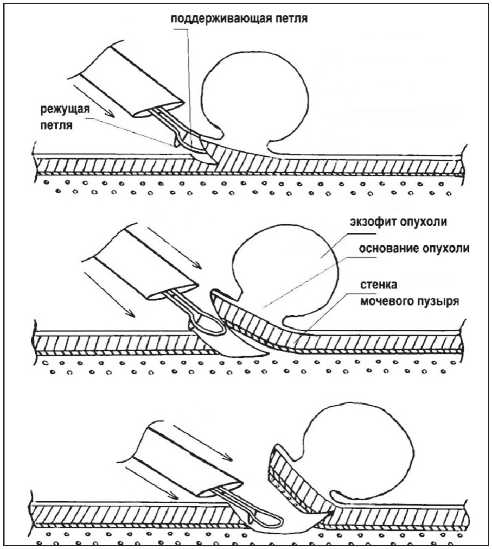
Рис. 1. Схема операции ТУР стенки мочевого пузыря с опухолью единым блоком при размерах новообразования <3 см
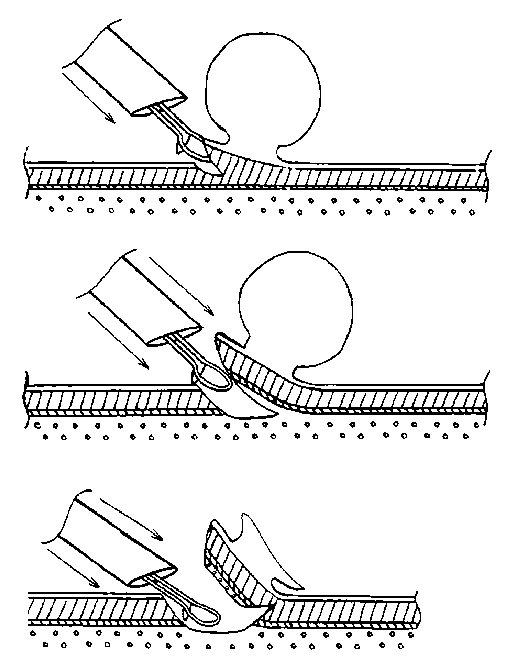
Рис. 2. Схема операции ТУР стенки мочевого пузыря с опухолью единым блоком при размерах новообразования >3 см
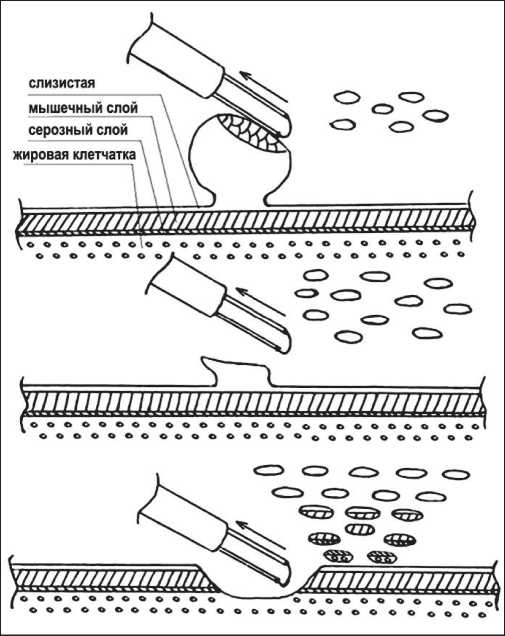
Рис. 3. Схема стандартной ТУР
электронных таблиц EXCEL. Статистическую обработку производили стандартным пакетом «STATISTICA 5.11». Использовали программы корреляционного, дискриминантного и регрессионного анализа. Общую и скорректированную выживаемость оценивали по методу Kaplan – Meier (при расчетах скорректированной выживаемости учитывали больных, умерших только от рака мочевого пузыря). Различия выживаемости в группах определяли с помощью log-rank теста. Для выявления прогностически значимых для выживаемости факторов использовали одно- и многофакторный регрессионный анализ Сох. Достоверность различий между количественными показателями вычисляли по критерию t Стьюдента. Для сравнения качественных параметров применялся точный критерий Фишера и χ2 с учетом непараметрических данных и нормального распределения Пуассона. Различия признавали значимыми при p<0,05.
Результаты исследования и обсуждение
По данным флуоресцентной диагностики у 32 (11,5 %) пациентов была выявлена флуоресценция участков слизистой оболочки мочевого пузыря, которые казались не измененными в белом свете. При гистологическом исследовании прицельно взятых биоптатов у 8 (2,8 %) пациентов диагностирован Са in situ, у 10 (3,6 %) – тяжелая дисплазия. У 11 (4 %) пациентов с мультифокальным РМП при флуоресцентной диагностике были выявлены резидуальные опухоли, в группе больных с единичными очагами резидуальные новообразования были обнаружены в 3 (1 %) случаях. Таким образом, у каждого двенадцатого пациента не были выявлены опухоли при цистоскопии в белом свете. Полученные результаты позволяют утверждать, что во всех флуоресцирующих участках слизистой мочевого пузыря имеются патологические изменения, вплоть до опухолевого поражения, в связи с чем эти структуры должны подвергаться биопсии и хирургическому воздействию.
Для адекватного определения местной распространенности опухоли (критерий Т) все удаленные во время операции ткани должны быть исследованы патоморфологом с разделенным анализом экзофитной части и основания опухоли. В проведенном исследовании после ТУР опухоли единым блоком во всех случаях патоморфологического исследования операционного материала было описано наличие в препарате как самой опухоли, так и структур стенки мочевого пузыря (слизистый слой, мышечная стенка) и определена истинная глубина опухолевой инвазии. После стандартных операций диагноз по категории Т в ряде случаев не был установлен, при морфологическим исследовании наблюдалось термическое повреждение слизистой оболочки, но в мышечном слое мочевого пузыря опухолевого роста не наблюдали.
Таблица 2
Частота и характер послеоперационных осложнений
|
Вид осложнений |
Основная группа (n=94) |
Группа сравнения (n=176) |
|
Внутрибрюшная перфорация |
- |
3 (1,7 %) |
|
Кровотечение из ложа опухоли |
- |
7 (3,9 %) |
|
Острый орхит |
- |
1 (0,6 %) |
|
Стриктура устья мочеточника |
7 – пересадка мочеточника; 2 – холодное рассечение стриктуры, стентирование мочеточника |
1 – пересадка мочеточника; 1 – холодное рассечение стриктуры, стентирование мочеточника |
|
Летальность |
- |
1 (0,6 %) ТЭЛА |
Таблица 3
Отдаленные результаты лечения в сравниваемых группах
|
Показатель |
Основная группа (n=94) |
Группа сравнения (n=176) |
p |
|
Всего рецидивов |
32 (34,0 %) |
84 (47,7 %) |
<0,05 |
|
Рецидив в зоне резекции |
- |
2 (1,1 %) |
|
|
Среднее время появления рецидива, мес |
17,1 ± 1,9 |
11,4 ± 1,2 |
>0,05 |
|
Частота случаев прогрессирования |
2 (2,1 %) |
15 (8,5 %) |
<0,001 |
|
Среднее время до прогрессирования, мес |
32,5 ± 7,5 |
16,1 ± 3,1 |
<0,05 |
При анализе течения послеоперационного периода нами получены данные о том, что ТУР стенки мочевого пузыря с опухолью единым блоком является безопасным методом лечения. В этой группе больных интраоперационных и ранних послеоперационных осложнений не наблюдалось (табл. 2), тогда как в группе сравнения при выполнении стандартной ТУР во время операции и в раннем послеоперационном периоде осложнения возникли в 10 (5,7 %) наблюдениях. У 3 (1,7 %) больных произошла внутрибрюшная перфорация стенки мочевого пузыря, что потребовало лапаротомии, ушивания стенки органа, дренирования брюшной полости. У 7 (4,0 %) пациентов в раннем послеоперационном периоде развились внутрипузырные кровотечения, не купирующиеся консервативно и потребовавшие повторных операций: в 6 (3,4 %) случаях выполнена гемостатическая ТУР, в 1 (0,56 %) – цистотомия и прошивание кровоточащего сосуда.
При оценке частоты поздних осложнений возникла несколько иная картина. У части больных, перенесших ТУР с резекцией в зоне устья мочеточника (в основной группе подобные вмешательства выполнены 12 больным, в группе сравнения – 13 пациентам, во всех случаях в конце операции устанавливали мочеточниковый стент), произошло формирование рубца с нарушением оттока мочи. После операции ТУР стенки мочевого пузыря с опухолью единым блоком стриктура возникла у 9, после стандартной ТУР – у 2 пациентов (табл. 2). Данное обстоятельство может быть связано с тем, что при стандартной операции глубина резекции стенки мочевого пузыря меньше, поэтому она должна выполняться только при неинвазивной папиллярной карциноме (стадия Та).
При сравнительном анализе отдаленных результатов оперативного лечения больных РМП (табл. 3)
установлено, что в основной группе число местных рецидивов было в 1,4 раза меньше, чем в группе сравнения, – 47,7 % и 34,0 % (p<0,05), а случаев прогрессирования заболевания в 4 раза меньше – 8,5 % и 2,1 % (p<0,001) соответственно. Кроме того, у этой когорты больных в основной группе сроки до прогрессирования были почти в 2 раза выше, чем при стандартных операциях, – 16,1 ± 3,1 и 32,5 ± 7,5 мес (p<0,05) соответственно.
При оценке влияния основных параметров на отдаленные результаты лечения не выявлено значимых различий частоты рецидивирования в зависимости от возраста. У пациентов моложе 60 лет рецидивы возникли в 21,9 %, у больных старше 60 лет – в 28,6 % случаев (p>0,05). Аналогичные результаты получены при анализе влияния локализации первичной опухоли – частота рецидивов при исходном поражении дна мочевого пузыря, передней стенки, задней стенки, боковой стенки, треугольника Льетто и шейки мочевого пузыря составила 42,9, 45,0, 29,7, 22,0, 28,9 и 30,0 % соответственно. Также не было значимых различий при опухолях различной гистопатологической дифференцировки – при G1 рецидивы наблюдались в 26,3 %, при G2 – в 22,9 %, при G3 – в 32,9 % случаев (p>0,05).
При этом в обеих группах отмечено значимое увеличение частоты рецидивов при множественных новообразованиях – 42,5 %, по сравнению с группой больных, у которых имелись одиночные опухоли – 21,3 % (р=0,001). Кроме того, значимое влияние оказывали размеры опухоли, рецидивы зарегистрированы у 19,5 % пациентов с очагами менее 3 см в диаметре и у 34,3 % больных с новообразованиями диаметром более 3 см (р=0,009).
За период наблюдения умерло 25 (9,3 %) больных. Из них от причин, связанных с основным
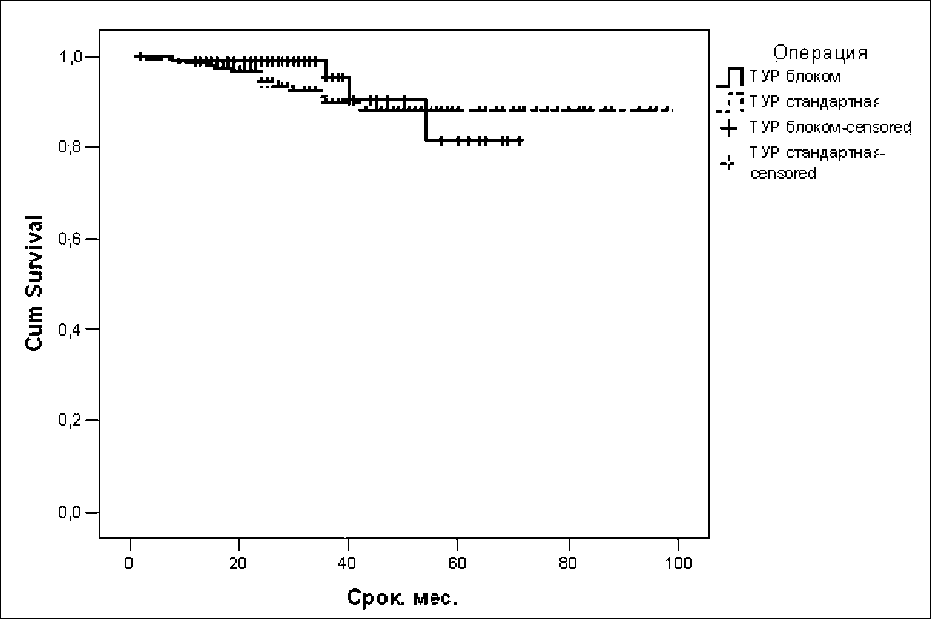
Рис. 4. Показатели выживаемости в сравниваемых группах
заболеванием, – 9 (3,3 %) пациентов, из них в основной группе (ТУР единым блоком) – 2 (2,1 %), в группе сравнения (стандартная ТУР) – 7 (4,0 %) больных. Значимых различий в показателях выживаемости, связанных с основным заболеванием, в зависимости от вида операции не выявлено (р=0,465). Медиана выживаемости не достигнута ни в одной из сравниваемых групп (рис. 4).
Заключение
При поверхностном раке мочевого пузыря методика трансуретрального удаления опухоли единым блоком с прилежащей стенкой позволяет снизить количество интраоперационных осложнений. Данная операция во всех случаях позволяет точно установить глубину инвазии опухоли и снизить частоту местных рецидивов.
Список литературы Трансуретральная резекция стенки мочевого пузыря с опухолью единым блоком
- Державец Л.А. Лабораторные показатели и выживаемость пациентов, страдающих раком мочевого пузыря//Сибирский онкологический журнал. 2013. № 4. С. 12-16
- Злокачественные новообразования в России в 2012 г./Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М., 2015. 250 с
- Мартов А.Г., Ергаков Д.В., Байков Н.А., Поминальная В.М., Соломатов И.А. Трансуретральное удаление опухолей мочевого пузыря единым блоком//Онкоурология. 2015. Т. 1, № 1. С. 41-49
- Allard P., Bernard P., Fradet Y., Têtu B. The early clinical course of primary Ta and T1 bladder cancer: a proposed prognostic index//Br. J. Urol. 1998. Vol. 81 (5). P. 692-698
- Domínguez G., Carballido J., Silva J., Silva J.M., García J.M., Menéndez J., Provencio M., España P., Bonilla F. p14ARF promoter hypermetylation in plasma DNA as an indicator of disease recurrence in bladder cancer patients//Clin. Cancer Res. 2002. Vol. 8 (4). P. 980-985
- Epstein J.I., Amin M.B., Reuter V.R., Mostofi F.K. The world health organization/international society of urological patology consensus classification of urotelial (transitional cell) neoplasms of the urinary bladder//Am. J. Surg. Pathol. 1998. Vol. 22 (12). P. 1435-1448
- Herr H.W., Donat M.S. Quality control in transurethral resection of bladder tumors//BJU Int. 2008. Vol. 102 (9. Pt. B). P. 1242-1246 DOI: 10.1111/j.1464-410X.2008.07966.x
- Hu Z., Mudaliar K., Quek M.L., Paner G.P., Barkan G.A. Measuring the dimension of invasive component in pT1 urothelial carcinoma in transurethral resection specimens can predict time to recurrence//Ann. Diagn. Pathol. 2014. Vol. 18 (2). P. 49-52. doi: 10.1016/j. anndiagpath.2013.11.002
- Kawada T., Ebihara K., Suzuki T., Imai K., Yamanaka H. A new technique for transurethral resection of bladder tumors: rotational tumor resection using a new arched electrode//J. Urol. 1997. Vol. 157 (6). P. 2225-2226
- Lodde M., Lusuardi L., Palermo S., Signorello D., Maier K., Hohenfellner R., Pycha A. En bloc transurethral resection of bladder tumors: use and limits//Urology. 2003. Vol. 62 (6). P. 1089-1091
- Millán-Rodríguez F., Chéchile-Toniolo G., Salvador-Bayarri J., Palou J., Algaba F., Vicente-Rodríguez J. Primary superficial bladder cancer risk groups according to progression, mortality and recurrence//J. Urol. 2000. Vol. 164 (3. Pt 1.) P. 680-684
- Muto G., Collura D., Giacobbe A., D’Urso L., Muto G.L., Demarchi A., Coverlizza S., Castelli E. Thulium:yttrium-aluminum-garnet laser for en bloc resection of bladder cancer: clinical and histopathologic advantages//J. Urology. 2014. Vol. 83 (4). P. 851-855. doi: 10.1016/j. urology.2013.12.022
- Naselli A., Introini C., Germinale F., Spina B., Puppo P. En bloc transurethral resection of bladder lesions: a trick to retrieve specimens up to 4.5 cm//BJU Int. 2012. Vol. 109 (6). P. 960-963 DOI: 10.1111/j.1464410X.2012.10982.x
- Saito S. Transurethral en bloc resection of bladder tumors//J. Urol. 2001. Vol. 166 (6). P. 2148-2150
- Upadhyay R., Kapoor R., Srivastava A., Krishnani N., Mandhani A. Does En-bloc transurethral resection of bladder tumor give a better yield in terms of presence of detrusor muscle in the biopsy specimen?//Indian J. Urol. 2012. Vol. 28 (3). P. 275-279 DOI: 10.4103/0970-1591.102700


