Трансвенозная экстракция электродов сердечных имплантируемых электронных устройств: оценка безопасности и эффективности
Автор: Демурчев М.Ф., Гришин И.Р., Сапельников О.В., Айвазьян С.А., Сорокин И.Н., Косоногов К.А., Черкашин Д.И., Ардус Д.Ф., Подьянов М.А., Куликов А.А., Верещагина А.В., Емельянов А.В., Ширяев А.А., Акчурин Р.С.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Нарушения ритма сердца
Статья в выпуске: 1 т.29, 2025 года.
Бесплатный доступ
Актуальность. Прогрессивное увеличение количества сердечно-сосудистых имплантируемых электронных устройств влечет за собой рост числа осложнений. Последние нередко требуют полной экстракции системы. Применение лазерного катетера и механического дилятора значительно усовершенствовало экстракцию систем и повысило успех операции. Трансвенозная экстракция электродов с использованием дополнительных инструментов позволяет безопасно удалить электрод в большинстве случаев, однако несет риск осложнений, самым грозным из которых является перфорация сосудистого русла. Гибридный подход (трансвенозная экстракция с торакоскопической поддержкой) обеспечивает визуальный контроль каждого этапа вмешательства для своевременной диагностики интраоперационных осложнений. Цель. Изучить безопасность и эффективность различных подходов к трансвенозной экстракции электродов. Методы. В исследование включили 154 пациента, которым c 2018 по 2024 г. в НМИЦК им. ак. Е.И. Чазова выполнили трансвенозную экстракцию электродов по инфекционным и неинфекционным показаниям. Результаты. Из 154 вмешательств 80 (51,9 %) произвели по инфекционным показаниям (группа 1) и 74 (48,1 %) — по неинфекционным (группа 2). Медиана «возраста» электрода составила 64 [30; 144] мес. За одну операцию удаляли от 1 до 5 электродов (среднее количество — 2). Одномоментную реимплантацию нового устройства пациентам из группы 2 произвели в 58 случаях (78,3 %) из 74. В качестве техники трансвенозной экстракции электродов в 68 случаях (44 %) избрали метод простой тракции на запирательном стилете, в 86 (56 %) использовали дополнительный инструментарий. Механический дилятор применили в 14 (17 %) случаях, эксимерный лазер — в 26 (30 %), 2 инструмента совместно — 25 (29 %). Количество гибридных вмешательств с торакоскопическим контролем — 21 (24 %). Полной экстракции системы достигли в 128 (83,2 %) случаях, частичного успеха (величина остаточного фрагмента электрода > 4 см) — в 26 (17,8 %). Конверсия в открытую операцию потребовалась во время 3 (1,9 %) вмешательств из 154. Заключение. Трансвенозная экстракция электродов с использованием высокотехнологичных инструментов позволяет повысить успех операции. Торакоскопический контроль открывает возможности интраоперационной визуализации анатомических структур для предотвращения фатальных осложнений.
Механический дилятор, сердечное имплантируемое электронное устройство, торакоскопический контроль, трансвенозная экстракция электродов, эксимерный лазер
Короткий адрес: https://sciup.org/142243997
IDR: 142243997 | DOI: 10.21688/1681-3472-2025-1-18-30
Текст научной статьи Трансвенозная экстракция электродов сердечных имплантируемых электронных устройств: оценка безопасности и эффективности
Цитировать: Демурчев М.Ф., Гришин И.Р., Сапельников О.В., Айвазьян С.А., Сорокин И.Н., Косоногов К.А., Черкашин Д.И., Ардус Д.Ф., Подьянов М.А., Куликов А.А., Верещагина А.В., Емельянов А.В., Ширяев А.А., Акчурин Р.С. Трансвенозная экстракция электродов сердечных имплантируемых электронных устройств: оценка безопасности и эффективности. Патология кровообращения и кардиохирургия. 2025;29(1):18-30. https://doi. org/10.21688/1681-3472-2025-1-18-30
org/0000-0002-5186-2474 С.А. Айвазьян, https://orcid. org/0000-0002-9642-9754 И.Н. Сорокин, https://orcid. org/0000-0002-7350-8353 К.А. Косоногов, https://orcid. org/0000-0001-7482-4983
How to cite: Demurchev M.F., Grishin I.R., Sapelnikov O.V., Ayvazyan S.A., Sorokin I.N., Kosonogov K.A., Cherkashin D.I., Ardus D.F., Podyanov M.A., Kulikov A.A., Vereshchagina A.V., Emelyanov A.V., Shiryaev A.A., Akchurin R.S. Transvenous extraction of cardiac implantable electronic device leads: the assessment of safety and efficacy. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2025;29(1):18-30. (In Russ.)
M.F. Demurchev, https://orcid.
I.R. Grishin, O.V. Sapelnikov, https://orcid.
S.A. Ayvazyan,
I.N. Sorokin, K.A. Kosonogov, https://orcid.
D.I. Cherkashin, https://orcid.
D.F. Ardus, M.A. Podyanov, https://orcid.
A.A. Kulikov, A.V. Vereshchagina, https://orcid.
A.V. Emelyanov, https://orcid.
A.A. Shiryaev, R.S. Akchurin, © 2025 Demurchev et al.
Впервые в мире внутрисердечное устройство (трансвенозный электрокардиостимулятор) было имплантировано в 1958 г., а в 1962 г. в НМИЦ ССХ им. А.Н. Бакулева произвели первую установку миокардиальной системы электрокардиостимуляции в СССР [1]. Позднее в практику были внедрены кардиовертеры-дефибрилляторы, устройства для ресинхронизирующей и кардиомодулирующей терапии. Разнообразие устройств, их усложнение, расширение показаний для имплантации привели к экспоненциальному росту количества операций, что способствовало увеличению числа осложнений [2–5] и, как следствие, трансвенозных экстракций электродов (ТЭЭ).
Показания к экстракции имплантированных систем делятся на инфекционные и неинфекционные. К первым относятся изолированная инфекция ложа устройства, эрозия кожи над устройством, бактериемия, электрод-ассоциированный эндокардит. Неинфекционными показаниями являются повреждение электродов, жизнеугрожающая межэлектродная интерференция, окклюзия вены, препятствующая имплантации нового элек- трода при необходимости, хроническая некупи-рующаяся боль, связанная с имплантированным устройством, жизненные показания к проведению магнитно-резонансной томографии при отсутствии альтернативных методов диагностики [6; 7].
Осложнения, связанные с сердечно-сосудистыми имплантируемыми электронными устройствами (СИЭУ), зачастую невозможно устранить изменением программных настроек устройства или консервативной терапией. Хотя накоплен большой опыт имплантации внутрисердечных устройств, инфекции систем стимуляции составляют большую долю общего количества осложнений. В таких случаях показана полная экстракция имплантированного устройства и электродов (I класс показаний) [6].
Первую операцию по извлечению электродов СИЭУ провел в 1985 г. C.L. Byrd в связи с инфицированием системы [8]. Ежегодно в мире выполняется более 15 тыс. эксплантаций эндокардиальных систем [9; 10].
Экстракция может быть выполнена открытым оперативным или трансвенозным доступом. Наличие вегетаций более 2 см — показание для открытого вмешательства, так как при ТЭЭ существует риск массивной тромбоэмболии. Трансвенозный доступ при отсутствии противопоказаний более предпочтителен ввиду малой травматичности, меньшего косметического дефекта, более короткого реабилитационного периода, меньшего риска осложнений.
Однако ТЭЭ осложняется тем, что со временем вокруг электрода формируется фиброзная капсула, особенно плотная в местах длительного контакта электрода с сосудистой стенкой. Зачастую фиброзная покрышка кальцинируется, в особенности у молодых пациентов, что затрудняет процесс извлечения электродов. В таком случае ТЭЭ методом простой тракции неосуществима ввиду крайне высокого риска конверсии в открытое вмешательство.
Эта проблема и развитие технологий привели к разработке новых инструментов для экстракции электродов. Наиболее распространенными и эффективными считаются лазерный катетер (SLS II, GlideLight (Philips, Амстердам, Нидерланды)) и механический ротационный дилятор (TightRail (Philips)).
Принцип действия лазерного катетера основан на генерации эксимерного лазера с использованием хлорида ксенона (рис. 1). Образующаяся энергия длиной волны 308 нм и глубиной проникновения 0,05 мм поглощается белками и липидами, входящими в состав фиброзной капсулы, которая окружает электрод [11; 12].
В клинической практике это означает, что фиброзную оболочку, обычно окружающую электроды, можно «разрезать», не повреждая эндотелиальную стенку или изоляцию электродов. Основным ограничением при использовании лазерного катетера являются участки с выраженным кальцинозом, в отношении которых он неэффективен.

Рис. 1. Эксимерная лазерная система: установка для генерации эксимерного лазера (A);
поперечное сечение лазерного катетера (B) (адаптировано с сайта компании-производителя:
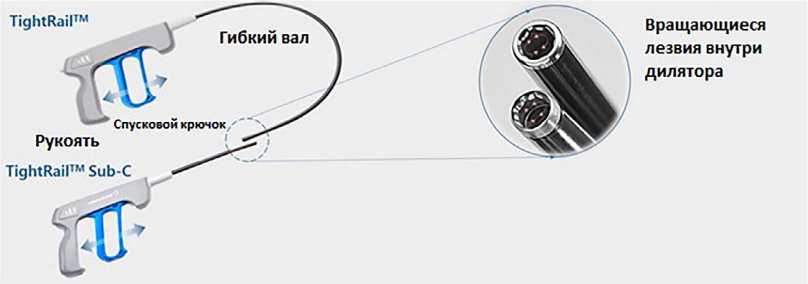
Рис. 2. Внешний вид и поперечное сечение механического дилятора (адаптировано с сайта компании-производителя:
В отличие от лазерного катетера, механический дилятор обеспечивает «освобождение» электрода от окружающих тканей за счет вращения выкручивающихся лезвий на конце инструмента, которые приводятся в движение путем мануального нажатия на рукоять (рис. 2).
Механический дилятор эффективен в отношении участков с выраженным фиброзом и/или кальцинозом. Вследствие отсутствия избирательности воздействия движение инструмента должно быть строго коаксиальным по отношению к электроду, в противном случае возможно повреждение последнего вплоть до его пересечения.
Гибридный подход (ТЭЭ с торакоскопической поддержкой) позволяет осуществлять визуальный контроль каждого этапа вмешательства, что помо- гает своевременно диагностировать интраоперационные осложнения [13–15].
Цель — изучение безопасности и эффективности современных подходов к трансвенозной экстракции электродов.
Методы
В исследование включили 154 пациента, которым с 2018 по 2024 г. выполнили экстракцию системы стимуляции в НМИЦК им. ак. Е.И. Чазова. ТЭЭ проводили как по инфекционным, так и по неинфекционным показаниям. Пациентов включали в исследование последовательно. Критериями включения являлись инфекция системы имплантированного эндокардиального устройства, вегетации на электродах, не превышавшие 2 см. К неинфекционным

показаниям относили дисфункцию электродов, перелом электрода и повреждение изоляции электрода. Критерием исключения были показания к открытой экстракции системы стимуляции. Дизайн исследования представлен на рис. 3. В общей когорте пациентов и после разделения на группы в соответствии с показаниями к ТЭЭ провели анализ количества интраоперационных осложнений, оценку структуры эксплантированных систем, «возраста» электродов, выраженности трикуспидальной регургитации до и после трансвенозной экстракции.
Трансвенозная экстракция электродов
Все операции проводили под эндотрахеальным наркозом с внутривенным потенцированием. В каждом случае выполняли интраоперационную чреспищеводную эхокардиографию для оценки степени трикуспидальной регургитации и мониторинга перикардиального выпота. При отсутствии у пациента спонтанного ритма устанавливали электрод для временной кардиостимуляции через правую внутреннюю яремную вену. Перед началом каждого вмешательства осуществляли пункционный доступ к бедренной вене для заведения проводника, по которому в случае необходимости доставляли баллонный окклюзионный катетер (Philips–Spectranetics, Колорадо-Спрингс, США) или ловушку для захвата интравенозных или изначально фрагментированных электродов Needle’s Eye Snare (Cook Medical, Блумингтон, США). Все операции проводили с кардиохирургическим сопровождением для осуществления при необходимости конверсии в открытый доступ.
Операционное поле трехкратно обрабатывали 10% раствором повидон-йода, затем однократно 95% этанолом. После кожного разреза выделяли корпус СИЭУ с проксимальными концами электродов. Последние освобождали от окружающих тканей максимально дистально до их места впадения в подключичную вену. Срезали коннекторные части, в просвет электрода заводили прочищающий, а затем запирательный стилет LLD (англ. Lead Locking Device) (Philips–Spectranetics, Колорадо-Спрингс, США), изоляцию закрепляли швом. Изначально проводили тракцию на стилете, при отсутствии результата использовали лазерный катетер и/или механический дилятор в зависимости от клинической ситуации.
Торакоскопический контроль проводили пациентам высокого риска, которые соответствовали параметрам: имплантация СИЭУ в возрасте до 30 лет; «возраст» стимулирующего электрода > 10 лет, дефибриллирующего электрода > 5 лет; выраженный кальциноз по данным мультиспиральной компьютерной томографии [9].
Конверсию в открытый доступ осуществляли в случаях жизнеугрожающих осложнений и/или безуспешной экстракции при абсолютных показаниях к извлечению электродов. Стимулятор-зависимым пациентам с неинфекционными показаниями к экстракции проводили одномоментную реимплантацию СИЭУ. Больным с инфекционными показаниями к ТЭЭ в случае подозрения на наличие вегетаций по данным чреспищеводной эхокардиографии выполняли отсроченную имплантацию после получения отрицательного бактериального посева крови
Табл. 1. Клинико-демографическая характеристика пациентов
|
Показатель Возраст, лет |
Значение, n = 154 68 [56; 76] |
|
Пол |
Мужской, n (%) 96 (62,3) Женский, n (%) 58 (37,7) |
|
Функциональный класс хронической сердечной недостаточности по классификации Нью-Йоркской кардиологической ассоциации |
I, n (%) 7 (8,7) II, n (%) 35 (47,4)
|
|
Фракция выброса левого желудочка, % |
57 [50; 60] |
|
Ишемическая болезнь сердца, n (%) |
54 (35) |
|
Хроническая сердечная недостаточность, n (%) |
74 (48,3) |
Статистический анализ
Статистический анализ данных осуществляли с помощью пакета прикладных программ Excel 2010 (Microsoft, Редмонд, США) и статистических программ STATISTICA 10 (StatSoft Inc., Талса, США). Качественные величины представлены как абсолютные значения и доли. Выборочные параметры, приведенные в таблицах, представлены в виде медианы (Ме) и межквартильного размаха (Lq; Uq). Для оценки различий между двумя независимыми выборками использовали U-критерий Манна – Уитни. Уровень различий считали достоверным при р < 0,05, значения 0,05 < p < 0,10 интерпретировали как тенденцию.
Результаты
Клинико-демографическая характеристика пациентов представлена в табл. 1. В общей выборке 62,3 % (n = 96) составили мужчины. Медиана возраста больных — 68 [56; 76] лет. Среди 154 пациентов у 74 (48,3 %) диагностирована хроническая сердечная недостаточность, медиана фракции выброса левого желудочка — 57 [50; 60] %.
В структуре эксплантированных систем 57,1 % (n = 88) составили устройства для постоянной электрокардиостимуляции, что, вероятно, связано с их большей распространенностью по сравнению с кардиовертерами-дефибрилляторами (доля эксплантаций 11,7 % (n = 18)) и устройствами для сердечной ресинхронизирующей терапии (7,8 % (n = 12)). Также провели экстракцию 6 (3,9 %) систем модуляции сердечной сократимости.
Суммарно удалили 313 электродов: 8 % (n = 25) — с пассивной фиксацией и 92 % (n = 288) — с активной. С учетом того, что основную массу удаленных систем составили электрокардиостимуляторы, отмечали значительное количество эксплантирован-ных стимуляционных желудочковых электродов (n = 155; 49,5 %). Все дефибриллирующие электроды, подвергшиеся ТЭЭ, были двуспиральными и составили 7,1 % (n = 22) общего количества удаленных электродов.
Медиана «возраста» электрода составила 64 [30; 144] мес. За одно вмешательство удаляли от 2 до 4 электродов. На ТЭЭ направляли в том числе пациентов с наличием заглушенных (n = 18; 5,8 %) или обрезанных (n = 25; 7,9 %) электродов.
Одномоментную реимплантацию нового устройства в группе с неинфекционными показаниями к ТЭЭ произвели в 58 (78,3 %) из 74 операций.
Летальные случаи отсутствовали. Из 154 оперативных вмешательств 80 (51,9 %) произвели по инфекционным показаниям (группа 1) и 74 (48,1 %) — по неинфекционным (группа 2) (рис. 4).
По основным клинико-демографическим характеристикам группы были сопоставимы, однако в группе 1 наблюдалась тенденция к большему ко-
Табл. 2. Клинико-демографическая характеристика пациентов по группам
|
Показатель |
Группа 1, n = 80 |
Группа 2, n = 74 |
р |
|
|
Возраст, лет |
70 [61; 76] |
66,5 [50,5; 73,0] |
0,15 |
|
|
Мужской, n (%) |
55 (69,2) |
44 (59,7) |
||
|
Пол |
Женский, n (%) |
25 (30,8) |
30 (40,3) |
0,25 |
|
Функциональный класс хронической |
I, n (%) |
8 (9,4) |
9 (12,5) |
|
|
сердечной недостаточности |
II, n (%) |
40 (50) |
37 (50) |
|
|
по классификации Нью-Йоркской |
III, n (%) |
32 (40,6) |
27 (37,2) |
0,38 |
|
кардиологической ассоциации |
IV, n (%) |
0 |
1 (1,3) |
|
|
Фракция выброса левого желудочка, % |
55 [47; 60] |
57,5 [50; 60] |
0,41 |
|
|
Ишемическая болезнь сердца, n (%) |
28 (35,2) |
26 (32,2) |
0,77 |
|
|
Хроническая сердечная недостаточность, n (%) |
38 (47) |
36 (53,2) |
0,69 |
|
|
Гипертоническая болезнь, n (%) |
53 (66,1) |
47 (59,6) |
0,52 |
|
|
Индекс массы тела, кг/м2 |
27 [23; 32] |
27 [25; 31] |
0,409 |
|
|
Скорость клубочковой фильтрации, мл/мин |
75,5 [58,25; 92,00] |
80 [61; 93] |
0,59 |
|
|
Острое нарушение мозгового кровообращения, n (%) |
9 (11,7) |
13 (14,5) |
0,61 |
|
|
Сахарный диабет, n (%) |
22 (27,9) |
13 (14,5) |
0,07 |
|
Примечание. Полужирным шрифтом выделены достоверный уровень различий при р < 0,05 или тенденция — значения 0,05 < p < 0,10.
A
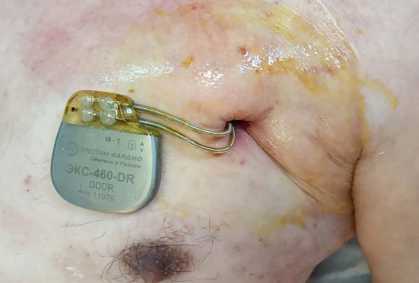
B
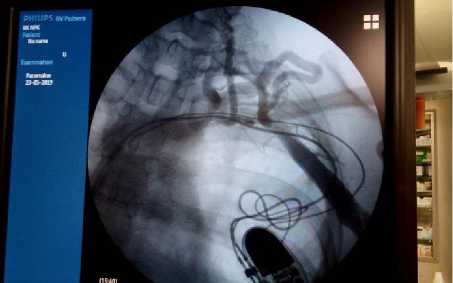
Рис. 4. Осложнения у пациентов с сердечно-сосудистыми имплантируемыми электронными устройствами: пролежень ложа электрокардиостимулятора (абсолютное показание к экстракции системы стимуляции, класс I) (A); синдром Педжета – Шреттера (неинфекционное показание (класс IIА) к трансвенозной экстракции электродов при необходимости имплантации дополнительного электрода) (B)
Табл. 3. Характеристика пациентов, которым выполнили трансвенозную экстракцию электродов по инфекционным показаниям
|
Показатель |
Значение |
|
Общие данные |
|
|
Санация ложа до экстракции*, n (%) |
38 (47,5) |
|
Эрозия кожи, n (%) |
60 (75,4) |
|
Продолжительность инфекции до экстракции, мес. |
4,5 [2,00; 8,25] |
|
Лабораторные данные |
|
|
Лейкоцитоз, ×109/л |
7,2 [5,5; 8,6] |
|
С-реактивный белок, пг/мл |
4,7 [2,10; 15,15] |
|
Прокальцитонин, нг/мл |
0,06 [0,0325; 0,1000] |
|
Результаты бактериологии |
|
|
Возбудитель (посев из раны): |
|
|
Acinetobacter baumannii, n (%) |
1 (1,25) |
|
Enterococcus faecalis, n (%) |
1 (1,25) |
|
Moraxella osloensis, n (%) |
1 (1,25) |
|
Pseudomonas aeruginosa, n (%) |
1 (1,25) |
|
Staphylococcus aureus, n (%) |
8 (10) |
|
Streptococcus haemolyticus, n (%) |
3 (3,75) |
|
Staphylococcus lugdunensis, n (%) |
1 (1,25) |
|
Staphylococcus capitis, n (%) |
1 (1,25) |
|
Staphylococcus epidermidis, n (%) |
17 (21,25) |
|
Staphylococcus hominis, n (%) |
3 (3,75) |
|
Бактериемия, n (%) |
11 (13,75) |
|
Возбудитель в крови: |
|
|
Staphylococcus aureus, n (%) |
4 (4,9) |
|
Staphylococcus epidermidis, n (%) |
7 (8,7) |
|
Данные чреспищеводной эхокардиографии |
|
|
Вегетации более 2 см, n (%) |
3 (3,7) |
|
Вегетации менее 2 см, n (%) |
4 (5) |
Примечание. * — рекомендовано полное удаление системы.
Табл. 4. Причины эксплантации электродов у пациентов, которым выполнили трансвенозную экстракцию электродов по неинфекционным показаниям
В группе 1 в среднем продолжительность инфекции до экстракции составила 4,5 мес. Санацию раны на дооперационном этапе произвели в 38 (47,5 %) случаях. У 37 пациентов при проведении посевов из раны обнаружили возбудителя инфекции (табл. 3). При этом у 11 больных (13,75 %) выявили бактериемию, преимущественно определяли рост колоний Staphylococcus aureus и Staphylococcus epidermidis . Примечательно, что при оценке анализов крови значительного лейкоцитоза, повышения уровня С-реактивного белка и прокальцитонина не обнаружили.
Причины экстракции электродов в группе 2 представлены в табл. 4.
В группе неинфекционных показаний было значимо больше эксплантированных кардиовертеров-дефибрилляторов (р = 0,02). При этом по общему количеству удаленных электродов группа 1 превосходила группу 2 (р = 0,003). Выявили закономерно большее число удаленных стимулирующих правожелудочковых (р = 0,05) и предсердных электродов (р = 0,016). В остальном группы сопоставимы (табл. 5).
Табл. 5. Результаты трансвенозной экстракции электродов в группах
|
Показатель |
Группа 1, n = 80 |
Группа 2, n = 74 |
р |
|
Электрокардиостимулятор, n (%) |
52 (64,7) |
36 (62,9) |
0,84 |
|
Кардиовертер-дефибриллятор, n (%) |
4 (4,4) |
14 (16,1) |
0,02 |
|
Устройство для ресинхронизирующей терапии (CRT-D/P), n (%) |
7 (8,8) |
5 (9,6) |
0,86 |
|
Модулятор сердечной сократимости, n (%) |
2 (2,9) |
4 (3,2) |
0,4 |
|
«Возраст» электродов, мес. |
63,5 [26,5; 143,5] |
55 [28,5; 144,0] |
0,67 |
|
Общее количество электродов |
184 |
129 |
0,003 |
|
Интраоперационные осложнения, n (%) |
5 (5,8) |
5 (6,4) |
0,84 |
|
Виды удаленных электродов |
|||
|
Дефибриллирующий двуспиральный, n (%) |
11 (6,2) |
14 (10,9) |
0,33 |
|
Стимуляционный желудочковый, n (%) |
90 (48,9) |
63 (49,0) |
0,05 |
|
Стимуляционный предсердный, n (%) |
80 (43,4) |
50 (39,0) |
0,016 |
|
Левожелудочковый, n (%) |
6 (3,4) |
5 (3,6) |
0,82 |
|
Результат операции |
|||
|
Частичное удаление, n (%) |
12 (14,7) |
14 (19,4) |
0,24 |
|
Полное удаление, n (%) |
68 (85,3) |
60 (80,6) |
0,25 |
Примечание. Полужирным шрифтом выделены достоверный уровень различий при р < 0,05 или тенденция — значения 0,05 < p < 0,10.
ьнепетс ,яицатигругер яаньладипсукир
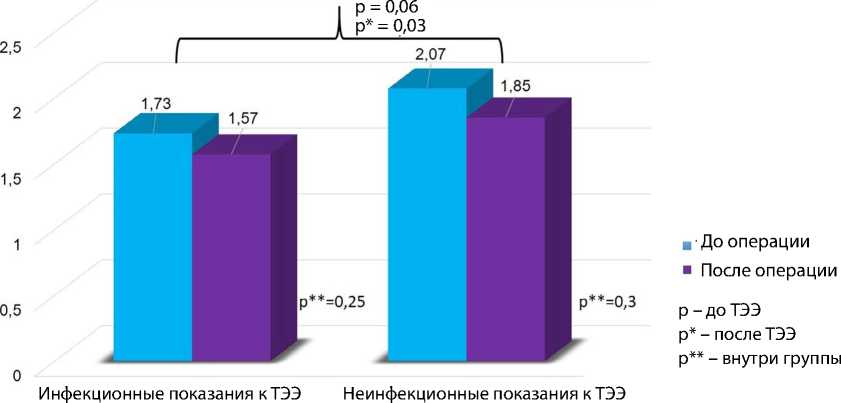
Рис. 5. Динамика трикуспидальной регургитации у пациентов с инфекционными и неинфекционными показаниями к трансвенозной экстракции электродов до и после вмешательства
Примечание. ТЭЭ — трансвенозная экстракция электродов.
У всех пациентов с имплантированными устройствами оценивали состояние трикуспидального клапана. До ТЭЭ степень тяжести трикуспидальной регургитации в группе 2 была статистически значимо выше (р = 0,06), чем в группе 1. В послеоперационном периоде между группами сохранилось различие по этому показателю (р = 0,03), однако внутри групп значимого изменения недостаточности трикуспидального клапана не выявили (рис. 5).
В 44 % (n = 68) случаев ТЭЭ проводили методом простой тракции на запирательном стилете, в 56 % (n = 86) применяли дополнительные инструменты. В 17 % (n = 14) случаев использовали механический дилятор, в 30 % (n = 26, пациенты без выраженного
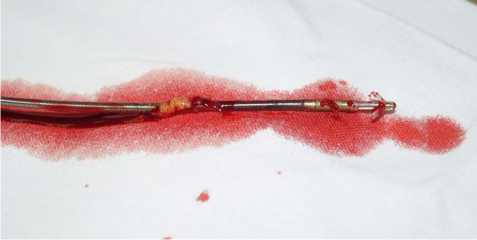
Рис. 6. Фиброзная капсула вокруг электрода с пассивной фиксацией кальциноза фиброзной капсулы вокруг электрода) — лазерный катетер (рис. 6). Совместное использование лазера и дилятора составило 29 % (n = 25). В 24 % (n = 21) случаев проводили гибридное вмешательство с торакоскопическим контролем (рис. 7).
При сравнении двух групп по использованным техникам выявили, что в группе 2 значимо чаще применяли простую тракцию (р = 0,04), в остальном группы статистически значимо не различались (рис. 8).
Пяти (3,4 %) пациентам потребовался дополнительный бедренный доступ (1 случай заведения доставляемого окклюзионного баллона при повреждении верхней полой вены и 4 случая заведения ловушки Needle’s Eye при безуспешной экстракции из подключичного доступа).
Окклюзионный баллон использовали у больного с инфекционными показаниями к экстракции си- стемы стимуляции: при работе механическим ди-лятором в области впадения верхней полой вены в правое предсердие отмечали прогрессирующую гипотонию, выпот в полости перикарда по данным чреспищеводной эхокардиографии. Незамедлительно по проводнику завели окклюзионный баллон, раздули в верхней полой вене. Выполнили экстренную стернотомию. При ревизии установили разрыв верхней полой вены в месте впадения в правое предсердие, баллон был неэффективен. Начали массивную гемотрансфузию, подключили больного к аппарату искусственного кровообращения. Выполнили открытую экстракцию электродов, пластику верхней полой вены. Время с момента диагностики до начала искусственного кровообращения составило 12 мин. Суммарная кровопотеря не превышала 4,5 л. Пациента выписали через 2 недели в удовлетворительном состоянии.
У 27 (17,7 %) больных выявили окклюзию подключичной вены. Полной экстракции систем и электродов удалось достичь в 128 (83,2 %) случаях, частичный успех (величина остаточного фрагмента электрода > 4 см) составил 26 случаев (17,8 %).
Конверсия в открытое вмешательство потребовалась при 3 (1,9 %) операциях из 154. Из них 1 экстренную стернотомию провели вследствие разрыва верхней полой вены при ТЭЭ без торакоскопии и 2 плановые конверсии в открытый доступ потребовались при интраоперационном развитии
Простая тракция, 68 (44 %)
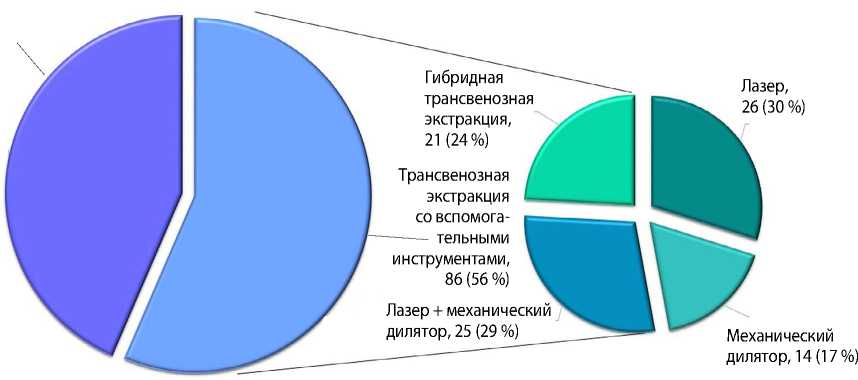
Рис. 7. Техники трансвенозной экстракции электродов
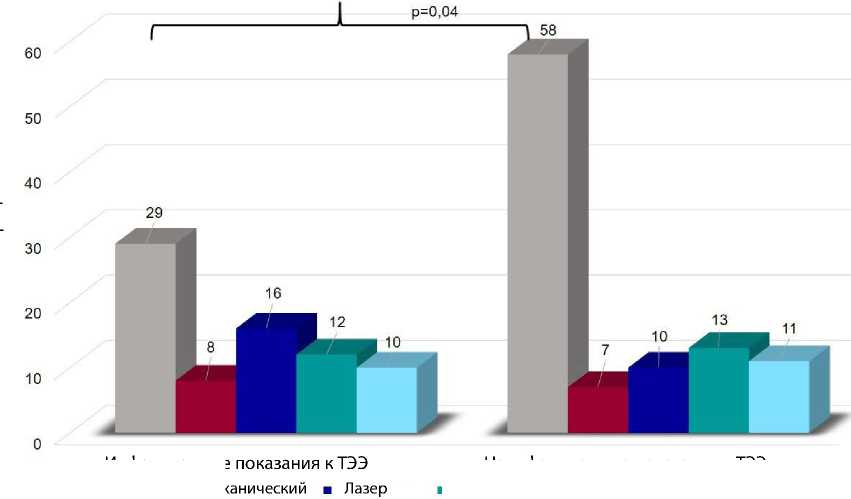
дилятор
Инфекционные ■ Тракция ■ Мех
Неинфекционные показания к ТЭЭ
■ Лазер+механический дилятор ■ Гибридная ТЭЭ
Рис. 8. Техники трансвенозной экстракции электродов по группам пациентов Примечание. ТЭЭ — трансвенозная экстракция электродов.
гематомы верхней полой вены во время гибридной трансвенозной экстракции.
Обсуждение
ТЭЭ сердечных имплантируемых устройств — безопасный и эффективный метод хирургического лечения. Безопасность процедуры подтверждена низкой частотой интраоперационных осложнений: 1,7 % по данным мировой литературы [16], что согласуется с результатами настоящего исследования.
Об эффективности операции свидетельствуют данные B.L. Wilkoff и соавт., которые сообщили о 94% успехе полного удаления систем СИЭУ, причем экстракция электродов с пассивной (53 %) и активной фиксацией (47 %) была представлена практически в равной степени. Средний «возраст» электродов, как и в нашем исследовании, составил 69 ± 46 и 65 ± 42 мес. соответственно для экстракции без лазера и с его применением [12].
Основными показаниями для ТЭЭ как в нашем исследовании, так и по данным зарубежных работ, были инфекционные осложнения, ассоциированные с СИЭУ. В регистре ELECTRa проанализировано 3 510 пациентов, которым выполнили ТЭЭ. В 53 % случаев показанием к экстракции стала инфекция системы стимуляции, а неинфекционные причины составили 46 % [16; 17].
При сравнении двух групп мы выявили различия в динамике трикуспидальной регургитации до и после ТЭЭ, количестве удаляемых электродов, технике экстракции. Вероятнее всего, разница в числе удаляемых электродов обусловлена необходимостью полной экстракции системы стимуляции и всех электродов в случае инфекционных показаний к ТЭЭ, а статистически значимое различие в экстракции электродов методом простой тракции вызвано более агрессивной фиброзной инкапсуляцией при наличии инфекции системы стимуляции, что можно считать дополнительным фактором риска.
Успех ТЭЭ определяет не только «возраст», но и тип удаляемого электрода. Несмотря на большую долю стандартных стимулирующих электродов как в предсердной, так и в желудочковой позиции, в данном исследовании встречались двуспиральные дефибриллирующие и левожелудочковые электроды. Двуспиральные дефибриллирующие электроды по сравнению с односпиральными имеют бόльшую площадь контакта спирали с сосудистой стенкой, что обусловливает образование выраженной фиброзной капсулы, в особенности после срабатывания устройства, и значительно усложняет процедуру ТЭЭ. В исследовании S. Pecha и соавт. также отмечена высокая доля экстракции стандартных стимуляционных электродов (пред- сердных — 35,4 %, желудочковых — 57,7 %), что в целом связано с большей распространенностью имплантаций систем ЭКС по сравнению с другими сердечно-сосудистыми имплантируемыми устройствами [18].
ТЭЭ с использованием механических дилято-ров и/или лазерных катетеров позволяет безопасно удалить электрод в большинстве случаев, однако несет риск осложнений, самое грозное из которых — перфорация сосудистого русла. Серьезные осложнения требуют немедленного (в течение 5–10 мин) хирургического вмешательства с торакотомией или стернотомией [13]. Интраоперационно заподозрить их помогает постоянный инвазивный контроль артериального давления, чреспищеводная эхокардиография, однако зачастую этого недостаточно при операциях высокого риска, в связи с чем мы внедрили гибридный подход к ТЭЭ. В данном исследовании из всех экстракций со вспомогательными инструментами 21 (24 %) выполнили с торакоскопическим контролем. В зарубежной литературе встречаются единичные описания данного метода, при этом многоцентровые исследования, как и отечественные работы, отсутствуют. Наиболее крупный регистр по ТЭЭ ELECTRa не включал гибридный подход к трансвенозной экстракции.
Ограничения
Ограничением исследования является невозможность выделить группу сравнения, так как ТЭЭ выполняют по жизненным показаниям.
Заключение
ТЭЭ — безопасный и эффективный метод удаления систем СИЭУ. Процедура является приоритетной в регламентирующих документах при отсутствии показаний к открытому вмешательству, характеризуется меньшей травматичностью и непродолжительным реабилитационным периодом. Совместное применение механического дилято-ра и лазерного катетера позволяет с большой эффективностью выполнять экстракцию значительно кальцинированных и фиброзированных электродов. Рекомендован бедренный доступ при каждой операции ТЭЭ для быстрой доставки окклюзионного баллона при наличии показаний. Торакоскопический контроль при ТЭЭ является новейшей разработкой, позволяет своевременно диагностировать и предупреждать фатальные осложнения, в связи с чем рекомендован для проведения операций у пациентов высокого риска.


