Трехлетние результаты эндокардиальной имплантации аутологичных клеток костного мозга пациентам с ишемической болезнью сердца с нормальной фракцией выброса левого желудочка
Автор: Кливер Елена Николаевна, Чернявский Александр Михайлович, Покушалов Евгний Анатольевич, Романов Александр Борисович, Терехов Игорь Николаевич
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ишемическая болезнь сердца
Статья в выпуске: 1 т.19, 2015 года.
Бесплатный доступ
Цель. Оценить трехлетние результаты трансэндокардиальной имплантации мононуклеарной фракции аутологичных клеток костного мозга (МФККМ) у пациентов с ишемической болезнью сердца с сохраненной систолической функцией левого желудочка (ЛЖ). Материал и методы. Обследовано 30 пациентов с постинфарктным кардиосклерозом: с фракцией выброса ЛЖ 50-70%. Система NOGA использована для введения в пограничную зону инфаркта миокарда в среднем 41 ±16 х 10 6 МФККМ. Результаты. Летальность на этапе 36-мес. контроля составила 6,6% (2 человека), и оба случая не были связаны с основной патологией. Имплантация клеток привела через 36 мес. к улучшению функционального класса (ФК) стенокардии с 2,8±0,1 до 2,1±0,1 (р
Мононуклеарная фракция аутологичных клеток костного мозга, сердечная недостаточность, ишемическая болезнь сердца
Короткий адрес: https://sciup.org/142140656
IDR: 142140656 | УДК: 616.127-005.4-08:611.018.46
Текст научной статьи Трехлетние результаты эндокардиальной имплантации аутологичных клеток костного мозга пациентам с ишемической болезнью сердца с нормальной фракцией выброса левого желудочка
Хроническая сердечная недостаточность (ХСН) в настоящее время остается одним из тяжелых и неблагоприятных в прогностическом отношении осложнений ишемической болезни сердца (ИБС) [1–3]. До половины больных, госпитализированных по поводу ХСН, имеют нормальную систолическую функцию левого желудочка. В их лечении применяются преимущественно медикаментозные и хирургические методы. Однако остаются пациенты, которым эти методы не подходят: больные с атеросклеротическим диффузным или дистальным поражением коронарных артерий, которым выполнение операции прямой реваскуляризации технически не представляется возможным [1], а также пациенты с возвратной, прогрессирующей стенокардией, перенесшие аортокоронарное шунтирование (АКШ), с невозможностью повторного хирургического вмешательства. Клеточная терапия – новое направление в лечении ишемической болезни сердца. На сегодняшний день широко внедряется технология доставки стволовых клеток к сердцу посредством кардиальной навигационной системы NOGA, которая, по мнению ряда исследователей [4–6], более доступна и безопасна.
Целью исследования стала оценка непосредственных и отдаленных результатов у больных ишемической болезнью сердца с сердечной недостаточностью с сохранной систолической функцией левого желудочка, в лечении которых использовалась методика трансэндокардиальной имплантации МФККМ с применением навигационной системы NOGA.
Материал и методы
В исследование вошли 30 пациентов с хронической ишемической болезнью сердца, находившихся на стационарном лечении в центре хирургии аорты, коронарных и периферических артерий ФГБУ «ННИИПК им. акад. Е.Н. Мешалкина» Минздрава России.
Соотношение принявших участие в исследовании муж-чин/женщин составило 28/2 (92,8/7,2%) соответственно, средний возраст – 60,2±1,6 лет.
Критериями включения в исследование были: давность инфаркта миокарда (более 12 мес. до регистрации в исследовании) и фиксирование дефекта перфузии Tc-99m-tetrofosmin SPECT; выраженные клинические симптомы сердечной недостаточности; резистентность к максимальной консервативной терапии и отсутствие выбора для стандартной реваскуляризации. Критерии выключения: возможность чрескожного коронарного вмешательства, стентирования коронарной артерии, геморрагические симптомы; выраженные почечная и печеночная недостаточность; тромб в полости левого желудочка, по данным ЭхоКГ; стенозирование аортального клапана или ранее выполненное его протезирование; фибрилляция предсердий; наличие онкозаболеваний. Первичной конечной точкой исследования была оценка эффективности интрамиокардиального введения МФККМ по данным двухэтапной сцинтиографиии миокарда через 12 и 36 мес. Вторичные конечные точки включали: безопасность инт-рамиокардиального введения МФККМ, оценку ФК стенокардии, сердечной недостаточности по NYHA, функции ЛЖ (по результатам ЭхоКГ), выживаемость и изменение вольтажной карты ЛЖ, оцениваемой при эндокардиальном картировании с помощью навигационной системы NOGA.
Протокол исследования одобрен Локальным этическим комитетом (протокол № 10 от 15.02.2007), все пациенты подписали информированное согласие на участие в исследовании.
Перед вмешательством и при контроле через 12 и 36 мес. с целью оценки отдаленных результатов всем больным проводили полное клинико-инструментальное обследование, включая ЭКГ, ЭхоКГ, селективную коронарографию и тест 6-мин. ходьбы. Для выявления зон нарушений перфузии миокарда левого желудочка пациентам выполняли двухэтапную сцинтиграфию миокарда Tc-99m (1-й этап – в покое, 2-й этап – нагрузочная фармакологическая проба с использованием аденозина для создания стресс-дефектов). Процедуру проводили до имплантации МФККМ, через 12 и 36 мес. после введения. Была использована полуколичественная 20-сег-ментарная балльная система со шкалой в баллах от 0 до 4 (0 – нормальная активность, 4 – нет активности). Эти баллы складывались, показывая суммарные значения при покое и стрессе [7].
Мононуклеарную фракцию аутологичных клеток костного мозга получали двумя методами: 1) Накануне операции из аспирата аутологичного костного мозга выделяли и отмывали МФККМ. Мононуклеарные клетки костного мозга изолировались путем центрифугирования на градиенте плотности Ficoll (1.077; Ficoll-Plaque Plus, Amersham Pharmacia Biotech). Затем проводили три пошаговые отмывки, клетки ресуспензирова-лись в гепаринизированном физиологическом растворе для дальнейшего использования. 2) Рекомбинантный человеческий G-CSF (Grasalva, Израиль) вводился подкожно в дозе 3,3–5,0 мкг/кг веса в сутки общим количеством пять инъекций. До и после мобилизации G-CSF у пациентов забиралась венозная кровь. На шестые сутки пациентам проводилась процедура аппаратного цитофереза на сепараторе клеток крови (Haemonetics MCS+, США). Использовалась программа PBSC (получение периферических стволовых клеток), параметры циркуляции и рециркуляции (recirculation № 2, recirc ratio 1/3). МНК из сепарированной крови выделяли на градиенте плотности фиколла/верографина ( ρ = 1,078 г/л), дважды отмывали в забуференном физиологическом растворе (ЗФР), подсчитывали количество.
Жизнеспособность клеток тестировалась трипановым синим (метод исключения) и достигала более чем 98% для каждого трансплантата. Далее полученную суспензию вводили через NOGA-катетер в зоны, идентифицированные предшествующим электромеханическим картированием, в среднем около 15 инъекций по 0,2 см3. Технология введения была следующей: перпендикулярная позиция катетера к миокардиальной стенке, отличная стабильность петли, лежащей в основе вольтажа > 6,9 mV.
Среднее значение введенных каждому пациенту МФККМ клеток составляло 41±16 х 10 6 . Фракция CD34/CD45-пози-тивных клеток – 2,5±1,6%.
Статистические результаты представлены как средние значения для продолжительных параметров или как чис-ла/проценты для параметров категорий. Продолжительные переменные сопоставлялись с использованием метода ANOVA; Т-теста. Переменные категории сравнивались по Х 2 -критерию Пирсона и критерию Фишера. Для определения независимых соответствий применяли метод многофакторной логистической регрессии. Величина р <0,05 считалась статистически значимой.
Результаты
При контрольном обследовании через 12 и 36 мес. у пациентов отмечено статистически значимое уменьшение функционального класса стенокардии относительно исходных показателей с 2,8±0,1 до 1,8±0,1 и 2,1±0,1 соответственно (р <0,05). ФК ХСН (NYHA) также статистически значимо
Таблица 1 Клинико-функциональные показатели у обследованных пациентов, M±m
|
Показатель |
ФВ ЛЖ 50–70% |
||
|
до лечения (n = 30) |
12 мес. (n = 29) |
36 мес. (n = 28) |
|
|
ФК СН |
2,8±0,1 |
1,8±0,1* |
2,1±0,1* |
|
ХСН (NYHA) |
2,8±0,1 |
2,0±0,1* |
2,3±0,1 |
|
ФВ ЛЖ, % |
61,3±0,8 |
60,3 ±1,2 |
60,5 ±1,1 |
|
КДО ЛЖ, мл |
103,1±5,5 |
111,5±5,9 |
105,3±6,1 |
|
КСО ЛЖ, мл |
47,1±3,3 |
47,1±4,0 |
43,1±6,1 |
|
КДР ЛЖ, см |
4,7±0,1 |
4,8±0,1 |
4,8±0,1 |
|
УО, мл |
63,5±3,1 |
64,2±3,5 |
62,3±3,5 |
|
р ЛА, мм рт. ст. |
28,2±0,4 |
29,5±0,9 |
29,4±1,0 |
|
Тест 6-мин. ходьбы, м |
259,1±15,1 |
376,7±20,7* |
306,6±15,1* |
* р <0,05 относительно исходных данных
Таблица 2 Данные сцинтиграфии миокарда у обследованных пациентов, в баллах (M±m)
Расстояние, пройденное пациентами во время теста 6-мин. ходьбы после имплантации МФККМ на этапе годового и трехгодового контроля, возросло с исходных 259,1±15,1 до 376,7±20,7 и 398,1±48,6 м соответственно (p <0,05). Функция левого желудочка оценивалась по данным ЭхоКГ. ФВ ЛЖ, как и показатели конечного диастолического объема (КДО ЛЖ), конечного систолического объема (КСО ЛЖ) и давления в стволе легочной артерии (р ЛА) существенно не изменялись на протяжении 12 и 36 мес. контроля (табл. 1).
Миокардиальная перфузия оценивалась по двухэтапной перфузионной сцинтиграфии. Суммарный индекс в покое и при нагрузке в течение 36 мес. не претерпел статистически значимых изменений, но имел положительную тенденцию (табл. 2, рис. 1, а, б, в ).
Электроанатомическое картирование ЛЖ через 12 и 36 мес. проводилось у всех пациентов. При этом общее число точек и их распределение (число точек в сегменте) незначительно отличалось от первоначального картирования. Как видно на рис. 2, по сравнению с исходным картированием ( а ), через 12 ( б ) и 36 мес. ( в ) отмечается улучшение перфузии миокарда левого желудочка (уменьшение площади красного цвета с увеличением зоны сиреневого цвета).
Летальность на этапе 36-мес. контроля составила 6,6% (2 человека), и оба случая не были связаны с основной патологией (внесердечные причины).
Учитывая небольшое количество полученных наблюдений и тот факт, что данный результат относится к неполным наблюдениям (случаи с летальным исходом, не связанным с болезнью сердца), на рис. 3 мы приводим статистические данные по анализу выживаемости, проведенному на основе оценки функции выживаемости методом Каплана – Майера в сравнении с группами с ФВ ЛЖ 36–49 и <35%, которые также участвовали в расширенном варианте нашего исследования.
Как видно из рис. 3, пациенты с ФВ ЛЖ 50–70% имеют наибольший шанс выживания по сравнению с больными других групп на всем периоде наблюдения.
Обсуждение
Хроническая сердечная недостаточность – одно из неблагоприятных в прогностическом отношении осложнений всех заболеваний сердечно-сосудистой системы. При этом большой процент смертности приходится именно на патологию, связанную с утратой части работоспособного миокарда (ишемия, инфаркт и др.) [2, 3].
Несмотря на достижения в области хирургии коронарных сосудов, остается группа пациентов, для которых существу- в
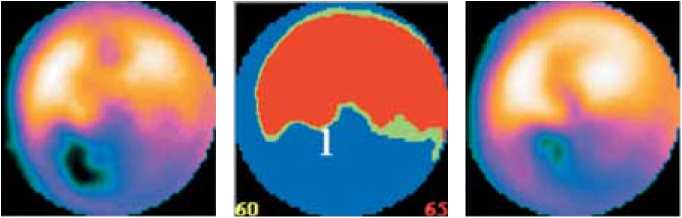
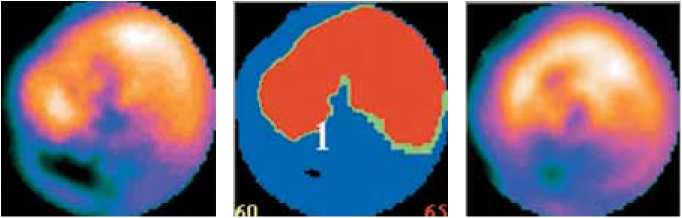
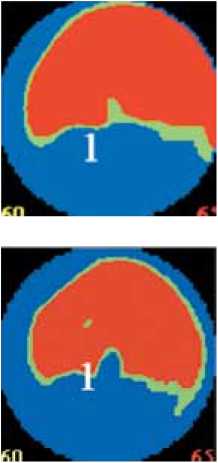
Рис. 1. Данные двухэтапной сцинтиграфии пациента Н., 57 лет: а – до начала лечения, б – через 12 мес., в – через 36 мес. после лечения
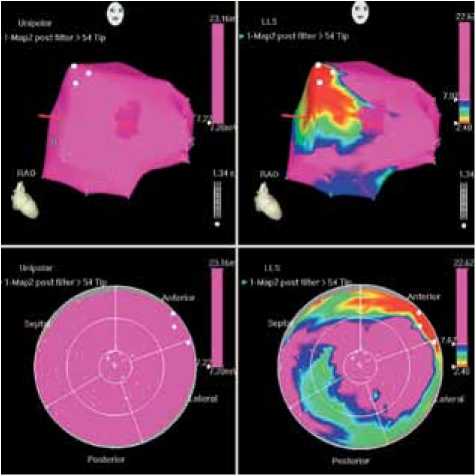
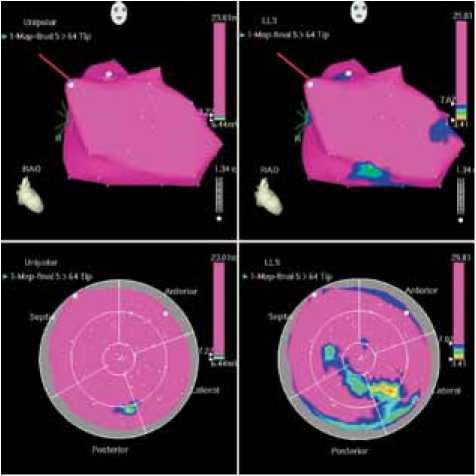
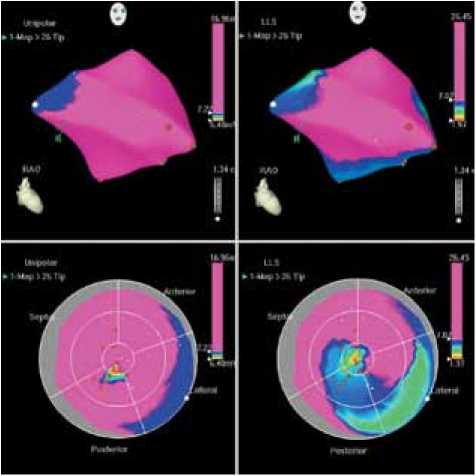
Рис. 2. Данные электрофизиологического исследования миокарда пациента Д., 48 лет: а – до начала лечения, отмечается зона нарушения перфузии (красный цвет) на фоне миокарда с нормальной перфузией (сиреневый цвет); б – через 12 мес., в – через 36 мес. после лечения, улучшение перфузии миокарда в ранее нарушенных участках (уменьшение зоны красного цвета)
ющие методы прямой реваскуляризации миокарда не эффективны. Это пациенты, ранее перенесшие аортокоронарное шунтирование, с диффузным и дистальным поражением коронарного русла [8]. На основании вышеизложенного в наше исследование были включены больные с ИБС, ранее перенесшие АКШ, которым выполнение повторного коронарно- го шунтирования невозможно, пациенты с однососудистым поражением, когда невозможно выполнение коронарной ангиопластики, а также больные с диффузным поражением коронарных артерий и несостоятельным дистальным руслом.
По мнению некоторых авторов, трансэндокардиальное введение клеток в миокард с использованием кардиальной
Кумулятивная доля выживших (оценка по методу Каплана – Майера)
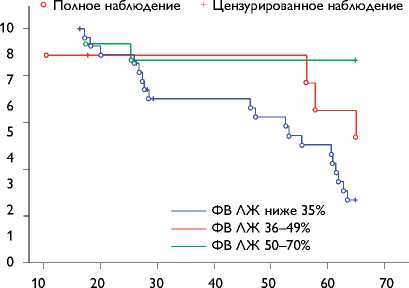
Рис. 3. Графики оценки функции выживаемости по группам пациентов с ИБС с ФВ ЛЖ <35, 36–49, 50–70% навигационной системы NOGA имеет преимущество по сравнению с остальными способами клеточной кардиомиопластики [5]. К одному из его достоинств относится безопасность, которая достигается малоинвазивностью метода, в отличие от введения МФККМ в миокард при проведении открытой операции. Кроме этого МФККМ вводится непосредственно в ишемизированные зоны, что является положительным моментом и отличает данный метод от транскоронарной инфузии клеток через баллон при ангиопластике [9–15].
Заключение
Целью нашего исследования была оценка непосредственного и отдаленного влияния трансэндокардиальной имплантации МФККМ на этапе годового и трехгодового контроля на клиническое состояние пациентов ИБС с сохраненной систолической функцией левого желудочка. Полученные в исследовании данные показывают, что имплантация МФК-КМ приводит у большинства пациентов к улучшению миокардиальной перфузии в ишемизированных сегментах без увеличения рубцовой зоны. Отмеченное повышение уровня толерантности к физической нагрузке при проведении теста 6-мин. ходьбы при контрольных обследованиях указывает на стабилизацию состояния больных.
Кардиальная навигационная система NOGA на сегодняшний день одна из наиболее высокотехнологичных методик, позволяющих создавать трехмерные изображения сердца, что способствует более точному определению области нару- шения перфузии миокарда и локализации области введения МФККМ. Положительный эффект клеточной терапии может удерживаться в течение 12–36 мес.
Список литературы Трехлетние результаты эндокардиальной имплантации аутологичных клеток костного мозга пациентам с ишемической болезнью сердца с нормальной фракцией выброса левого желудочка
- Бокерия Л.А. Минимально инвазивная хирургия сердца. М., 1998.
- Беленков Ю.Н. Дисфункция левого желудочка у больных с ишемической болезнью сердца: современные методы диагностики, медикаментозной и немедикаментозной коррекции//Рус. мед. журн. 2000. Т. 3. № 17. С. 685-693.
- Беленков Ю.Н. Ремоделирование левого желудочка: комплексный подход//Сердечная недостаточность. 2002. Т. 3. № 4. С. 161-169.
- Tse H.F., Kwong Y.L., Chan J.K. et al. Angiogenesis in ischemic myocardium by intramyocardial autologous bone marrow mononuclear cell implantation//Lancet. 2003. Vol. 361. Р. 47-49.
- Смолянинов А.Б., Горелов А.И. Кардиология будущего и клеточная терапия. СПб., 2006.
- Кливер Е.Н., Чернявский А.М., Покушалов и др. Отдаленные результаты трансэндокардиальной клеточной кардиомиопластики у пациентов с выраженной ишемической дисфункцией миокарда//Вестник НГУ. Биология, клиническая медицина. Т. 10. № 3. 2012. С. 105-112.
- Liu Y., Guo J., Zhang P. Bone marrow mononuclear cell transplantation into heart elevates the expression of angiogenic factors//Microvasc. Res. 2004. Vol. 68. P. 156-160.
- Бураковский В.И. Первые шаги. Записки кардиохирурга. М., 1988.
- Fuchs S., Satler L.F., Kornowski R. Catheter-based autologous bone marrow myocardial injection in no-option patients with advanced coronary artery disease//J. Am. Coll. Cardiol. 2003. Vol. 41. Р. 1721-1724.
- Perin E.C., Dohmann H.F., Borojevic R. Transendocardial, autologous bone marrow cell transplantation for severe, chronic ischemic heart failure//Circulation. 2003. Vol. 107. Р. 2294-2302.
- Perin E.C., Dohmann, H.F., Borojevic R. Improved exercise capacity and ischemia 6 and 12 months after transendocardial injection of autologous bone marrow mononuclear cells for ischemic cardiomyopathy//Circulation. 2004. Vol. 110 (suppl. II). Р. 213-218.
- Beeres S., Bax J., Dibbets P. et al. Effect of Intramyocardial Injection of Autologous Bone Marrow-Derived Mononuclear Cells on Perfusion, Function, and Viability in Patients with Drug-Refractory Chronic Ischemia//J. Nucl. Med. 2006. Vol. 47. Р. 574-580.
- Weintraub W.S., Jones E.L., Craver J.M. Frequency of repeat coronary bypass or coronary angiogplasty after coronary artery bypass surgery using saphenous venous grafts//Am. J. Cardiol. 1994. Vol. 73. P. 103-108.
- Silva G., Perin E., Dohmann H. et al. Catheter-based transendocardial delivery of autologous bone-marrow-derived mononuclear cells in patients listed for heart transplantation//Texas Heart. Inst. 2004. Vol. 31. P. 214-219.
- Стрельников А.Г., Романов А.Б., Артеменко С.Н., Лосик Д.В., Гражданкин И.О., Камиев Р.Т., Туров А.Н., Покушалов Е.А. Коррекция последствий инфаркта миокарда при помощи интрамиокардиальных инъекций аутологичных стволовых клеток-предшественниц костного мозга//Патология кровообращения и кардиохирургия. 2013. № 4. С. 37-41.


