Триметазидин как модификатор доксорубицинциклофосфамидной гипердислипидемии
Автор: Авагимян А.А., Кактурский Л.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 2 т.37, 2022 года.
Бесплатный доступ
Цель настоящего экспериментального исследования: изучение проатерогенного потенциала доксорубицин-циклофосфамидного (АС) режима химиотерапии с одновременным обоснованием применения триметазидина как модификатора вызванных изменений.Материал и методы. Проведенное исследование характеризуется как фундаментальное, рандомизированное, контролируемое, экспериментальное, in vivo. С целью проведения экспериментальной работы было задействовано 80 инбредных крыс линии Wistar, которые были рандомно разделены на 4 равные группы. Курсовая дозировка доксорубицина была равна 15 мг/кг, циклофосфамида - 150 мг/кг, а триметазидина - 42 мг/кг. Продолжительность эксперимента составила 14 дней. В качестве вероятного стабилизатора функционирования эндотелия был выбран триметазидин.Результаты. В рамках настоящего исследования оценены девиации следующих параметров: общего холестерина (ОХС), триглицеридов (ТГ), а также липопротеинов высокой (ЛПВП) и низкой плотности (ЛПНП). Также проанализированы такие прогностические показатели, как коронарный и атерогенный индекс. Спустя 2 нед. от начала AC-режима химиотерапии зарегистрированы статистически значимые межгрупповые различия со стороны липидограммы (oneway ANOVA, p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Кардиотоксичность, доксорубицин, атеросклероз, триметазидин
Короткий адрес: https://sciup.org/149140489
IDR: 149140489 | УДК: 616.153.915:577.125.8:615.272.4 | DOI: 10.29001/2073-8552-2022-37-2-105-111
Текст научной статьи Триметазидин как модификатор доксорубицинциклофосфамидной гипердислипидемии
Кардиоонкология представляет собой актуальное и междисциплинарное направление в современной медицине [1]. Проблема кардиотоксичности химиопрепаратов остро стоит в реальной клинической практике [2]. Несмотря на более чем полувековое изучение данной проблемы, решение до сих пор отсутствует [3]. Согласно данным общеевропейского регистра CARDIOTOX-2020, при сравнении с представителями общей популяции риск развития сердечно-сосудистой патологии в разы выше среди пациентов со злокачественными новообразованиями различных локализаций [4].
При ведении таких пациентов был отмечен факт того, что среди молодых пациенток с отсутствием каких-либо факторов риска развития кардиотоксичности (предложенные со стороны ESC [5]) в исходе назначения химиотерапии в режиме АС в связи с раком молочной железы при усредненных кумулятивных дозах развивается целый спектр кардиологической симптоматики. Нами подробно описаны клинические случаи развития фибрилляции предсердий (ФП) [6], липоматоза миокарда [7], микрова-скулярной стенокардии [8] и атерогенной гипердислипидемии [9].
В связи с вышеотмеченным было решено исследовать кардиотоксический и проатерогенный потенциал АС-режима химиотерапии. Нашей рабочей группой уже опубликованы данные соматометрии миокарда [10] и взаимосвязи между введением АС и развитием гипергомоци-стеинемии [11], наряду с системным обзором патогенеза антрациклиновой кардиотоксичности [12]. В настоящей статье мы затрагиваем такое звено сердечно-сосудистого континуума АС-режима химиотерапии, как гипердислипидемия. Схематическое изображение механизмов компонентов кардиотоксичности АС-режима химиотерапии изображено на авторских схемах (рис. 1).
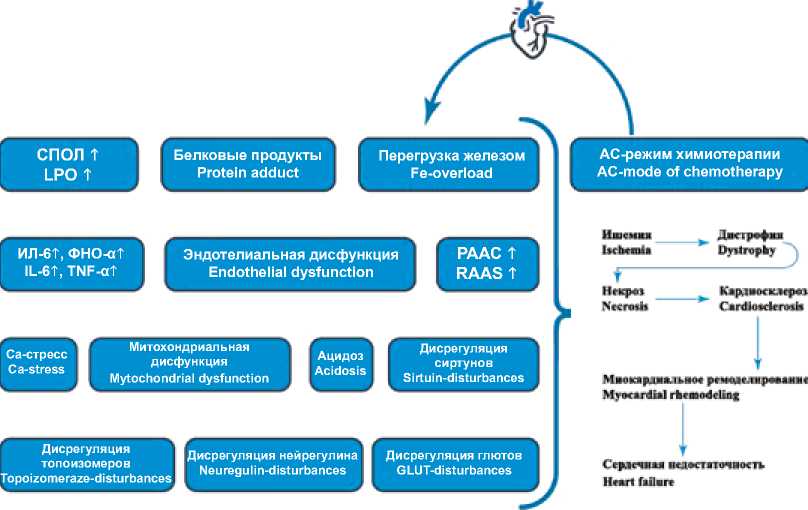
Рис. 1. Патогенетический континуум развития сердечной недостаточности, развившейся на фоне введения химиотерапии в АС-режиме Fig. 1. Pathogenetic continuum of heart failure development in the presence of chemotherapy administered in AC mode
При анализе методологии проведения аналогичных экспериментальных исследований был отмечен факт повсеместного изучения только одного химиотерапевтического препарата, в то время как в современной онкологии монотерапия, как правило, не используется [13]. В настоящем исследовании экспериментальным животным вводили полный режим химиотерапии, что делает результаты более экстраполятивными и максимально сопоставимыми с реальной клинической практикой.
В качестве модификатора химиотерапией индуцированных осложнений был выбран единственный кардиопротектор триметазидин (TMZ), признанный со стороны Российского кардиологического общества и включенный в руководство Минздрава РФ по ведению пациентов с ишемической болезнью сердца [14]. Фармакологическое действие TMZ связано с ингибированием митохондриальной 3-кетоацил-КоА-тиолаз и проявляется антиоксидантным, цитопротекторным и антигипоксическим эффектом [15].
Материал и методы
С целью проведения исследования были изучены 80 инбредных крыс линии Wistar (половозрелые самцы массой 280–300 г). Животных содержали в виварии в обычных условиях, а именно в пластиковых клетках с щепой, по 5 особей в каждой, при температуре 22– 24 °С, в условиях 12-часового светового дня, со свободным доступом к пище (стандартная диета) и воде (вволю). Исследование на экспериментальных животных проводилось в соответствии со строгими рекомендациями, изложенными в «Руководстве по уходу и использованию лабораторных животных – НПД, 2012». Все манипуляции проводились в соответствии с положениями Европейской конвенции о защите позвоночных, используемых в экспе- риментальных и других научных целях (Страсбург, 1986 г.; ред. Страсбург, 2006 г.), и с законодательством о защите животных, используемых в научных целях (Директива 2010/63/ ЕВРОПА).
В начале исследования подопытные животные методом простой рандомизации с помощью функции RAND Microsoft Excel, были распределены на 4 равные группы по 20 крыс в каждой:
Группа 1 – крысам вводили внутрибрюшинно физиологический раствор в дозе 10 мл/кг однократно 3 раза в неделю в течение 2 нед.
Группа 2 – назначенная схема химиотерапии АС, проводившаяся внутрибрюшинным введением DOX-гидрохлорида в разовой дозе 2,5 мг/кг и CY-моногидрата в разовой дозе 25 мг/кг 3 раза в неделю в течение 2 нед.
Группа 3 – применяли АС-режим химиотерапии по аналогичной схеме (DOX+ CY) с дополнительным и ежедневным внутрижелудочным введением измельченного дигидрохлорида TMZ в разовой дозе 3,0 мг/кг.
Группа 4 – крысам аналогично вводили TMZ дигидрохлорид в указанной ранее дозировке, а также физиологический раствор внутрибрюшинно по схеме группы 1 в течение 2 нед.
Дизайн составлен с учетом рекомендаций ARRIVE. Кумулятивная доза DOX составила 15 мг/кг и CY 150 мг/кг, TMZ 42 мг/кг [11]. В дни, совпадающие с введением химиопрепаратов, TMZ вводили за час до внутрибрюшинных инъекций химиопрепаратов.
За 12 ч до забора крови кормление животных прекращали. Доступ к питью был свободным. Перед забором биоматериала крыс подвергали глубокой анестезии телазолом 20 мг/кг внутримышечно (в/м) и ксиланитом 6 мг/кг в/м. После этого выполняли торакотомию с после- дующим забором крови из предсердия одноразовым стерильным шприцем на 10 мл (в среднем от каждой крысы получали 5–6 мл крови). С целью получения сыворотки 4 мл крови (от каждого животного) помещали в вакуумные пробирки объемом 4 мл с активатором свертывания (SiO2) и гелем на 30 мин, после чего центрифугировали при 2000 g при температуре +4 оС в течение 10 мин. Из каждой пробы цельной крови (4 мл) получали в среднем 2–2,3 мл сыворотки.
Полученные образцы делили на аликвоты. Сыворотку, четыре криопробирки по 1,0 мл, по 500 мкл сыворотки на каждую, хранили в морозильной камере при температуре –80 °С. Образцы повторно не замораживали. Проведение биохимических анализов осуществлялось посредством микропланшетного считывателя SpectraMax 250 (Molecular Devices).
Количественное определение концентрации общего холестерина (ОХС) в сыворотке крови проводили колориметрическим методом при помощи тест-системы Total Cholesterol Colorimetric Assay Kit (E-BC-K109-M, Elabscience Biotechnology, Китай). Диапазон измерения тест-системы – 0,29–25,85 ммоль/л. Чувствительность тест-системы – 0,29 ммоль/л.
Количественное определение концентрации триглицеридов (ТГ) в сыворотке крови проводили колориметрическим методом при помощи тест-системы Triglyceride Colorimetric Assay Kit (E-BC-K238, Elabscience Biotechnology, Китай). Диапазон измерения тест-системы – 0,001–9,04 ммоль/л.
Количественное определение концентрации липопротеинов низкой плотности (ЛПНП) в сыворотке крови проводили колориметрическим методом при помощи тест-системы Low-density Lipoprotein Cholesterol Colorimetric Assay Kit (E-BC-K205, Elabscience Biotechnology, Китай). Диапазон измерения тест-системы – 0,20–12,0 ммоль/л.
Количественное определение концентрации липопротеинов высокой плотности (ЛПВП) в сыворотке крови про- водили колориметрическим методом при помощи тест-системы High-density Lipoprotein Cholesterol Colorimetric Assay Kit (E-BC-K109-M, Elabscience Biotechnology, Китай). Диапазон измерения тест-системы – 0,065–3,80 ммоль/л.
Предварительно перед определением коэффициента атерогенности (КА) и индекса коронарного риска (ИКР) проводили пересчет результатов ЛПНП, ЛПВП и ОХС из ммоль/л в мг/дл. КА рассчитывали как отношение ЛПНП к ЛПВП (мг/дл). ИКР рассчитывали как отношение ОХС к ЛПВП (мг/дл).
Проведенное исследование характеризуется как фундаментальное, рандомизированное, контролируемое, экспериментальное in vivo . Статистический анализ был проведен с помощью программного обеспечения GraphPadPrism 7 (GraphPad Company, США) и STATISTICA 13 (StatSoft Inc, США). Все полученные результаты представлены в виде средних значений ( M ) ± стандартное отклонение среднего ( SD ). С целью оценки статистической значимости межгрупповых различий при сравнении трех и более групп по исследуемому показателю применяли однофакторный дисперсионный анализ (one-way ANOVA), определением F – критерия и последующим апостериорным тестом Тьюки с использованием SPSS 22. Уровнем статистической значимости, при котором принималась альтернативная гипотеза, во всех случаях считали p < 0,05.
Результаты
Спустя 2 нед. от начала AC-режима химиотерапии в сыворотке крови крыс зарегистрированы статистически значимые межгрупповые различия со стороны таких показателей липидограммы, как ОХС, ТГ, ХС-ЛПНП, ХС-ЛП-ВП, КА и ИКР (one-way ANOVA, p < 0,0001) (таблица). В ходе проведения попарных сравнений между группами 1 (контроль) и № 4 (TMZ) по уровню исследуемых показателей липидограммы статистически значимых различий не выявлено (post-hoc тест Тьюки, p > 0,05).
Таблица. Характеристика влияния триметазидина на показатели липидограммы спустя 2 недели от начала AC-режима химиотерапии
Table. Characteristics of trimetazidine impact on the lipid profile parameters two weeks after beginning the chemotherapy administered in AC mode
|
Показатели Parameters |
Группа 1 Group 1 |
Группа 2 Group 2 |
Группа 3 Group 3 |
Группа 4 Group 4 |
Тест Тьюки Tukey’s test |
|
ОХС, ммоль/л Ch mmol/L F = 101,80 p < 0,0001 |
2,02 ± 0,47 |
4,73 ± 0,92 |
3,62 ± 0,44 |
2,01 ± 0,35 |
p 1-2 = 0,0001 p 1-3 = 0,0001 p 1-4 = 0,9999 p 2-3 = 0,0001 p 2-4 = 0,0001 p 3-4 = 0,0001 |
|
ТГ, ммоль/л TG, mmol/L F = 65,12 p < 0,0001 |
0,69 ± 0,16 |
1,62 ± 0,29 |
1,01 ± 0,30 |
0,63 ± 0,23 |
p 1-2 = 0,0001 p 1-3 = 0,0008 p 1-4 = 0,8742 p 2-3 = 0,0001 p 2-4 = 0,0001 p 3-4 = 0,0001 |
|
ЛПНП, ммоль/л LDL, mmol/L F = 255,00 p < 0,0001 |
0,34 ± 0,11 |
2,34 ± 0,47 |
1,59 ± 0,28 |
0,27 ± 0,08 |
p 1-2 = 0,0001 p 1-3 = 0,0001 p 1-4 = 0,8609 p 2-3 = 0,0001 p 2-4 = 0,0001 p 3-4 = 0,0001 |
|
ЛПВП, ммоль/л HDL, mmol/L F = 23,06 p < 0,0001 |
1,45 ± 0,24 |
0,90 ± 0,17 |
1,08 ± 0,25 |
1,40 ± 0,30 |
p 1-2 = 0,0001 p 1-3 = 0,0001 p 1-4 = 0,9163 p 2-3 = 0,1005 p 2-4 = 0,0001 p 3-4 = 0,0005 |
Обсуждение
Наиболее выраженные по отношению к группе 1 (контроль) и группе 4 (TMZ) отклонения показателей липидного профиля крови выявлены на фоне изолированного применения АС-режима химиотерапии (post-hoc тест Тьюки, p < 0,05).
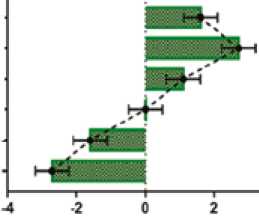
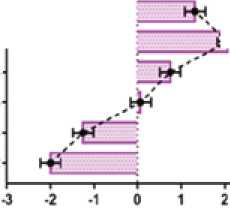
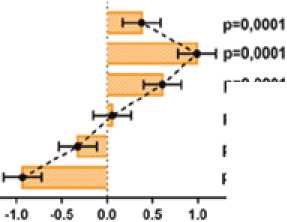
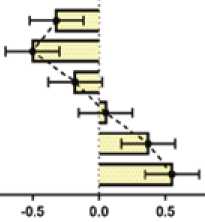
В группе 2 концентрация ОХС выше на 80,3 и 80,7%, ТГ выше на 80,5 и 88,0%, ЛПНП выше на 149,3 и 158,6%, ЛПВП ниже на 46,8 и 43,5%, КА выше на 187,4 и 172,8%, ИКР выше на 115,8 и 113,9%, чем в группах 1 и 4 соответственно (рис. 2).
В группе 3 применение TMZ на фоне АС-режима химиотерапии сопровождалось отчетливой тенденцией к нормализации показателей липидного обмена. В ходе сравнения групп 3 и 2 отмечено, что применение TMZ ассоциировано со снижением концентрации ОХС на 26,6%, ТГ на 46,4%, ЛПНП на 38,2%, с ростом ЛПВП на 18,2%, а также снижением КА на 55,5% и ИКР на 44,2% (post-hoc тест Тьюки, p < 0,05).
Полученные результаты КА < 0,5 у.е. и ИКР < 2 у.е. указывают на нормальное состояние липидного обмена у крыс: как в контроле, так и на фоне применения TMZ. О тяжести дислипидемии в группе 2 можно судить по росту КА в 5,2 раза и ИКР в 2,6 раза по отношению к верхней границе нормы данных показателей у крыс (рис. 3).
TC 3 • TC4
TC 2 • TC 4-
TC 2. TC 3-
TC 1 - TC 4-
TC 1 - TC 3-I
TC 1 • TC 2
p-0,0001
p-0.0001
p=0 9999
p-0,0001
p-0,0001
Difference between group means mmol/L
LDL 3 • LOL 4
LOL 2 • LOL 4
LDL 2 - LDL 3-
LDL 1 - LDL 4
LDL1•LDL 3
LDL1 • LDL 2
p-0.0001
p-0,0001
p-0,8609
p-0,0001
p-0,0001
Difference between group means mmol/L
Йн P-O.0OC1
TC 3 • TG 4-
TG2-TG4-
TG 2 - TG 3-
TG 1 • TG 4-
TG 1 - TG 3-
TG 1 • TG 2-
p-0.0001
p-O,8742
p-0.0008
p-0,0001
•1.S 1.5
Difference between group means mmol/L
HDL2•HOL 4
HDL 3 - HDL 4-
HDL 2 - HDL 3-
HOL 1 • HOL 4-
HDL 1 - HDL 3-
HOL 1 - HOL 2-
-1.0
p=0.0005
p-0,0001
p=0,1005
p-0.9163
p-0,0001
p=0,0001
1.0
Difference between group means mmol/L
Рис. 2. Межгрупповые различия в концентрации параметров липидограммы: ОХС, ТГ, ЛПНП и ЛПВП через 2 недели от начала AC-режима химиотерапии (разница средних, ± 95% ДИ, one-way ANOVA, post-hoc тест Тьюки)
Fig. 2. Intergroup differences in the concentrations of lipid profile parameters: total cholesterol, triglycerides, LDL, and HDL two weeks after beginning the AC chemotherapy regimen (mean difference, ± 95% CI, one-way ANOVA, Tukey’s post-hoc test)

Рис. 3. Межгрупповые различия коэффициента атерогенеза и индекса коронарного риска через 2 недели от начала AC-режима химиотерапии (разница средних, ± 95 % ДИ, one-way ANOVA, post-hoc тест Тьюки)
Fig. 3. Intergroup differences in the atherogenesis ratio and coronary risk index two weeks after beginning the AC chemotherapy regimen (mean difference, ± 95% CI, one-way ANOVA, post-hoc Tukey test)
Примечательно, что при поиске аналогичных изданий в библиотеке Ереванского государственного медицинского университета им. М. Гераци, а также при анализе данных, представленных в системе Scopus, PubMed, Eliblary, аналогичных работ не зафиксировано. Следовательно, методология проведения эксперимента, наряду с полученными данными, является принципиально актуальной и оригинальной. По сути, обнаружено новое плейотроп-ное воздействие триметазидина.
При всестороннем изучении метаболизма холестерина, а также фармакодинамики и фармакокинетики используемых лекарственных средств нами был предложен ряд гипотез:
-
1. Можно предположить, что триметазидин, помимо митохондриальной 3-кетоацил-КоА-тиолазы [16], ингибирует ацетоацетил-КоА-тиолазу мевалонового пути синтеза холестерина, несколько ограничивая биосинтез последнего.
-
2. Доксорубицин вызывает воспаление и эндотелиальную дисфункцию [17]. Основываясь на воспалительной теории атерогенеза проведены клинические исследования эффективности применения
Список литературы Триметазидин как модификатор доксорубицинциклофосфамидной гипердислипидемии
- Meilhac A., Cautela J., Thuny F. Cancer therapies and vascular toxicities. Curr. Treat. Options Oncol. 2022;23(3):333-347. https://doi.org/10.1007/s11864-022-00964-2.
- Briasoulis A., Chasouraki A., Sianis A., Panagiotou N., Kourek C., Ntalianis A. et al. Cardiotoxicity of non-anthracycline cancer chemotherapy agents. J. Cardiovasc. Dev. Dis. 2022;9(3):66. https://doi.org/10.3390/jcdd9030066.
- Brickler M., Raskin A., Ryan T.D. Current State of Pediatric Cardio-Oncology: A Review. Children (Basel). 2022;9(2):127. https://doi.org/10.3390/children9020127.
- López-Sendón J., Álvarez-Ortega C., Zamora Auñon P., Buño Soto A., Lyon A.R., Farmakis D. et al. Classification, prevalence, and outcomes of anticancer therapy-induced cardiotoxicity: the CARDIOTOX registry. Eur. Heart J. 2020;41(18):1720-1729. https://doi.org/10.1093/eurheartj/ehaa006.
- Zamorano J.L., Lancellotti P., Rodriguez Muñoz D., Aboyans V., Asteggiano R., Galderisi M. et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur. J. Heart Fail. 2017;19(1):9-42. https://doi.org/10.1002/ejhf.654.
- Авагамян А.А., Мкртчян Л.., Геворкян А.А., Конончук Н.Б., Кактурский Л.В., Джндоян З.Т. Взаимосвязь между химиотерапией и фибрилляцией предсердий. Рациональная Фармакотерапия в Кардиологии. 2021;17(5):785-791. https://doi.org/10.20996/1819-6446-2021-10-17.
- Авагимян А.А., Мкртчян Л.Г., Конончук Н.Б., Кактурский Л.В., Агати Л. Химиотерапия как возможный триггер развития липоматоза миокарда. Артериальная гипертензия. 2021;27(6):706-712. https://doi.org/10.18705/1607-419X-2021-27-6-706-712.
- Avagimyan A., Mkrtchyan L., Abrahomovich O., Sheibani M., Guevorkyan A., Sarrafzadegan N. et al. AC-Mode of Chemotherapy as a Trigger of Cardiac Syndrome X: A Case Study. Curr. Probl. Cardiol. 2021;100994. https://doi.org/10.1016/j.cpcardiol.2021.100994.
- Avagimyan A., Mkrtchyan L. Cardiotoxicity of Chemotherapeutic Drugs (Literature Review and Clinical Case Description). Lviv Clinical Bulletin. 2019;4(28):56-62. https://doi.org/10.25040/lkv2019.04.051.
- Avagimyan A, Kakturskiy L. The impact of trimetazidine on the anthropometric parameters of doxorubicin-cyclophosphamide mode in chemotherapy-induced heart alteration. Georgian Med. News. 2022;(322):158-161.
- Avagimyan A. Hyperhomocysteinemia as a link of chemotherapy-related endothelium impairment. Curr. Probl. Cardiol. 2021;100932. https://doi.org/10.1016/j.cpcardiol.2021.100932.
- Avagimyan A., Kakturskiy L., Heshmat-Ghahdarijani K., Pogosova N., Sarrafzadegan N. Anthracycline associated disturbances of cardiovascular homeostasis. Curr. Probl. Cardiol. 2021;47(5):100909. https://doi.org/10.1016/j.cpcardiol.2021.100909.
- Hu C., Zhang X., Song P., Yuan Y.P., Kong C.Y., Wu H.M. et al. Meteorin-like protein attenuates doxorubicin-induced cardiotoxicity via activating cAMP/PKA/SIRT1 pathway. Redox Biol. 2020;37:101747. https://doi.org/10.1016/j.redox.2020.101747.
- Стабильная ишемическая болезнь сердца. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):40-76. https://doi.org/10.15829/1560-4071-2020-4076.
- Кочеткова И.В., Черных Т.М., Панюшкина Г.М. Опыт применения триетазидина у пациентов с коморбидной патологией. Российский кардиологический журнал. 2018;(3):37-42. https://doi.org/10.15829/1560-4071-2018-3-37-42.
- Mahajan S., Mahajan A.U. Current clinical evidence of trimetazidine in the management of heart disease in patients with diabetes. J. Assoc. Physicians India. 2020;68(11):46-50.
- Libby P. Inflammation in atherosclerosis-no longer a theory. Clin. Chem. 2021;67(1):131-142. https://doi.org/10.1093/clinchem/hvaa275.
- Zhang Y., Li C., Li X., Wu C., Zhou H., Lu S. et al. Trimetazidine improves hepatic lipogenesis and steatosis in nonalcoholic fatty liver disease via AMPKChREBP pathway. Mol. Med. Rep. 2020;22(3):2174-2182. https://doi.org/10.3892/mmr.2020.11309.
- Prasanna P.L., Renu K., Valsala Gopalakrishnan A. New molecular and biochemical insights of doxorubicin-induced hepatotoxicity. Life Sci. 2020;250:117599. https://doi.org/10.1016/j.lfs.2020.117599.
- Iqubal A., Iqubal M.K., Sharma S., Ansari M.A., Najmi A.K., Ali S.M. et al. Molecular mechanism involved in cyclophosphamide-induced cardiotoxicity: Old drug with a new vision. Life Sci. 2019;218(1):112-131. https://doi.org/10.1016/j.lfs.2018.12.018.


