Тройной негативный рак молочной железы: современное состояние проблемы и не совсем обычный случай лечения
Автор: Муфазалов Фагим Фанисович, Шарипова Наиля Саматовна
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Диагностика и лечение опухолей. Состояние проблемы
Статья в выпуске: 1 (8), 2014 года.
Бесплатный доступ
В статье представлен обзор литературных данных о клинических исследованиях, посвященных лечению тройного негативного рака молочной железы (ТНРМЖ), рассматривается активность существующих таргетных и химиопрепаратов. Описан не совсем обычный случай клинического течения и лечения ТНРМЖ.
Тройной негативный рак молочной железы, клинический случай
Короткий адрес: https://sciup.org/14045469
IDR: 14045469
Текст научной статьи Тройной негативный рак молочной железы: современное состояние проблемы и не совсем обычный случай лечения
На сегодняшний день вполне устоявшимся является представление об обязательности назначения химиотерапии при лечении ТНРМЖ [1]. Однако очень сложные и противоречивые вопросы лечения этой тяжелой категории больных еще далеки от своего окончательного решения [2]. Надо признать, что ТНРМЖ сейчас является самой неблагоприятной прогностической формой заболевания, так как даже при HER-2-положительном раке молочной железы (РМЖ) все же имеется мишень воздействия [3]. Лечение «иммуногистохимического» ТНРМЖ цитотоксическими препаратами давало смешанные результаты и имело переменное влияние на отдаленный прогноз, что и стало убедительным доказательством того, что ТНР-МЖ неоднороден [4].
Еще в 2011 г. Lehmann и его коллеги путем анализа комплексной экспрессии генов структуры ТНРМЖ выделили следующие его подтипы: базальноподобный 1 и 2 типа (BL1; BL2),
иммуномодуляторный (IM), мезенхимальный (M), мезенхимальноподобный (MSL), протоковый андроген-рецепторный (LAR) [5]. Таким образом, было найдено множество молекулярных точек приложения для конкретного терапевтического агента и проведено немало исследований, тестировавших соответствующие препараты. В настоящее время доступны данные подгрупповых анализов для ТНРМЖ этих исследований.
Что показали эти исследования?
Была изучена частота полного патологического ответа (pCR) при проведении таксан-содержащей химиотерапии [5]. Оказалось, что при базальноподобных подтипах (БПРМЖ) она составляет более 60%, при мезенхимальных подтипах — в половину меньше и совсем низкая при андроген-рецепторных формах (рис. 1).
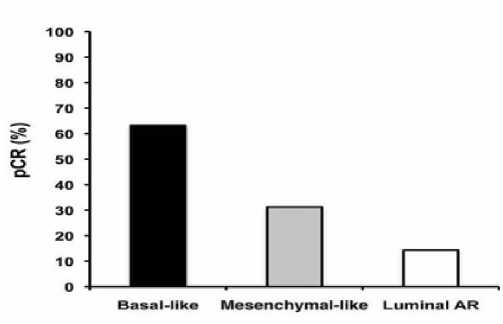
Рис. 1. Эффективность таксансодержащей химиотерапии при ТНРМЖ
(по Lehmann et al. / JCI, 2011)
Basal-like
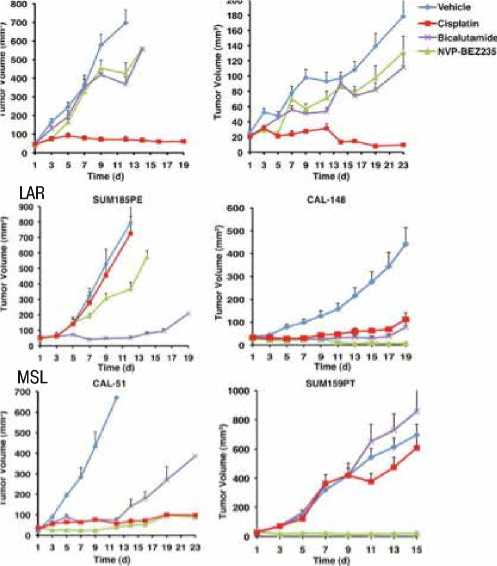
Рис. 2. Чувствительность клеточных линий ТНРМЖ (по Lehmann et al. / JCI, 2012)
На клеточных линиях (рис. 2) было показано, что при БПРМЖ эффективен цисплатин, при мезенхимальноподобном ТНРМЖ — ингибиторы m-TOR, а при LAR — ингибиторы андрогеновых рецепторов — бикалутамид.
Возможная чувствительность ТНРМЖ к препаратам платины и PARP-ингибиторам в рандомизированных клинических исследованиях была обоснована тем, что BRCA1/2 гер-миногенные и соматические мутации, вызывающие геномную нестабильность и нарушение репарации ДНК, в общей группе ТНРМЖ встречаются в 20% случаев [6].
По данным Byrski T. (2009 г.), неоадъювантное лечение 25 больных с истинными BRCA мутациями 4 циклами цисплатина в монорежиме дали частоту полного патологического ответа (pCR), равную 72% случаев, но при проведении такого же режима в общей группе ТНРМЖ pCR составила только 22% [7].
Результаты монотерапии метастатического ТНРМЖ платиносодержащими препаратами были незначительными. Двух- и трехкомпонентная терапия была более эффективна, и три рандомизированных исследования описали преимущества этих комбинаций.
В рандомизированном исследовании II фазы второй линии при распространенном ТНРМЖ [8] (табл. 1) добавление цисплатина к метро-номной схеме метотрексата с циклофосфамидом привело к увеличению медианы времени до прогрессирования на 6 месяцев (с 7 до 13 месяцев) и общей выживаемости на 4 месяца (с 12 до 16 месяцев). Профиль токсичности был управляемым. Результаты, хотя и казались перспективными, были ограничены незначительными единичными институциональными условиями.
Другое исследование II фазы [9] (табл. 1) продемонстрировалo повышение общей частоты ответа (17% против 6%) при добавлении карбоплатина в монотерапию цетуксимабом в группах пациентов с ранее леченным распространенным ТНРМЖ, но результаты выживаемости без прогрессирования и общей выживаемости находятся на рассмотрении.
В третьем исследовании II фазы [10] было продемонстрировано, что добавление препаратов платины к антрациклин- и /или таксан-содержащей химиотерапии в неоадъювантном режиме дает многообещающие результаты
Тройной негативный рак молочной железы: современное состояние проблемы и не совсем обычный случай лечения
Таблица 1. Показатели выживаемости больных ТНРМЖ при платиносодержащей ПХТ
|
Исследования при распространенном ТНРМЖ, 1 линия |
Общая частота ответа, % |
Медиана выживаемости без прогрессирования, месяцы |
Медиана общей выживаемости, месяцы |
|
Bhattacharrya |
– |
– |
– |
|
Метотрексат+Циклофосфамид+Цисплатин |
62 |
13 |
16 |
|
Метотрексат +Циклофосфамид |
33 |
7 |
12 |
|
TBCRC 001 |
– |
– |
– |
|
Карбоплатин+Цетуксимаб |
17 |
2 |
– |
|
Карбоплатин |
6 |
8 |
– |
Таблица 2. Результаты применения инипариба в лечении ТНРМЖ
В качестве ингибиторов PARP был изучен инипариб. Результаты II фазы рандомизированного исследования инипариба с гемцитабином и карбоплатином [11] (табл. 2) заключались в снижении риска прогрессирования на 41% (медиана выживаемости без прогрессирования составила 5,9 месяца против 3,6) и снижении риска смерти (медиана общей выживаемости — 12,3 месяца против 7,7).
Результаты многоцентрового исследования III фазы [12], оценивающего ту же самую комбинацию инипариба при распространенном ТНРМЖ, не подтвердили ее эффективности: выживаемость без прогрессирования составила 4,1 по сравнению с 5,1 месяца и общая выживаемость — 11,1 по сравнению с 11,8 месяца (табл. 2).
Внутриопухолевая экспрессия VEGF намного выше при TНРМЖ, чем при не ТНРМЖ [13], что обеспечивает биологическую обоснованность применения ингибиторов ангиогенеза д ля лечения больных ТНРМЖ.
Три исследования лечения метастатического рака в первой линии оценили добавление к химиотерапии бевацизумаба — моноклонального антитела, специфичного для VEGF.
Ретроспективный анализ подгрупп ТНР-МЖ (E2100-исследование) показал, что добав-
Таблица 3. Результаты применения бевацизумаба в лечении ТНРМЖ
С целью определения эффективности бева-цизумаба в комбинации с химиотерапией во II линии терапии метастатического РМЖ было инициировано исследование RIBBON-2 — исследование III фазы [15]. По его результатам, добавление бевацизумаба ко II линии химиотерапии позволило значимо увеличить медиану времени до прогрессирования, причем независимо от режима химиотерапии (табл. 4).
Два клинических испытания оценили бе-вацизумаб в неоадъювантном режиме [16, 17]. В обоих исследованиях — GeparQuinto и NSABP-B40 — бевацизумаб комбинировали с неоадъювантной антрациклин-таксановой химиотерапией у HER2-отрицательных пациентов. В результате у пациентов, получавших бевацизумаб, наблюдалось общее улучшение патологического полного ответа в сравнении с теми, кто получал только химиотерапию (GeparQuinto — 18,4% против 14,9%, р=0,04; NSABP-40–34,5% против 28,4%, р=0,027) (табл. 5).
Анализ заранее определенной подгруппы пациентов TНРМЖ (N=663) в исследовании GeparQuinto выявил статистически значимое улучшение патологического полного ответа (39,3% против 27,9%, р=0,003) у пациентов, получавших бевацизумаб, по сравнению с теми, кто получал химиотерапию [16]. В противоположность этому, исследование NSABP-B40
Тройной негативный рак молочной железы: современное состояние проблемы и не совсем обычный случай лечения
Таблица 4. Результаты применения бевацизумаба в лечении ТНРМЖ
|
RiBBOn-2 |
химиотерапия+ бевацизумаб (N=112) |
химиотерапия+плацебо (N=47) |
p |
|
Непосредственная эффективность, % |
41 |
18 |
0,0078 |
|
1-годичная выживаемость, % |
63 |
50 |
|
|
Медиана времени до прогрессирования, месяцы |
6,0 |
2,7 |
0,0006 |
|
Общая выживаемость, месяцы |
17,9 |
12,6 |
0,0534 |
Таблица 5. Результаты применения бевацизумаба в неоадъювантном режиме
Исследование BEATRICE III фазы (сравнение стандартной адъювантной химиотерапии с/без бевацизумаба) показало, что добавление бевацизумаба к адъювантной химиотерапии не улучшает результаты лечения больных тройным негативным раком молочной железы (табл. 6). 3-летняя безрецидивная выживаемость составила в группе химиотерапии 82,7% и 83,7% в группе химиотерапия+бевацизумаб (HR=0,87, p=0,18). Характер прогрессирования не отличался в обеих группах. Частота побочных эффектов 3–4 степени составила 57% в группе химиотерапии и 72% в группе химио-терапия+бевацизумаб [18].
Рецепторы тирозинкиназы на клеточной мембране, включая VEGF рецепторы, имеют решающее значение для ангиогенеза. Было оценено действие двух ингибиторов тирозин-киназ на пролиферацию эндотелиальных клеток при ТНРМЖ. Ни в монотерапии, ни в комбинации с капецитабином или доцетакселом не было выявлено преимуществ сунитиниба по сравнению с контрольной группой [19, 20, 21].
Сорафениб продемонстрировал скромный результат в монотерапии [20, 21]. Однако три рандомизированных двойных слепых плацебо-контролируемых исследования IIb фазы продемонстрировали улучшенные общие результаты для комбинаций сорафениба с химиотерапией в первой и во второй линиях лечения метастатического ТНРМЖ [24, 25].
Анализ результатов в заранее определенных подгруппах пациентов ТНРМЖ в исследовании SOLTI-0701 показал улучшение почти на два месяца в медиане выживаемости без прогрессирования при добавлении сорафениба к капецитабину (4,3 против 2,5 месяца) и тенденцию к улучшению выживаемости без
Таблица 6. Результаты применения сорафениба при распространенном ТНРМЖ
|
Исследования |
Медиана выживаемости без прогрессирования, месяцы |
Общая выживаемость, месяцы |
|
SOLTI-0701(N=53) Сорафениб+Капецитабин Капецитабин |
4,3 HR=0,596 p=0,3-1,1 2.5 |
17,5 16,1 |
|
AC01B07(N=50) Сорафениб+Гемцитабин+Капецитабин Плацебо+ Гемцитабин+Капецитабин |
3,1 HR=0,57 p=0,30–1,09 2,6 |
Таблица 7. Результаты применения цетуксимаба при распространенном ТНРМЖ
Ингибиторы EGFR были вовлечены в качестве таргетной терапии TНРМЖ на основе частой экспрессии EGFR при иммуногистохимическом анализе тройной негативной опухоли (27% –57%) [26, 27].
Цетуксимаб продемонстрировал хорошие результаты в двух проспективных и в одном ретроспективном анализе рандомизированных исследований II фазы при распространенном ТНРМЖ. Самое большое исследование BALI-1 проспективно оценило добавление цетуксимаба к цисплатину при первой и второй линии лечения ТНРМЖ (табл. 7) [28]. Сочетание было безопасным, с минимальным повышением токсичности в виде угревой сыпи и значительным повышением медианы выживаемости без прогрессирования по сравнению с применением только цисплатина. Однако данному режиму не удалось улучшить общую выживаемость и выживаемость без прогрессирования (табл. 7). Добавление цетуксимаба к иринотекану и карбоплатину в первой и второй линиях лечения пациентов с метастатическим РМЖ в исследовании USOR04–070 привело к улучшению частоты ответа среди подгрупп пациентов ТНРМЖ: общий ответ составил 49% против 30%. Тем не менее, не было очевидных улучшений ни в выживаемости без прогрессирования ни в общей выживаемости (табл. 7) [29]. В исследовании TBCRC [7] цетуксимаб был добавлен к карбоплатину в группе предварительно леченных пациентов ТНРМЖ. Общая частота ответа составила 17%, повысилась выживаемость без прогрессирования (8 против 2 месяцев) по сравнению с общей исследуемой популяцией. Результаты общей выживаемости находятся на рассмотрении.
Тройной негативный рак молочной железы: современное состояние проблемы и не совсем обычный случай лечения
Следующее рандомизированное исследование II фазы оценило сочетание эрлотиниба с карбоплатином и доцетакселом в неоадъювантном режиме и продемонстрировало перспективную активность с минимально повышенной токсичностью и патологическим полным ответом 40% [30].
Ретроспективные данные из двух рандомизированных исследований II фазы продемонстрировали скромный ответ гефитиниба в сочетании со стандартной неоадъювантной химиотерапией и отсутствие активности ла-патиниба в комбинации с паклитакселом при распространенном ТНРМЖ [31, 32].
Доклинические исследования показали, что активированный mTOR или абберантный фосфатидилинозитол-3-киназный путь повышают чувствительность к ингибиторам mTOR [33, 34], к таким, как эверолимус, и нарушают эпителиально-мезенхимальный переход [5]. Хотя начальные клинические результаты исследования эверолимуса и паклитаксела были обнадеживающими [35, 37], рандомизированное исследование II фазы неоадъювантного лечения базальноподобного РМЖ показало, что комбинация эверолимуса со стандартной химиотерапией значительно не улучшила патологический полный ответ [37].
Стартовавшее в августе 2013 г. исследование II фазы (NCT0193116) еще определит роль эверолимуса при лечении ТНРМЖ. Данное исследование предусматривает проведение химиотерапии в режиме: цисплатин 20 мг/м2 один раз в неделю (1, 8, 15 дни) и 4 цикла эве-ролимуса по 10 мг внутрь ежедневно — больным с остаточной опухолью после стандартной химиотерапии. Первичным критерием оценки будет являться ответ опухоли до химиотерапии и каждые 6 недель с начала лечения до прогрессирования заболевания.
Проведенные на сегодняшний день рандомизированные исследования позволяют сделать ряд выводов .
-
1. Результаты исследований таргетных препаратов в чистом виде и в комбинации с химиопрепаратами, несмотря на биологическую обоснованность их применения во многих случаях, в целом не оправдали ожиданий, хотя продемонстрировали некоторое увеличение показателей выживаемости без прогрессирования и общей выживаемости.
-
2. При применении бевацизумаба у больных ТНРМЖ наиболее выраженным эффект был во второй линии и в неоа дъювантном лечении . Однако прирост показателя выживаемости без прогрессирования остается незначительным (объединенные данные первой линии — 2,7 месяца, второй линии — 3,3 месяца).
-
3. Результаты исследований для EGFR и mTOR ингибиторов оказались ничем не примечательными.
-
4. Хотя начальные приросты показателей выживаемости без прогрессирования и общей выживаемости для комбинаций химиотерапии с PARP ингибиторами были многообещающими (3,6 и 3,5 месяца), но результаты III фазы были разочаровывающими.
-
5. Клеточные культуры выявленных подтипов ТНРМЖ продемонстрировали ключевые механизмы прогрессии этих подтипов опухолей, повышенную чувствительность к агентам, направленным на подтип-спец-ифичные канонические пути, в том числе избирательный ответ BL1 и BL2 подтипов на цисплатин и повышенную восприимчивость эпителиально-мезенхимальных подтипов к ингибиторам mTOR , LAR подтипов — к бикалутамиду .
-
6. Препараты платины при ТНРМЖ наиболее эффективны при истинных наследственных мутациях BRCA1.
-
7. Оптимальный химиотерапевтический режим не определен. Целесообразно использование режимов химиотерапии с включением антрациклинов и таксанов.
В повседневной практике мы все чаще сталкиваемся с очень непростыми задачами определения тактики лечения пациентов с ТНРМЖ. Несмотря на то, что уже имеются определенные знания о характере течения заболевания, выработаны условные стандарты лечения, ряд вопросов по-прежнему не имеет однозначного ответа. Например, всегда ли нужно проводить адъювантную химиотерапию пациентам с ТНРМЖ или насколько «ранним» и «специфичным» является метастазирование при ТНРМЖ? Под наше наблюдение все чаще попадают случаи ТНРМЖ с несколько нетипичными клиническими проявлениями, что предполагает создание новой методологии лечения.
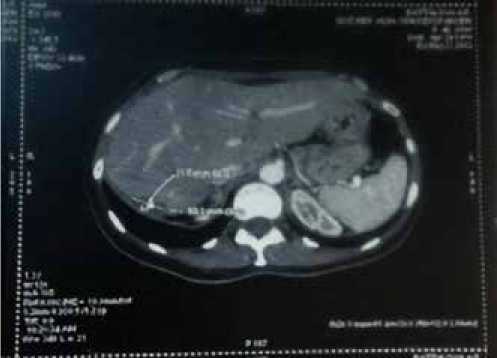
Рис. 3. Компьютерная томография органов брюшной полости пациентки Б.А.Ф. от 29.03.12
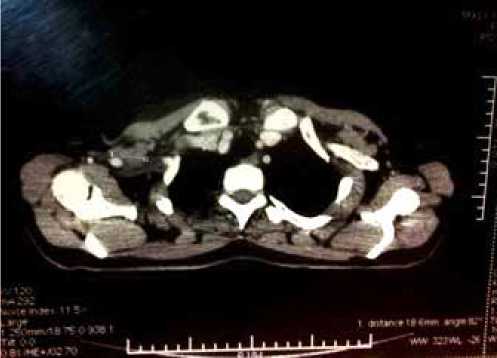
а)
Рис. 4. Компьютерная томография органов грудной клетки (а), позитронно-эмиссионная томография всего тела (б) пациентки Б.А.Ф. от 23.05.12
б)
Расскажем подробнее на одном из таких клинических наблюдений.
Пациентка Б. А.Ф., 44 лет, с диагнозом: рак правой молочной железы pT1сN0M0 (диаметр опухоли — 2,0 см). Морфологически — железисто-солидный рак, иммуногистохимически — тройной негативный, Ki-67–60%.
Базальные маркеры — цитокератины, ви-ментин, EGFR, с-kit — не определены, андроге-новые рецепторы не обнаружены.
BRCA1 мутации (5382insC, 4153delA, 185delAG) не обнаружены.
Онкологический анамнез отягощен: у матери и у четырех двоюродных сестер по материнской линии — рак молочной железы и/ или яичников, у двух сестер заболевание возникло в возрасте до 50 лет.
Анамнез заболевания: пациентка с 2000 г. проходила тщательный скрининг на РМЖ. Опухоль была выявлена при профилактическом осмотре в 2007 г. Тогда же проведена радикальная резекция правой молочной железы с последующей дистанционной лучевой терапией правой молочной железы с бустом ложа опухоли (СОД=50/60Гр). Пациентка никакого другого противоопухолевого лечения не получала, далее наблюдалась в течение 5 лет, рецидива и метастазов не было.
В марте 2012 г., по данным КТ ОБП, выявлены метастазы в печень — в правой доле в S6–15х30мм, в S5–18х17мм (рис. 3). Проведено оперативное лечение — сегментарная резекция правой доли печени, с морфологической верификацией процесса — метастазы протоковой карциномы молочной железы в печень.
В мае 2012 г. больной проводится ПЭТ и КТ-исследование всего тела, МРТ головного мозга, по результатам которых выявлены метастазы в подмышечные лимфоузлы с обеих сторон, подключичные лимфоузлы справа (рис. 4).
Проведена дистанционная лучевая терапия пораженных лимфоузлов и 6 курсов полихимиотерапии по схеме: паклитаксел 135мг/ м2 и доксорубицин 60 мг/м2 в 1 и 22 дни с достижением полного ответа. По данным контрольных КТ ОБП, ОГК, МРТ головного мозга в динамике, метастазы не выявлены.
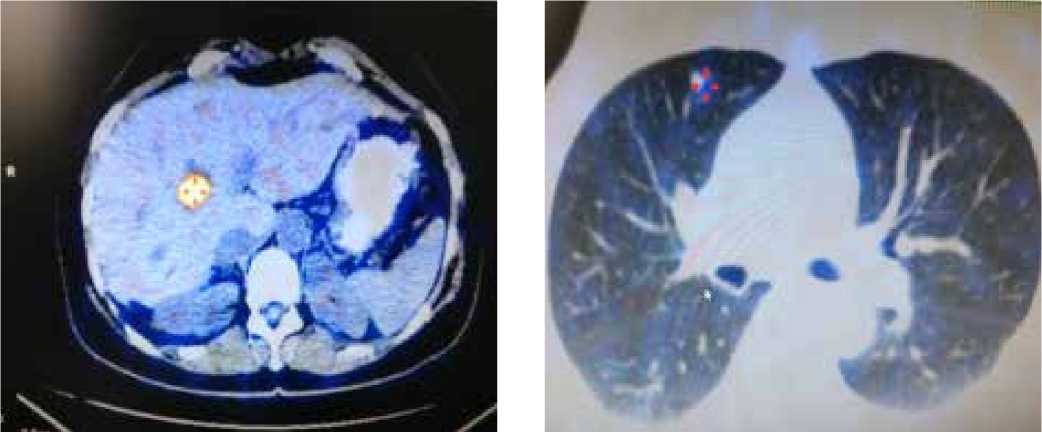
Через год, в мае 2013 г., по данным ПЭТ/ КТ, выявлены новые очаги в правой доле печени — в S8–18 х17мм, в правом легком единичный очаг до 7 мм; в левом легком визуали-
Тройной негативный рак молочной железы: современное состояние проблемы и не совсем обычный случай лечения
а) б)
Рис. 5. Позитронно-эмиссионная и компьютерная томография печени (а), легких (б) пациентки Б.А.Ф. от 12.05.2013
Рис. 6. Позитронно-эмиссионная и компьютерная томография печени (а), легких (б) пациентки Б.А.Ф. от 12.05.2013
а)
б)
зируются единичные очаги очень маленьких размеров, не накапливающие радиофармпрепарат (рис. 5).
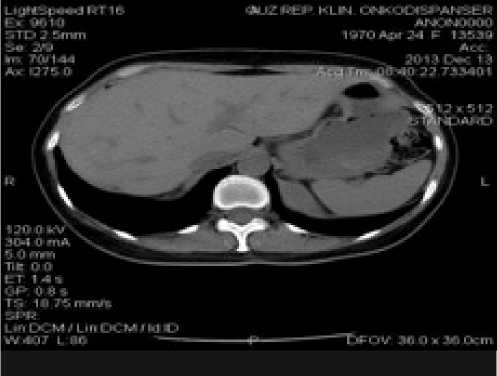
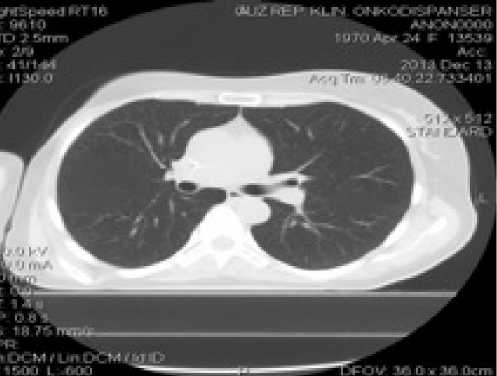
С мая по октябрь 2013 г. проводится 9 курсов полихимиотерапии по схеме: гемцитабин 1600 мг + карбоплатин 250 мг внутривенно в 1 и 8 дни 21-дневного цикла. После 3-х курсов, по данным КТ ОБП, ОГК (рис.6), визуализировался хороший ответ на проводимое лечение в виде уменьшения очагов в печени до 6х6мм и в легких справа до 3х3мм. Несмотря на посто- янную поддержку колониестимулирующими факторами, девятый курс полихимиотерапии привел к некупируемой тромбоцито- и лейкопении, и дальнейшая химиотерапия была приостановлена (по плану лечения 20/12/13 должен был начаться 10 курс, но при всем том, что с 6 по 20 декабря через день вводился нейпоген (в дозе 3 млн) лейкоциты не поднимались выше 1,8х109/л). По данным КТ, в октябре и декабре 2013 г. продолжал персистировать метастаз в печени, не имевший тенденции к уменьше-
а)
б)
Рис. 7. Компьютерная томография органов брюшной полости (а), органов грудной клетки (б) пациентки Б.А.Ф. от 13.12.2013
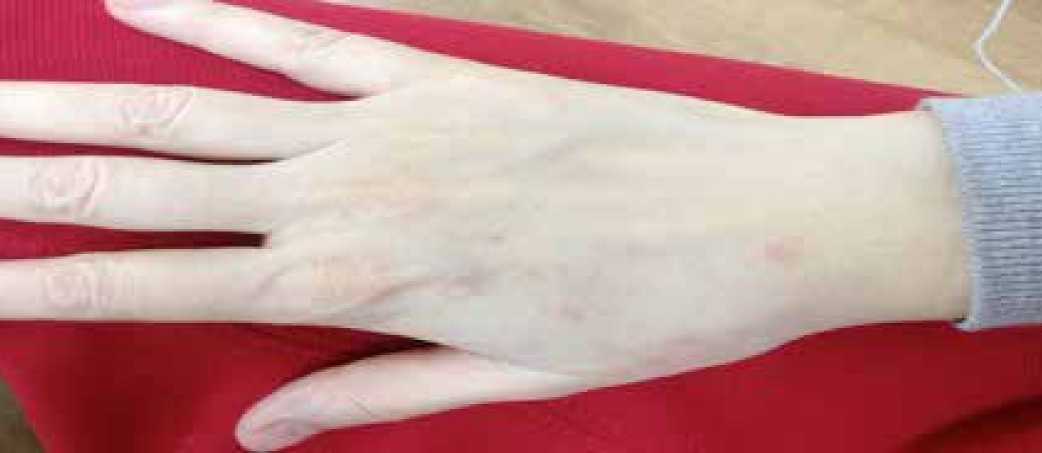
Рис. 8. Кожная токсичность при приеме Афинитора у пациентки Б.А.Ф.
нию и прекращению накопления контрастного вещества (рис. 7).
С 4 января 2014 г. пациентка начинает получать ингибитор mTOR — Афинитор по 10 мг в день ежедневно. На фоне приема препарата в первые недели наблюдалась кожная токсичность первой степени (рис. 8) в виде единичных гиперпигментированных папул на тыле кисти.
После 7-недельного приема Афинитора на контрольных КТ-исследованиях всего тела в печени и легких очаги не визуализируются, новых очагов также не выявлено (рис. 9).
Таким образом, резюмируя данное клиническое наблюдение, можно отметить, что даже при тотальной онкологической отягощенно-сти наследственности по материнской линии (у всех 5 женщин в 2-х поколениях выявлен рак молочной железы и/ или яичников) у пациенток с ТНРМЖ может отсутствовать BRCA-гер-миногенная мутация.
Заметим также, что больной после выявления опухоли было проведено только местное лечение, и, несмотря на отсутствие адъювантной химиотерапии, рецидива и метастаза не
Тройной негативный рак молочной железы: современное состояние проблемы и не совсем обычный случай лечения
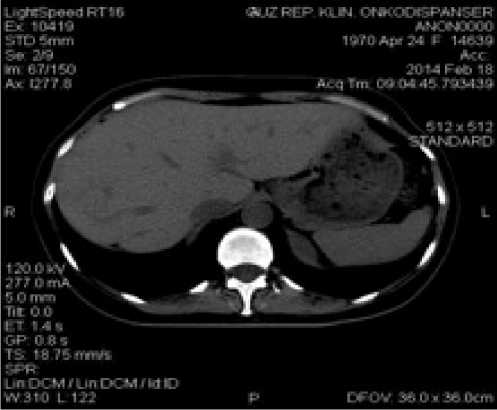
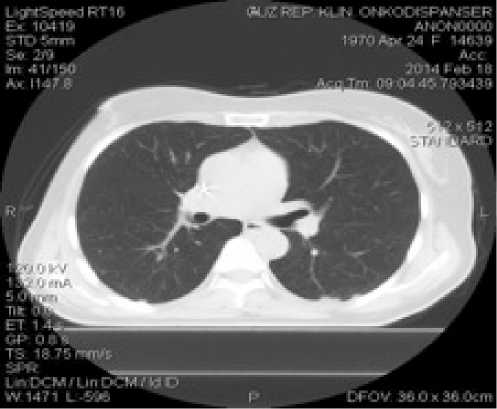
Рис. 9. Компьютерная томография печени (а), легких (б) пациентки Б.А.Ф. от 18.02.2014
а)
б)
было в течение 5 лет, а первый появившийся метастаз был в печени.
Химиотерапия (гемцитабин+цисплатин) и таргетная терапия ингибиторами m-TOR во второй линии оказались эффективными и привели к полному ответу метастатических опухолей.
И, наконец, несмотря на тщательный скрининг, ТНРМЖ может развиться в промежутке
Список литературы Тройной негативный рак молочной железы: современное состояние проблемы и не совсем обычный случай лечения
- Семиглазов В. Ф. Стратегические и практические подходы к решению проблемы рака молочной железы. -М. -RUSSCO. -2013. -№ 4. -С. 1-3
- Жукова Л. Г. Современные возможности терапии метастатического рака молочной железы с тройным негативным фенотипом//Материалы Большой конференции RUSSCO «Рак молочной железы», Москва, 22-24 января 2014 г. -М., 2014. -С. 235-241
- Haffty B. G., Yang Q., Reiss M. et al. Locoregional relapse and distant metastasis in conservatively managed triple negative early-stage breast cancer//J ClinOncol. -2006; 24: 5652-5657
- Lehmann B. D., Bauer J. A., Chen X. et al. Identification of human triple-negative breast cancer subtypes and preclinical models for selection of targeted therapies//J Clin Invest. -2011; 121: 2750-2767
- Gonzalez-Angulo A.M., Timms K. M., Liu S. et al. Incidence and outcome of BRCA mutations in unselected patients with triple receptor-negative breast cancer//Clin Cancer Res. -2011; 17: 1082-1089
- Byrski T., Huzarski T., Dent R. et al. Response to neoadjuvant therapy with cisplatin in BRCA1-positive breast cancer patients//Breast Cancer Res Treat. -2009; 115: 359-363
- Bhattacharyya G. S., Basu S., Agarwal V. et al. Single institute phase II study of weekly cisplatinum and metronomic dosing of cyclophosphamide and methotrexate in second line metastatic breast cancer triple-negative//Eur J Cancer. -2009
- Carey L. A., Rugo H. S., Marcom P. K. et al. TBCRC 001: EGFR inhibition with cetuximab added to carboplatin in metastatic triple-negative (basal-like) breast cancer//J ClinOncol. -2008; 26 (Abstr 1009, presented data -ASCO Annual Meeting 2008)
- Frasci G., Comella P., Rinaldo M. et al. Preoperative weekly cisplatin-epirubicin-paclitaxel with G-CSF support in triple-negative large operable breast cancer//AnnOncol. -2009; 20: 1185-1192
- O’Shaughnessy J., Osborne C., Pippen J. E. et al. Iniparib plus chemotherapy in metastatic triple-negative breast cancer//N Engl J Med. -2011; 364: 205-214
- O’Shaughnessy J., Schwartzberg L. S., Danso M. A. et al. A randomized phase III study of iniparib (BSI-201) in combination with gemcitabine/carboplatin (G/C) in metastatic triple-negative breast cancer (TNBC)//J ClinOncol. -2011; 29: (Abstr 1007, presented data -ASCO Annual Meeting 2011)
- Linderholm B. K., Hellborg H., Johansson U. et al. Significantly higher levels of vascular endothelial growth factor (VEGF) and shorter survival times for patients with primary operable triple-negative breast cancer//Ann Oncol. -2009; 20:1639-1646
- O’Shaughnessy J., Dieras V., Glaspy J. et al. Comparison of subgroup analyses of PFS from three phase III studies of bevacizumab in combination with chemotherapy in patients with HER2-negative metastatic breast cancer (MBC)//Cancer Res. -2009; 69: (Abstr 207, presented data -SABCS 2009)
- Brufsky A., Valero V., Tiangco B. et al. Impact of bevacizumab (BEV) on efficacy of second-line chemotherapy (CT) for triple-negative breast cancer (TNBC): analysis of RIBBON-2//J ClinOncol. -2011; 29: (Abstr 1010, presented data -ASCO Annual Meeting 2011)
- Коваленко Е. И. Адъювантная терапия тройного негативного рака молочной железы//Видеоматериалы Большой конференции RUSSCO «Рак молочной железы», Москва, 22-24 января 2014 г
- VonMinckwitz G. Eidtmann H., Rezai M. et al. Neoadjuvant chemotherapy and bevacizumab for HER2-negative breast cancer//N Engl J Med. -2012; 366:299-309
- Bear H. D., Tang G., Rastogi P. et al. The effect on pCR of bevacizumab and/or antimetabolites added to standard neoadjuvant chemotherapy: NSABP protocol B-40//J ClinOncol. -2011; 29: (Abstr LBA 1005, presented data -ASCO Annual Meeting 2011)
- Cameron D., Brown J., Dent R. et al. Adjuvant bevacizumab-containing therapy in triple-negative breast cancer (BEATRICE): primary results of a randomised, phase 3 trial//J The Lancet Oncol. -2013; 14:933-942
- Curigliano G., Pivot X., Cortes J. et al. A randomized phase II study of sunitinib vs. standard of care for patients with previously treated advanced triple-negative breast cancer//Cancer Res. -2010; 70: (Abstr P6-12-02, presented data -SABCS 2010)
- Wildiers H., Fontaine C., Vuylsteke P. et al. Multicenter phase II randomized trial evaluating antiangiogenic therapy with sunitinib as consolidation after objective response to taxane chemotherapy in women with HER2-negative metastatic breast cancer//Breast Cancer Res Treat. -2010; 123: 463-469
- Burstein H. J., Elias A. D., Rugo H. S. et al. Phase II study of sunitinib malate, an oral multitargeted tyrosine kinase inhibitor, in patients with metastatic breast cancer previously treated with an anthracycline and a taxane//J ClinOncol. -2008; 26: 1810-1816
- Moreno-Aspitia A., Morton R. F., Hillman D. W. et al. Phase II trial of sorafenib in patients with metastatic breast cancer previously exposed to anthracyclines or taxanes: North Central Cancer Treatment Group and Mayo Clinic Trial N0336//J ClinOncol. -2009; 27: 11-15
- Bianchi G., Loibl S., Zamagni C. et al. Phase II multicenter, uncontrolled trial of sorafenib in patients with metastatic breast cancer//Anticancer Drugs. -2009; 20:616-624
- Gomez P., Roche H., Costa F. et al. Overall survival data from SOLTI-0701: a multinational, double-blind, placebo-controlled, randomized phase 2b study evaluating the oral combination of sorafenib and apecitabine in patients with locally advanced or metastatic HER2-negative breast cancer//Cancer Res. -2010;70: (Abstr P2-16-01, presented data -SABCS 2010)
- Hudis C., Tauer K. W., Hermann R. C. et al. Sorafenib (SOR) plus chemotherapy (CRx) for patients (pts) with advanced (adv) breast cancer (BC) previously reated with bevacizumab (BEV)//J ClinOncol. -2011; 29: (Abstr 1009, presented data -ASCO Annual Meeting 2011)
- Viale G., Rotmensz N., Maisonneuve P. et al. Invasive ductal carcinoma of the breast with the «triple-negative» phenotype: prognostic Тройной негативный рак молочной железы: современное состояние проблемы и не совсем обычный случай лечения implications of EGFR immunoreactivity//Breast Cancer Res Treat. -2009; 116: 317-328
- Rakha E. A., El-Sayed M.E., Green A. R. et al. Prognostic markers in triple-negative breast cancer//Cancer. -2007; 109: 25-32
- Baselga J., Stemmer S., Pego A. et al. Cetuximab + cisplatin in estrogen receptor-negative, progesterone receptor-negative, HER2-negative (triple negative) metastatic breast cancer: results of the randomized phase II BALI-1 trial//Cancer Res. -2010; 70: (Abstr PD01-01, presented data -SABCS 2010)
- O’Shaughnessy J., Weckstein D., Vukelja S. et al. Preliminary results of a randomized phase II study of weekly irinotecan/carboplatin with or without cetuximab in patients with metastatic breast cancer//Breast Cancer Res Treat 2007; 106: S32 (Abstr 308, presented data -SABCS 2007)
- Sharma P., Khan Q. J., Kimler B. F. et al. Results of a phase II study of neoadjuvant platinum/taxane based chemotherapy and erlotinib for triple negative breast cancer//Cancer Res. -2010; 70: (Abstr P1-11-07, presented data -SABCS 2010)


