Тромбоз ложного просвета и аневризматическая трансформация неоперированной аорты после хирургического лечения проксимального расслоения
Автор: Чернявский А.М., Ляшенко М.М., Сирота Д.А., Шаданов А.А., Козлов Б.Н., Панфилов Д.С., Скурихина Е.В.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Оригинальные статьи ишемическая болезнь сердца
Статья в выпуске: 3 т.27, 2023 года.
Бесплатный доступ
Актуальность. Одно из самых грозных отдаленных осложнений хирургического лечения проксимального расслоения аорты - аневризма ее неоперированных отделов. Цель. Сравнительный анализ различных методик хирургического лечения проксимальных расслоений аорты в отношении развития тромбоза ложного канала неоперированных отделов. Методы. Провели простое обсервационное ретроспективное многоцентровое исследование эффективности техники «замороженный хобот слона» в сравнении со стандартным хирургическим вмешательством (косой агрессивный анастомоз или полное протезирование дуги аорты многобраншевым протезом). В анализ включили 101 пациента, которых разделили на группы в зависимости от метода лечения: первая группа - вмешательство на дуге аорты по методике «замороженный хобот слона» (n = 31); вторая группа - реконструкция грудной аорты стандартными методами (группа контроля, n = 70). С учетом ретроспективного характера исследования и неравнозначности групп по отдельным характеристикам производили выравнивание групп методом псевдорандомизации (англ. propensity score matching) для повышения достоверности результатов. Собирали данные пациентов в дооперационном периоде, из протоколов хирургических вмешательств, в послеоперационном и отдаленном периодах (3-6 мес., 1, 2, 3 года после операции). Статистические расчеты проводили в программе RStudio версии 0.99.879 (RStudio, Inc., Бостон, США). Результаты. Отсутствие тромбоза ложного канала на уровне грудного отдела аорты сохранялось после хирургического лечения у половины пациентов из группы контроля (n = 13; 52 %) и не определялось в группе «замороженного хобота слона». Полного тромбоза ложного канала на уровне грудного отдела аорты (уровень установки стент-графта и дистальнее до диафрагмы) удалось добиться более чем у половины больных группы «замороженного хобота слона» и только у 3 (12 %) пациентов из группы контроля. Аневризматическая трансформация неоперированной аорты произошла у 12 (48 %) больных из группы стандартных методов и отсутствовала в группе «замороженного хобота слона». Заключение. Методика «замороженный хобот слона» позволяет снизить частоту аортосвязанных событий до 0 % в течение 3 лет по сравнению со стандартным подходом (32 %, p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Аорта, расслоение аорты, тромбоз, хирургия
Короткий адрес: https://sciup.org/142239083
IDR: 142239083 | DOI: 10.21688/1681-3472-2023-3-19-30
Текст научной статьи Тромбоз ложного просвета и аневризматическая трансформация неоперированной аорты после хирургического лечения проксимального расслоения
протезирование многобраншевым протезом или косой агрессивный анастомоз дуги аорты) [12; 13]. Вмешательства на торакоабдоминальном отделе выполнялись, как правило, в отдаленном периоде, по мере определения показаний при аневризматической трансформации либо сохранении мальпер-фузии внутренних органов [14–16] после первичного вмешательства. Постепенно стало очевидно, что существующих хирургических подходов и стратегий послеоперационного ведения пациентов недостаточно, чтобы предотвратить дилатацию расслоенной аорты на уровне торакоабдоминального отдела [17; 18]. Однако с развитием эндоваскулярных методик вмешательств на аорте, понимания механизмов взаимодействия армированных эндолюми-нальных протезов с аортальной стенкой начались попытки укрепления истинного канала и исключения из кровотока ложного канала расслоенной аорты на уровне проксимальной части нисходящего грудного отдела с целью профилактики дальнейшего расширения на уровне имплантации. Вмешательства дополнялись эндопротезированием нисходящей грудной аорты отдельным стент-графтом. Такую методику впервые предложили M. Kato и со-авт. в 1996 г. [19], после чего начались разработки серийного устройства для одновременной гибридной реконструкции. Сейчас технология применяется при острых и хронических расслоениях аорты I типа по Де Бейки, аневризмах дуги и нисходящего отдела аорты [20–21].
Цель исследования — сравнительная оценка безопасности и эффективности технологии «замороженный хобот слона» (англ. frozen elephant trunk, FET) и общепринятой техники хирургического лечения проксимального расслоения аорты в отношении развития тромбоза ложного канала неопе-рированных отделов, а также частоты и скорости аневризматической трансформации аорты в отдаленном периоде.
Методы
Проведено простое обсервационное ретроспективное многоцентровое исследование эффективности применения техники FET в сравнении со стандартным хирургическим вмешательством (косой агрессивный анастомоз или полное протезирование дуги аорты многобраншевым протезом) на основании свободы от повторных вмешательств на дистальных отделах аорты в отдаленном периоде. Критерии включения определяли на основе действующих рекомендаций по диагностике и лечению заболеваний аорты: у пациентов с расслоением аорты типа A рекомендуется проведение экстренного хирургического вмешательства (класс рекомендаций I, уровень доказательности B) [4].
Проанализировали данные 147 пациентов, оперированных с 2001 по 2017 г. по поводу расслоений аорты I типа по Де Бейки. Исключили из рассмотрения 46 человек, не прошедших рекомендованное послеоперационное обследование. В окончательную выборку включили две группы пациентов: стандартный хирургический подход (группа сравнения, n = 70) и технология FET (n = 31). В связи с неравнозначностью групп для повышения достоверности результатов провели выравнивание методом псевдорандомизации (англ. propensity score matching, PSM). Используя метод «поиска ближайшего соседа» (англ. Caliper Nearest Neighbor Matching), сформировали 25 пар пациентов из обеих групп. В дальнейшем исследовали как полные группы сравнения используемых методик, так и отобранные после псевдорандомизации. Результаты раннего послеоперационного периода проанализировали и опубликовали в 2018 г. [22].
Собирали данные пациентов в дооперационном периоде, из протоколов хирургических вмешательств, в послеоперационном и отдаленном периодах (3–6 месяцев, 1, 2, 3 года после операции). Источниками служили протоколы инструментальных обследований, опрос, переписка. Полученные данные заносили в таблицы Microsoft Excel (Microsoft, Редмонд, США). Поскольку исследование ретроспективное, а контрольные обследования осуществляли в рамках стандартных протоколов послеоперационного ведения больных, дополнительных рисков для пациентов не было.
Всем пациентам, включенным в исследование, в дооперационном периоде выполняли стандартное обследование согласно принятому в клиниках протоколу. Для оценки насосной функции сердца и клапанного аппарата, уточнения необходимости коррекции клапанной патологии проводили эхокардиографию. Гемодинамическую значимость по- ражения брахиоцефальных артерий определяли на основании дуплексного исследования кровотока по сонным, позвоночным и подключичным артериям (ветви дуги аорты). Согласно принятой в клиниках тактике при остром и подостром расслоении аорты I типа коронарографическое исследование не проводили; при хроническом расслоении с его помощью оценивали необходимость шунтирования коронарных артерий. Всем больным до операции, в раннем послеоперационном периоде (до выписки), через 3–6 мес., 1, 2 и 3 года после хирургического лечения выполняли контрастную мультиспи-ральную компьютерную томографию (МСКТ) всей аорты. Обязательным условием было использование томографа с числом срезов не менее 64.
Исследование выполнено в соответствии со стандартами надлежащей клинической практики (англ. Good Clinical Practice) и принципами Хельсинкской декларации.
Клиническая и анатомическая характеристика пациентов представлена в предыдущей публикации [22]. Диаметр аорты на различных уровнях определяли по данным МСКТ – ангиографии. Измерение осуществляли перпендикулярно оси кровотока данной области. Таким же образом измеряли диаметр истинного и ложного каналов. При хронической стадии расслоения аорты I типа по Де Бейки всем пациентам в предоперационном периоде проводили чреспищеводное ультразвуковое исследование сердца, аорты и МСКТ – ангиографию всей аорты с контрастированием от фиброзного кольца аортального клапана до бифуркации подвздошных артерий. В случае экстренного поступления больного с диагнозом острого расслоения аорты его направляли на МСКТ минуя приемный покой.
Для оценки отсроченных результатов открытого хирургического лечения проксимального расслоения аорты I типа по Де Бейки в отдаленном периоде выполняли МСКТ – ангиографию с контрастированием торакоабдоминального отдела с количеством срезов не менее 64.
Статистический анализ
Данные для исследования структурировали в электронных таблицах, проверяли на полноту и наличие ошибок ввода, проводили их разведочный анализ для выявления выпадающих значений. Проверенные данные обрабатывали методами статистического анализа.
Эмпирические распределения данных испытывали на согласие с законом нормального распределения по критериям Шапиро – Уилка. По
Табл. 1. Сравнение случаев первого увеличения диаметра аорты больше 55 мм или скорости роста диаметра аорты больше 5 мм в год в группах контроля и методики «замороженный хобот слона» в течение 3 лет после операции
|
Показатель |
До псевдорандомизации |
После псевдорандомизации |
||||||
|
Группа контроля, n = 70, n (%) |
Группа FET, OШ |
p |
Группа контроля, n = 25, n (%) |
Группа FET, n = 25, n (%) |
OШ [95% ДИ] |
p |
||
|
n = 31, n (%) |
[95% ДИ] |
|||||||
|
Дуга аорты |
0 (0) |
0 (0) |
– |
> 0,999 |
0 (0) |
0 (0) |
– |
> 0,999 |
|
Нисходящая грудная аорта, 1/3 |
7 (16) |
0 (0) |
0 [0; 1,1] |
0,040* |
2 (10) |
0 (0) |
0 [0; 4,6] |
0,210 |
|
Нисходящая грудная аорта, 2/3 |
11 (26) |
0 (0) |
0 [0; 0,6] |
0,005* |
5 (25) |
0 (0) |
0 [0; 0,8] |
0,016* |
|
Нисходящая грудная аорта, 3/3 |
4 (9) |
2 (8) |
0,8 [0,1; 6,2] |
> 0,999 |
3 (15) |
0 (0) |
0,5 [0; 5,4] |
0,650 |
|
Брюшная аорта супраренально |
9 (21) |
1 (4) |
0,2 [0; 1,2] |
0,077 |
7 (35) |
1 (4) |
0,1 [0; 0,8] |
0,017* |
|
Брюшная аорта инфраренально |
3 (7) |
2 (8) |
1,1 [0,1; 10,4] |
> 0,999 |
2 (10) |
2 (9) |
0,9 [0,1; 13,0] |
> 0,999 |
Примечание. FET — англ. frozen elephant trunk, «замороженный хобот слона»; ОШ — отношение шансов; ДИ — доверительный интервал; * — статистически достоверное различие.
этой причине для сравнения показателей между группами использовали непараметрический U-критерий Манна – Уитни. Дескриптивные характеристики представлены в виде медианы (первый квартиль; третий квартиль) для числовых данных, процента от общего количества (нижняя граница 95% доверительного интервала (ДИ); верхняя граница 95% ДИ) для категориальных данных с вычислением границ ДИ по формуле Уилсона. Для статистической проверки гипотез о равенстве числовых характеристик выборочных распределений в сравниваемых группах использовали непарный U-критерий Манна – Уитни, производили расчет смещения распределений с построением 95% ДИ для смещения. Для сравнения бинарных и категориальных показателей применяли точный двусторонний критерий Фишера. Попарные ассоциации исследовали путем расчета коэффициентов корреляции Спирмена. Проверку статистических гипотез проводили при критическом уровне значимости р = 0,05, то есть различие считалось статистически значимым при p < 0,05. Нижнюю границу доказательной мощности брали равной 80 %. К исходным группам для выравнивания предоперационных показателей применяли метод «поиска ближайшего соседа». Для выявления предикторов осложнений и летальности в группах проводили однофакторный и многофакторный регрессионный анализ с определением отношения шансов и уровня значимости для каждой переменной. Все статистические расчеты осуществляли в программе RStudio версии 0.99.879 (RStudio, Inc., Бостон, США).
Результаты
В раннем послеоперационном периоде обследовали 101 пациента (100 %): проводили клиническую оценку с фиксацией осложнений раннего послеоперационного периода и МСКТ – ангиографию аорты от фиброзного кольца аортального клапана до бифуркации аорты. Как правило, данное обследование выполняли перед выпиской при неосложненном течении послеоперационного периода (12–15-е сут.) либо при подозрении на гемодинамически значимое нарушение кровотока по аорте и ее ветвям. Средний период наблюдения в послеоперационном периоде — 14,6 ± 7,1 дня.
Общая внутригоспитальная летальность составила 10 пациентов (9,9 %). В группе FET зарегистрировали 2 летальных исхода (6,5 %), в группе контроля — 8 (11,4 %), после псевдорандомизации — 2 (8 %) и 3 (12 %) соответственно.
В группе FET причинами летальных исходов являлись: острая сердечная недостаточность на фоне периоперационного инфаркта миокарда, резистентная к кардиотонической поддержке, пациент погиб на 3-и сут. послеоперационного периода; полиорганная недостаточность на фоне длительной искусственной вентиляции легких с присоединением внутрибольничной пневмонии, смерть на 23-и сут. послеоперационного периода. В группе контроля установлены следующие причины смерти: в 2 случаях — периоперационный инфаркт миокарда с прогрессированием сердечно-сосудистой и полиорганной недостаточности, в 2 случаях — острое нарушение мозгового кровообращения по
Группы —i— Контроль, 37 % [7 %; 62 %] —н FET, 17 % [0 %; 41 %]
Log-rank test, p = 0,08
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 2021 22 23 2425 2627 28293031 32 33 3435 36 Время, мес.
191918181817 16151515151514131313121212 12121111 11 109 9 9 9 9 9 9 9 9 9 77
23 21 21 2121 21 21 19 19 1818 1816 1513 1212 12 12 1211 11 11 9 8 8 7 7 6 5 5 5 5 4 4 33
0 1 2 3 4 5 6 7 8 9 1011 12 13 1415 1617 1819 2021 22 23 2425 2627 28293031 32 33 343536
Время, мес.
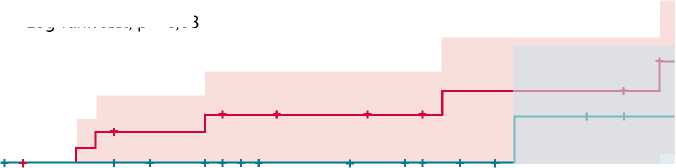
Рис. 1. Случаи первого увеличения диаметра брюшной аорты больше 55 мм или скорости роста диаметра аорты больше 5 мм в год в группах контроля и методики «замороженный хобот слона» в течение 3 лет после операции: кривая Каплана – Майера
Примечание. FET — англ. frozen elephant trunk, «замороженный хобот слона».
ишемическому типу на фоне острой стадии расслоения аорты с вовлечением ветвей дуги аорты; в 4 случаях — полиорганная недостаточность у пациентов, которые исходно были оперированы с симптоматикой мальперфузии внутренних органов и нуждались в продленной искусственной вентиляции легких.
После псевдорандомизации не получили статистически значимой разницы по уровню летальности в раннем послеоперационном периоде, несмотря на технически более сложное хирургическое вмешательство в группе методики «замороженный хобот слона» [22].
В качестве критериев аортосвязанного события мы рассматривали рекомендованные параметры определения показаний к хирургическому лечению на уровне торакоабдоминального отдела аорты: общий диаметр более 55 мм либо скорость роста более 5 мм в год. Всем исследуемым при выписке было рекомендовано ежегодно проходить контрольное обследование в объеме МСКТ – ангиографии торакоабдоминального отдела аорты. По результатам анализа выявлено статистически достоверное различие в диаметрах/скорости роста на уровне грудного и инфраренального отделов аорты у прооперированных с использованием разных методик больных (табл. 1).
На уровне брюшного отдела аорты в группе FET зафиксировали 2 случая увеличения диаметра аорты на 5 мм в течение 1-го года наблюдения (рис. 1) при общем диаметре аорты менее 30 мм. При дальнейшем наблюдении диаметр аорты оставался стабильным, показаний к хирургическому лечению не было.
Путем построения однофакторных моделей логистической регрессии установили отдельные значимые предикторы скорости роста аорты более 5 мм в год на уровне любого отдела у всех пациентов:
-
• аортальная недостаточность (p = 0,016), предиктор ассоциирован с повышением шансов скорости роста аорты более 5 мм в год в 3,43 [1,31; 9,91] раза;
-
• уровни дистальной фенестрации (p = 0,047), предиктор ассоциирован с повышением шансов скорости роста аорты более 5 мм в год в 3,03 [1,05; 9,68] раза. То есть при смещении уровня наиболее дистальной фенестрации от 0 к IV, V повышается риск аневризматической трансформации торакоабдоминального отдела аорты.
С помощью многофакторной модели логистической регрессии выявили мультипликативные значимые предикторы скорости роста аорты более 5 мм в год на уровне любого отдела у всех пациентов:
-
• аортальная недостаточность (p = 0,022), предиктор ассоциирован с повышением шансов скорости роста аорты более 5 мм в год на уровне любого отдела в 4,31 [1,31; 16,52] раза при прочих равных показателях в многофакторной модели;
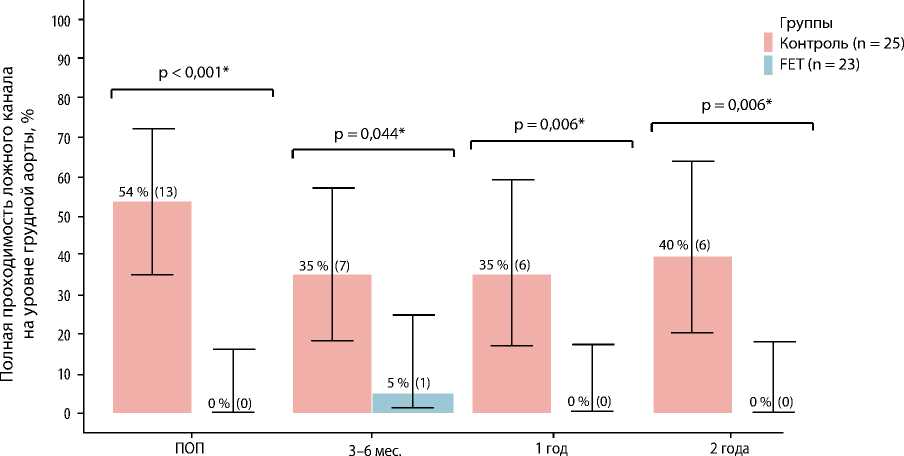
Рис. 2. Полная проходимость ложного канала на уровне грудного отдела аорты в послеоперационном периоде Примечание. FET — англ. frozen elephant trunk, «замороженный хобот слона»; ПОП — послеоперационный период.
-
• имплантация стент-графта (p = 0,031), предиктор ассоциирован с понижением шансов скорости роста аорты более 5 мм в год в 0,97 [0,93; 0,99] раза при прочих равных показателях в многофакторной модели;
-
• полный тромбоз ложного канала аорты (p = 0,043), предиктор ассоциирован с понижением шансов скорости роста аорты более 5 мм в год на уровне любого отдела в 0,24 [0,05; 0,89]
раза при прочих равных показателях в многофакторной модели.
Согласно полученным данным, полная проходимость ложного канала на уровне грудного отдела аорты (уровень установки стент-графта и дистальная область до диафрагмы) сохранялась сразу после хирургического лечения у половины пациентов контрольной группы (n = 13; 52 %) и не определя-
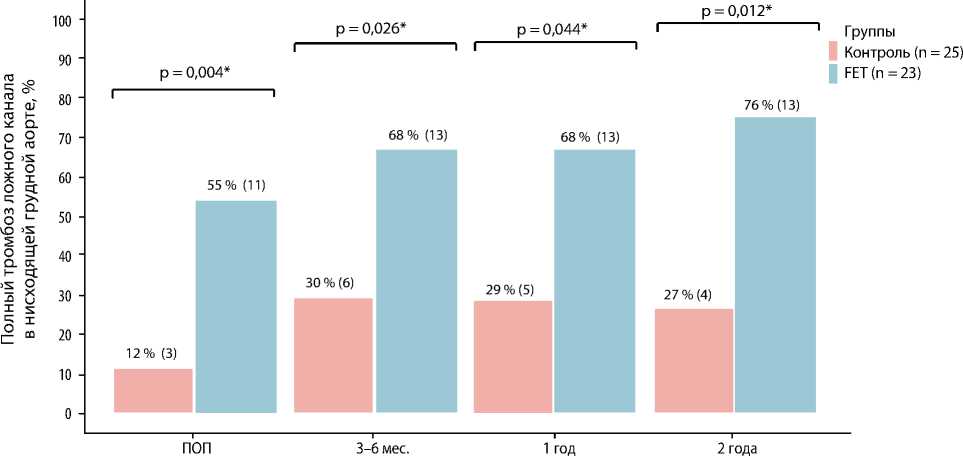
Рис. 3. Полный тромбоз ложного канала в нисходящей грудной аорте
Примечание. FET — англ. frozen elephant trunk, «замороженный хобот слона»; ПОП — послеоперационный период.
Табл. 2. Характеристика тромбоза ложного канала в исследуемых группах
|
Показатель |
До псевдорандомизации |
После псевдорандомизации |
||||||
|
Группа контроля, n = 70, n (%) |
Группа FET, n = 31, n (%) |
OШ [95% ДИ] |
p |
Группа Группа контроля, FET, |
OШ [95% ДИ] |
p |
||
|
n = 25, n (%) |
n = 25, n (%) |
|||||||
|
Послеоперационный период |
||||||||
|
Полный тромбоз |
9 (18) |
12 (44) |
3,7 [1,2; 12,1] |
0,016* |
3 (12) |
11 (55) |
8,1 [1,6; 56,2] |
0,004* |
|
Частичный тромбоз |
13 (25) |
15 (56) |
3,6 [1,2; 11,0] |
0,013* |
8 (33) |
9 (45) |
1,6 [0,4; 6,6] |
0,539 |
|
Полностью проходим |
29 (57) |
0 (0) |
0 [0; 0,1] |
< 0,001* |
13 (54) |
0 (0) |
0 [0; 0,2] |
< 0,001* |
|
Полный тромбоз + частичный тромбоз |
22 (43) |
27 (100) |
+∞ [7,6; +∞] |
< 0,001* |
11 (46) |
20 (100) |
+∞ [4,3; +∞] |
< 0,001* |
|
3–6 месяцев |
||||||||
|
Полный тромбоз |
13 (30) |
14 (54) |
2,7 [0,9; 8,3] |
0,075 |
6 (30) |
13 (68) |
4,8 [1,1; 24,6] |
0,026* |
|
Частичный тромбоз |
12 (28) |
11 (42) |
1,9 [0,6; 5,9] |
0,293 |
7 (35) |
5 (26) |
0,7 [0,1; 3,2] |
0,731 |
|
Полностью проходим |
18 (42) |
1 (4) |
0,1 [0; 0,4] |
< 0,001* |
7 (35) |
1 (5) |
0,1 [0; 1] |
0,044* |
|
Полный тромбоз + частичный тромбоз |
25 (58) |
25 (96) |
17,4 [2,4; 776,2] |
< 0,001* |
13 (65) |
18 (95) |
9,2 [1,0; 459,3] |
0,044* |
|
1 год |
||||||||
|
Полный тромбоз |
12 (30) |
13 (54) |
2,7 [0,9; 9,0] |
0,068 |
5 (29) |
13 (72) |
5,9 [1,2; 35,0] |
0,018* |
|
Частичный тромбоз |
11 (28) |
11 (46) |
2,2 [0,7; 7,3] |
0,177 |
6 (35) |
5 (28) |
0,7 [0,1; 3,7] |
0,725 |
|
Полностью проходим |
17 (42) |
0 (0) |
0 [0; 0,3] |
< 0,001* |
6 (35) |
0 (0) |
0 [0; 0,7] |
0,008* |
|
Полный тромбоз + частичный тромбоз |
23 (58) |
24 (100) |
+∞ [3,7; +∞] |
< 0,001* |
11 (65) |
18 (100) |
+∞ [1,5; +∞] |
0,008* |
|
2 года |
||||||||
|
Полный тромбоз |
10 (29) |
13 (62) |
3,8 [1,1; 14,4] |
0,025* |
4 (27) |
13 (76) |
8,2 [1,4; 60,3] |
0,012* |
|
Частичный тромбоз |
8 (24) |
8 (38) |
2 [0,5; 7,7] |
0,360 |
5 (33) |
4 (24) |
0,6 [0,1; 3,8] |
0,699 |
|
Полностью проходим |
16 (47) |
0 (0) |
0 [0; 0,3] |
< 0,001* |
6 (40) |
0 (0) |
0 [0; 0,6] |
0,006* |
|
Полный тромбоз + частичный тромбоз |
18 (53) |
21 (100) |
+∞ [3,7; +∞] |
< 0,001* |
9 (60) |
17 (100) |
+∞ [1,7; +∞] |
0,006* |
Примечание. FET — англ. frozen elephant trunk, замороженный хобот слона; ОШ — отношение шансов; ДИ — доверительный интервал.
лась в группе методики «замороженный хобот слона» (рис. 2).
После псевдорандомизации в сравниваемых группах МСКТ – ангиографию в раннем послеоперационном периоде не удалось выполнить только у двух пациентов в группе FET (1 — смерть на операционном столе и 1 — нетолерантность к исследованию в послеоперационном периоде). Различия между группами статистически достоверны на протяжении всего периода наблюдения.
Полного тромбоза ложного канала на уровне грудного отдела аорты (уровень установки стент-графта и дистальнее до диафрагмы) добились более чем у половины пациентов из группы FET и только у 3 (12 %) из группы контроля (рис. 3).
В табл. 2 объединены данные по тромбозам ложного канала в исследуемых группах.
Таким образом, на протяжении периода наблюдения в группе FET все пациенты достигли полного или частичного тромбоза на уровне грудной аорты

Log-rank test, p < 0,001*
Hazard Ratio = 4,77 [2,24; 10,16]
0 3 6 9 12 15 18 21 24 27 30 33 36
Время, мес.
Число пациентов под риском (всего событий)
|
Е Е CL |
25 (0) |
10 (12) |
7 (14) |
6 (14) |
6 (14) |
6 (14) |
6 (14) |
6 (14) |
6 (14) |
6 (14) |
6 (14) |
6 (14) |
4 (15) |
|
24 (1) |
0 (24) |
0 (24) |
0 (24) |
0 (24) |
0 (24) |
0 (24) |
0 (24) |
0 (24) |
0 (24) |
0 (24) |
0 (24) |
0 (24) |
|
|
0 |
3 |
6 |
9 |
12 |
15 |
18 |
21 |
24 |
27 |
30 |
33 |
36 |
Время, мес.
Рис. 4. Свобода от полного или частичного тромбоза ложного канала на уровне грудной аорты в исследуемых группах Примечание. FET — англ. frozen elephant trunk, «замороженный хобот слона».
(рис. 4), в то время как в контрольной группе ложный канал на уровне грудного отдела, как правило, функционировал. Разница между группами статистически достоверна.
Обсуждение
В отдаленном периоде основной целью исследования было выявить комбинацию условий, которые можно охарактеризовать как «аортосвязанные события». В нашем исследовании этим условиям соответствовали: связанная с аортой смерть, вмешательства на торакоабдоминальном отделе аорты, достигнутый диаметр грудной аорты 55 мм и более, а также скорость роста грудного или брюшного отделов аорты более 5 мм в год. При пересечении условий (диаметр аорты/хирургическое вмешательство) учитывали то, которое возникло первым. Перечисленные условия соотносятся с актуальными рекомендациями по лечению заболеваний аорты [4; 23].
В группе FET на протяжении всего периода наблюдения не зарегистрировали аортосвязанных событий среди выписанных пациентов. В группе контроля отметили 2 случая связанных с аортой летальных исходов, выполнили 4 вмешательства (3 по поводу аневризм торакоабдоминального отдела аорты через 7, 12 и 31 мес. после первичного вмешательства, 1 по поводу сохраняющейся мальперфузии внутренних органов через 4 мес. после операции). Различия между группами по частоте развития аортосвязанных событий в отдаленном периоде достигли статистической значимости (p = 0,005).
При анализе изменения диаметра аорты в отдаленном периоде выявили статистически значимые различия между группами: при сравнении совокупности анатомических изменений неоперированных отделов (увеличение грудного отдела аорты свыше 55 мм или скорость роста более 5 мм в год) не зафиксировали случаев, которые являлись бы показаниями к хирургическому лечению, в группе FET. В контрольной группе у 12 пациентов наблюдали изменения диаметра аорты по одной из предложенных анатомических характеристик в течение периода наблюдения. Результаты соотносятся с описанными в литературе: M.E. Tan и соавт. отмечают формирование аневризм торакоабдоминального отдела аорты у 15–40 % оперированных на проксимальных отделах пациентов в течение 5 лет после вмешательства [24].
Для определения предикторов анатомического изменения неоперированных отделов аорты построили однофакторные и многофакторные модели логистической регрессии. С помощью однофакторных моделей выявили отдельные значимые предикторы скорости роста аорты более 5 мм в год: аортальная недостаточность (p = 0,016), предиктор ассоциирован с повышением шансов скорости роста аорты более 5 мм в год в 3,43 [1,31; 9,91] раза; уровни дистальной фенестрации (p = 0,047), предиктор ассоциирован с повышением шансов скорости роста аорты более 5 мм в год в 3,03 [1,05; 9,68] раза, то есть при смещении уровня наиболее дистальной фенестрации от 0 к IV, V повышается риск аневризматической трансформации торакоабдоминального отдела аорты. Путем построения многофакторной модели логистической регрессии выявили мультипликативные значимые предикторы скорости роста аорты более 5 мм в год на уровне любого отдела у всех пациентов: аортальная недостаточность (p = 0,022), предиктор ассоциирован с повышением шансов скорости роста аорты более 5 мм в год на уровне любого отдела в 4,31 [1,31; 16,52] раза при прочих равных показателях в многофакторной модели; имплантация стент-графта (p = 0,031), предиктор ассоциирован с понижением шансов скорости роста аорты более 5 мм в год в 0,97 [0,93; 0,99] раза при прочих равных показателях в многофакторной модели; полный тромбоз ложного канала аорты (p = 0,043), предиктор ассоциирован с понижением шансов скорости роста аорты более 5 мм в год на уровне любого отдела в 0,24 [0,05; 0,89] раза при прочих равных показателях в многофакторной модели.
Полученные результаты, преимущественно моделей логистической регрессии, не полностью перекликаются с данными других работ. Так, исследованный нами диаметр на уровне проксимального отдела нисходящей грудной аорты не демонстрировал статистической значимости в формировании аневризм, как это было показано в нескольких публикациях [24; 25]. Также мы проанализировали остальные предполагаемые предикторы аневризматической трансформации (синдромы дисплазии соединительной ткани, острая стадия расслоения, исходные диаметры аорты на всех уровнях), однако не выявили статистически значимых различий. При этом в литературе описана полиэти-ологичность аортальных осложнений в отдаленном послеоперационном периоде.
Тромбоз ложного канала аорты в неоперирован-ных отделах является независимым предиктором отсутствия роста аорты в подавляющем большинстве исследований, посвященных как гибридной, так и стандартной хирургии расслоений аорты проксимального типа. Мы сделали аналогичный вывод: полный тромбоз ложного канала на уровне грудного отдела аорты достоверно предотвращал рост аорты в отдаленном послеоперационном периоде (p = 0,043).
По данным сравнительного анализа в группах, полная проходимость ложного канала на уровне грудного отдела аорты (уровень установки стент-графта и дистальная область до диафрагмы) сохранялась сразу после хирургического лечения у половины пациентов из контрольной группы (n = 13; 52 %) и не определялась в группе FET. В то же время полного тромбоза ложного канала на том же уровне аорты достигли более чем у половины пациентов из группы FET и только у 3 (12 %) из группы контроля. Частичный тромбоз начальных отделов ложного канала при стандартных операциях (косой агрессивный анастомоз или полное протезирование дуги аорты многобраншевым протезом) — это, как правило, максимум, которого удается добиться хирургу, осуществляющему хирургическое вмешательство при расслоениях аорты I типа по Де Бейки. В то же время сохранение кровотока на уровне стент-графта при гибридных вмешательствах — достаточно редкая ситуация.
В литературе описаны наиболее вероятные причины сохранения кровотока в ложном канале на уровне грудной аорты: оторванные устья межреберных артерий, многочисленные дистальные фенестрации. Установка стент-графта с тканевым покрытием позволяет не только стабилизировать истинный канал, оказав компрессию на ложный, но и физически закрыть дополнительные пути кровоснабжения ложного канала из просвета аорты.
В нашем исследовании наблюдалась статистически значимая разница в развитии тромбоза ложного канала аорты на протяжении всего периода наблюдения (Log-rank test, p < 0,001).
Заключение
Методика «замороженный хобот слона» при лечении проксимальных расслоений аорты не увеличивает частоту периоперационных осложнений по сравнению со стандартными методиками. У пациентов, оперированных по поводу проксимального расслоения аорты с использованием этой хирургической техники, по сравнению со стандартными вмешательствами достоверно чаще происходит тромбирование ложного канала аорты в грудном отделе (p = 0,004); статистически значимо ниже частота аневризматической трансформации или скорости роста аорты в грудном отделе более 5 мм в год в отдаленном периоде (p = 0,016); достоверно ниже скорость роста неоперированных отделов аорты (p = 0,024).
Список литературы Тромбоз ложного просвета и аневризматическая трансформация неоперированной аорты после хирургического лечения проксимального расслоения
- Гордеев М.Л., Успенский В.Е., Баканов А.Ю., Волков В.В., Ибрагимов А.Н., Щербинин Т.С., Иртюга О.Б., Найму-шин А.В. Реконструктивные вмешательства на дуге аорты при хирургическом лечении аневризм и расслоений восходящего отдела аорты. Патология кровообращения и кардиохирургия. 2016;20(4):45-57. https://doi. org/10.21688/1681-3472-2016-4-45-57 Gordeev M.L., Uspenskiy V.E., Bakanov A.Yu., Volkov V.V., Ibragimov A.N., Scherbinin T.S., Irtyuga O.B., Naimushin A.V. Aortic arch reconstruction in surgical treatment of ascending aortic aneurysms and dissections. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2016;20(4):45-57. (In Russ.) https://doi. org/10.21688/1681-3472-2016-4-45-57
- Sayed A., Munir M., Bahbah E.I. Aortic dissection: a review of the pathophysiology, management and prospective advances. Curr Cardiol Rev. 2021;17(4):e230421186875. PMID: 33059568. PMCID: PMC8762162. https://doi.org/10.2174/157 3403X16666201014142930
- Evangelista A., Isselbacher E.M., Bossone E., Gleason T.G., Di Eusanio M., Sechtem U., Ehrlich M.P., Trimarchi S., Braverman A.C., Myrmel T., Harris K.M., Hutchinson S., O'Gara P., Suzuki T., Nienaber C.A., Eagle K.A.; IRAD Investigators. Insights from the International Registry of Acute Aortic Dissection: a 20-year experience of collaborative clinical research. Circulation. 2018;137(17):1846-1860. PMID: 29685932. https:// doi.org/10.1161/CIRCULATI0NAHA.117.031264
- Erbel R., Aboyans V., Boileau C., Bossone E., Bartolomeo R.D., Eggebrecht H., Evangelista A., Falk V., Frank H., Gaemperli O., Grabenwoger M., Haverich A., Iung B., Manolis A.J., Meijboom F., Nienaber C.A., Roffi M., Rousseau H., Sechtem U., Sirnes P.A., Allmen R.S., Vrints C.J.; ESC Committee for Practice Guidelines. 2014 ESC guidelines on the diagnosis and treatment of aortic diseases: document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The task force for the diagnosis and treatment of aortic diseases of the European Society of Cardiology (ESC). Eur Heart J. 2014;35(41):2873-2926. PMID: 25173340. https:// doi.org/10.1093/eurheartj/ehu281
- Rosinski B.F., Idrees J.J., Roselli E.E., Germano E., Pasadyn S.R., Lowry A.M., Blackstone E.H., Johnston D.R., Soltesz E.G., Navia J.L., Desai M.Y., Mick S.L., Bakaeen F.G., Svensson L.G. Cannulation strategies in acute type A dissection repair: a systematic axillary artery approach. J Thorac Cardiovasc Surg. 2019;158(3):647-659.e645. PMID: 30770117. https://doi. org/10.1016/j.jtcvs.2018.11.137
- Ghoreishi M., Sundt T.M., Cameron D.E., Holmes S.D., Roselli E.E., Pasrija C., Gammie J.S., Patel H.J., Bavaria J.E., Svensson L.G., Taylor B.S. Factors associated with acute stroke after type A aortic dissection repair: an analysis of the Society ofThoracic Surgeons National Adult Cardiac Surgery Database. J Thorac Cardiovasc Surg. 2020;159(6):2143-2154.e2143. PMID: 31351776. https://doi.org/10.1016/j.jtcvs.2019.06.016
- Moizumi Y., Motoyoshi N., Sakuma K., Yoshida S. Axillary artery cannulation improves operative results for acute type A aortic dissection. Ann Thorac Surg. 2005;80(1):77-83. PMID: 15975344. https://doi.org/10.1016/j.athoracsur.2005.01.058
- Jormalainen M., Raivio P., Mustonen C., Honkanen H.-P., Vento A., Biancari F., Juvonen T. Direct aortic versus peripheral arterial cannulation in surgery for type A aortic dissection.
- Ann Thorac Surg. 2020;110(4):1251 -1258. PMID: 32165179. https://doi.Org/10.1016/i.athoracsur.2020.02.010
- Bonser R.S., Ranasinghe A.M., Loubani M., Evans J.D., Thalji N.M.A., Bachet J.E., Carrel T.P., Czerny M., Di Bar-tolomeo R., Grabenwöger M., Lonn L., Mestres C.A., Schepens M.A.A.M., Weigang E. Evidence, lack of evidence, controversy, and debate in the provision and performance of the surgery of acute type A aortic dissection. J Am Coll Cardiol. 2011;58(24):2455-2474. PMID: 22133845. https://doi. org/10.1016/i.iacc.2011.06.067
- Di Eusanio M., Trimarchi S., Peterson M.D., Myrmel T., Hughes G.C., Korach A., SundtT.M., Di Bartolomeo R., Greason K., Khoynezhad A., Appoo J.J., Folesani G., De Vincentiis C., Montgomery D.G., Isselbacher E.M., Eagle K.A., Nienaber C.A., Patel HJ. Root replacement surgery versus more conservative management during type A acute aortic dissection repair. Ann Thorac Surg. 2014;98(6):2078-2084. PMID: 25282163. https:// doi.org/10.1016/i.athoracsur.2014.06.070
- Yang B., Norton E.L., Hobbs R., Farhat L., Wu X., Hornsby W.E., Kim K.M., Patel H.J., Deeb G.M. Short- and long-term outcomes of aortic root repair and replacement in patients undergoing acute type A aortic dissection repair: twenty-year experience. J Thorac Cardiovasc Surg. 2019;157(6):2125-2136. PMID: 30737109; PMCID: PMC6588514. https://doi.org/10.1016/i. itcvs.2018.09.129
- Tokunaga C., Kumagai Y., Chubachi F., Hori Y., Takazawa A., Hayashi J., Asakura T., Ishii R., Nakajima H., Yoshitake A. Total arch replacement using frozen elephant trunk technique with Frozenix for distal aortic arch aneurysms. Interact Cardiovasc Thorac Surg. 2022;35(1):ivac038. PMID: 35179581; PMCID: PMC9252127. https://doi.org/10.1093/icvts/ivac038
- Poon S.S., Theologou T., Harrington D., Kuduvalli M., Oo A., Field M. Hemiarch versus total aortic arch replacement in acute type A dissection: a systematic review and meta-analysis. Ann Cardiothorac Surg. 2016;5(2):156-173. PMID: 27386403; PMCID: PMC4893527. https://doi.org/10.21037/ acs.2016.05.06
- Kamman A.V., Yang B., Kim K.M., Williams D.M., Michael Deeb G., Patel H.J. Visceral malperfusion in aortic dissection: the Michigan experience. Semin Thorac Cardiovasc Surg. 2017;29(2):173-178. PMID: 28823323. https://doi. org/10.1053/j.semtcvs.2016.10.002
- Merkle J., Sabashnikov A., Deppe A.-C., Zeriouh M., Maier J., Weber C., Eghbalzadeh K., Schlachtenberger G., Shostak O., Diordievic I., Kuhn E., Rahmanian P.B., Madershahian N., Rustenbach C., Liakopoulos O., Choi Y.-H., Kuhn-Régnier F., Wahlers T. Impact of ascending aortic, hemiarch and arch repair on early and long-term outcomes in patients with Stanford A acute aortic dissection. Ther Adv Cardiovasc Dis. 2018;12(12):327-340. PMID: 30295137; PMCID: PMC6266246. https://doi.org/10.1177/1753944718801568
- Leontyev S., Haag F., Davierwala P.M., Lehmkuhl L., Borger M.A., Etz C.D., Misfeld M., Gutberlet M., Mohr F.W. Postoperative changes in the distal residual aorta after surgery for acute type A aortic dissection: impact of false lumen patency and size of descending aorta. Thorac Cardiovasc Surg. 2017;65(2):90-98. PMID: 27111499. https://doi.org/10.1055/s-0036-1571813
- Borst H.G., Walterbusch G., Schaps D. Extensive aortic replacement using "elephant trunk" prosthesis. Thorac Cardiovasc Surg. 1983;31(1):37-40. PMID: 6189250. https://doi. org/10.1055/s-2007-1020290
- Dapunt O.E., Galla J.D., Sadeghi A.M., Lansman S.L., Mezrow C.K., de Asla R.A., Quintana C., Wallenstein S., Ergin A.M., Griepp R.B. The natural history of thoracic aortic aneurysms. J Thorac Cardiovasc Surg. 1994;107(5):1323-1332. PMID: 8176976.
- Kato M., Ohnishi K., Kaneko M., Ueda T., Kishi D., Mizushima T., Matsuda H. New graft-implanting method for thoracic aortic aneurysm or dissection with a stented graft. Circulation. 1996;94(9 Suppl):II188-193. PMID: 8901744.
- Suto Y., Yasuda K., Shiiya N., Murashita T., Kawasaki M., Imamura M., Takigami K., Sasaki S., Matsui Y., Sakuma M. Stented elephant trunk procedure for an extensive aneurysm involving distal aortic arch and descending aorta. J Thorac Cardiovasc Surg. 1996;112(5):1389-1390. PMID: 8911340. https://doi.org/10.1016/S0022-5223(96)70157-5
- Shrestha M., Kaufeld T., Beckmann E., Fleissner F., Umminger J., Abd Alhadi F., Boethig D., Krueger H., Haverich A., Martens A. Total aortic arch replacement with a novel 4-branched frozen elephant trunk prosthesis: single-center results of the first 100 patients. J Thorac Cardiovasc Surg. 2016;152(1 ):148-159.e1. PMID: 27167026. https://doi.org/10.1016/j.jtcvs.2016.02.077
- Чернявский А.М., Ляшенко М.М., Сирота Д.А., Хван Д.С., Козлов Б.Н., Панфилов Д.С., Лукинов В.Л. Гибридные технологии при хирургическом лечении проксимальных расслоений аорты. Российский кардиологический журнал. 2018;(11):8-13. https://doi.org/10.15829/1560-4071-2018-11-8-13 Chernyavsky A.M., Lyashenko M.M., Syrota D.A., Khvan D.S., Kozlov B.N., Panfilov D.S., Lukinov V.L. Hybrid technology in the surgical treatment of proximal aortic dissection. Russian Journal of Cardiology. 2018;(11 ):8-13. (In Russ.) https://doi. org/10.15829/1560-4071-2018-11-8-13
- Hiratzka L.F., Bakris G.L., Beckman J.A., Bersin R.M., Carr V.F., Casey D.E. Jr, Eagle K.A., Hermann L.K., Isselbacher E.M., Kazerooni E.A., Kouchoukos N.T., Lytle B.W., Milewicz D.M., Reich D.L., Sen S., Shinn J.A., Svensson L.G., Williams D.M.; American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines; American Association for Thoracic Surgery; American College of Radiology; American Stroke Association; Society of Cardiovascular Anesthesiologists; Society for Cardiovascular Angiography and Interventions; Society of Interventional Radiology; Society of Thoracic Surgeons; Society for Vascular Medicine. 2010 ACCF/AHA/AATS/ACR/ ASA/SCA/SCAI/SIR/STS/SVM guidelines for the diagnosis and management of patients with Thoracic Aortic Disease: a report of the American College of Cardiology Foundation/ American Heart Association Task Force on Practice Guidelines, American Association for Thoracic Surgery, American College of Radiology, American Stroke Association, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of Thoracic Surgeons, and Society for Vascular Medicine. Circulation. 2010;121(13):e266-369. PMID: 20233780. https://doi.org/10.1161/CIR.0b013e3181d4739e
- Tan M.E.S.H., Morshuis W.J., Dossche K.M.E., Kelder J.C., Waanders F.G.J., Schepens M.A.A.M. Long-term results after 27 years of surgical treatment of acute type A aortic dissection. Ann Thorac Surg. 2005;80(2):523-529. PMID: 16039197. https:// doi.org/10.1016/j.athoracsur.2005.02.059
- Ma W.-G., Chen Y., Zhang W., Li Q., Li J.-R., Zheng J., Liu Y.-M., Zhu J.-M., Sun L.-Z. Extended repair for acute type A aortic dissection: long-term outcomes of the frozen elephant trunk technique beyond 10 years. J Cardiovasc Surg (Torino). 2020;61(3):292-300. PMID: 32077675.


