Тромбоз воротной вены: патогенетические механизмы, варианты течения и прогноз
Автор: Муркамилов И.Т., Айтбаев К.А., Юсупов А.Ф., Райимжанов З.Р., Юсупова Т.Ф., Юсупов Ф.А., Солижонов Ж.И., Закиров О.Т., Хабибуллаев К.К., Абдибалиев И.А.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 8 т.11, 2025 года.
Бесплатный доступ
Тромбоз воротной вены - редкое, но потенциально жизнеугрожающее состояние в клинике внутренних болезней, которое нередко протекает бессимптомно в так называемом «терапевтическом окне», затрудняя своевременную диагностику. Выделяют острый и хронический, окклюзионный и неокклюзионный, прогрессирующий и спонтанно регрессирующий варианты тромбоза. К факторам риска развития тромбоза воротной вены относятся как наследственные, так и приобретённые, локальные и системные причины. Наиболее распространённые из них включают приём пероральных контрацептивов, антифосфолипидный синдром, беременность и послеродовой период, дефицит антитромбина III, гипер- и дисфибриногенемию, гипергомоцистеинемию, мутации генов протромбина и фактора V Лейдена, дефицит протеинов С и S. Риск повышается при наличии злокачественных новообразований, хронических воспалительных заболеваний, нефротического синдрома, цирроза печени, ожирения, после трансплантации печени, при паразитарных инфекциях органов брюшной полости, а также на фоне диуретической терапии. Диагностика включает тщательный сбор анамнеза, оценку клинической картины, визуализацию сосудистого русла гепатобилиарной зоны, а также лабораторную оценку биохимических показателей и тромбоэластограмму. Острый тромбоз воротной вены сопровождается болевым синдромом в животе и/или признаками системного воспалительного ответа: лейкоцитозом, лимфопенией, гипоальбуминемией, повышением уровня С-реактивного белка, D-димера, фибриногена, прокальцитонина и ЛДГ. Обнаружение плотного тромба при визуализации указывает на его давность (примерно месяц). Рецидивирующий тромбоз может проявляться сочетанием каверномы, обструкцией ветвей воротной вены, болевым синдромом и асцитом. Повторные эпизоды болей в животе при тромбозе являются тревожным признаком прогрессирующей ишемии кишечника и неблагоприятного прогноза. Пациентам необходимо раннее назначение антикоагулянтной терапии для предотвращения роста тромба и новых эпизодов тромбоза. Препаратами выбора являются нефракционированный или низкомолекулярный гепарин, а также антагонисты витамина К (варфарин) с целью достижения МНО (международное нормализованное отношение) 2,0-3,0. Варфарин предпочтителен при отсутствии цирроза печени. При гепарин-индуцированной тромбоцитопении и невозможности контроля МНО альтернативой являются прямые пероральные антикоагулянты: ривароксабан (10-20 мг 1 раз в сутки), апиксабан (2,5-5 мг 2 раза в сутки), эдоксабан (15-30 мг, реже 60 мг в сутки). При их назначении необходим контроль функции печени и почек для снижения риска геморрагических осложнений. Локальный тромболизис показан при остром тромбозе, в то время как баллонная ангиопластика и/или стентирование без тромбэктомии могут быть безопасной и эффективной альтернативой. Восстановление проходимости воротной вены может занять от 6 до 12 месяцев. В статье представлен клинический случай тромбоза воротной вены у 31-летней пациентки в отдалённом послеродовом периоде на фоне антифосфолипидного синдрома.
Тромбоз воротной вены, d-димер, антитромбин iii, гомоцистеин, антитела к кардиолипинам, асцит, антикоагулянты, прогноз
Короткий адрес: https://sciup.org/14133518
IDR: 14133518 | УДК: 616-002.616.01/-099 | DOI: 10.33619/2414-2948/117/32
Текст научной статьи Тромбоз воротной вены: патогенетические механизмы, варианты течения и прогноз
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616-002.616.01/-099
Нижняя полая вена (inferior vena cava, IVC) является основным сосудом, отводящим венозную кровь от нижней половины тела, включая стенки и внутренние органы брюшной полости, а также нижние конечности [1].
IVC имеет сложное эмбриональное развитие и состоит из сегментов, различающихся по топографии и происхождению [2].
Согласно литературным данным, компьютерная томография с внутривенным контрастированием позволяет визуализировать различные анатомические варианты строения нижней полой вены [3].
Около 20% сердечного выброса поступает в печень через печёночную артерию и воротную вену. При этом печёночная артерия обеспечивает лишь 30% притока крови, но доставляет более 50% необходимого органу кислорода. Воротная вена (vena portae/vena portae hepatis), не имеющая клапанов, транспортирует 70–80% общего печёночного кровотока и около 50% кислорода. В воротах печени воротная вена и печёночная артерия делятся в соответствии с анатомическим строением органа, обеспечивая кровоснабжение всех восьми сегментов печени [4].
В отдельных исследованиях описаны ранее не известные варианты кровоснабжения печени и строения её протоковой системы [5].
У взрослого человека длина воротной вены составляет в среднем 5–8 см, а диаметр — 1,8–2,1 см [6].
Бюллетень науки и практики / Bulletin of Science and Practice Т. 11. №8 2025
Воротная вена собирает кровь от всех непарных органов брюшной полости, включая желудок, пищевод, селезёнку, поджелудочную железу, тонкий и толстый кишечник и др. Согласно данным ультразвукового исследования, нормальный диаметр воротной вены составляет 12–14 мм, а средняя линейная скорость кровотока варьирует от 12,4±3,5 до 15,0±4,4 см/с. Объёмная скорость кровотока в воротной вене в норме составляет от 426±240 до 578±312 мл/мин [7].
Диаметр селезёночной вены (vena lienalis) в пределах нормы составляет 6–8 мм. При допплерографическом исследовании распределение кровотока в системе воротной вены может быть вариативным: возможно преобладание кровотока в правой или левой ветви, а также наличие коллатерального сброса между различными венозными бассейнами. В норме допплерограмма демонстрирует типичный венозный спектр с гепатопетальным направлением кровотока (в сторону печени) [7].
Патология венозных сосудов и связанные с ней тромбоэмболические осложнения занимают одно из ведущих мест в структуре неотложных состояний. Согласно опубликованным данным, частота венозных тромбозов составляет от 10 до 35%, а по результатам аутопсий достигает 60% [8].
В общей популяции риск венозных тромбозов выше у лиц с ожирением, злокачественными новообразованиями, нефротическим синдромом, у беременных, а также у женщин, принимающих пероральные контрацептивы, даже в низких дозах. Дополнительными предрасполагающими факторами к тромбозу воротной вены являются инфекции брюшной полости, цирроз печени, пересадка печени, терапия петлевыми диуретиками и длительное применение глюкокортикостероидов.
Согласно литературным данным, тромбоз воротной вены представляет собой частичную или полную окклюзию её просвета вследствие образования тромба [9].
Распространённость тромбоза воротной вены в общей популяции составляет 1–1,5%. Как показывает клиническая практика, в последние годы выявляемость этой патологии возросла благодаря широкому внедрению неинвазивной допплерографии сосудов гепатобилиарной системы. Факторы, способствующие развитию тромбоза воротной вены, приведены в Таблице 1.
Таблица 1
ФАКТОРЫ РИСКА ТРОМБОЗА ВОРОТНОЙ ВЕНЫ [9, 10]
С возрастом увеличивается частота венозных тромбоэмболических осложнений, включая тромбоз воротной вены. Это связано с уменьшением эластичности и податливости сосудистой стенки, снижением фибринолитической активности крови, а также с ограничением физической активности. Согласно литературным данным, риск развития тромботических состояний удваивается примерно каждые 10 лет жизни, что обусловлено ухудшением венозного оттока, усилением венозного стаза и снижением физической активности [11].
Кроме того, с возрастом изменяются концентрация и биологические свойства антитромбина III — одного из ключевых естественных антикоагулянтов. Его дефицит может наблюдаться как у мужчин, так и у женщин, поскольку наследуется по аутосомнодоминантному типу. В настоящее время описано несколько типов дефицита антитромбина III, представленных в Таблице 2.
|
Таблица 2 КЛАССИФИКАЦИЯ ДЕФИЦИТА АНТИТРОМБИНА III В КРОВИ [12] |
|
|
Типы |
Характеристика |
|
I тип |
Снижение как антигенной, так и функциональной антитромбогенной активности в крови. У гетерозиготных носителей обе величины снижены примерно на 50%. В основе типа лежат более 80 различных мутаций. |
|
II тип |
Наиболее распространенный вариант. Характеризуется внутримолекулярным дефектом – нарушением молекулярной структуры белка. При нормальной антигенной активности наблюдается выраженное снижение фунциональной активности, что существенно повышает риск венозных тромбозов. |
|
III тип |
Уровни антигена и функциональной активности антитромбина находятся в пределах нормы, однако нарушено взаимодействие с гепарином, без которого антитромбин реализует свою функцию крайне медленно. У 70% пациентов со сниженной антитромбиновой активностью отмечаются тромбоэмболические осложнения до 50летнего возраста. Для детского возраста клинические проявления, как правило, нехарактерны. |
В последние годы в клинической медицине активно изучается роль гомоцистеина — молекулы, метаболические нарушения которой играют определённую роль в развитии сосудистых тромбозов. Повышение сывороточной концентрации гомоцистеина при сохранённой функции почек может рассматриваться как предиктор атеросклеротических и тромбоэмболических заболеваний [13].
Причинами гипергомоцистеинемии могут быть полиморфизмы генов фолатного цикла, выраженный дефицит фолиевой кислоты, недостаток витаминов группы B и другие факторы. Ранее А. С. Петриков и соавт. сообщили, что в 75,4% случаев гипергомоцистеинемия у пациентов с венозными тромбоэмболическими осложнениями обусловлена мутациями генов фолатного цикла, в частности, метилентетрагидрофолатредуктазы [14].
Сниженная активность аллельных полиморфизмов генов фолатной группы, таких как MTHFR 677C→T, MTR 2756A→G и MTRR 66A→G, может приводить к нарушению метилирования гомоцистеина и его накоплению в организме. Гипергомоцистеинемия обладает двояким патофизиологическим эффектом. Во-первых, в условиях повышенного уровня гомоцистеина усиливается повреждение эндотелия сосудов и увеличивается агрегационная способность тромбоцитов. Во-вторых, снижение активности фермента MTR связано с угнетением продукции и/или нарушением биологического действия оксида азота. В аналитическом исследовании отмечено, что гипергомоцистеинемия ассоциируется с подавлением продукции тромбомодулина, снижением активности антитромбина III и эндогенного гепарина, а также с активацией синтеза тромбоксана А2 [15]. Таким образом, структурно-функциональная перестройка сосудистой стенки на фоне гипергомоцистеинемии способствует развитию венозных тромбозов и эмболий.
Следует учитывать, что с возрастом уровень гомоцистеина в сыворотке крови имеет тенденцию к увеличению. В связи с этим у пожилых пациентов стабильно высокие значения гомоцистеина могут рассматриваться как прогностический маркёр сосудистых тромбозов. Цирроз печени и гепатоцеллюлярная карцинома являются наиболее частыми причинами развития тромбоза воротной вены у пожилых пациентов. На стадии метастазирования злокачественных опухолей повреждение венозной стенки активирует тромбогенный потенциал крови. Тромбоз воротной вены может также развиться при злокачественных новообразованиях поджелудочной железы. Острый тромбоз воротной вены нередко регистрируется после трансплантации печени. Длительная иммобилизация, венозный застой при шоковых состояниях, катетеризация центральных вен могут способствовать развитию гиперкоагуляции и, как следствие, приводить к венозным тромбозам, включая тромбоз воротной вены. Тромбоз воротной вены может возникать и при ряде неонкологических состояний: острый аппендицит, обострение хронического панкреатита, воспалительные заболевания кишечника, холангит, эритроцитоз, политравма. Риск его возникновения также повышается при ожогах, сепсисе и в послеродовом периоде. Известно, что сосудистые осложнения во время беременности, особенно начиная с 27 недели, значительно повышают риск тромбозов и тромбоэмболических осложнений в послеродовом периоде. Исследования показывают, что тромбоз воротной вены часто остаётся недиагностированным из-за своего бессимптомного течения в так называемом «терапевтическом окне», что существенно затрудняет своевременное начало лечения [8].
Каждый второй пациент с острым тромбозом воротной вены погибает вследствие несвоевременной диагностики. Следует подчеркнуть, что на сегодняшний день не разработаны чёткие алгоритмы диагностики и профилактики тромбоза воротной и селезёночной вен. Патогенетические механизмы тромбоза воротной вены. Классическими механизмами тромбообразования являются повреждение сосудистой стенки (в первую очередь — эндотелия), нарушение кровотока (гемодинамики, венозный стаз) и изменения в системе гемостаза (гиперкоагуляция). Согласно данным литературы, артериальные тромбы преимущественно состоят из тромбоцитов и фибрина, тогда как венозные тромбы формируются главным образом из фибрина и эритроцитов, хотя могут также содержать различное количество тромбоцитов и лейкоцитов [11].
Гиперпродукция воспалительных цитокинов, таких как интерлейкин-6, интерлейкин-8, интерлейкин-12, интерлейкин-17, интерлейкин-18 и фактор некроза опухоли-α, приводит к повреждению эндотелия, активации лейкоцитов и их миграции к сосудистой стенке. Потеря антитромбина III с мочой при массивной протеинурии, а также наследственный дефицит антитромбина III и протеина S являются прямыми причинами развития сосудистых тромбозов и тромбоэмболических осложнений [16].
У женщин репродуктивного возраста венозные тромбоэмболические события часто связаны с антифосфолипидным синдромом (АФС) [17].
Согласно последним данным, АФС как клинико-лабораторный синдром чаще развивается в среднем возрасте [18, 19].
В острой фазе заболевания у пациентов с АФС нередко выявляется тромбоцитопения. Следует помнить, что АФС практически всегда является приобретённой формой тромбофилии. При АФС в организме вырабатываются аутоантитела к фосфолипидным компонентам клеточных мембран, либо к фосфолипид-связывающим белкам плазмы крови.
Тромбозы различной локализации чаще наблюдаются у пациенток с повышенным уровнем аутоантител к кардиолипину и β2-гликопротеину I класса IgG [20].
Следует отметить, что у 40% пациентов с системной красной волчанкой выявляется АФС, однако менее чем у 40% из них регистрируются эпизоды тромбозов [21].
Общеизвестно, что беременность и роды рассматриваются как важные факторы риска развития тромбозов. У беременных женщин нарушение венозного оттока обусловлено механическим сдавлением сосудов растущей маткой и дилатацией глубоких вен. Особенно уязвимыми к венозным тромботическим событиям являются женщины в третьем триместре беременности и в родах. Это связано с физиологическим состоянием гиперкоагуляции, характерным для поздних сроков беременности, которое включает повышение уровня фибриногена, а также факторов свертывания VII, VIII и IX, на фоне снижения фибринолитической активности крови [17].
С патофизиологической точки зрения, тромбоз сосудов развивается стадийно. Первая стадия — острая, сопровождается формированием тромба, который может частично флюктуировать (подострый процесс). Вторая стадия — реканализация, при которой происходит частичное разрушение тромба и восстановление кровотока по поражённому сосуду. Мелкие тромбы, как правило, подвергаются спонтанному лизису под действием протеолитических ферментов, высвобождаемых лейкоцитами. Крупные тромбы чаще подвергаются организации — процессу замещения тромботических масс соединительной тканью. По мере замещения тромба соединительной тканью в его структуре образуются каналы, выстланные эндотелием, — происходит так называемая реканализация. В дальнейшем эти каналы могут превращаться в полноценные сосуды, содержащие кровь, что свидетельствует о васкуляризации тромба и зачастую приводит к частичному восстановлению проходимости сосуда. Однако организация тромба не всегда завершается реканализацией и васкуляризацией. В ряде случаев возможно отложение солей кальция с последующей петрификацией тромба. При этом в просвете вен могут формироваться флеболиты — камнеподобные образования [22].
В клинической практике тромбоз воротной вены часто проявляется тромбоэмболией легочных сосудов. Научно-клиническое исследование, выполненные рядом авторов показали, что при тромбозе воротной вены ведущими симптомами являются боли в животе, увеличение печени, накопление жидкости в брюшной полости и повышение активности печеночных ферментов [23].
В клинике внутренних болезней о тромбозе воротной вены или ее ветвей следует думать во всех случаях внезапного появления болей в эпигастральной области, сочетающихся с резким вздутием живота, быстрым накоплением жидкости в брюшной полости, повторной рвотой [24].
Патоморфологические и прогностические особенности тромбоза воротной вены, как правило, освещаются в формате клинических наблюдений. Описан случай тромбоза воротной вены у 49-летнего пациента, страдавшего острым панкреатитом и хроническим алиментарно-токсическим гепатитом [22]. У пациента были зафиксированы значительные изменения биохимических показателей печени — высокий уровень аланинаминотрансферазы (АлТ) и гамма-глутамилтранспептидазы (ГГТ), что подчёркивает необходимость проведения мультиспиральной компьютерной томографии (МСКТ) органов брюшной полости при подозрении на тромбоз воротной вены.
В другом клиническом случае, представленном в исследовании, описан тромбоз воротной вены у 20-летнего пациента, причиной которого явилась истинная полицитемия[24].
При этом уровень печёночных трансаминаз оставался в пределах нормы, однако наблюдались тромбоцитоз и повышение общего белка в крови. Клиническая картина у молодых пациентов, как правило, дебютирует выраженным болевым синдромом в животе, увеличением печени и селезёнки. Отмечается, что тромбоз воротной вены может возникать как на фоне хронических заболеваний органов брюшной полости, так и при отсутствии явной сопутствующей патологии, особенно в острый период.
В одном из исследований представлен случай диагностики и успешного лечения протяжённого тромбоза воротной, селезёночной и верхней брыжеечной вен у 49-летнего пациента К.В.А., перенёсшего коронавирусную инфекцию средней степени тяжести [8]. Заболевание осложнилось инфарктами селезёнки и почек, гидроперитонеумом и частичной тонкокишечной непроходимостью. Лечение включало применение прямых антикоагулянтов и полуселективного тромболизиса. По данным авторов, у данного пациента были исключены заболевания печени и врождённые формы тромбофилии как возможные причины тромбоза.
В то же время, по другим данным, тромбоз воротной вены может не сопровождаться нарушениями печёночной функции [25].
По нашему мнению, повышение активности печёночных ферментов у пациентов с тромбозом воротной вены чаще наблюдается в острой фазе заболевания или при наличии АФС. Согласно литературным источникам, одним из ультразвуковых признаков тромбоза воротной вены является заполнение просвета сосуда содержимым средней эхогенности.
Лечение тромбоза воротной вены. Современные подходы к лечению тромбоза воротной вены включают системный или локальный тромболизис, тромбэктомию, интервенционную ангиопластику, трансъюгулярное внутрипечёночное портосистемное шунтирование (TIPS -чрескожный малоинвазивный метод создания калиброванного внутри-печеночного портосистемного шунта для декомпрессии портальной гипертензии), а также антикоагулянтную терапию [26].
Согласно международным рекомендациям, всем пациентам с острым тромбозом воротной вены показана антикоагулянтная терапия продолжительностью не менее трёх месяцев [25, 26].
Лечение, как правило, начинают с применения низкомолекулярного гепарина, с последующим переходом на пероральные антикоагулянты. Отмечается, что использование антикоагулянтов не увеличивает риск развития кровотечений. Более того, своевременно начатая антикоагулянтная терапия позволяет снизить риск инфаркта кишечника и, как следствие, выраженность болевого синдрома в животе.
С учётом высокой частоты рецидивов тромбоза воротной вены, некоторые авторы рекомендуют продлевать антикоагулянтную терапию до шести месяцев [26].
По данным российских исследователей, повышенный риск венозных тромбозов сохраняется в течение шести недель после родоразрешения. В связи с этим при выявлении у беременных женщин дефицита антитромбина III, гомозиготной мутации фактора V Лейдена или протромбина показано проведение профилактической антикоагулянтной терапии в течение всей беременности и не менее шести недель после родов [9-12].
Пациентам с установленным диагнозом тромбоза воротной вены антикоагулянтная терапия должна быть назначена как можно раньше с целью предотвращения прогрессирования тромбообразования и развития новых эпизодов тромбоза. В качестве антикоагулянтов могут использоваться нефракционированный или низкомолекулярный гепарин, либо антагонисты витамина К с целевым уровнем международного нормализованного отношения (МНО) в пределах 2,0–3,0. Варфарин рекомендуется преимущественно пациентам без цирроза печени.
При наличии гепарин-индуцированной тромбоцитопении или невозможности регулярного контроля МНО возможно применение прямых оральных антикоагулянтов: ривароксабан (10–20 мг 1 раз в сутки), апиксабан (2,5–5 мг 2 раза в сутки) или эдоксабан (15–30 мг, реже 60 мг 1 раз в сутки). На фоне антикоагулянтной терапии необходим регулярный контроль функции печени и почек с целью предупреждения геморрагических осложнений.
Локальный тромболизис считается обоснованным в случае острого тромбоза воротной вены. В некоторых случаях баллонная ангиопластика и/или установка стента без выполнения тромбэктомии или тромболизиса могут быть безопасной и эффективной альтернативой [27].
Восстановление проходимости воротной вены может занимать от 6 до 12 месяцев [26].
Описание клинического случая. Пациентка А., 31 года, поступила 13.04.2025 в многопрофильный госпиталь “DOC University Clinic” г. Бишкек с жалобами на тошноту, рвоту после приёма пищи, головную боль, головокружение, выраженную мышечную слабость, сухость во рту, жажду, олигурию, отёки в области живота и нижних конечностей, учащённое сердцебиение и повышение температуры тела до 37,5 °C. Заболевание дебютировало в начале апреля 2025 года с болью в животе, тошноты, рвоты, ежедневного вечернего повышения температуры тела до 37 °C, увеличения объёма живота и появления отёков на нижних конечностях. До госпитализации пациентка неоднократно проходила обследование и лечение по месту жительства. При обследовании от 04.04.2025 выявлено повышение активности печёночных трансаминаз. УЗИ органов брюшной полости показало гепатоспленомегалию и асцит. МРТ брюшной полости выявило признаки тромбоза воротной и нижней полой вены. Эхокардиография патологических изменений не выявила.
Анамнез жизни: контакта с инфекционными больными не отмечает. Беременностей и родов — пять. Шесть месяцев назад родила здорового ребёнка путём кесарева сечения. Ухудшение самочувствия отмечает с начала апреля 2025 года. По месту жительства была осмотрена гинекологом, инфекционистом и онкологом. В связи с выраженным асцитом был установлен дренаж брюшной полости для эвакуации жидкости (Рисунок 1).
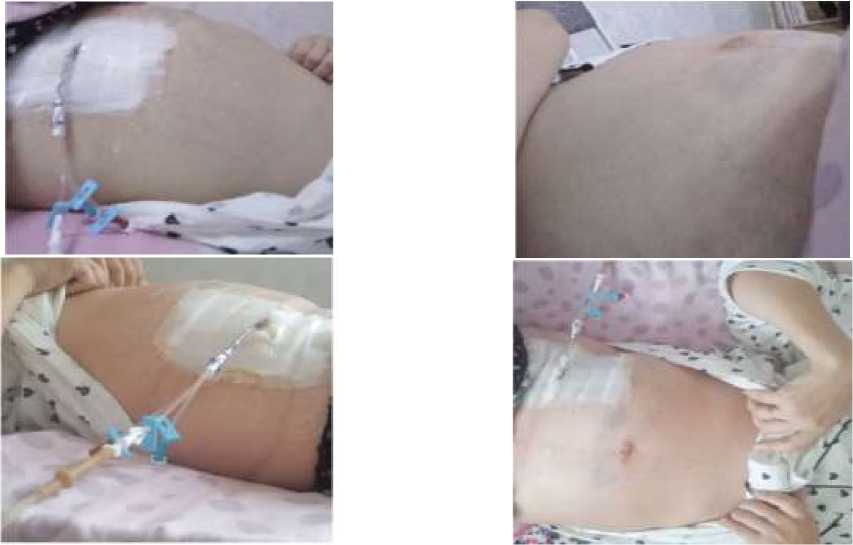
Рисунок 1. Пациентка А., 31 год, с выраженным асцитом на фоне тромбоза воротной вены. Виден установленный дренаж в брюшной полости
При поступлении общее состояние пациентки тяжёлое. Кожа и видимые слизистые оболочки бледные. Выраженный асцит, отёки нижних конечностей. Частота сердечных сокращений — 140 в минуту, артериальное давление — 90/60 мм рт. ст. В лёгких выслушивается везикулярное дыхание, хрипов нет. Частота дыхания — 20–24 в минуту. На ЭКГ от 13.04.2025 — синусовая тахикардия, неполная блокада правой ножки пучка Гиса.
Общий анализ крови (ОАК): гемоглобин — 110 г/л, гематокрит — 33,2%, эритроциты — 4,69х1012/л, тромбоциты — 152х109/л, лейкоциты — 7,45х109/л, лимфоциты — 30,8%, эозинофилы — 0,7%, скорость оседания эритроцитов (СОЭ) — 14 мм/ч. ОАК в динамике: гемоглобин — 114 г/л, гематокрит — 35,4%, эритроциты — 5,05×10¹²/л, тромбоциты — 275х109/л, лейкоциты — 10,08х109/л, лимфоциты — 33,5%, эозинофилы — 0,9%, СОЭ — 12 мм/ч.
Общий анализ мочи (ОАМ): выявлена эритроцитурия — изменённые и неизменённые эритроциты в поле зрения. Белок и глюкоза в моче не обнаружены.
Биохимический анализ крови: глюкоза венозной крови натощак — 3,38 ммоль/л; железо — 2,63 мкмоль/л (норма: 7,20–27,00); альбумин — 27,4 г/л (норма: 35,0–50,0); гамма-глутамилтрансфераза (ГГТ) — 38 Ед/л (норма: 0–49); аспартатаминотрансфераза (АсТ) — 257 Ед/л (норма: 0–49); аланинаминотрансфераза (АлТ) — 154 Ед/л (норма: 0–49). Антитела к фосфолипидам: антитела к кардиолипину IgG — 57,98 Ед/мл (норма до 44 – антител нет); антитела к кардиолипину IgM — 35,82 Ед/мл (норма до 48 – антител нет). Показатели липидного обмена: общий холестерин — 1,49 ммоль/л; холестерин ЛПВП — 0,32 ммоль/л; холестерин ЛПНП — 1,04 ммоль/л; триглицериды — 0,55 ммоль/л. Оценка функции почек: креатинин — 59,0 мкмоль/л (норма: 44,0–84,0); остаточный азот — 17,5 ммоль/л (норма: 10,6–24,4); мочевина — 5,0 ммоль/л (норма: 1,7–8,3); цистатин C — 0,73 мг/л (норма: 0,47– 1,09); гомоцистеин — 8,9 мкмоль/л (норма: 3,4–20,4); паратгормон — 48,1 пг/мл (норма: 15,0–65,0); скорость клубочковой фильтрации (СКФ) по формуле CKD-EPI — 115 мл/мин.
Показатели электролитного обмена: уровень калия составил 3,80 ммоль/л (норма: 3,30– 5,50), натрия — 130 ммоль/л (норма: 130,00–155,00), кальция — 1,94 ммоль/л (ниже нормы: 2,15–2,50), неорганического фосфора — 0,50 ммоль/л (норма: 0,48–2,20).
Показатели острой фазы воспаления: отмечено повышение уровня С-реактивного белка (СРБ) — 35,22 мг/л (норма: 0,00–8,00) и активности лактатдегидрогеназы (ЛДГ) — 402 МЕ/л (норма: 135,00–214,00). Уровень фибриногена — 2,90 г/л (в пределах нормы). Ферритин — 34,9 нг/мл (норма: 13,00–150,00). D-димер — 1,51 мкг/мл (значительно повышен; норма: 0,00–0,55). Уровень тропонина I < 0,1 нг/мл (норма: 0,40–3,00).
Функция щитовидной железы при первичном обследовании: Т3 — 1,76 нмоль/л (норма: 1,08–3,14), Т4 — 106 нмоль/л (норма: 59,00–135,00), ТТГ — 1,68 мМЕ/л (норма: 0,40–4,00). В динамике: Т3 — 1,69 нмоль/л, Т4 — 109 нмоль/л, ТТГ — 2,13 мМЕ/л. Уровень тиреоглобулина — 21,5 нг/мл (норма: 0,0–55,0), антитела к тиреопероксидазе (АТ-ТПО) — 10,5 МЕ/мл (норма: 0,00–34,00). Пролактин — 284 мМЕ/л (в пределах нормы: 102,00– 496,00). Уровень фолиевой кислоты — 6,49 нг/мл (норма: 3,10–20,00). Онкомаркеры: уровень раково-эмбрионального антигена (РЭА) — 1,34 нг/мл (норма: 0,00–5,00), СА 19-9 — 20,1 МЕ/мл (норма: 0,00–35,00), при этом отмечено значительное повышение уровня СА 125 — 136 МЕ/мл (норма: 0,00–35,00).
Инструментальные методы исследования. По данным ультразвукового дуплексного сканирования сосудов нижних конечностей признаков тромбоза не выявлено. На УЗИ органов брюшной полости визуализированы признаки тромбоза воротной вены и нижней полой вены в стадии реканализации (Рисунок 4-7). Также отмечаются эхо-признаки диффузных изменений паренхимы печени и накопление свободной жидкости в брюшной полости. МРТ органов малого таза очаговой патологии не выявила. При УЗИ щитовидной железы патологических изменений не обнаружено. По данным допплерографии печени: кровоток в воротной вене сохранён, но ослаблен; определяется пристеночное гипоэхогенное включение (Рисунок 5). Диаметр портальной вены — 8,6 мм, холедох — 2,0 мм. Параметры печёночной артерии: PSV — 54 см/с, EDV — 13 см/с, индекс резистентности (RI) — 0,76. Тазовая артерия: максимальная скорость потока (ТА max) — 26 см/с. Диаметр селезёночной вены — 4,6 мм. Эхокардиография в динамике признаков сердечной патологии не выявила.
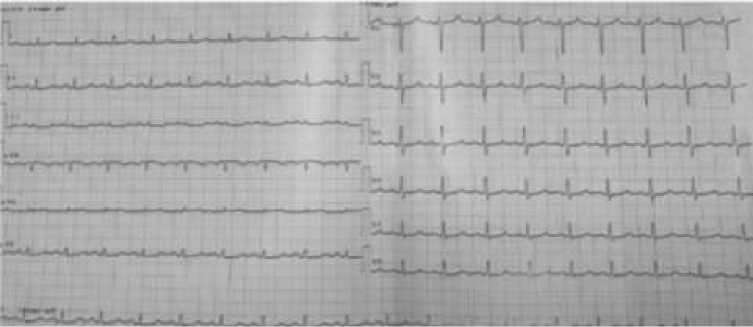
Рисунок 2. Электрокардиография пациентки А., 31 лет с тромбозом воротной вены
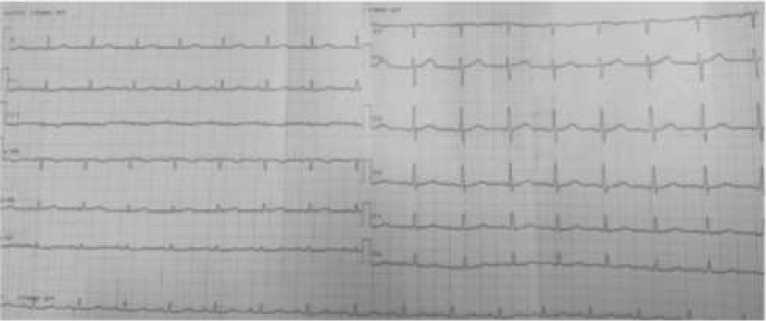
Рисунок 3. Электрокардиография пациентки А., 31 лет с тромбозом воротной вены
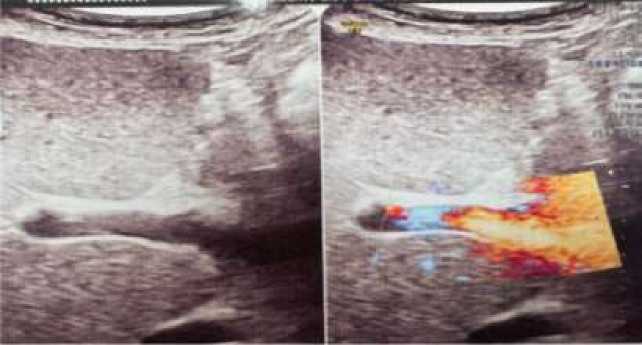
Рисунок 4. УЗИ печени пациентки А., 31 лет с тромбозом воротной вены
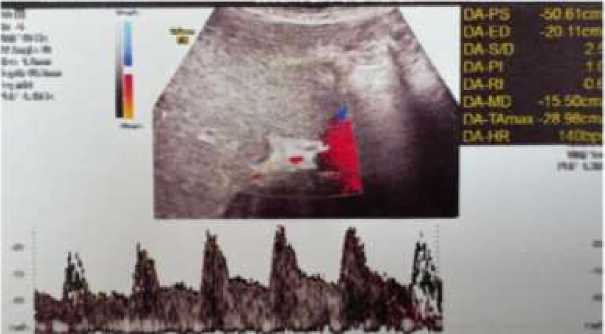
Рисунок 5. УЗИ печени (режим ЦДК) пациентки А., 31 лет с тромбозом воротной вены
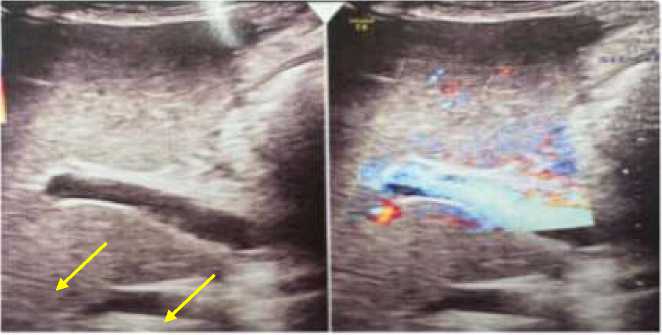
Рисунок 6. УЗИ печени (режим ЦДК) пациентки А., 31 лет с тромбозом воротной вены. В просвете сосуда визуализируется гиперэхогенное образование с неровными контурами (стрелка)
Клинический диагноз: тромбоз воротной вены. Тромбоз нижней полой вены, стадия частичной реканализации. Реактивный гепатит. Асцит. Вторичный антифосфолипидный синдром.
Проводимая терапия. Пациентка получала комплексное лечение, включающее: антикоагулянтную терапию — гепарин; венотоники — детралекс, флебодиа; гепатопротектор — гептрал; диуретики — верошпирон, фуросемид; антибактериальную терапию — цефтриаксон; β-адреноблокатор — бисопролол.
Пациентка продолжает динамическое наблюдение на клинической базе кафедры факультетской терапии. По данным УЗИ печени, сохраняется картина тромбоза воротной вены на стадии реканализации.
Общий анализ крови (на фоне проводимой терапии): гемоглобин — 110 г/л; гематокрит — 33,4%; эритроциты — 4,87х1012/л; тромбоциты — 226х109/л; лейкоциты — 9,1*109/л; лимфоциты — 25,1%; эозинофилы — 1,1%; скорость оседания эритроцитов (СОЭ) — 10 мм/ч.
В динамике лечения и наблюдения: отмечалось снижение уровня альбумина до 23 г/л (норма: 35,0–50,0), повышение ГГТ до 71 U/L (норма: 0,00–49,00), АсТ — до 184,1 Ед/л (норма: 0,00–49,00), АлТ — до 108,0 Ед/л (норма: 0,00–49,00). Нарушения коагулограммы: МНО — 1,25 (норма: 0,80–1,20), протромбин — 64 % (норма: 70–140), АЧТВ — 41,1 сек (норма: 25,1–37,0). Альфа-фетопротеин — 4,01 МЕ/мл (норма: 0,00–10,00). Мочевая кислота — 0,26 ммоль/л (норма: 0,14–0,31).
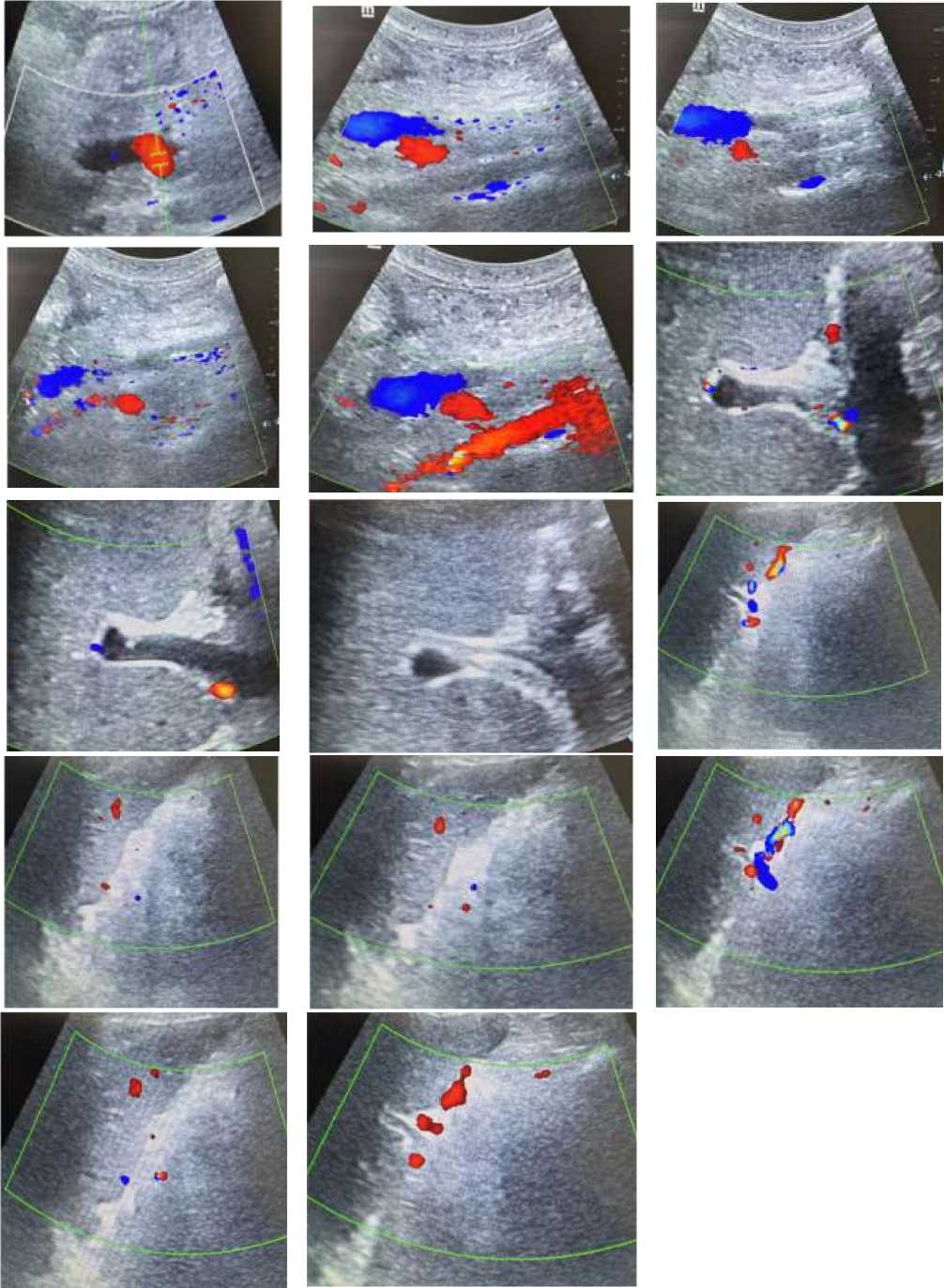
Рисунок 7. УЗИ печени (режим ЦДК) пациентки А., 31 лет с тромбозом воротной вены
В общем анализе мочи признаки мочевого синдрома не выявлены. При контрольных исследованиях: альбумин — 20,9 г/л (норма: 35,0–50,0), АсТ — 68,9 Ед/л, АлТ — 44,5 Ед/л, МНО — 1,20, протромбин — 69 %, АЧТВ — 31,9 сек, протромбиновое время — 14,6 сек (все показатели — с отклонениями от нормы). Уровень калия — 5,0 ммоль/л (норма: 3,3–5,5). Показатели острой фазы воспаления: С-реактивный белок — 18,57 мг/л (норма: 0,00–8,00), фибриноген — 3,80 г/л (норма: 1,80–4,00), D-димер — 4,53 мкг/мл (норма: 0,00–0,55).
Заключение
Тромбоз воротной вены — редкое, но потенциально жизнеугрожающее состояние. Полученные данные, а также сведения из литературы подчёркивают важность своевременной диагностики и начала лечения. Особое внимание заслуживают венозные тромбозы, в частности тромбоз воротной вены, а также антифосфолипидный синдром в послеродовом периоде. Совершенствование принципов диагностики, ведения и терапии данной патологии остаётся актуальной задачей современной медицины. В этой связи особенно значимы дальнейшие исследования, направленные на расширение знаний о патогенезе и возможностях профилактики, что позволит снизить материнскую и перинатальную заболеваемость и смертность.
Вклад авторов: И. Т. Муркамилов — ведение пациентки, написание данной статьи, суммирование всех данных лабораторной и инструментальной диагностики; К. А. Айтбаев — редактирование статьи; А. Ф. Юсупов., З. Р. Райимжанов, Т. Ф. Юсупова, Ф. А. Юсупов, Ж. И. Солижонов., О. Т. Закиров., К. К. Хабибуллаев., И. А. Абдибалиев — литературный обзор современных сведений и рекомендаций по ведению пациентов с данной патологией.
Прозрачность исследования. Исследование не имело спонсорской поддержки. Авторы несут полную ответственность за предоставление окончательной версии рукописи в печать.
Декларация о финансовых и других взаимоотношениях . Все авторы принимали участие в разработке концепции статьи и в написании рукописи. Окончательная версия рукописи была одобрена всеми авторами. Авторы не получали гонорар за статью.


