Участие эндогенных агонистов опиоидных рецепторов в повышении устойчивости сердца к повреждающему действию реперфузии
Автор: Мухомедзянов Александр Валерьевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.32, 2017 года.
Бесплатный доступ
Установлено, что при внутривенном введении неселективный антагонист опиоидных рецепторов (ОР) налтрексон (5 мг/кг), а также селективный антагонист δ1-ОР BNTX (0,7 мг/кг), селективный блокатор δ2-ОР налтрибен (0,3 мг/кг), селективный антагонист κ-ОР нор-биналторфимин (2 мг/кг) не влияют на реперфузионное повреждение сердца in vivo. Установлено, что селективный антагонист μ-ОР СТАР ограничивает размер инфаркта.
Опиоидные рецепторы, опиоиды, сердце, реперфузия
Короткий адрес: https://sciup.org/14920160
IDR: 14920160 | УДК: 616.12-008
Текст научной статьи Участие эндогенных агонистов опиоидных рецепторов в повышении устойчивости сердца к повреждающему действию реперфузии
В 70-е и 80-е годы прошлого столетия были обнаружены эндогенные опиоиды [5]. Затем последовало открытие ОР на сарколемме кардиомиоцитов [11]. В экспериментах на изолированном сердце было установлено, что блокада μ-ОР перед ишемией способствует уменьшению развития реперфузионной контрактуры [1]. Блокада δ- и κ-ОР перед ишемией, напротив, способствует ухудшению реперфузионной сократительной дисфункции изолированного сердца [10]. Есть данные о том, что блокада всех типов периферических ОР приводит к повышению устойчивости сердца к аритмогенному действию корона-роокклюзии [7]. Эти данные говорят о том, что эндогенные агонисты ОР могут регулировать устойчивость сердца к патогенному действию ишемии. Однако остается неясным, как влияют на размер зоны инфаркта эндогенные опиоиды при воздействии реперфузии in vivo. Впер- вые будет изучено участие эндогенных агонистов ОР в повышении устойчивости сердца к действию реперфузии.
Цель исследования: выяснить, влияют ли эндогенные агонисты ОР на размер зоны инфаркта при действии реперфузии in vivo.
Материал и методы
Исследование было выполнено на 120 крысах-самцах линии Вистар массой 250–300 г. Животных наркотизировали внутрибрюшинным введением α -хлоралозы (60 мг/кг, внутрибрюшинно, Sigma) и подключали к аппарату искусственной вентиляции легких “SAR-830 Series” (CWE Inc. США). Коронароокклюзию и реперфузию осуществляли по методу J.E. Schultz и соавт. [9]. Регистрация АД осуществлялась с помощью датчика давления SS13L (BiopacSystemInc., Goleta, Калифорния, США), сопряжен-
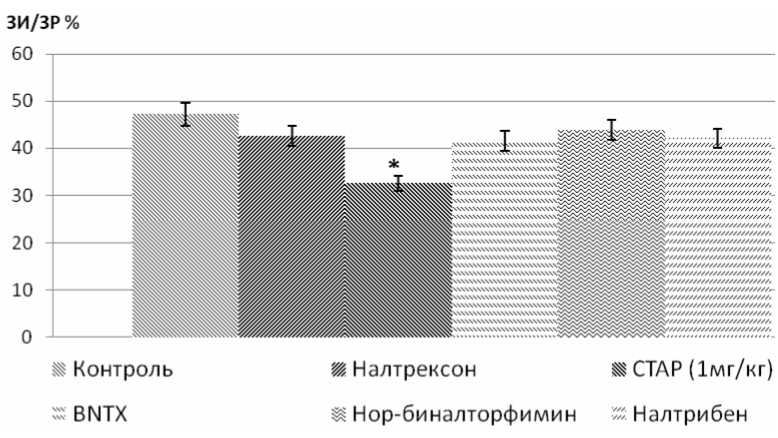
Рис. 1. Размер ЗИ/ЗР при 45-минутной коронароокклюзии и 120-минутной реперфузии у крыс (M±SEM): *p<0,05 по сравнению с контролем
ного с аппаратом для электрофизиологических исследований MP35 (BiopacSystemInc., Goleta, США). Измерение артериального давления проводили путем каннюлирова-ния правой сонной артерии с помощью датчика давления SS13L (BiopacSystemInc., Goleta, Калифорния, США), сопряженного с аппаратом для электрофизиологических исследований MP35 (BiopacSystemInc., Goleta, США) и персональным компьютером компании Intel. Данный прибор также использовался для регистрации ЭКГ. После 45 мин ишемии лигатуру снимали и восстановление кровотока подтверждали появлением эпикардиальной гиперемии. Продолжительность реперфузии составляла 2 ч. Выявление зоны некроза и области риска проводили по методу J. Neckar и соавт. [8]. После реперфузии сердце удаляли из грудной клетки и промывали ретроградно через аорту физиологическим раствором. Для определения зоны риска (ЗР) лигатуру вновь затягивали и миокард окрашивали струйно через аорту 5%-м перманганатом калия. ЗР принято называть миокард, подвергнутый ишемии-реперфузии. После промывки физиологическим раствором делали срезы сердца толщиной в 1 мм перпендикулярно к продольной оси с помощью слайсера HSRA001-1 (ZivicInstruments, Pittsburgh, США). Визуализацию зоны некроза от ЗР осуществляли путем окрашивания 1%-м раствором 2,3,5-трифенил тетразолия хлорида в течение 30 мин при 37 °C. В основе метода лежит способность 2,3,5-трифенил тетразолия хлорида приобретать стойкую окраску при переходе из окисленного состояния в восстановленное под действием дегидрогеназ. Поскольку в погибших кардиомиоцитах отсутствовали дегидрогеназы, некротизированный миокард не окрашивался. После окончания окраски срезы помещали в 10%-й раствор формальдегида на 1 сутки. Срезы сканировали с обеих сторон сканером HP Scanjet G4050. Размер ЗР и зоны инфаркта (ЗИ) определяли компьютеризированным планиметрическим методом. Размер ЗИ вы- ражали в процентах от размера зоны гипоперфузии (ЗР), как соотношение ЗИ/ЗР.
Все антагонисты ОР вводили внутривенно за 10 мин до реперфузии. Для блокады всего пула ОР использовали налтрексон в дозе 5 мг/кг, производство “Sigma-Aldrich” (St. Louis, США). Для блокады μ -ОР применяли CTAP (NH2-D-Phe-c[Cys-Tyr-D-Trp-Arg-Thr-L-Pen]-Thr-NH2), который вводили в дозе 1 мг/кг, синтезирован в “Multiple Peptide Systems” (San Diego, США). Ингибирование δ 1-ОР осуществляли с помощью введения BNTX (7-Benzylidenenaltrexone) в дозе 0,7 мг/кг, а блокаду δ 2-ОР – с помощью налтрибена в дозе 0,3 мг/кг, оба ингибитора были приобретены в “Tocris Bioscience” (Bristol, Великобритания). Антагонист κ -ОР нор-биналторфимин применяли в дозе 2 мг/кг, был закуплен в “Sigma-Aldrich” (St. Louis, США). В группу контроля были включены животные, которым внутривенно вводили физиологический раствор из расчета 1 мл/кг. При выборе доз препаратов мы руководствовались данными литературы [2, 6, 12].
Налтрексон, CTAP и нор-биналторфимин растворяли в 0,9%-м NaCl. Налтрибен, BNTX растворяли в 0,1 мл DMSO, а затем в 0,9 мл 20%-го гидроксипропил- β -цикло-декстрине.
Статистическую обработку данных проводили с помощью пакетов программы “STATISTICA 6.0”. Для оценки значимости различий полученных результатов использовали критерий Манна–Уитни. Статистически значимыми считались различия при p<0,05. Результаты всех экспериментов представлены в виде среднего арифметического (М) ± стандартной ошибки среднего (SEM).
Результаты
Как показано на рисунке 1, в контрольной группе соотношение ЗИ/ЗР составило 47%. После внутривенного введения блокатора всего пула ОР налтрексона не было выявлено статистически значимого изменения соотношения ЗИ/ЗР по отношению к контролю. Стоит отметить, что налтрексон имеет различную степень сродства по отношению к отдельным типам ОР. В связи с этим дальнейшие наши исследования были направлены на изучение блокаторов каждого типа ОР по отдельности. При использовании ингибитора μ-ОР СТАР в дозе 1 мг/кг мы обнаружили достоверное уменьшение индекса ЗИ/ЗР на 15% по сравнению с контрольной группой. Полученный результат стал для нас несколько неожиданным, т.к. до этого никому из исследователей не удавалось обнаружить кардиопротекторный эффект у блокаторов ОР.
При этом исследования, проведенные в нашей лаборатории, показывают, что агонисты данных рецепторов не оказывают подобного эффекта. Следовательно, инфарктлимитирующий эффект СТАР в дозе 1 мг/кг, по всей видимости, является результатом взаимодействия этого пептида с неопиоидными рецепторами. В этой связи следует отметить, что пептид СТАР проявляет умеренное сродство к рецепторам соматостатина. Рецепторы соматостатина, как известно, присутствуют в сердце [4]. Представляется вполне вероятным, что инфарктлимити-рующий эффект СТАР может быть связан с активацией рецептов соматостатина или иных, пока неидентифици-рованных, рецепторов. Внутривенное введение селективного блокатора δ 2-ОР налтрибена не оказывало достоверного эффекта на соотношение ЗИ/ЗР (рис. 1). Инъекция антагониста δ 1-ОР BNTX также не влияла на значение ЗИ/ЗР (рис. 1). При использовании ингибитора κ -ОР мы не обнаружили статистически значимых изменений по отношению к контрольной группе. Эти данные согласуются с результатами других исследователей, которые также не смогли обнаружить изменения индекса ЗИ/ЗР при использовании антагонистов ОР во время реперфузии [3, 10].
Таким образом, полученные нами результаты указывают на то, что эндогенные агонисты ОР не участвуют в повышении функциональной устойчивости сердца к патогенному действию реперфузии.
Список литературы Участие эндогенных агонистов опиоидных рецепторов в повышении устойчивости сердца к повреждающему действию реперфузии
- Лишманов Ю.Б., Маслов Л.Н., Наумова А.В., Богомаз С.А. Активация -опиатных рецепторов как фактор повышения устойчивости сердца к ишемическим и реперфузионным повреждениям//Рос. физиол. журн. -1998. -Т. 84, № 11. -С. 1223-1230.
- Guo H.T., Zhang R.H., Zhang Y. et al. Endogenous -opioid peptide mediates the cardioprotection induced by ischemic postconditioning//J. Cardiovasc. Pharmacol. -2011. -Vol. 58, No. 2. -P. 207-215.
- Jang Y., Xi J., Wang H., Mueller R.A. et al. Postconditioning prevents reperfusion injury by activating -opioid receptors//Anesthesiology. -2008. -Vol. 108, No. 2. -P. 243-250.
- Ludvigsen E., Carlsson C., Tiensuu Janson E. et al. Somatostatin receptor 1-5; expression profiles during rat development//Ups. J. Med. Sci. -2015. -Vol. 120, No. 3. -P. 157-168.
- Maslov L.N., Khaliulin I., Oeltgen P.R. et al. Prospects of creation of cardioprotective and antiarrhythmic drugs based on opioid receptor agonists//Med. Res. Rev. -2016. -Vol. 36, No. 5. -P. 871-923.
- Maslov L.N., Lishmanov Yu.B., Oeltgen P.R. et al. Activation of peripheral 2 opioid receptors increases cardiac tolerance to ischemia/reperfusion injury: Involvement of protein kinase C, NO-synthase, KATP channels and the autonomic nervous system//Life Sci. -2009. -Vol. 84, No. 19-20. -P. 657-663.
- Murphy D.B., Murphy M.B. Opioid antagonist modulation of ischaemia-induced ventricular arrhythmias: a peripheral mechanism//J. Cardiovasc. Pharmacol. -1999. -Vol. 33, No. 1. -P. 122-125.
- Neckar J., Szarszoi O., Herget J. et al. Cardioprotective effect of chronic hypoxia is blunted by concomitant hypercapnia//Physiol. Res. -2003. -Vol. 52, No. 2. -P. 171-175.
- Schultz J.E.J., Hsu A.K., Gross G.J.J. Ischemic preconditioning and morphine-induced cardioprotection involve the delta ()-opioid receptor in the intact rat hear//Mol. Cell. Cardiol. -1997. -Vol. 29, No. 8. -P. 2187-2195.
- Tsutsumi Y.M., Yokoyama T., Horikawa Y. et al. Reactive oxygen species trigger ischemic and pharmacological postconditioning: in vivo and in vitro characterization//Life Sci. -2007. -Vol. 81, No. 15. -P. 1223-1227.
- Ventura C., Bastagli L., Bernardi P. et al. Opioid receptors in rat cardiac sarcolemma: effect of phenylephrine and isoproterenol//Biochim. Biophys. Acta. -1989. -Vol. 987, No. 1. -P. 69-74.
- Yamada H., Nakamoto H., Suzuki Y. et al. Pharmacological profiles of a novel opioid receptor-like1 (ORL(1)) receptor antagonist, JTC-801//Br. J. Pharmacol. -2002. -Vol. 135, No. 2. -P. 323-332.


