Участие каппа-опиатных рецепторов в регуляции пролиферативной и секреторной активности мышиных спленоцитов in vivo
Автор: Гейн С.В., Баева Т.А., Маерова Е.Д., Тендрякова С.П.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Медико-биологические науки
Статья в выпуске: 1, 2010 года.
Бесплатный доступ
Динорфин А оказывал модулирующее влияние in vivo на антителогенез в селезенке мышей, пролиферативную активность спленоцитов и секрецию ими IL-2 и IL-4. Направленность и выраженность обнаруженных эффектов зависела от вводимой дозы ??-агониста, степени активации иммунокомпетентных клеток, а также характера действия активационного стимула.
Каппа-опиатные рецепторы, динорфин а, иммуногенез, спленоциты, пролиферативная активность, цитокины il-2 и il-4
Короткий адрес: https://sciup.org/147204884
IDR: 147204884 | УДК: 612-017.1.018
Текст научной статьи Участие каппа-опиатных рецепторов в регуляции пролиферативной и секреторной активности мышиных спленоцитов in vivo
Стресс как типовой комплекс неспецифических защитно-приспособительных и патологических реакций организма на агенты, угрожающие жизни и благополучию организма, реализуется у высших животных и человека при обязательном участии нейроэндокринной системы, необходимым звеном которой являются эндогенные опиоидные пептиды. Актуальная проблема современной нейроиммунологии – регуляция опиоидными пептидами иммунологических реакций на уровне целостного организма и их роль в регуляции иммуногенеза при стрессе. В настоящее время выделяют три типа опиатных рецепторов, экспрессирующихся на клетках нервной и иммунной систем (δ-, μ-, κ-), к каждому из которых в организме имеются свои высо-коафинные лиганды. Наиболее полно охарактеризованы эффекты и механизм действия эндорфинов и энкефалинов, обладающих высоким сродством к δ- и μ-опиатным рецепторам, экспрессирующимся с высокой плотностью на зрелых, активированных клетках иммунной системы. Основной задачей κ-рецепторов, по-видимому, является регуляция функциональной активности незрелых Т-клеток, так как максимальная их плотность зарегистрирована на мембранах тимоцитов, а в процессе созревания клеток уровень экспрессии κ-рецепторов на поверхности Т-лимфоцитов значительно снижается (Ignatowski, Bidlack, 1999). В этой связи значительный интерес представляет анализ иммунорегуля- торной активности сигналов, поступающих с κ-опиатных рецепторов, экспрессированных на зрелых клетках иммунной системы. В современной литературе имеются немногочисленные данные об участии эндогенных (динорфины А и В) и экзогенных (U50,488H и U69,593) κ-агонистов в модуляции пролиферации, продукции антител, поглотительной и секреторной активности клеток естественного и адаптивного иммунитета (Bidlack, 2000). Однако совершенно не освещены вопросы регуляции ди-норфинами продукции цитокинов, ответственных за процессы переключения доминирующего типа иммунного ответа с клеточно-опосредованного на гуморальный (IL-4) и наоборот (IFN-γ, IL-2). Цель работы – изучение эффектов эндогенного высоко-афинного κ-агониста динорфина А (1–17) в системе in vivo на пролиферативную активность спленоци-тов мыши и секрецию ими цитокинов IL-2 и IL-4, играющих важную роль в регуляции развития иммунного ответа по гуморальному или клеточноопосредованному типу.
Материалы и методы
Эксперимент выполнен на беспородных мышах-самцах массой 17–22 г. Динорфин А (1–17) (Sigma, США) вводили внутрибрюшинно в разовой дозе 100, 1, 0.01, 0.0001 мкг/кг массы тела; контрольным животным вводилось эквиобъемное количество 0.9% NaCl. В дальнейшем экспериментальные животные были поделены на две группы. Первую группу мышей через 1 ч после введения
пептида иммунизировали внутрибрюшинно эритроцитами барана (ЭБ) в разовой дозе 108 кл/0.2 мл 0.9% NaCl. На 5-е сут животных декапитировали под эфирным наркозом, определяли титр анти-эритроцитарных антител в плазме периферической крови методом прямой гемагглютинации и количество антителообразующих клеток (АОК) в селезенке методом локального гемолиза в геле агарозы. Вторую группу экспериментальных животных через 1 ч после введения пептида выводили из эксперимента, выделяли спленоциты и культивировали их в пластиковых круглодонных 96-луночных планшетах ("Медполимер", Санкт-Петербург) в течение 72 ч. Каждая культура содержала 5∙105 кл/0.2 мл полной культуральной среды, которую готовили ex tempore на основе среды RPMI 1640 («Биолот», Санкт-Петербург) с добавлением 10 mM HEPES (Sigma), 2 mM L-глутамина (Sigma), 100 мкг/мл пенициллина, 100 мкг/мл стрептомицина и 10% ЭТС («Биолот», Санкт-Петербург). В качестве митогенов использовали липополисахарид (ЛПС из E. coli B55:О5, Sigma; 10 мкг/мл) и конконовалин А (КонА, Sigma; 20 мкг/мл). За 18 ч до окончания культивирования в лунки вносили по 2 мкКи 3H-метилтимидина в объеме 10 мкл. Радиоактивность проб определяли на жидкостном сцинтилляционном счетчике "Guardian" (Wallac, Финляндия).
Для оценки секреторной активности спленоци-тов супернатанты 24-часовых (IL-2) и 48-часовых (IL-4) культур собирали в пробирки Эппендорфа, замораживали и хранили при -20оС. Количественное определение цитокинов проводили методом твердофазного иммуноферментного анализа с помощью наборов Bender Medsystems (Австрия) по методике, предложенной производителем.
Статистический анализ проводили с использованием непарного двухфакторного дисперсионного анализа и LSD-критерия Фишера (post-hoc). Все данные на рисунках представлены в виде средней величины и её стандартной ошибки (M ± m).
Результаты и их обсуждение
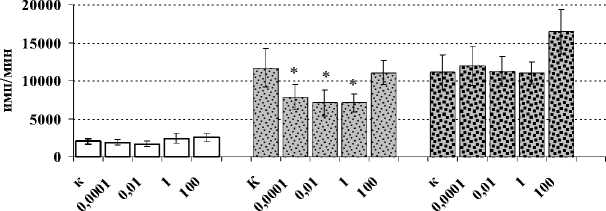
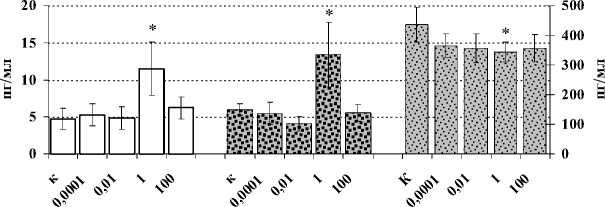
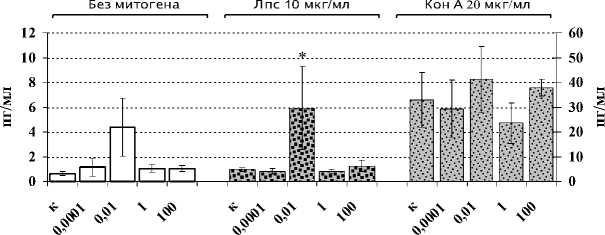
Установлено (рис. 1А), что динорфин А (1–17) оказывает статистически значимый стимулирующий эффект на количество АОК в селезенке экспериментальных животных только при введении самой низкой (0.0001 мкг/кг) исследуемой дозы. При этом анализ титра антиэритроцитарных антител в плазме крови не выявил значимых количественных изменений в опытных группах по сравнению с контрольными животными (рис. 1Б). При анализе пролиферативной активности спленоцитов под воздействием динорфина зарегистрирован угнетающий эффект пептида, используемого в дозах 1, 0.01 и 0.0001 мкг/кг, на пролиферацию сплено-цитов, индуцированную ЛПС (рис. 2А), который является активатором В-лимфоцитарного звена иммунитета. Стимуляция клеток КонА – поликлональным активатором Т-лимфоцитов, а также оценка влияния динорфина на спонтанный пролиферативный ответ спленоцитов не выявили статистически значимых эффектов пептида (рис. 2А). Неоднозначные результаты получены в отношении продукции IL-2 – цитокина, необходимого, с одной стороны, для поддержания пролиферативных процессов, а с другой стороны – для развития Th1-хелперов, протектирующих клеточноопосредованный тип иммунного ответа. Так, в группе животных, которым вводился динорфин в дозе 1 мкг/мл, продукция IL-2 спленоцитами снижалась в присутствии КонА, но стимулировалась в спонтанных и ЛПС-индуцированных культурах (рис. 2Б). Кроме того, у мышей, предобработанных динорфином А в дозе 0.01 мкг/кг, в условиях дополнительной стимуляции клеток ЛПС, статистически значимо усиливалась продукция IL-4, ответственного за пролиферацию и дифференцировку В-клеток – одного из ключевых звеньев гуморального иммунного ответа (рис. 2В).
Таким образом, динорфин А в системе in vivo оказывал модулирующее влияние на антителоге-нез в селезенке, пролиферативную активность спленоцитов и секрецию ими IL-2 и IL-4. Направленность и выраженность наблюдаемых эффектов
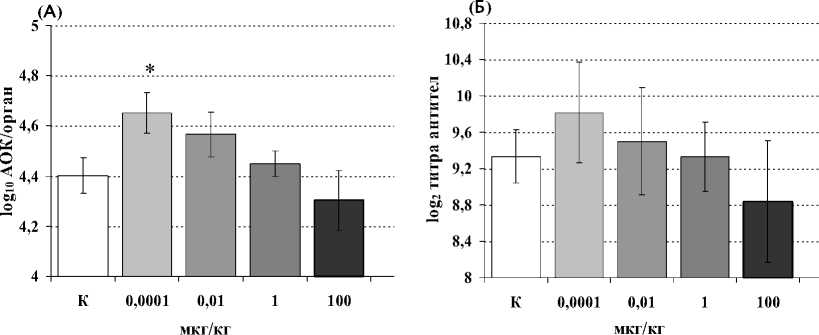
Рис. 1. Влияние динорфина А на количество АОК в селезенке (А; n=12) и титр антител к ЭБ (Б; n=12) в плазме крови мышей. Здесь и далее: * р < 0.05 по непарному LSD-критерию Фишера
( А )
Без митогена
Лпс 10 мкг / мл
Кон А 20 мкг / мл
мкг/кг
( Б )
Без митогена Лпс 10 мкг / мл Кон А 20 мкг / мл
мкг/кг
мкг/кг
Рис. 2. Влияние динорфина А на пролиферативную активность спленоцитов мыши (А; n=12), продукцию ими IL-2 (Б; n=6) и IL-4 (B; n=6)
зависела от вводимой дозы κ -агониста, степени активации иммунокомпетентных клеток, а также характера действия активационного стимула.
В современной литературе представлены весьма ограниченные сведения, иллюстрирующие эффекты динорфинов, а также других лигандов κ-опиатных рецепторов природного или синтетического происхождения на функциональную активность В-лимфоцитов в системах in vitro и in vivo. В то же время, имеющиеся данные однозначно указывают на тоническое угнетение процессов анти-телообразования при эндогенной и экзогенной активации κ-опиатных рецепторов. Так, показано (Vassou et al., 2008), что экзогенный лиганд κ-опиатных рецепторов αs1-казоморфин в высокой (10-6М) концентрации снижал секрецию Ig M, G, A в культурах СD 19+ B-лимфоцитов. Эксперименты, выполненные на мышах, нокаутированных по гену κ-опиатного рецептора, показали, что после иммунизации животных гемоцианином улитки продукция антиген-специфичных иммуноглобулинов значительно повышалась, в то время как мыши, у которых отсутствовал ген μ- или δ-опиатных рецепторов, демонстрировали нормальные уровни продукции антител (Gavériaux-Ruff et al., 2003). Несоответствие литературных данных и выявленных нами эффектов динорфина А на антителогенез связано, главным образом с выбором экспериментальной модели. В частности, использование чистой популяции СD 19+ лимфоцитов необходимо для изучения прямых эффектов κ-агонистов на функции B-клеток, но не отображает истиной картины, развертывающейся в организме, так как огромную роль при формировании конечных интегральных эффектов играют процессы межклеточной кооперации и нейроэндокринной регуляции. В организме генетически-модифицированных животных большое значение приобретает развитие компенсаторных механизмов на месте выключен- ного звена, поэтому не совсем корректно предполагать, что в нормальном здоровом организме физиологические процессы будут протекать аналогичным образом.
В научных базах практически отсутствуют данные о роли κ -опиатных рецепторов и их лигандов в регуляции in vivo пролиферативной активности лимфоцитов и продукции Th1/Th2-поляризующих цитокинов. В то же время, аналогичные эффекты κ -агонистов в системах in vitro в присутствии динор-финов, согласно литературным данным, могут сильно варьировать в зависимости от видовой принадлежности, состава выбранного объекта исследования, временного фактора. Ранее нами было выявлено разнонаправленное влияние динорфина А (113) на пролиферацию лимфоцитов в очищенной лимфоцитарной фракции и смешанной лейкоцитарной взвеси (Гейн и др., 2009). Показано (Ni et al., 1999) стимулирующее влияние динорфина А на пролиферативный ответ спленоцитов мыши и продукцию ими IL-2 и IL-1 β . В работе Barreca et al. (1987) установлено, что стимулирующий эффект динорфина А на пролиферацию мононуклеаров зависит от срока внесения пептида в культуру. С другой стороны, имеются данные (Gorodinsky et al., 1994) об угнетающем эффекте динорфина В на пролиферацию клеток головного мозга эмбрионов крыс; данный эффект блокировался nor-BNI. Таким образом, наличие большого количества факторов, определяющих конечный эффект динорфинов, требует более масштабных и детальных исследований в системах in vivo .
Работа поддержана грантами Президента РФ «Ведущие научные школы» НШ-64403.2010.4 и программы Президиума РАН «Молекулярная и клеточная биология».
Список литературы Участие каппа-опиатных рецепторов в регуляции пролиферативной и секреторной активности мышиных спленоцитов in vivo
- Гейн, С.В. Эффект динорфина А (1-13) на пролиферативный ответ лимфоцитов и изменение Тh1/Тh2 цитокинового профиля/С.В. Гейн, А.А. Сятчихин, С.П. Тендрякова//Докл. Академии наук. 2009. Т. 424, № 4. С. 563-566.
- Barreca, T. Effects of dynorphin on the pha-induced lymphocyte proliferation in vitro/T. Barreca, G. Di Benedetto, G. Corsini [et al.]//Immunopharmacol. Immunotoxicol. 1987. Vol. 9. P. 467-475.
- Bidlack, J.M. Detection and function of opioid receptors on cells from the immune system//Clin. Diagn. Lab. Immunol. 2000. Vol. 7. P. 719-723.
- Gavériaux-Ruff, C. Enhanced humoral response in kappa-opioid receptor knockout mice/C. Gavériaux-Ruff, F. Simonin, D. Filliol, B.L. Kieffer//J. Neuroimmunol. 2003. Vol.134. P. 72-81.
- Gorodinsky, A. Dynorphin B inhibits thymidine incorporation into DNA in fetal rat and guinea pig brain cell aggregates/A. Gorodinsky, J. Barg, M.M. Belcheva [et al.]//Reg. Peptides. 1994. Vol. 54. P. 109-110.
- Ignatowski, T.A. Differential -opioid receptor expression on mouse lymphocytes at varying stages of maturation and on mouse macrophages after selective elicitation/T.A. Ignatowski, J.M. Bidlack//J. Pharmacol. Exp. Therapy. 1999. Vol. 290. P. 863-870.
- Ni, X. Dynorphin A enhances mitogen-induced proliferative response and interleukin 2 production of rat splenocytes/X. Ni, B.C. Lin, C.Y. Song, C.H. Wang//Neuropeptides. 1999. Vol. 33. P. 137-143.
- Vassou, D. Opioids modulate constitutive B-lymphocyte secretion/D. Vassou, E. Bakogeorgou, M. Kampa [et al.]//Int. Immunopharmacol. 2008. Vol. 8. P. 634-644.


