Участвуют ли жировые тела щек в постнатальном гемопоэзе?
Автор: Марков Игорь Иванович, Буланов Сергей Иванович, Моисеева Татьяна Васильевна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.23, 2015 года.
Бесплатный доступ
Изучена гистоструктура жировых тел щек, извлеченных при аутопсии новорожденных, детей и взрослых людей обоего пола. Цель исследования - доказать участие жировых тел щек в постнатальном гемопоэзе. Полученные данные позволяют считать, что жировые тела щек являются органами, функционирующими на протяжении всего постнатального периода онтогенеза человека. У новорожденных и детей грудного возраста в жировых телах щек происходит активный внутрисосудистый эритро - и миелопоэз.
Жировые тела щек, постнатальный онтогенез, гемопоэз
Короткий адрес: https://sciup.org/143177058
IDR: 143177058
Текст научной статьи Участвуют ли жировые тела щек в постнатальном гемопоэзе?
Введение. В перинатальном периоде развития ребенка основным органом кроветворения является костный мозг [1]. Однако в этот период у многих млекопитающих кроветворение еще сохраняет эмбриональный характер [2]: его очаги обнаруживаются в тимусе [ 3 ], в печени [4] в селезенке [5] и даже в брыжейке тонкой кишки [6]. Нередко подобная ситуация отмечается и у новорожденных детей [7]. Более того, у них в периферической крови наблюдается лейкоцитоз с выраженной лимфопенией и нейтрофильным гранулоцитом [1, 10 ] при индексе Шагана – 0,4 [2 ]. Очевидно, что эритроциты способствуют снижению у новорожденных детей иммунореактивности [ 11-13 ], а «аварийная» линия защиты у них формируются нейтрофильными гранулоцитами, принадлежащими к неспецифическим факторам иммунитета [14]. В работе [15] впервые были опубликованы данные об эритропоэзе в жировых телах щек новорожденных детей. Однако продолжается ли эритропоэз в жировых телах щек и в более поздние сроки постнатального онтогенеза или он ограничен только неонатальным периодом до настоящего времени остается неясным.
Цель исследования – доказать участие жировых тел щек человека в постнатальном гемопоэзе.
Материал и методы исследования. В работе использован аутопсийный материал жировых тел щек новорожденных детей (п=5), детей грудного возраста (п=3) и биопсийный материал жировых тел щек людей I периода зрелого (п=5) и пожилого (п=5) возрастов.
При аутопсиях жировые тела щек полностью извлекались после линейных разрезов кожи по линии, соединяющей угол рта и мочку ушной раковины. Биопсийный материал получен во время хирургических операций в челюстно-лицевой области. После фиксации материала в 10% нейтральном формалине (5-7 суток) готовились серийные парафиновые срезы для окраски гемо-токсилином и эозином, по Ван Гизону, азур II-эозином и парарозанилином и толуидиновым синим. Микропрепараты изучались под микроскопом drica ДМ1000 и фотографировались цифровой видеокамерой.
Результаты исследования и их обсуждение. Жировые тела щек справа и слева обнажались после линейных разрезов кожи по линиям, соединяющие мочки ушных раковин с углами рта. Скуловые дуги распиливались и удалялись после отделения от них височных фасций. Жевательные мышцы удалялись вместе со скуловыми дугами и фрагментами ветвей нижней челюсти. Масса жировых тел была удивительно постоянна и не коррелировала с массой тела субъекта. Основная часть жировых тел щек представляется в виде желоба с вертикальной осью, открытого в заднем отделе, имеющего боковую и срединную поверхности, выпуклые спереди и вогнутые сзади. Топографически в основной части жировых тел необходимо выделить три отдела: нижний – ску- ловой, верхний – латерально - пазушный и латеральный – орбитальный. Нижний скуловой отдел снаружи прилежит к жировой клетчатке щечной области, вверху – большой скуловой мышце, а спереди – ограничен ротовыми ветвями лицевого нерва. Снаружи к скуловому отделу прилежит выводной проток околоушной слюнной железы, окруженный жировой клетчаткой. Проток делает резкий под прямым углом изгиб, проникает в жевательно-щечную ямку и затем перфорирует щечную мышцу. Верхний – латерально-пазушный и латерально-орбитальный отделы жировых тел продолжаются вверх и на уровне глазниц переходят в височные отростки тел. Основная часть жировых тел щек является постоянным образованием и была обнаружена в 100% случаев (рис. 1).
По гистоструктуре щечная область представляет собой два отчетливо выраженных слоя тканей: 1 – поверхностный, расположенный под кожей (надфасциальный) и 2 – глубокий (подфасциальный или подапоневротический). Первый слой объединен с подкожно-жировой клетчаткой височной и околоушной областей, второй – с жировым телом щеки.
Жировые тела щек окружены тонкой соединительно-тканевой капсулой, которая легко и полностью снимается. Капсула имеет достаточно постоянную толщину, как на аутопсийных препаратах новорожденных детей, так и на биопсийных препаратах людей I зрелого возраста - от 60, 5 + 12,2 мм (растянутая капсула) до 106,8 +14,7 мм (собранная в складки). Жевательная и щечная мышца в области жирового тела щеки без всяких границ переходят друг в друга. Слизистая оболочка щеки и щечная мышца интимно соединены между собой, а пучки щечной мышцы проникают в паренхиму жирового тела. Щечная мышца у новорожденных детей развита чрезвычайно слабо и находится непосредственно под слизистой оболочкой щеки. Она начинается широким основанием от наружных поверхностей верхней и нижних челюстей напротив альвеол моляров, а сзади - от крыловидно-нижнечелюстных связок и направляется к углу рта. Здесь она сливается внизу и вверху с круговой мышцей рта. Сзади щечная мышца прикрывается жевательной мышцей, от которой она отделена крыловидно-нижнечелюстным отростком жирового тела. В щечных отделах преддверия рта щечная мышца находится в глубине мягких тканей на нижней челюсти. Ее пучки идут сзади от крыло-челюстного шва, сверху – от альвеолярного отростка верхней челюсти, снизу - от тела нижней челюсти, латеральнее наружной косой линии в зоне нижнее-челюстного кармана, на участке, ограниченном медиально-альвеолярным гребнем. В мышечных пучках щечной мышцы мало рыхлой соединительной ткани, поэтому сарколеммы пер- вичных мышечных волокон плотно контактируют друг с другом, а их продолговатые вытяжные ядра располагаются непосредственно под сарколеммой. Средний диаметр мионов составлял 10,2 +0,5 мкм и их поперечная исчерченность была выражена чрезвычайно слабо. В многочисленных участках щечной мышцы на всех препаратах наблюдались различные стадии формирования эктопических очагов эритропоэза. Вначале ее мышечные волокна окончательно теряли поперечную исчерченность и фрагментировались, а ядра утрачивали вытянутую форму и становились округлыми или овальными (рис. 2). Измененные мышечные ядра располагались внутри мышечных волокон беспорядочно, смещаясь на периферию и в дальнейшем, очевидно, исчезали из них. Поэтому часть мышечных волокон и на поперечных, и на продольных срезах была лишена ядер (рис. 3). В других участках щечной мышцы контуры, фрагментов трансформированных мионов выглядели более четкими, а между ними возникали многочисленные связи в виде сарколеммальных мостиков. Затем за счет сарколеммальных связей и длинных отростков реликулярных клеток целые группы фрагментарно трансформированных ми-онов оказывались изолированными от интактных участков щечной мышцы (рис. 4). Этот процесс изоляции фрагментов трансформированных ми-онов завершался формированием значительных по диаметру вазоидов (от 300,0 – 600,0 мкм). Стенка их была образована длинными отростками ретикулярных клеток, но в отдельных участках она могла прерываться при полном отсутствии базальной мембраны (рис. 5). Просвет вазои-дов был заполнен в одних случаях фрагментами трансформированных миоцитов и форменными элементами крови, в других случаях - эритробластическими островками и эритроцитами, в третьих - полипотентными стволовыми клетками; в четвертых – только нейрофильными гранулоцитами (рис. 5,6,7,8). В большинстве препаратов к стенке вазоидов снаружи интимно прилегали фрагменты трансформированных миоцитов, возможно, и участвующих в структурной организации ее стенки (рис. 9). Окончательно сформированные вазоиды, в просвете которых определялись только форменные элементы крови – эритроциты и лейкоциты, становились составной частью микрососудистого русла жировых тел щек (рис. 10).
В красном костном мозге млекопитающих основными структурами, обеспечивающими гемопоэз являются синусоиды.
Они формируются в пренатальном периоде онтогенеза, но активно начинают функционировать только после рождения. Структуры, подобные синусоидам красного костного мозга, формируются постнатальном периоде и в жировых телах щек
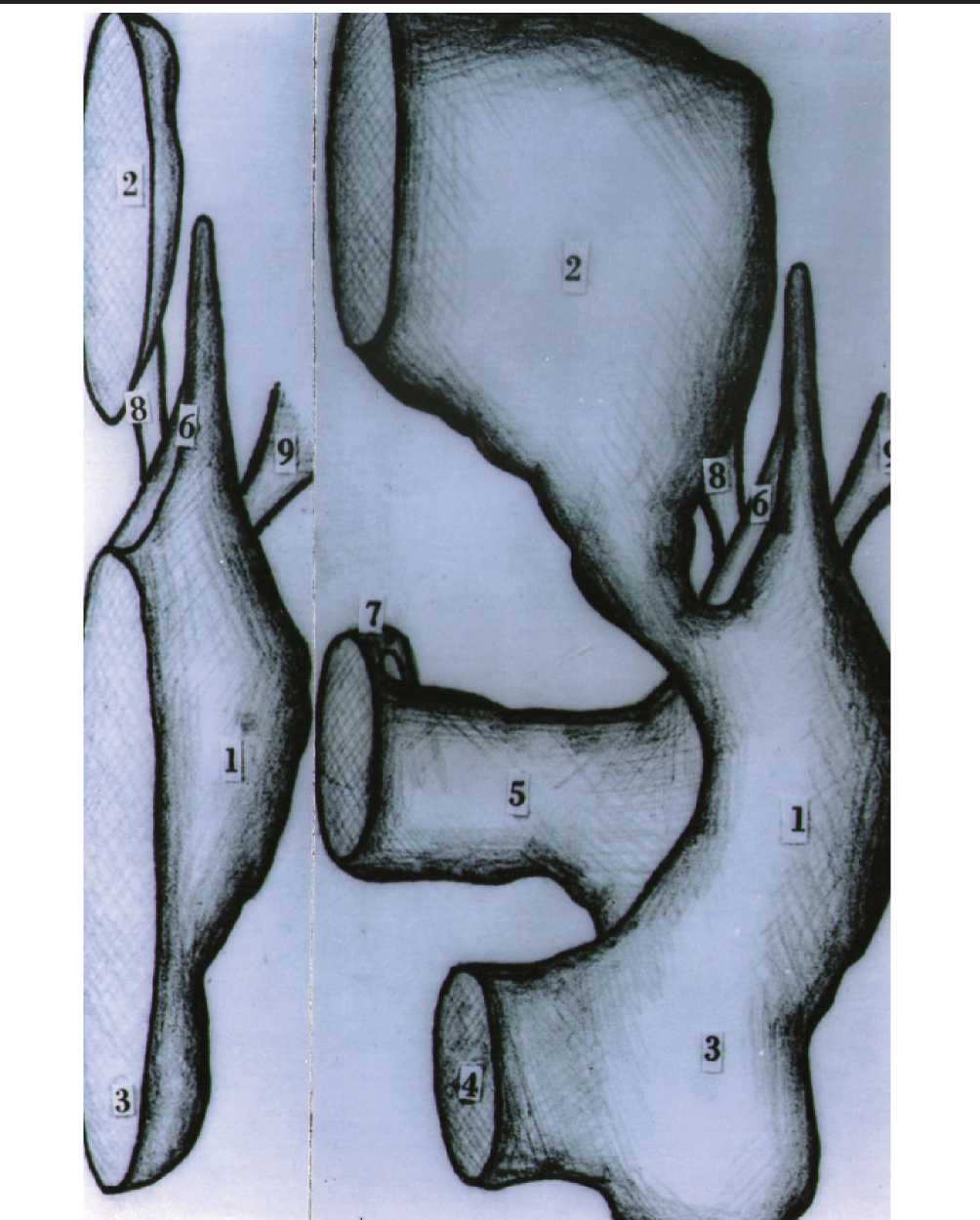
Рис. 1. Схема жирового тела щеки новорожденного ребенка 1, 3 – основная часть; 2 – поверхностный височный отросток; 4 – жевательный отросток; 5 – крыловиднонижнечелюстной отросток; 6 – глубокий височный отросток; 7 – межкрыловидный отросток; 8 0 крыло-небный отросток; 9 – нижнее-глазничный отросток. а – вид спереди; б – вид снаружи. Реконструкция с макропрепаратов.
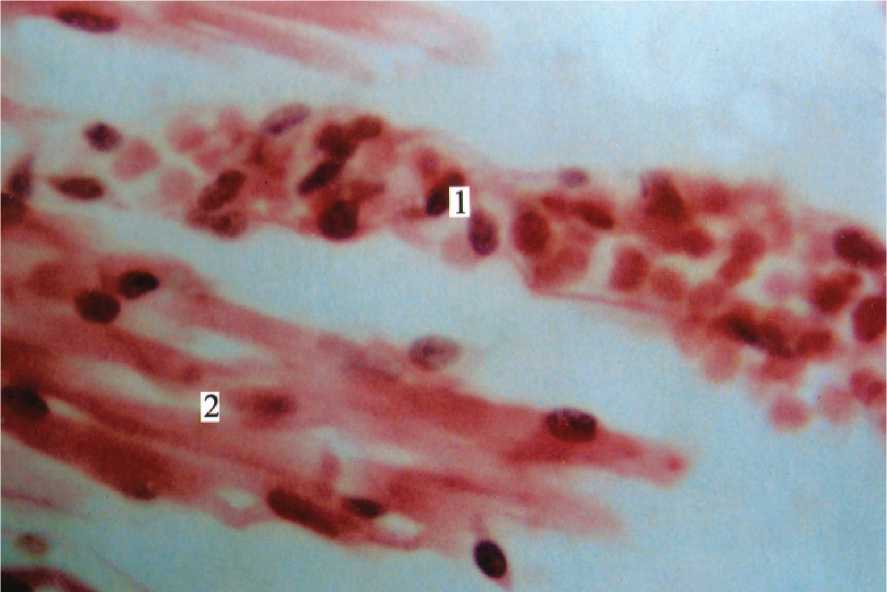
Рис. 2. Форменные элементы крови (1) и фрагмент щечной мышцы (2). Новорожденный ребенок. Окраска гематоксилином и эозином. Цв. 400
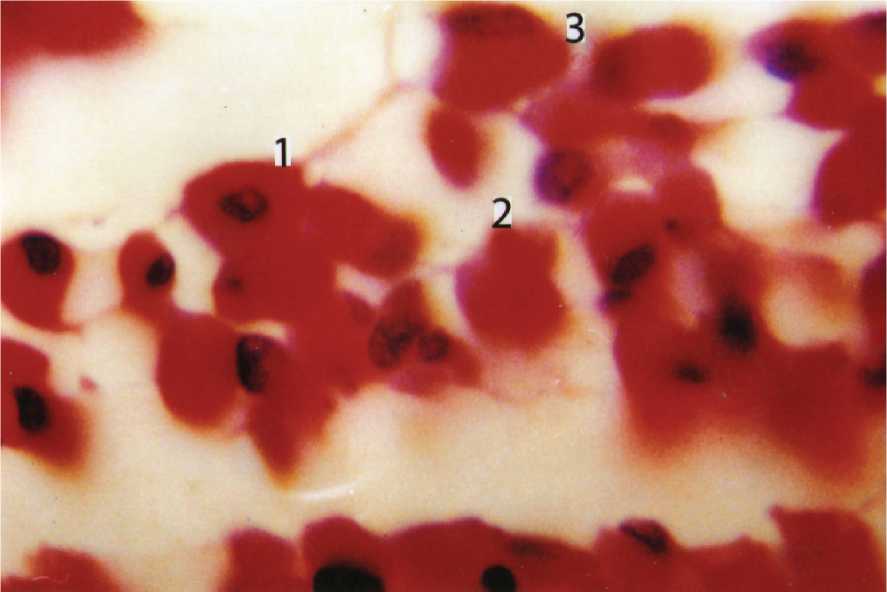
Рис. 3. Фрагменты трансформированных первичных мышечных волокон (1, 2, 3) щечной мышцы. Новорожденный ребенок. Окраска гематоксилином и эозином. Цв. 900.
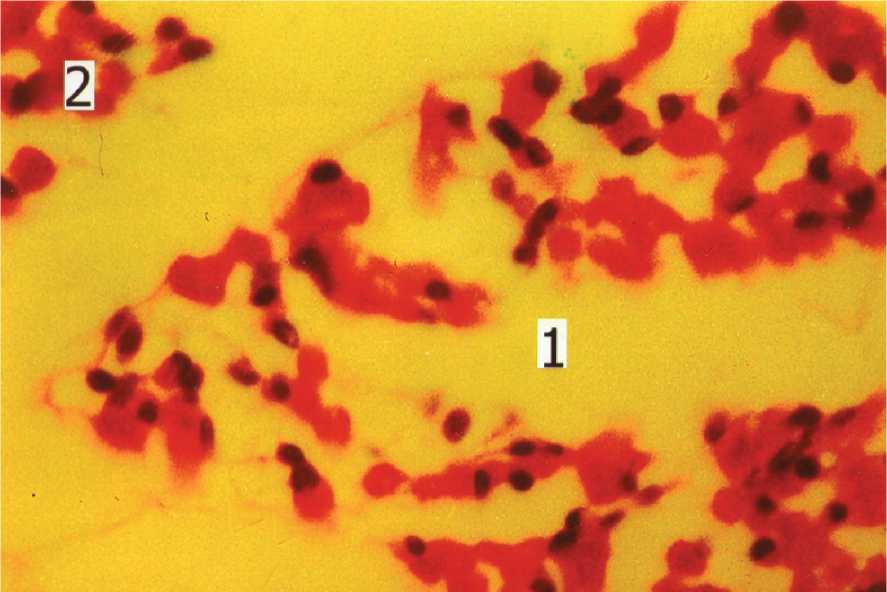
Рис. 4. Изоляция фрагментов трансформированных первичных мышечных волокон (1) от интактных участков щечной мышцы. Биопсия жирового тела щеки. Мужчина 27 лет. Окраска парарозанилином и толуидиновым синим. Цв. 900.
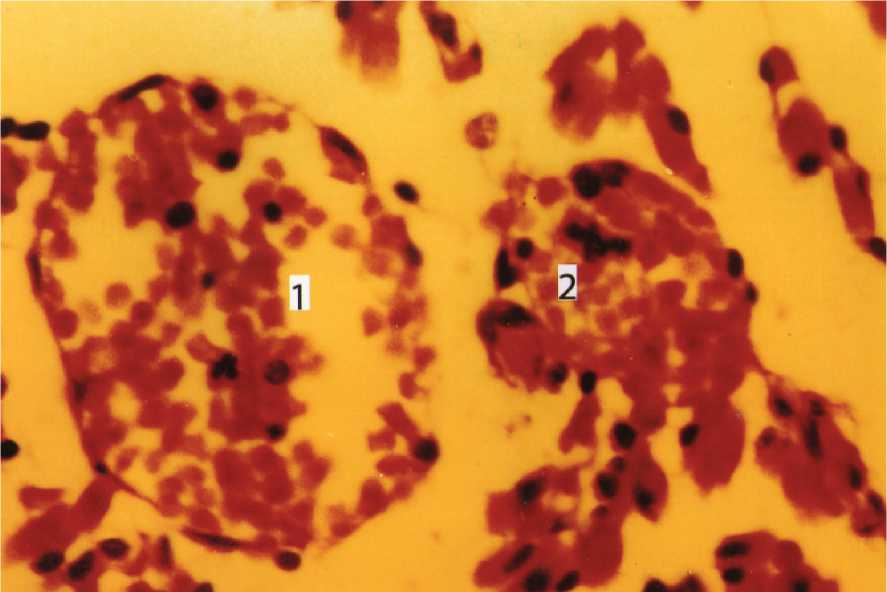
Рис. 5. Вазонды (1, 2) в жировом теле щеки. Биопсийный материал. Мужчина 32 лет.
Окраска гематоксилином и эозином. Цв. 400
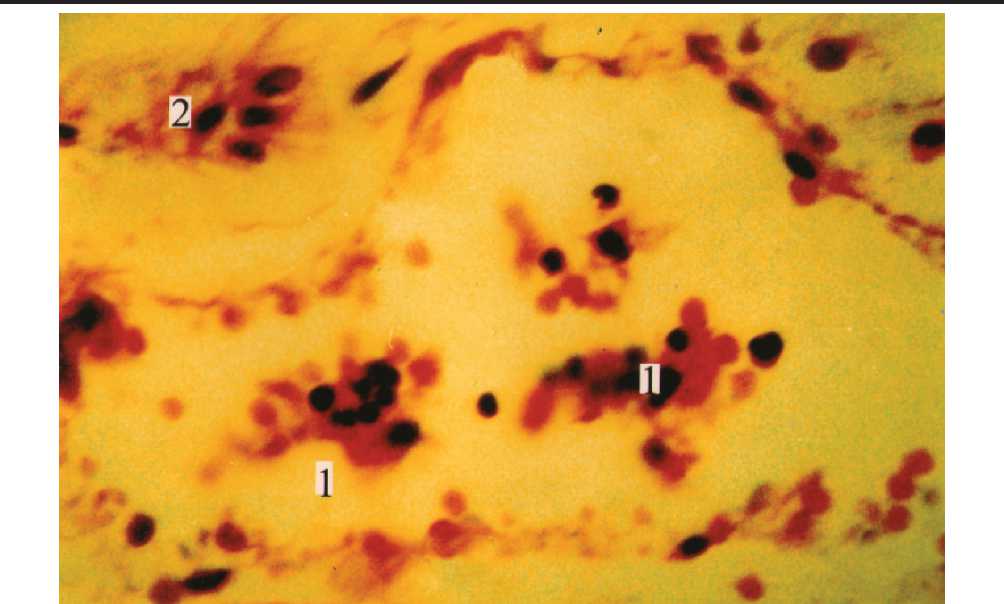
Рис. 6. Эритробластические островки (1) в просвете вазонда. 2) трансформированные мионы щечной мышцы. Новорожденный ребенок. Окраска гематоксилином и эозином. Цв.600
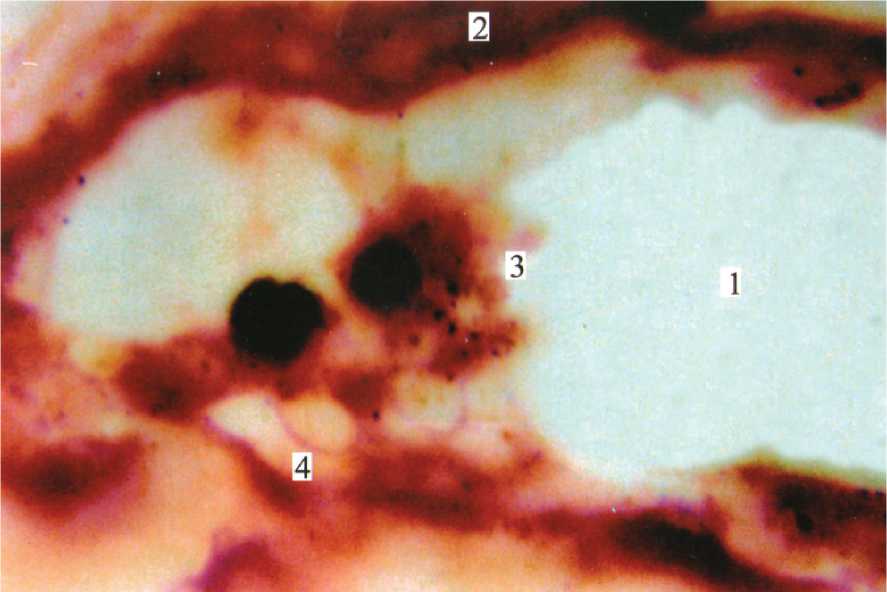
Рис. 7. Полипотентные стволовые клетки (3) и адипоциты (4) в просвете вазонда (1) 2) стенка вазонда. Биопсийный материал. Женщина 40 лет. Окраска парарозанилином и толуидиновым синим. Цв. 900
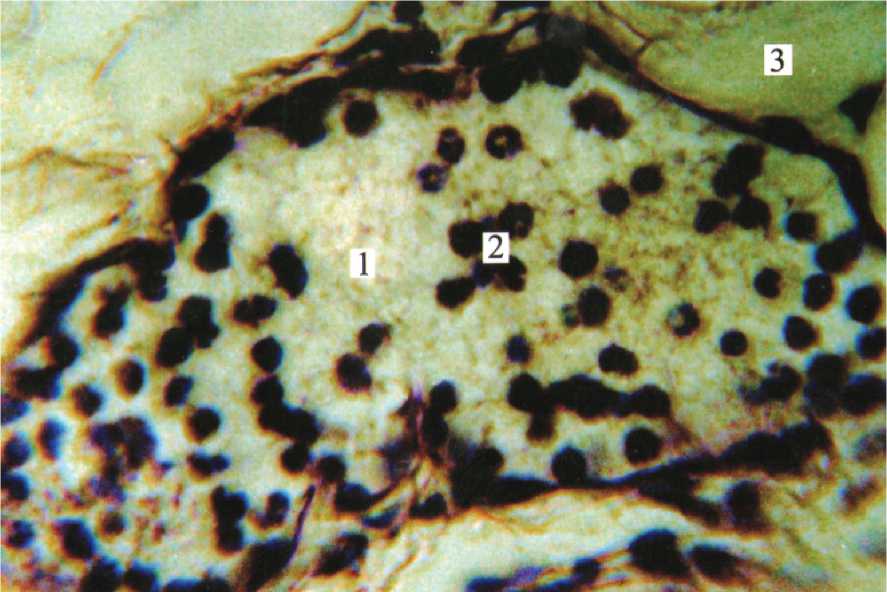
Рис. 8. Гранулопоэз (2) в просвете вазонда (2) жирового тела щеки. Ребенок 1,5 лет.
Окраска по Ван Гипоиз. Цв.600
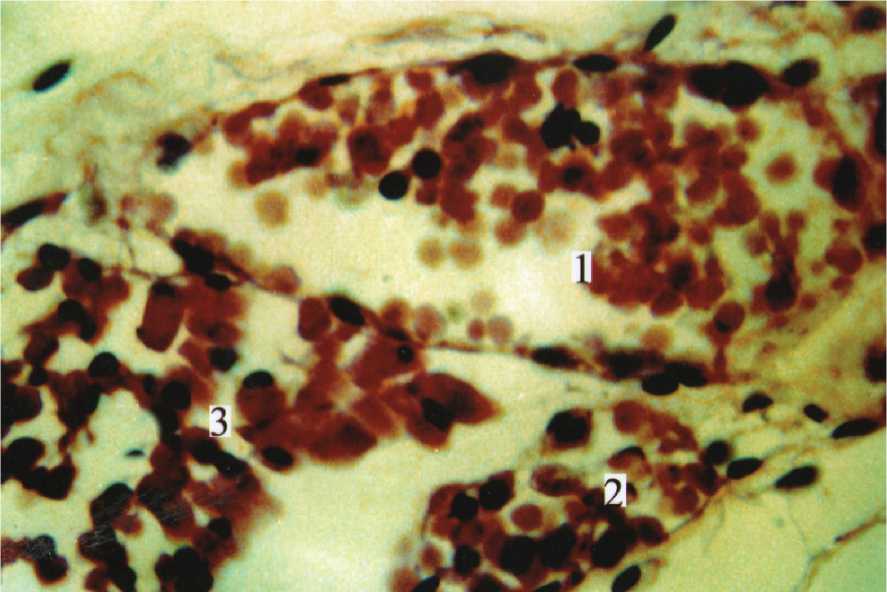
Рис. 9. Вазонд (1) и трансфомированные фрагменты щечной мышцы (2,3) в жировом теле щеки. Биопсийный материал. Женщина 37 лет. Окраска гематоксилином и эозином. Цв.600
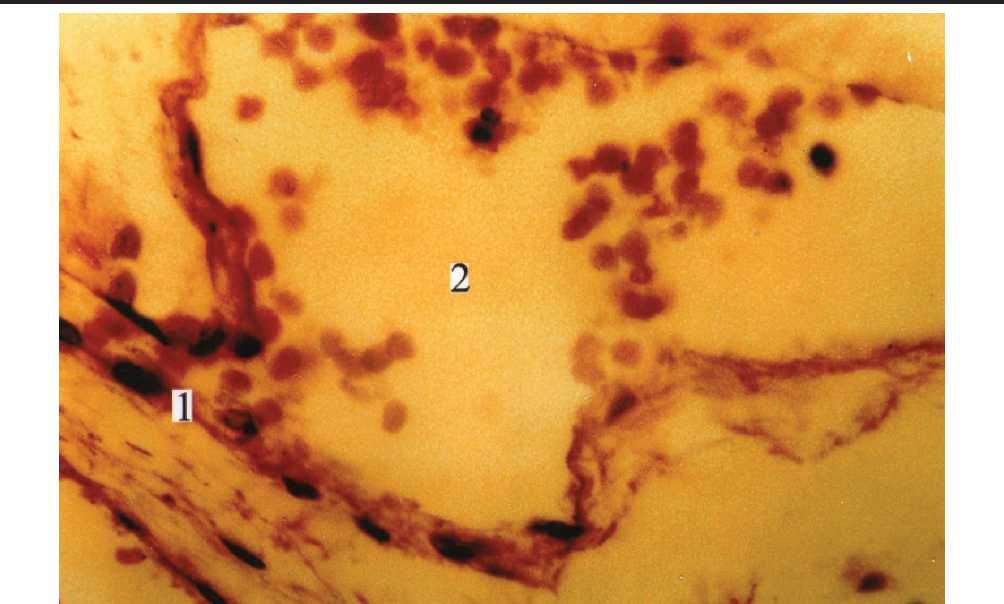
Рис. 10. Гемокапилляр (1) и вазонд (2) жирового тела щеки. Биопсийный материал.
Женщина 23 лет. Окраска гематоксилином и эозином. Цв.600.
человека. В их формировании принимают участие так же и трансформированные фрагменты щечных мышц. В костном мозге клетки предшественники, собранные в грозди [16] и окруженные фибробластами и эндотелиоцитами, должны пробить себе путь в синусоиды, а из них – в общую циркуляцию. В жировых телах щек происходит совершенно иной процесс формирования очагов гемопоэза. Он базируется на трансформации отдельных фрагментов щечных мышц, их изоляции на формировании вазоидов с эритро- и гранулопоэзом в просвете и дальнейшим включением их в общую циркуляцию. Вопрос о метаплазии первичных мышечных волокон в элементы крови и соединительной ткани дискутируется с середины ХIХ века [17]. Так И.И.Мечников [18] считал, что фагоциты могут происходить из мышечных волокон, а В.П. Вейцман [19], - что синцитиальный апотелий поперечнополосатых мышц, обладает большим потенциалом и поэтому все новообразованные сосуды и соединительная ткань могут развиваться так же и непосредственно из первичных мышечных волокон. Эти положения, хотя и соответствуют трансформационной клеточной теории Г.Э.Корицкого [20], не получили до настоящего времени ни широкого признания, ни отрицательной оценки.
Список литературы Участвуют ли жировые тела щек в постнатальном гемопоэзе?
- Тур А.Ф. Гематология детского возраста / А.Ф.Тур//Л.Медгиз, 1957, 312с.
- Шаган Б.Ф. Основы учения о новорожденном ребенке /Б.Ф.Шаган// М.Медиз, 1959, 331 с.
- Ивановская Т.Е. Функциональная морфология вилочковой железы /Т.Е.Ивановская, Т.Ф.Когой //Арх.патол., 1968, № 10, с.3-11.
- Fried W. The inflyence of and sex on erythropoietin tires plasma and tissue homogenates of hypoxis rat / W.Fried etal//Exp. Hematol, 1982, v. 10, № 5, р.472-477.
- Назаров С.Б. Динамика становления эритроидного ростка кроветворных органов белых крыс в онтогенезе/ С.Б.Назаров// Физиол.журн., 1992, № 3, с.54-59.
- Мичурина Т.В. Строение эктопических очагов кроветворения у мышей /Т.В.Мичурина, Г.П.Садыкова и др.//Арх.анат., 1985 № 7, с.62-69.
- Владимировская Е.Б. Регуляция кровотворения и иммуногенеза в перинатальный период/ Е.Б.Владимирская, Н.Н.Володин и др.// Педиатрия, 1997, № 4, с.76-82.
- Моршакова Е.Ф. Эритропоэз и его регуляция в эмбриональном, фетальном и неонотальном периодах/Е.Ф.Маоршакова, А.Д.Павлов// Рос. вестн.перинатол.,педиатр., 1999, № 3, с.12-16.
- Феер Е. Руководство по детским болезням/ Е.Феер// М.Госиздат, 1930, 885с.
- Шиллер И.Г. Картина крови и ее клиническое значение/И.Н.Шиллер//М.Медицина, 1989,272с.
- Козлов В.А. Иммунорегуляторные клетки нелимфоцитарной природы/ В.А.Козлов, И.Г.Цырлова//Докл. АН СССР, 1984, № 1, с.247-249.
- Цырлова И.Г. Иммуносупрессивный эффект популяции клеток с различной эритропоэтической активностью у зародышей и новорожденных мышей/И.Г.Цырлова, В.В.Чеглякова//Онтогенез, 1985, № 2, с.143-148.
- Прокопенко Л. Г. Эритроциты как модуляторы иммунных реакций/ Л.Г.Прокопенко, Л.Е.Сиплая// Усп.физиол.наук, 1992, № 4, с.89-106.
- Мовэт Г.З. Воспаление, иммунитет,гиперчувствительность/ Г.З.Мовэт// М.Медицина (пер.с англ.), 1975, 560с.
- Марков А.И. Эритропоэз в жировых телах щек человека/ А.И.Марков и др.// Морфологические ведомости, 2004, №.3-4, с.55-57.
- Натан Д. Г. Регуляция кровотворения/ Д. Г. Натан, К.А. Зифф// Гематол., трансфузиол., 1994, № 2, с.3-4.
- Waldeger W. Uber die Veranberung der guergestreiften Muskeln bei Entrundung und dem Typhusprozess sowie uber die Regeneration derselben nach Substanzdrfecten/ W.Waldeger// Virch.Arch., 1865, Bd.34, P.473-514
- Мечников И.И. Atrophie des muscles pendant la transformation des Babracies/ И.И.Чечников// Annal.del Ynsf/Pasteur, 1892, Vol.6, p.1-12.
- Вейцман В.Р. Об ангиоматозном превращении мышечной ткани /В.В.Вейцман// Сов.хирургия, 1934, № 7, с.760-767.
- Налетов Н.А. Основы трансформационной клеточной теории /Н.А.Налетов// Арх.патол., 1993, № 7, с.79-80.


