Удаление метастазов при метастатическом раке толстой кишки с мутацией в гене BRAF -результаты многоцентрового ретроспективного исследования
Автор: Федянин М.Ю., Эльснукаева Х. Х.-М., Демидова И.А., Строяковский Д.Л., Шелыгин Ю.А., Цуканов А.С., Сергеев Ю.С., Пономаренко А.А., Панина М.В., Шубин В.П., Моисеенко Ф.В., Карпенко Е.Ю., Болотина Л.В., Кудрявцева А.В., Филипенко М.Л., Воскобоев М.Е., Оскорбин И.П., Владимирова Л.Ю., Кит О.И., Строганова А.М., Дранко С.Л., Сендерович А.И., Трякин А.А., Тюляндин С.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 3 т.11, 2021 года.
Бесплатный доступ
Цель: Локальные методы лечения метастазов являются неотъемлемой частью терапии больных раком толстой кишки. Однако данных по эффективности хирургического удаления метастазов при мутации в гене BRAF недостаточно, чтобы рекомендовать данный подход в рутинной практике. Нами инициировано ретроспективное многоцентровое исследование по оценки встречаемости мутаций в гене BRAF при метастатическом раке толстой кишки, в рамках которого изучена эффективность метастазэктомии в этой группе пациентов. Материалы и методы: Из базы данных пациентов с мутацией в гене BRAF, созданной в результате многоцентрового ретроспективного исследования с участием 7 клиник Российской Федерации, были отобраны все пациенты, которым проводилось хирургическое удаление метастазов различной локализации. С целью сравнительного анализа из регистра отделения химиотерапии № 2 НМИЦ онкологии им. Н. Н. Блохина были отобраны все 57 пациентов с мутацией в генах RAS и 43 пациента с диким типом генов RAS и BRAF, которым также проводилось хирургическое удаление метастазов на любом из этапов лечения. В качестве основных критериев эффективности рассматривались выживаемость без признаков болезни и общая выживаемость. Результаты: Было найдено 26 больных с мутацией в гене BRAF, которым выполнялось хирургическое удаление метастазов. При сравнении выживаемости без признаков болезни наихудший показатель медианы был достигнут в группе пациентов с мутацией в гене BRAF - 7 месяцев против 14 месяцев при мутации в генах RAS (ОР 0,4, 94 % ДИ 0,23-0,7, р=0,006); медиана выживаемости без признаков болезни в группе с диким типом генов RAS и BRAF не была достигнута (ОР 0,2, 95 % ДИ 0,11-0,45, р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Рак толстой кишки, метастазэктомия, braf
Короткий адрес: https://sciup.org/140290749
IDR: 140290749 | DOI: 10.18027/2224-5057-2021-11-3-5-14
Текст научной статьи Удаление метастазов при метастатическом раке толстой кишки с мутацией в гене BRAF -результаты многоцентрового ретроспективного исследования
Локальные методы лечения метастазов являются неотъемлемой частью терапии больных раком толстой кишки. И хотя проспективных рандомизированных исследований не проводилось для подтверждения эффективности метастазэктомии в сравнении с системной терапией, тем не менее, по результатам ретроспективных баз данных, удаление метастазов позволяет достичь медианы общей выживаемости до 58–69 месяцев, а у 25% больных обеспечить выздоровление [1–3]. С другой стороны, такие высокие показатели выживаемости могут быть во многом связаны с отбором пациентов на хирургическое лечение и опытом хирурга.
Создано большое количество прогностических систем для оценки риска прогрессирования после метастазэкто-мий, и все они в большинстве включают такие клинические факторы, как число метастазов, их размеры, число органов, пораженных метастазами, уровень РЭА, поражение лимфоузлов, синхронное метастазирование и т. п. [4]. По данным ретроспективного анализа, проведение адъювантной химиотерапии значительно улучшает результаты хирургического лечения только у пациентов с неблагоприятным прогнозом. В то же время, результаты хирургического лечения пациентов с благоприятным прогнозом практически не зависели от добавления адьювантной химиотерапии [5]. Вероятно, в данной группе заболевание имеет индолентный характер и радикального хирургического лечения вполне достаточно для достижения длительной ремиссии. Результаты другого ретроспективного анализа свидетельствуют, что у 40% больных рецидив заболевания с генерализацией процесса наблюдается в ранние сроки после хирургического удаления метастазов [6]. Соответственно, в этой группе хирургическое удаление метастазов, по-видимому, не меняет прогноз заболевания, а эти больные изначально являются кандидатами для проведения только системной терапии. Возможно, наряду с клиническими характеристиками необходимо учитывать и молекулярно-генетический портрет опухоли.
К настоящему времени в клинической практике в качестве такого генетического маркера с наиболее неблагоприятным прогнозом применяется определение мутационного статуса гена BRAF . Так, при данной альтерации при метастатическом раке толстой кишки медиана продолжительности жизни с момент начала первой линии терапии составляла в академических центрах 11,7 месяцев [7], а по данным популяционного исследования США и Канады — всего 6 месяцев [8]. Худший прогноз также отмечается и у пациентов с более ранними стадиями [9].
Первоначальные исследования по оценки возможности метастазэктомии при мутации в гене BRAF касались метастатического поражения легких. Показатели 5-тилетней общей выживаемости (ОВ) в группе с мутацией в гене BRAF составила 0%, в сравнении с 44% и 100% при мутации в гене KRAS и диком типе гена KRAS и BRAF, что вылилось в показатели медианы ОВ в 15, 55 и 98 месяцев соответственно. Авторы работы сделали вывод, что необходимо учитывать наличие мутации в гене BRAF при принятии решения о выполнении метастазэктомии в легких. Однако данный вывод был сделан лишь на 19 больных с данной альтерацией [11]. И действительно, частота встречаемости данной мутации в популяции больных метастатическим раком толстой кишки довольно низкая и составляет от 4 до 15% [12], что осложняет проведение исследований в данной подгруппе пациентов, да еще с целью решения вопроса об эффективности метастазэктомии.
Тем не менее, нами инициировано ретроспективное многоцентровое исследование по оценки встречаемости мутаций в гене BRAF при метастатическом раке толстой кишки, в рамках которого планировалось изучить и эффективность метастазэктомии в этой группе пациентов.
Материалы и методы
Из базы данных пациентов с мутацией в гене BRAF , созданной в результате многоцентрового ретроспективного исследования с участием 7 клиник Российской Федерации, были отобраны все пациенты, которым проводилось хирургическое удаление метастазов различной локализации. С целью сравнительного анализа из регистра отделения химиотерапии № 2 НМИЦ онкологии им. Н. Н. Блохина были отобраны все 57 пациентов с мутацией в генах RAS и 43 пациента с диким типом генов RAS и BRAF , которым также проводилось хирургическое удаление метастазов на любом из этапов лечения.
В качестве основных критериев эффективности рассматривалась выживаемость без признаков болезни, рассчитывавшаяся с момента начала хирургического удаления метастазов до прогрессирования и/или смерти от любой причины или даты последнего наблюдения, и ОВ, рассчитывавшаяся с момента хирургического удаления метастазов до даты смерти от любой причины или даты последнего наблюдения. Ситуации, когда пациент не умер и при этом не имел прогрессирования заболевания, рассматривались как цензурированные события. Выживаемость рассчитывалась по методу Каплана–Майера. Сравнение групп больных по выживаемости проводилось с помощью лог-ранг теста, теста Breslow–Wilcoxon или с помощью Cox анализа, в зависимости от статистической ситуации. Для переменных, отражающих различные признаки, применялись методы описательной статистики. Для сравнения групп больных по частоте встречаемости признаков, представленных непараметрическими (номинальными) переменными, применялся метод Fisher. Сравнение групп больных по факторам, представленных численными переменными, проводилось в зависимости от распределения признака. При нормальном распределении использовался t-критерий Стьюдента, при неправильном распределении независимых признаков — тест Mann–Whitney. При использовании перечисленных методов статистики применялся
УДАЛЕНИЕ МЕТАСТАЗОВ ПРИ МЕТАСТАТИЧЕСКОМ РАКЕ ТОЛСТОЙ КИШКИ С МУТАЦИЕЙ В ГЕНЕ BRAF —
РЕЗУЛЬТАТЫ МНОГОЦЕНТРОВОГО РЕТРОСПЕКТИВНОГО ИССЛЕДОВАНИЯ
Собственные исследования
95% доверительный интервал и значение двустороннего «р». Многофакторный анализ проводился с помощью пошагового регрессионного анализа Cox.
Статистический анализ проводился с помощью программ статистического пакета SPSS (IBM® SPPS® Statistics v. 20), ряд графиком представлены с помощью программы Graph Pad v. 5.0 и программы Microsoft® Excel® 2010.
Результаты
Всего в базе данных пациентов было найдено 26 больных с мутацией в гене BRAF , которым выполнялось хирургическое удаление метастазов. Сравнительная характеристика пациентов в зависимости от мутационного статуса представлена в табл. 1.
Как видно из табл. 1, в отличие от других мутационных фенотипов, при мутации в гене BRAF опухоли чаще были более распространёнными как по индексу T, так и по индексу N, чаще встречалось синхронное метастазирование и описано большее число органов, пораженных метаста- зами. Морфологически опухоли не отличались от других мутационных фенотипов по частоте наличия ни перстневидноклеточного, ни муцинозного компонента в опухоли, хотя при мутации в гене BRAF реже встречалась низкая степень злокачественности. По локализации первичной опухоли пациенты с разным фенотипом не отличались. Следует отметить, что для мутации в гене BRAF было характерно поражение метастазами брюшины и развитие рецидивов после удаления первичной опухоли. У всех, за исключением одного, пациентов с мутацией BRAF определялась мутация V600Е.
В группе m BRAF чаще всего операции проводились одномоментно при удалении первичной опухоли — в 53,8% случаев, и чаще всего это было удаление очагов по брюшине (19,2%). При этом радикальность оперативного вмешательства трактовалась как R0 у 88,5% пациентов. Операция на фоне прогрессирования, больше симптоматического характера, была проведена 4 больным (15,4%), из них в 2 наблюдениях—аднексэктомия при метастатическом поражении яичников (табл. 2). Не отмечено случаев
Таблица 1. Характеристика пациентов, в зависимости от мутационного статуса опухоли
|
Признак |
mBRAF n=26 (100 %) |
mRAS n=57 (100 %) |
wtRAS/wtBRAF n=43 (100%) |
р |
|
Возраст (среднее, мин-макс, σ) |
57(29–73, 12,8) |
58,1 (32–81, 9,7) |
55,6 (31–76, 11,3) |
0,6 |
|
Женский пол |
17 (65,4%) |
35 (61,4%) |
19 (44,2%) |
0,2 |
|
Сопутствующая патология |
5 (19,2%) |
13 (22,8%) |
4 (9,3%) |
0,2 |
|
Сердечно-сосудистая патология |
3 (11,5%) |
7 (12,3%) |
2 (4,7%) |
0,4 |
|
Сахарный диабет |
0 |
4 (7%) |
1 (2,3%) |
0,3 |
|
Первично-множественная опухоль |
3 (11,5%) |
3 (5,3%) |
1 (2,3%) |
0,3 |
|
Индекс Т: 1 |
0 |
0 |
0 |
|
|
2 |
2 (7,7%) |
4 (7%) |
2 (4,7%) |
0,8 |
|
3 |
11 (42,3%) |
31 (54,4%) |
30 (69,8%) |
0,04 |
|
4 |
7 (26,9%) |
21 (36,8%) |
11 (25,6%) |
0,4 |
|
Нет данных |
6 (23,1%) |
1 (1,8%) |
0 |
<0,001 |
|
Индекс N: 0 |
5 (19,2%) |
36 (63,2%) |
32 (74,4%) |
<0,001 |
|
1 |
3 (11,5%) |
9 (15,8%) |
2 (4,7%) |
0,2 |
|
2 |
10 (38,5%) |
8 (14%) |
8 (18,6%) |
0,04 |
|
Нет данных |
8 (30,8%) |
4 (7%) |
1 (2,3%) |
<0,001 |
|
Синхронные метастазы |
13 (50%) |
11 (19,3%) |
5 (11,6%) |
0,002 |
|
Стадия: 1 |
2 (7,7%) |
0 |
5 (11,6%) |
0,01 |
|
2 |
3 (11,5%) |
18 (31,6%) |
14 (32,6%) |
0,1 |
|
3 |
7 (26,9%) |
28 (49,1%) |
19 (44,2%) |
0,2 |
|
4 |
13 (50%) |
11 (19,3%) |
5 (11,6%) |
0,002 |
|
Нет данных |
1 (3,8%) |
0 |
0 |
0,2 |
|
Перстневидноклеточный компонент |
0 |
0 |
1 (2,3%) |
0,5 |
|
Муцинозный компонент |
3 (11,5%) |
11 (19,3%) |
10 (23,3%) |
0,5 |
|
Степень злокачественности: G1 |
3 (11,5%) |
5 (8,8%) |
4 (9,3%) |
0,9 |
|
G2 |
9 (34,6%) |
36 (63,1%) |
28 (65,1%) |
0,03 |
|
G3 |
6 (23,1%) |
6 (10,5%) |
5 (11,6%) |
0,3 |
|
Нет данных |
8 (30,8%) |
10 (17,6%) |
5 (11,6%) |
0,2 |
|
Тип мутации: V600 |
25 (96,2%) |
– |
– |
– |
|
Не V600 |
1 (3,8%) |
– |
– |
УДАЛЕНИЕ МЕТАСТАЗОВ ПРИ МЕТАСТАТИЧЕСКОМ РАКЕ ТОЛСТОЙ КИШКИ С МУТАЦИЕЙ В ГЕНЕ BRAF — РЕЗУЛЬТАТЫ МНОГОЦЕНТРОВОГО РЕТРОСПЕКТИВНОГО ИССЛЕДОВАНИЯ
Собственные исследования
Таблица 1. Характеристика пациентов, в зависимости от мутационного статуса опухоли (продолжение)
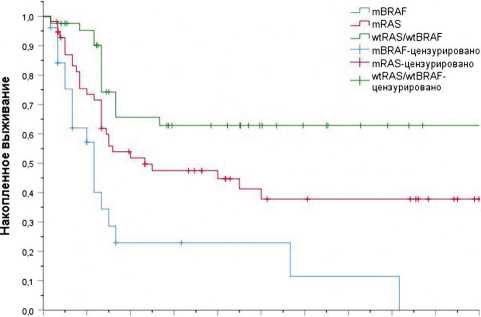
При сравнении выживаемости без признаков болезни наихудший показатель медианы был достигнут в группе пациентов с мутацией в гене BRAF — 7 месяцев против 14 месяцев при мутации в генах RAS (ОР 0,4, 94% ДИ 0,23–0,7,
Таблица 2. Характеристика хирургических вмешательств при mBRAF
При сравнении показателей ОВ выявлены аналогичные закономерности: медиана ОВ в группе с мутацией в гене BRAF составила 26 месяцев против 38 месяцев в группе с мутацией в генах RAS (ОР 0,8, 95% ДИ 0,33–1,98, р=0,6) и 49 месяцев в группе wt RAS /wt BRAF (ОР 0,46, 95% ДИ 0,17– 1,24, р=0,1). При этом медиана наблюдения за пациентами составила 8 месяцев (от 1 до 49) (рис. 2).
Отдельно проведен анализ выживаемости без признаков болезни пациентов с мутацией в гене BRAF в зависимости от сроков операции и локализации метастазов, за исключением случаев паллиативных операций на фоне прогрессирования (n=22) (рис. 3 и табл. 3). Значимых различий между группами выполнения метастазэктомии на первом этапе и группой с периоперационным назначением химиотерапии получено не было: медианы выживаемости без признаков болезни составили 7,0 и 4,0 месяца, соответственно (ОР 1,9, 95% ДИ 0,67–5,7, р=0,2).
Как видно из табл. 3, только удаление рецидивных опухолей и при поражении забрюшинных лимфоузлов
УДАЛЕНИЕ МЕТАСТАЗОВ ПРИ МЕТАСТАТИЧЕСКОМ РАКЕ ТОЛСТОЙ КИШКИ С МУТАЦИЕЙ В ГЕНЕ BRAF —
РЕЗУЛЬТАТЫ МНОГОЦЕНТРОВОГО РЕТРОСПЕКТИВНОГО ИССЛЕДОВАНИЯ
Собственные исследования
,0 6,0 12,0 16,0 24,0 30,0 36,0 42,0 46,0 64,0 60,0
Месяцы
Рисунок 1. Сравнение выживаемости без прогрессирования пациентов, которым проводилась метастазэктомия в зависимости от мутационного статуса.
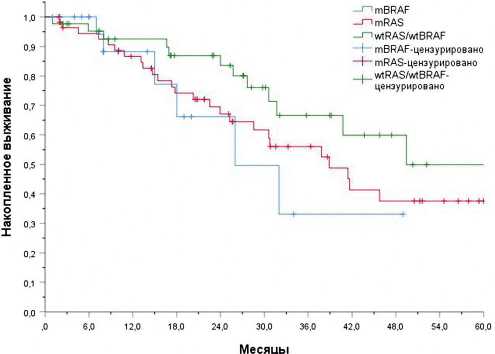
Рисунок 2. Сравнение общей выживаемости пациентов, которым проводилась метастазэктомия в зависимости от мутационного статуса.
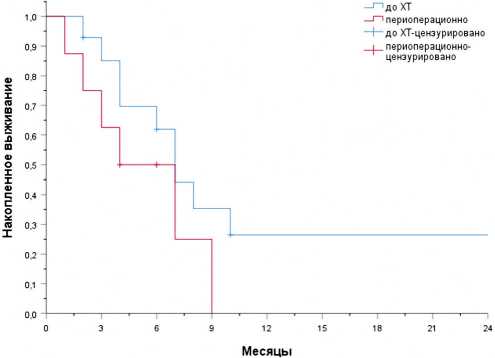
Рисунок 3. Сравнение выживаемости пациентов, которым проводилась метастазэктомия в зависимости от сроков операции.
Таблица 3. Медианы выживаемости без признаков болезни пациентов с мутацией в гене BRAF, которым выполнялась метастазэктомия, в зависимости от органа поражения
|
Орган поражения |
N (%) |
Медиана ВБПБ, мес. |
|
Яичники |
1 (4,5%) |
10 |
|
Головной мозг |
3 (13,6%) |
7 |
|
Печень |
9 (40,9%) |
7 |
|
Рецидив +/- забрюшинные лимфоузлы |
2 (9,1%) |
2 |
|
Брюшина |
4 (18,2%) |
8 |
|
Легкое |
3 (13,6%) |
6 |
ВБПБ — выживаемость без признаков болезни метастазами было ассоциировано с крайне низкой выживаемостью без признаков болезни, тогда как при удалении изолированных метастазов в печени, легких или по брюшине возможно достичь медианы данного показателя на уровне 6–8 месяцев.
Обсуждение
По результатам нашего исследования выживаемость без признаков болезни при удалении метастазов у больных метастатическим раком с мутацией в гене BRAF составила 7 месяцев, что значимо ниже в сравнении с пациентами с другими мутационными фенотипами. В связи с этим наличие информации по данной альтерации необходимо учитывать при планировании хирургического удаления метастазов. При этом медиана ОВ пациентов с мутацией в гене BRAF оказалась довольно высокой (26 месяцев), что можно объяснить коротким периодом наблюдения за пациентами.
В литературе опыт хирургии метастазов рака толстой кишки при мутации в гене BRAF ограничен небольшими ретроспективными исследованиями. Так, клиника MD Anderson представила результаты лечения 25 пациентов с мутацией в гене BRAF с длительной ОВ (медиана — 84 месяца), из них 10 была выполнена метастазэктомия и 2 — регионарная лучевая терапия. В этой подгруппе пациентов медиана ОВ составила 58 месяцев. Именно за счет этой подгруппы, а также за счет пациентов, которым при синхронном наличии микросателлитной нестабильности проводилась иммунотерапия, и была достигнута длительная выживаемость в общей группе пациентов [12].
Moran с соавторами в 2020 году представил опыт работы клиник Испании, отобрав 21 больного с мутацией в гене BRAF и сравнив их выживаемость с пациентами с диким типом гена после хирургического удаления метастазов. Медиана ОВ хотя и была ниже в сравнении с группой ди-
УДАЛЕНИЕ МЕТАСТАЗОВ ПРИ МЕТАСТАТИЧЕСКОМ РАКЕ ТОЛСТОЙ КИШКИ С МУТАЦИЕЙ В ГЕНЕ BRAF — РЕЗУЛЬТАТЫ МНОГОЦЕНТРОВОГО РЕТРОСПЕКТИВНОГО ИССЛЕДОВАНИЯ
Собственные исследования кого типа гена, но соответствовала нашим результатам — 24,8 против 41,56 месяцев (р=0,02). При этом в сравнении с пациентами без метастазэктомии общая выживаемость была выше в группе с хирургией метастазов — 38,2 против 18,5 месяцев, р=0,0435 [13].
Prassana с соавторами сравнил выживаемость 30 пациентов с мутацией в гене BRAF с 483 пациентами с диким типом гена после метастазэктомии. Безрецидивная выживаемость значимо не различалась между группами: 16 против 19 месяцев (ОР 1,5, р=0,09). Однако медиана ОВ была в практически в 2 раза ниже при мутации: 25 против 48 месяцев (ОР 1,9, р=0,009). Интересно, что при многофакторном анализе в общей популяции больных после ме-тастазэктомии, наличие мутации в гене BRAF не обладало независимым негативным влиянием на ОВ (ОР 1,39, 95% ДИ 0,8–2,43, р=0,247). В то же время метастазэктомия значимо улучшала показатели общей выживаемости в сравнении с пациентами, которым метастазы не удалялись (ОР 0,34, 95% ДИ 0,18–0,65, р=0,001). В отличие от нашей выборки, в данной работе большинство операций выполнялось спустя 12 месяцев с момента постановки диагноза. Не отмечено улучшения выживаемости при метастазэк-томии в случае поражения более 1 органа метастазами (ОР 0,86, р=0,7) или при поражении метастазами только брюшины или большого сальника (ОР 0,64, р=0,36) [14].
В еще одной относительно крупной работе была изучена эффективность резекций печени с метастазами у 43 пациентов с мутацией в гене BRAF , в качестве контроля выступали 480 пациентов с wt KRAS /wt BRAF и 326 пациентов с m KRAS -фенотипом. При многофакторном анализе наличие мутации в гене BRAF V600E, но не других BRAF -мутаций, значимо ухудшало выживаемость без признаков болезни (ОР 2,04, 95% ДИ 1,3–3,2, р=0,002) и ОВ (ОР 2,76, 95% ДИ 1,74–4,37, р<0,001) [15].
В работе Johnson с соавторами 21 из 52 пациентов выполнена операция (метастазэктомия) на печени. Медиана ОВ для всех 52 пациентов составила 25,0 месяцев, в группе метастазэктомии — 29,1 месяца против 13,6 месяцев в группе без нее (ОР 0,52, 95% ДИ 0,28–0,97, р=0,03), что подтверждено и в многофакторном анализе. Медиана выживаемости без признаков болезни составила 9,7 месяцев [16]. Более скромные результаты в отношении выживаемости без признаков болезни после резекции печени с метастазами при мутации в гене BRAF (n=12) продемонстрировал Schirripa с соавторами в сравнении с m RAS (n=160) и wt RAS /wt BRAF (n=137) популяциями: 5,7, 11 и 14,4 месяцев, соответственно (р=0,043). В многофакторном анализе наличие мутации в гене BRAF подтвердило свое негативное прогностическое значение (ОР 2,31, 95% ДИ 1,09–4,87, р=0,029). Аналогичные результаты были достигнуты и в отношении ОВ — ОР 1,47, 95% ДИ 1,05–2,07, р=0,025) [17]. Такие же неудовлетворительные результаты в отношении выживаемости без прогрессирования были получены и в исследовании Teng с соавторами, правда, всего на 6 пациентах [18].
В более раннем исследовании Yaeger с соавторами 32 пациентам с мутацией в гене BRAF была выполнена мета-стазэктомия, чаще в объеме резекции печени. При этом частота метастазэктомий была ниже в сравнении с другими мутационными фенотипами: 26 % против 41 %, р<0,01. Медиана безрецидивной выживаемости проигрывала в сравнении с пациентами без мутации: 7 против 11 месяцев (р=0,084). Тем не менее, 61 % больных были живы после 2 лет наблюдения [19].
Отдельный опыт представлен и в отношении пери-отенеумэктомии при мутации в гене BRAF . Из 180 пациентов, которым была выполнена полная циторедукция с HIPEC, мутация в гене BRAF выявлена в 23,4% наблюдений (в 16,4% — MSS, в 7% — MSI-H-фенотип). Трехлетняя выживаемость без прогрессирования в группе m BRAF / MSI-H составила 38,9% против 24,3% в группе wt KRAS / wt BRAF , 13,2 % в группе m KRAS и 17,9% в группе m BRAF / MSS-фенотипа. Медиана ОВ составила: 59 месяц, 30 месяцев, 41 месяц и 22 месяца, соответственно [20].
Таким образом, если принять во внимание, что выживаемость без прогрессирования в первой линии или во второй линии при применении даже ингибиторов BRAF с анти-EGFR-антителами при мутации в гене BRAF составляет 5 месяцев [21], то вариант лечения, который дает 7 месяцев дополнительной выживаемости без признаков болезни можно рассматривать к применению в клинической практике. С другой стороны, разнородность показателей выживаемости, полученной в нашей работе в зависимости от локализации метастазов, говорит о необходимости отбора пациентов на метастазэктомию даже при изолированном поражении опухоли. Так, удаление рецидивных опухолей и забрюшинных лимфоузлов ассоциировано с крайне низкой выживаемостью без признаков болезни, тогда как при удалении изолированных метастазов в печени, легких или по брюшине возможно достичь медианы данного показателя на уровне 6–8 месяцев. Данный тезис поддерживают результаты приведенного выше исследования из Висконсина. Авторы показали, что пациенты с поражением печени и легких чаще встречаются среди долгожителей с мутацией в гене BRAF [12]. Можно вспомнить и результаты исследования прогностических факторов при мутации в гене BRAF среди пациентов, которым проводилась терапия таргетными препаратами (ингибиторами BRAF с анти-EGFR-антитела-ми с или без ингибиторов МЕК) в исследовании Montañá с соавторами. При хорошем функциональном статусе (ECOG 0) и нормальном уровне РЭА медиана ОВ не была достигнута, при одном неблагоприятном факторе прогноза (ECOG1 или повышенный уровень РЭА) медиана составила 13,5 месяцев, при двух факторах неблагоприятного прогноза — 5,6 месяцев [22].
Интересно, что проведение периоперационной химиотерапии не влияло на выживаемость без прогрессирования заболевания в сравнении с пациентами, которым удалялись метастазы на первом этапе в нашем исследовании.
УДАЛЕНИЕ МЕТАСТАЗОВ ПРИ МЕТАСТАТИЧЕСКОМ РАКЕ ТОЛСТОЙ КИШКИ С МУТАЦИЕЙ В ГЕНЕ BRAF —
РЕЗУЛЬТАТЫ МНОГОЦЕНТРОВОГО РЕТРОСПЕКТИВНОГО ИССЛЕДОВАНИЯ
Собственные исследования
Вероятно, это связано с тем, что на первом этапе удалялись метастазы с меньшим объемом поражения органа — изолированное поражение тазовой брюшины, небольшое число метастазов в печени и т. п.
Основной недостаток нашей работы является ретроспективный его характер, и небольшое число пациентов, разнородность хирургических вмешательств в выборке, что не позволяет адекватно оценить прогностическую роль различных признаков, в том числе и время хирургического вмешательства, количества и размеров очагов в печени, эффективность системной терапии перед хирургическим этапом, а также разработать модель по отбору больных с мутацией в гене BRAF на хирургическое удаление метастазов.
Заключение
Прогноз больных с мутацией в гене BRAF после хирургического удаления метастазов хуже в сравнении с пациентами с другим мутационным фенотипом. Тем не менее данные литературы, а также результаты нашего исследования подтверждают возможность выполнения мета-стазэктомии в этой группе неблагоприятного прогноза но с тщательным отбором пациентов.
RESECTION OF METASTASES IN PATIENTS WITH BRAF MUTATEDMETASTATIC COLON CANCER: RESULTS OF A MULTICENTERRETROSPECTIVE STUDY
M. Yu. Fedyanin 1, 9, H H.‑M. Elsnukaeva 1, I. A. Demidova2, D. L. Stroyakovskii2, Yu. A. Shelygin3, A. S. Tsu‑ kanov3, Yu. S. Sergeev 1, A. A. Ponomarenko3, M. V. Panina3, V. P. Shubin3, F. V. Moiseenko 4, E. Yu. Karpenko 5, L. V. Bolotina 5, A. V. Kudriavtseva 5, M. L. Filipenko 6, M. E. Voskoboev 8, I. P. Oskorbin 7, L. Yu. Vladimirova 7, O. I. Kit 7, A. M. Stroganova 1, S. L. Dranko 1, A. I. Senderovich 10, A. A. Tryakin 1, S. A. Tjulandin 1
-
1 N. N. Blokhin National Medical Research Center of Oncology, Moscow, Russia
-
2 Moscow Municipal Oncological Hospital No. 62, Moscow Department of Health, Moscow, Russia
-
3 National Medical Research Center of Coloproctology named after A. N. Ryzhikh, Moscow, Russia
-
4 Saint Petersburg Clinical Research and Practice Centre for Specialized Care (Oncological), Saint Petersburg, Russia
-
5 P. Hertsen Moscow Oncology Research Institute — Branch of the National Medical Research Radiological Centre, Moscow, Russia
-
6 Institute of Chemical Biology and Fundamental Medicine, Siberian Branch of the Russian Academy of Sciences, Novosibirsk, Russia
-
7 National Medical Research Centre for Oncology, Rostov-on-Don, Russia
-
8 Novosibirsk State University, Novosibirsk, Russia
-
9 Peoples Friendship University of Russia, Moscow, Russia
-
10 Central Clinical Hospital with Polyclinic, Moscow, Russia
Materials and methods: we selected all patients who underwent surgical resection of metastases in various sites from the database of patients with BRAF gene mutations created as a result of a multicenter retrospective study with participation of 7 clinics in the Russian Federation. All 57 patients with RAS gene mutations and 43 patients with wild‑type RAS and BRAF genes who also underwent surgical resection of metastases at any stage of treatment were selected from the register of the Chemotherapy Department No. 2 of the NMRC of Oncology named after N. N. Blokhin for comparative analysis. Disease‑free survival and overall survival were used as primary efficacy criteria.
Results: we found 26 patients with BRAF gene mutations who underwent surgical resection of metastases. When comparing disease‑free survival, the worst median was achieved in the group of patients with BRAF gene mutations:
УДАЛЕНИЕ МЕТАСТАЗОВ ПРИ МЕТАСТАТИЧЕСКОМ РАКЕ ТОЛСТОЙ КИШКИ С МУТАЦИЕЙ В ГЕНЕ BRAF — РЕЗУЛЬТАТЫ МНОГОЦЕНТРОВОГО РЕТРОСПЕКТИВНОГО ИССЛЕДОВАНИЯ
Собственные исследования
-
7 months versus 14 months in patients with RAS gene mutations (HR 0.4, 94 % CI 0.23–0.7, P = 0.006); median disease‑free survival was not achieved in the wild‑type RAS and BRAF group (HR 0.2, 95 % CI 0.11–0.45, P <0.001). The median overall survival in the BRAF gene mutation group was 26 months versus 38 months in the RAS gene mutations group (HR 0.8, 95 % CI 0.33–1.98, P = 0.6) and 49 months in the wt RAS /wt BRAF group (RR 0.46, 95 % CI 0.17–1.24, P = 0.1). Resection of recurrent tumors in patients with metastases in retroperitoneal lymph nodes was associated with extremely low disease‑free survival (2 months); at the same time, disease‑free survival was 7 months after resection of isolated metastases in the liver and 8 months for metastases in the peritoneum.
Conclusion: prognosis of patients with a BRAF gene mutation after surgical resection of metastases is worse than in patients with a different mutation phenotype. Nevertheless, literature data, as well as the results of our study, confirm the possibility of performing metastasectomy with careful selection of patients.
Irina A. Demidova , MD, PhD, Head of the Laboratory of Molecular Biology, Moscow Municipal Oncological Hospital No. 62, Moscow, Russia
Daniil L. Stroyakovskii , MD, PhD, Head of the Chemotherapy Department, Moscow Municipal Oncological Hospital No. 62, Moscow, Russia
Yurii A. Shelygin , MD, PhD, DSc, Prof., Academician of the Russian Academy of Sciences, Scientific Director, National Medical Research Center of Coloproctology named after A. N. Ryzhikh, Moscow, Russia
Aleksey S. Tsukanov , MD, PhD, DSc, Leading Researcher, Head of the Laboratory Genetics Department, National Medical Research Center of Coloproctology named after A. N. Ryzhikh, Moscow, Russia
Yurii S. Sergeev , MD, PhD, Oncologist at the Surgical Department, N. N. Blokhin National Medical Research Center of Oncology, Moscow, Russia
Aleksey A. Ponomarenko , MD, PhD, DSc, Leading Researcher of the 3th Surgical Department (Rectal Oncology), National Medical Research Center of Coloproctology named after A. N. Ryzhikh, Moscow, Russia
Maria V. Panina , MD, PhD, Oncologist of the Department of Anticancer Chemotherapy, National Medical Research Center of Coloproctology named after A. N. Ryzhikh, Moscow, Russia
Vitaliy P. Shubin , MD, PhD biol., Senior Researcher, National Medical Research Center of Coloproctology named after A. N. Ryzhikh, Moscow, Russia
Fyodor V. Moiseenko , MD, PhD, DSc, Head of Chemotherapy Department, Saint Petersburg Clinical Research and Practice Centre for Specialized Care (Oncological), Saint Petersburg, Russia
Elena Yu. Karpenko , Junior Researcher, Chemotherapy Department, Department of Tumor Drug Treatment, P. Hertsen Moscow Oncology Research Institute — Branch of the National Medical Research Radiological Centre, Moscow, Russia Larisa V. Bolotina , MD, PhD, DSc, Head of the Chemotherapy Department, P. Hertsen Moscow Oncology Research In‑ stitute — Branch of the National Medical Research Radiological Centre, Moscow, Russia
Anna V. Kudriavtseva , MD, PhD biol., Researcher, Department of Pathology, P. Hertsen Moscow Oncology Research Institute — Branch of the National Medical Research Radiological Centre, Moscow, Russia
Maksim L. Filipenko , MD, PhD biol., Chief Researcher, Head of the Pharmacogenomics Laboratory, Institute of Chemical Biology and Fundamental Medicine, Siberian Branch of the Russian Academy of Sciences, Novosibirsk, Russia
Mikhail E. Voskoboev , Novosibirsk State University, Novosibirsk, Russia
Igor P. Oskorbin , MD, PhD biol., Junior Researcher, Pharmacogenomics Laboratory, Institute of Chemical Biology and Fundamental Medicine, Siberian Branch of the Russian Academy of Sciences, Novosibirsk, Russia
Lubov Yu. Vladimirova , MD, PhD, DSc, Professor, Head of the Department of Tumor Drug Treatment, Head of the De‑ partment of Anticancer Drug Therapy, Rostov‑on‑Don, Russia
УДАЛЕНИЕ МЕТАСТАЗОВ ПРИ МЕТАСТАТИЧЕСКОМ РАКЕ ТОЛСТОЙ КИШКИ С МУТАЦИЕЙ В ГЕНЕ BRAF —
РЕЗУЛЬТАТЫ МНОГОЦЕНТРОВОГО РЕТРОСПЕКТИВНОГО ИССЛЕДОВАНИЯ
Собственные исследования
Oleg I. Kit , MD, PhD, DSc, Professor, Honored Doctor of the Russian Federation, General Director, National Medical Research Centre for Oncology, Rostov‑on‑Don, Russia
Anna M. Stroganova , MD, PhD, Head of the Molecular Biology Laboratory, Department of Morphological and Molecular Genetic Diagnostics of Tumors, Research Institute of Clinical Oncology, N. N. Blokhin National Medical Research Center of Oncology, Moscow, Russia
Svetlana L. Dranko , Laboratory Geneticist, Molecular Biology Laboratory, N. N. Blokhin National Medical Research Center of Oncology, Moscow, Russia
Anastasiya I. Senderovich , MD, PhD, Laboratory Geneticist, Laboratory of Immunomorphology and Molecular Genetics, Central Clinical Hospital with Polyclinic, Moscow, Russia
Alexey A. Tryakin , MD, PhD, DSc, Chief Researcher, Oncology Department of Drug Therapy (Chemotherapy) No. 2, N. N. Blokhin National Medical Research Center of Oncology, Moscow, Russia
Список литературы Удаление метастазов при метастатическом раке толстой кишки с мутацией в гене BRAF -результаты многоцентрового ретроспективного исследования
- Engstrand J, Nilsson H, Strömberg C, et al. Colorectal cancer liver metastases - a population-based study on incidence, management and survival. BMC Cancer. 2018; 18: 78.
- Kopetz S, Chang GJ, Overman MJ, Eng C, Sargent DJ, Larson DW, Grothey A, Vauthey JN, Nagorney DM, McWilliams RR. Improved survival in metastatic colorectal cancer is associated with adoption of hepatic resection and improved chemotherapy. J Clin Oncol. 2009 Aug 1;27 (22):3677-83. doi: 10.1200/Jœ. 2008.20.5278.
- Adam R, Yi B, Innominato PF, Barroso E, Laurent C, Giuliante F, Capussotti L, Lapointe R, Regimbeau JM, Lopez - Ben S, Isoniemi H, Hubert C, Lin JK, Gruenberger T, Elias D, Skipenko OG, Guglielmi A, LiverMetSurvey International Contributing Centers. Resection of colorectal liver metastases after second-line chemotherapy: is it worthwhile? A LiverMetSurvey analysis of 6415 patients. Eur J Cancer. 2017 Jun;78:7-15. doi: 10.1016/j. ejca. 2017.03.009.
- Spolverato G, Ejaz A, Azad N and Pawlik TM. Surgery for colorectal liver metastases: ^e evolution of determining prognosis. World J Gastrointest Oncol. 2013 Dec 15; 5 (12): 207-221. doi: 10.4251/wjgo. v5. i12.207.
- Rahbari NN, Reissfelder C, Schulze-Bergkamen H, Jäger D, Büchler MW, Weitz J, Koch M. Adjuvant therapy after resection of colorectal liver metastases: the predictive value of the MSKCC clinical risk score in the era of modern chemotherapy. BMC Cancer. 2014;14:174. DOI: https://doi. org/10.1186/1471-2407-14-174.
- de Jong MC, Pulitano C, Ribero D, Strub J, Mentha G, Schulick RD, Choti MA, Aldrighetti L, Capussotti L, Pawlik TM. Rates and patterns of recurrence following curative intent surgery for colorectal liver metastasis: an international multi-institutional analysis of 1669 patients. Ann Surg. 2009 Sep;250 (3):440-8. doi: 10.1097/SLA. 0b013e3181b4539b.
- Modest DP, Ricard I, Heinemann V, Hegewisch-Becker S, Schmiegel W, Porschen R, Stintzing S, Graeven U, Arnold D, von Weikersthal L F, Giessen-Jung C, Stahler A, Schmoll HJ, Jung A, Kirchner T, Tannapfel A, Reinacher-Schick A. Outcome according to KRAS-, NRAS- and BRAF-mutation as well as KRAS mutation variants: pooled analysis of five randomized trials in metastatic colorectal cancer by the AIO colorectal cancer study group. Ann Oncol. 2016 Sep;27 (9):1746-53. doi: 10.1093/annonc/mdw261. Epub 2016 Jun 29.
- Chu JE, Johnson B, Morris VK, Raghav KPS, Swanson L, Lim HJ, Renouf DJ, Gill S, Wolber R, Karsan A, Schaeffer DF, Kopetz S, Loree JM. Population-based screening for BRAF V600E in metastatic colorectal cancer (mCRC) to reveal true prognosis. Journal of Clinical Oncology. 2019;37, no. 15_suppl: 3579-3579. DOI: 10.1200/Jœ. 2019.37.15_suppl. 3579.
- Taieb J, Kourie HR, Emile JF, Le Malicot K, Balogoun R, Tabernero J, Mini E, Folprecht G, Van Laethem JL, Mulot C, Bouché O, Aparicio T, Michel P, ^aler J, Bridgewater J, Van Cutsem E, Perkins G, Lepage C, Salazar R, Laurent-Puig P, Pan-European Trials in Alimentary Tract Cancer (PETACC) -8 Investigators. Association of prognostic value of primary tumor location in stage III colon cancer with RAS and BRAF mutational status. JAMA Oncol. 2018 Jul 12;4 (7):e173695. doi: 10.1001/jamaoncol. 2017.3695.
- Renaud S, Romain B, Falcoz P-E, Olland A, Santelmo N, Brigand C, Rohr S, Guenot D, Massard G. KRAS and BRAF mutations are prognostic biomarkers in patients undergoing lung metastasectomy of colorectal cancer. Br J Cancer. 2015 Feb 17;112 (4):720-8. doi: 10.1038/bjc. 2014.499.
- Hernández-Sandoval JA, Gutiérrez-Angulo M, Magaña-Torres MT, Alvizo-Rodríguez CR, Ramírez-Plascencia HHF, Flores-López BA, Valenzuela-Pérez JA, Peregrina-Sandoval J, Moreno-Ortiz JM, Domínguez-Valentín M, de la Luz Ayala-Madrigal M. Prevalence of the BRAF p. v600e variant in patients with colorectal cancer from Mexico and its estimated frequency in Latin American and Caribbean populations. J Investig Med. 2020 Jun;68 (5):985-991. doi: 10.1136/jim-2020-001301. Oncol Rep. https://doi. org/10.3892/or. 2011.1217.
- Morris VK, Kee BK, Overman MJ, Fogelman DR, Dasari A, Raghav KPS, Shureiqi I, Johnson B, Parseghian CM, Wolff RA, Eng C, Garg N, Kopetz S. Clinical and pathologic factors associated with survival in BRAFV600E colorectal cancers. J Clin Oncol 38: 2020 (suppl; abstr 4047). DOI: 10.1200/jc0. 2020.38.15_suppl. 4047.
- Ortega L, Beranek MB, Alonso NG, Alsar JS, Bianchi MA, Valles MA, Salcedo IA, Gallego IG, Gonzalez GG, Pérez-Solero GT, Martin AJM, Ferrandiz AC, Blanco-Codesido M, Martin M, Garcia-Alfonso P. Metastases resection in colorectal cancer patients with mutation in oncogene BRAF or tumors located on the right side: Experience at the HGUGM. J Clin Oncol 38: 2020 (suppl; abstr 4041). DOI: 10.1200/jœ. 2020.38.15_suppl. 4041.
- Prasanna T, Wong R, Price T, Shapiro J, Tie J, Wong HL, Nott L, Roder D, Lee M, Kosmider S, Jalali A, Burge M, Padbury R, Maddern G, Carruthers S, Moore J, Sorich M, Karapetis CS, Gibbs P, Yip D. Metastasectomy and BRAF mutation; an analysis of survival outcome in metastatic colorectal cancer. Curr Probl Cancer. 2020 Aug 14;100637. doi: 10.1016/j. currproblcancer. 2020.100637. Online ahead of print.
- Margonis GA, Buettner S, Andreatos N, Kim Y, Wagner D, Sasaki K, Beer A, Schwarz C, L0es IM, Smolle M, Kamphues C, He J, Pawlik TM, Kaczirek K, Poultsides G, L0nning PE, Cameron JL, Burkhart RA, Gerger A, Aucejo FN, Kreis ME, Wolfgang CL, Weiss MJ. Association of BRAF mutations with survival and recurrence in surgically treated patients with metastatic colorectal liver cancer. JAMA Surg. 2018 Jul 18;153 (7):e180996. doi: 10.1001/jamasurg. 2018.0996.
- Johnson B, Jin Z, Truty MJ, et al. Impact of metastasectomy in the multimodality approach for braf v600e metastatic colorectal cancer: the Mayo Clinic experience. Oncologist. 2018;23:128-134. doi:10.1634/theoncologist. 2017-0230.
- Schirripa M, Bergamo F, Cremolini C, et al. BRAF and RAS mutations as prognostic factors in metastatic colorectal cancer patients undergoing liver resection. Br J Cancer. 2015;112:1921-1928. doi:10.1038/bjc. 2015.142.
- Teng HW, Huang YC, Lin JK et al. BRAF mutation is a prognostic biomarker for colorectal liver metastasectomy. J Surg Oncol 2012;106:123-129.
- Yaeger R, Cercek A, Chou JF et al. BRAF mutation predicts for poor outcomes after metastasectomy in patients with metastatic colorectal cancer. Cancer 2014;120:2316-2324.
- Larsen SG, Dueland S, Goscinski M, et al. Survival according to mutations in BRAF, KRAS, or microsatellite instability (MSI-H) after cytoreductive surgery and hyperthermic intraperitoneal chemotherapy (HIPEC) in patients with peritoneal metastases from colorectal cancer. J Clin Oncol. 2019;37 (15_suppl): 3565. doi:10.1200/JCO. 2019.37.15_suppl. 3565.
- Montana JR, Martini G, Baraibar I, Villacampa G, Comas R, Ciardiello D, Garcia A, Yague XH, Queralt B, Salvia AS, Argiles G, Cuadra JL, Toledo RA, Chicote I, Mulet N, Vivancos A, Palmer HG, Dienstmann R, Tabernero J, Elez E. Patient and tumor characteristics as determinants of overall survival (OS) in BRAF V600 mutant (mt) metastatic colorectal cancer (mCRC) treated with doublet or triplet targeted therapy. J Clin Oncol 38: 2020 (suppl; abstr 4112). DOI: 10.1200/Jœ. 2020.38.15_suppl. 4112.
- Montana JR, Martini G, Baraibar I, Villacampa G, Comas R, Ciardiello D, Garcia A, Yague XH, Queralt B, Salvia AS, Argiles G, Cuadra JL, Toledo RA, Chicote I, Mulet N, Vivancos A, Palmer HG, Dienstmann R, Tabernero J, Elez E. Patient and tumor characteristics as determinants of overall survival (OS) in BRAF V600 mutant (mt) metastatic colorectal cancer (mCRC) treated with doublet or triplet targeted therapy. J Clin Oncol 38: 2020 (suppl; abstr 4112). DOI: 10.1200/Jœ. 2020.38.15_suppl. 4112.


