УФ-индуцированный дрожжевой продуцент липазы с широкой субстратной специфичностью - селекция, свойства и получение ферментного препарата
Автор: Гаскарова Е.Ф., Иванова Л.А., Чурмасова Л.А., Машенцева Н.Г., Клабукова Д.Л.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биопрепараты и продуценты
Статья в выпуске: 6 т.54, 2019 года.
Бесплатный доступ
Липазы, изменяющие количественные и/или качественные характеристики жиросодержащего сырья, широко применяются при решении разнообразных задач в современной пищевой и агропромышленной отраслях. Для обеспечения растущих потребностей в препаратах этих ферментов необходимы высокоэффективные продуценты, особенно проявляющие множественную активность в отношении жиров различного состава и происхождения. Цель работы заключалась в поиске нового высокоактивного дрожжевого продуцента липазы с широкой субстратной специфичностью и оптимизация условий его культивирования. Также в настоящем исследовании получен ферментный препарат, обеспечивающий высокую степень гидролиза различных масел, и охарактеризованы его технологические свойства. У 110 изолятов дрожжевых культур, выделенных из природных источников и полученных из коллекций ФГБОУ ВО МГУПП и ФГБУ ГосНИИгенетика, были изучены липолитические свойства. Качественное определение липазной активности осуществляли на дифференциальной питательной среде с трибутирином и красителем метиловым красным, количественное - в соответствии с модифицированным методом Y. Ota и K. Yamada при pH реакционной смеси 5,5. Из 23 штаммов, обладавших липолитической активностью (ЛА), 12 имели достаточно высокие показатели ЛА - от 2,5 до 7,5 Ед/см3. Из них выбрали изолят М10 с максимальной ЛА. Были изучены морфологические, культуральные и физиолого-биохимические особенности штаммов и выполнена молекулярно-генетическая идентификация высокоактивного изолята. С помощью филогенетического анализа штамм был идентифицирован как C andida parapsilosis (степень гомологии 99 %) и депонирован во Всероссийскую коллекцию промышленных микроорганизмов (ВКПМ ФГБУ ГосНИИгенетика) под номером Y-4055. После проведения УФ-мутагенеза получен высокоактивный мутант C. parapsilosis М10-10, и с применением методов математического планирования подобран состав питательной среды (ПС), оптимальный для культивирования продуцента и биосинтеза фермента (%): горчичное масло - 2,6; дрожжевой экстракт - 1,8; соевая мука - 1; глюкоза - 0,5; Tween 80 - 0,42; СаСО3 - 0,3; КН2РО4 - 0,03; MgSO4 · 7H2O - 0,02. Установлено, что при использовании посевного материала М10-10 в количестве 5 % от объема ПС липаза достигает наибольшей активности в культуральной жидкости к 48 ч ферментации. При глубинном культивировании штамма М10-10 при температуре 30-40 °С и рН питательной среды 5,5-6,5 получен ферментный препарат (ФП) липазы штамма М10-10 со степенью очистки Г20×, ЛА которого составила 30630 Ед/г. Определены оптимальные условия для действия ФП: температура 37 °С и рН 5,5. По активности полученный ФП не уступает коммерческим отечественными и зарубежными аналогам, в том числе препарату Novozym 435 («Sigma-Aldrich», США), имеющему ЛА 24020 Ед/г. Жирнокислотную специфичность препарата липазы определяли при ферментолизе различных растительных масел и анализе липидных продуктов методом газожидкостной хроматографии на хроматографе ShimadzuGC 2010 («Shimadzu», Япония). Модификация растительных масел ферментным препаратом липазы М10-10 Г20× в эмульсии масло/вода позволила достоверно снизить относительное содержание насыщенных жирных кислот (в том числе пальмитиновой и стеариновой) в 2,4; 4,6; 2,9 и 1,5 раза и увеличить относительное содержание полиненасыщенных жирных кислот (в том числе w-3 линоленовой и w-6 линолевой) в 1,5; 1,6; 1,1 и 12 раз соответственно для оливкового, горчичного, подсолнечного и кокосового масел.
Продуцент липазы, ферментный препарат, уф-мутагенез, условия ферментации, липолитическая активность, модификация растительных масел, насыщенные жирные кислоты, ненасыщенные жирные кисоты
Короткий адрес: https://sciup.org/142226288
IDR: 142226288 | DOI: 10.15389/agrobiology.2019.6.1290rus
Текст научной статьи УФ-индуцированный дрожжевой продуцент липазы с широкой субстратной специфичностью - селекция, свойства и получение ферментного препарата
Модификация сырья или изменение исходного сырьевого состава используются для улучшения качества продуктов пищевого и агропромышленного производства. Одна из задач современной пищевой промышленности — получение жиров и масел с требуемыми физико-химическими
∗ Работа выполнена в рамках проекта ¹ 0710-2017-0010 «Поиск живых систем и субстанций природного происхождения с анализом их биологической активности для создания функциональных продуктов питания и кормов».
характеристиками (консистенции, пластичности, твердости) посредством их модификации (1, 2), что достигается изменением жирнокислотного состава липидов. К наиболее перспективным методам его корректировки относится трансформация растительных масел с помощью липаз (3, 4).
В последние годы липазы (КФ 3.1.1.3) стали активно использоваться в пищевой биотехнологии, а именно в производстве хлебобулочных изделий, продуктов брожения, молочного обогащения, при переработке растительного масла и производстве маргарина (2, 5). При обработке липазами улучшается вкус и текстура продуктов питания, продлевается срок годности и увеличивается мягкость некоторых продуктов. Кроме того, липазы используются для создания новых функциональных ингредиентов и функциональных пищевых продуктов, таких как эквиваленты масла какао или эквиваленты жира человеческого молока (5). В качестве добавок или биокатализаторов, например в производстве кофейных добавок, липазы применяются для модификации вкуса и появления ароматических нот в результате синтеза сложных эфиров короткоцепочечных жирных кислот и спиртов (6). При переработке яиц эти ферменты улучшают эмульгирующие свойства липидов яичного желтка (5). На мировом рынке растет спрос на улучшение качества мяса, поэтому актуализируется применение липазы при производстве кормов (7). В молочной промышленности эти ферменты используются для липолиза жиров, улучшения вкуса и ускорения созревания сыров, производства продуктов, подобных сырам (8). Различные типы сыра могут быть получены с использованием липаз из разных источников, например сыр романо — с преджелудочным ферментом ягненка, сыр камамбер — с липазой из Penicillium camemberti , голубой сыр — с ферментами из P. roqueforti , чеддер — с включением в рецептуру ферментов Aspergillus niger или A. oryzae (9, 10).
С перспективами применения липаз в пищевой и агропромышленной отраслях (11, 12) связана необходимость изучения практически значимых характеристик этих ферментов — субстратной специфичности, оптимума активности, стабильности при изменении внешних параметров, например кислотности среды и температуры.
Известные липолитические ферментные препараты (ФП) микробного происхождения в России и за рубежом обычно имеют грибное (в основном представители рода Candida — C. rugosa , C. lipolytica , актиномице-ты Streptomyces и Thermoactinomyces ) и бактериальное происхождение (представители родов Pseudomonas , Bacillus ) и оптимум действия в нейтральной и щелочной областях рН. Пищевой промышленности необходимы новые продуценты этих ферментов, сохраняющие функциональность в кислой зоне рН и имеющие значительную липолитическую активность (ЛА) (13, 14).
В последнее время пищевым производствам все чаще предлагаются рекомбинантные энзимы, полученные методами генной инженерии, но вопросы безопасности использования таких штаммов и их метаболитов при выпуске пищевых продуктов все еще открыты. Поэтому применение метода индуцированного мутагенеза с последующим отборов по целевым признакам не утратило актуальности. Основное преимущество этого метода в том, что он относительно прост и практически не требует подробных сведений как о генетике и метаболизме штамма-продуцента, так и о свойствах желаемого продукта.
В представляемой работе мы выделили дрожжевой штамм, секретирующий липазу с высокой активностью и широкой субстратной специфичностью, охарактеризовали его технологические свойства и свойства полученного на его основе ферментного препарата в сравнении с извест- ными российскими и зарубежными аналогами.
Нашей целью было получение методами УФ-мутагенеза и селекции высокоэффективного продуцента липазы, определение условий его культивирования, необходимых для максимального биосинтеза фермента, и создание на его основе ферментного препарата, обеспечивающего высокую степень гидролиза различных масел.
Методика . Липолитические свойства проанализировали у 110 дрожжевых изолятов — представителей таксонов Candida interace , C. maltose , C. tropicalis , Debaryomyces huansenii , Rhodotorula rubra , Zygosaccharomyces bailii , Z. rouxii , Saccharamyces cerevisiae , Yarrowia lipolytica . Часть штаммов получили из коллекций микроорганизмов кафедры биотехнологии и технологии продуктов биоорганического синтеза ФГБОУ ВО МГУПП и ФГБУ ГосНИИге-нетика, остальные культуры были выделены из продуктов, имеющих высокое содержание липидов (образцы масел, мясных и молочных продуктов, фруктов), и природных мест обитания (почва).
Культуральные и морфологические признаки штаммов и изолятов описывали при выращивании на агаризованных и жидких средах Сабуро; для изучения морфологических характеристик применяли световую микроскопию (МИКМЕД 5, АО «ЛОМО», Россия). Термостатирование осуществляли с использованием термостата ТСО-1/80 СПУ (ОАО «Смоленское СКТБ СПУ», Россия).
Использовали следующие базовые питательные среды (ПС; далее приведено процентное содержание ингредиентов). ПС ¹ 1 (для отбора штаммов, способных усваивать оливковое масло в качестве единственного источника углерода) содержала оливковое масло — 1, Na2HPO4 — 0,6, KH 2 PO 4 — 0,3, NH 4 Cl — 0,1, NaCl — 0,05, агар — 2 (pH = 7,2±0,1). ПС ¹ 2 (дифференциальная солевая среда с трибутирином и метиловым красным) включала Na2HPO4 — 0,6, KH2PO4 — 0,3, NH4Cl — 0,1, трибутирин — 0,3, NaCl — 0,05, агар — 2, краситель метиловый красный — 0,2 (pH = 6,5±0,1). В состав ПС ¹ 3 (среда Сабуро, жидкая или с добавлением 2 % агара; «HiMedia Laboratories Pvt., Ltd», Индия) входили пептон — 1, глюкоза — 4, (pH = 5,6±0,1). ПС ¹ 4 (жидкая среда для глубинного культивирования дрожжей) содержала дрожжевой экстракт — 2,0, глюкозу — 2,0, СаСО3 — 0,5, КН2РО4 — 0,05 (pH = 5,4±0,1). В ПС ¹ 5 (среда с добавлением индукторов синтеза липазы) входили горчичное масло — 2, дрожжевой экстракт — 2, соевая мука — 1, глюкоза — 0,5, Tween 80 — 0,2, СаСО3 — 0,3, КН 2 РО 4 — 0,03,MgSO 4 ■ 7H 2 O — 0,02 (pH = 5,5±0,1). Для оптимизации состава ПС использовали метод последовательного смещения (метод Гаусса-Зейделя) — экспериментальный поиск экстремума функций многих переменных, предусматривающий поочередное нахождение частных экстремумов целевой функции по каждому фактору. Среды стерилизовали ав-токлавированием30-40 мин при 0,25 МПа.
Образцы, отобранные для выделения потенциальных продуцентов липаз, хранили не более 1 мес при температуре 4 °С. Затем их суспендировали в стерильном 0,9 % растворе хлорида натрия (соотношение 1:10), вносили 4 % раствор сульфата гентамицина (конечная концентрация 0,1 %) для исключения развития сопутствующих бактерий и инкубировали в термостате при температуре 30 °С 1 ч. Далее получали накопительные культуры с использованием среды Сабуро (ПС ¹ 3), пересевали их на селективную ПС № 1 и инкубировали 72 ч при 30 °С. Полученные чистые культуры дрожжей микроскопировали и высевали на дифференцированную ПС ¹ 2 с индикатором для выявления липолитической способности. О способности штамма синтезировать липазу судили при выращивании дрожжей при 30 °С в течение 48 ч по образованию вокруг колоний зон просветления и изменению цвета плотной ПС от желтого к оранжевому и далее к красному. Чистые культуры липолитически активных микроорганизмов пересевали на агаризованную среду Сабуро для хранения.
С целью количественной характеристики ЛА в центрифугате культуральной жидкости (КЖ) и отбора наиболее липолитически активных штаммов проводили глубинное культивирование на качалочной установке при 30±2 ° С в течение 48 ч в колбах Эрленмейера объемом 750 см3, содержащих 100 см3 ПС ¹ 4. Посевным материалом служила водная суспензия дрожжей, содержащая 5½106 кл/см3, выращенных в пробирках на скошенной агаризованной ПС № 3 в течение 48 ч при 30 ° С (количество инокулята — 5 % объем/объем). По завершении культивирования КЖ осветляли центрифугированием при 8000 об/мин в течение 15-20 мин (лабораторная центрифуга Дастан, ОАО ТНК «Дастан», Россия). ЛА оценивали титриметрически с использованием оливкового масла в качестве субстрата (модифицированный метод Y. Ota и K. Yamada) (15) при pH реакционной смеси 5,5. Метод основан на учете скорости ферментолиза оливкового масла по количеству образовавшихся органических кислот, содержание которых определяют титрованием с 0,05 н. NaOH. За единицу активности липазы принимают такое количество фермента, которое при температуре 37 ° С и pH 7,0 за 1 ч гидролизует 40 % эмульсию оливкового масла, образуя 1 мкмоль олеиновой кислоты.
Идентификацию выбранного штамма-продуцента проводили с помощью секвенирования вариабельных участков генов, кодирующих 18S рРНК (16). Для установления филогенетического родства использовали метод сравнения последовательностей, кодирующих 5,8S рРНК и внутренние транскрибируемые спейсеры ITS1 и ITS2, а также нуклеотидных последовательностей домена D1/D2 26S рРНК (17, 18). Биомассу для выделения ДНК накапливали на агаризованной среде Сабуро. При выделении хромосомной ДНК применяли стандартные наборы для ПЦР (PCR Kits, «Ap-plied Biosystems, Inc.», США) согласно инструкции производителя. При проведении исследований 18S рРНК использовали следующие консервативные праймеры: NS1, NS4; ITS1, ITS4; NL1, NL4; для 5,8S-ITS участка — праймеры ITS1 (5´-TCCGTAGGTGAACCTGCG-3´), ITS4 (5´-TCC-TCCGCTTATTGATATGC-3´), для домена D1/D2 — CTB6 (5´-GCATATC-AATAAGCGGAGGAAAG-3´) и TW13 (5´-GGTCCGTGTTTCAAGACGG-3´) (16). Амплификацию фрагментов проводили по следующему протоколу: 3 мин при 95 ° С (1 цикл); денатурация 30 с при 95 ° С, отжиг праймеров 30 с при 57 ° С, элонгация 30 с при 72 ° С (35 циклов); 5 мин при 72 ° С (1 цикл) (амплификатор Mastercycler gradient, «Eppendorf», Германия). Полученные фрагменты подвергали гель-электрофорезу (5 В/см3, 30 мин; «Bio-Rad Laboratories, Inc.», США). Продукты амплификации, окрашенные бромистым этидием (10 мг/мл), визуализировали в УФ-свете. Для выполнения секвенирования ДНК фрагменты очищали с помощью набора DNA Extraction kit («Thermo Scientific», Литва). Нуклеотидную последовательность определяли на автоматическом секвенаторе ABI 373A («Applied Biosystems», США).
Для анализа результатов секвенирования и построения филогенетических деревьев использовали специализированные компьютерные программы сервера BLAST и GenBank NCBI . Критерием отнесения микроорганизма к определенному виду была гомология нуклеотидных последовательностей не менее 97 %.
УФ-мутагенез проводили в чашках Петри на солевой ПС ¹ 2 с до- бавлением трибутирина, суспензию клеток засевали поверхностным способом в стерильных условиях. Открытые чашки Петри выдерживали в течение максимум 50 мин под УФ-лампой («Mineralight», США; мощность 30 Вт, расстояние от лампы до поверхности среды 1 м). Образцы отбирали с интервалом 10 мин и инкубировали в термостате в пробирках на скошенной агаризованной среде Сабуро (ПС ¹ 3) в течение 48 ч при температуре 30 °С для получения накопительных культур.
Продуцент липазы культивировали в полупромышленных условиях (ОАО «Биохиммаш», г. Москва) в лабораторном ферментере («Bioengi-neering AG», Швейцария) общим объемом 16 л (рабочий объем 11 л) в ПС № 4 в течение 48 ч при температуре 30±2 ° С, pH 5,5 и расходе воздуха 16 дм3/мин. В качестве посевного материала использовали суспензию дрожжей, содержащую 5½106 кл/см3, количество посевного материала составило 5 %. Культуральную жидкость отделяли центрифугированием (SL 40, «Thermo Scientific», США). Для очистки супернатанта от низкомелеку-лярных примесей и концентрирования ФП применяли ультрафильтрацию (УВМТ-5-20, полимерная мембрана с отсечением 10 кДа, температура 10-15 ° С, давление на входе 0,3 МПа, на выходе 0,2 МПа), стерилизующую фильтрацию при температуре 15-17 ° С; полученный осадок лиофилизировали. Для стерилизующей фильтрации использовали фильтро-держатель из нержавеющей стали с диаметром фильтра 142 мм («Milipore», США). В качестве фильтрующего элемента применялись гидрофильные мембранные фильтры («Pall Corp.», США), изготовленные из полиэфир-сульфона с размером пор 0,22 мкм. Фильтродержатель в сборе стерилизовали в автоклаве в течение 30 мин при температуре 121 ° С. Рабочее давление при стерилизующей фильтрации концентрата ФП составило 0,1 МПа. Лиофилизацию (УСП-20, ГДР) осуществляли при толщине слоя 1 см, температура замораживания - 50 ° С, температура хладагента - 70 ° С в первые 1,5 ч с повышением температуры до - 20-30 ° С в течение последующих 1,5 ч и окончательным высушиванием в течение 3-4 ч при температуре теплоносителя 40 ° С.
Экспериментальный ФП липазы сравнивали с коммерческими российскими и зарубежными аналогами — препаратами на основе штаммов Y. lipolytica Pold, S. cerevisiae FDS101, Y. lipolytica ВКПМ Y-3600, Candida spp. L3170, Pichia pastoris DVSA-PLC-004, а также препаратами панкреатин (ПАО «Биосинтез», Россия), Креон®10000 («Abbott Products GmbH», Германия), Мезим® форте 10000 («Berlin-Chemie AG», Германия) и Novozym 435 («Sigma-Aldrich», США). Для этого готовили 1 % растворы исследуемых препаратов в дистиллированной воде и определяли ЛА модифицированным методом Y. Ota и K. Yamada (15).
Для выяснения жирнокислотной специфичности фермента и получения липидных продуктов, обогащенных полиненасыщенными жирными кислотами (ПНЖК), провели гидролиз оливкового, горчичного, подсолнечного и кокосового масел (19). При определении условий эффективного ферментолиза растительных масел изучали влияние количества вносимого ФП, соотношения масло:вода, температуры и продолжительности реакции. Свободные жирные кислоты (ЖК) отделяли методом холодной рафинации. Исследуемый гидролизат промывали водой в соотношении 1:3, затем охлаждали до температуры 7±1 °С. В гидролизат в 10-кратном объеме постепенно вводили 2,5 % водный раствор NaOH, также охлажденный до 7±1 °С. Смесь разделяли в течение 30 мин при 7±1 °С. Натриевые соли жирных кислот, полученные при разделении, промывали водой. Отделившийся нейтральный жир нейтрализовали 5 % раствором H2SO4 и отделяли оставшиеся соли. Полученные ЖК в виде метиловых эфиров анализировали методом газожидкостной хроматографии (Shimadzu GC 2010, «Shimadzu», Япония) с масс-детектором GCMS-QP 2010 и колонкой MDN-1 (l = 30 м, 0 = 0,25 ммН; наполнитель — твердосвязанный метилсиликон). Рабочие параметры: температура инжектора 200 °С, интерфейса — 210 °С, детектора — 200 °С; газ-носитель — гелий, скорость потока 1 см3/мин, деление потока 1:5. Параметры масс-детектора: режим регистрации — TIC, диапазон m/z анализатора масс — 45-500. Компоненты проб идентифицировали с использованием библиотеки масс-спектров NIST 02 . Достоверность идентификации составила более 93 %.
Результаты экспериментов представлены как средние (М) при 3-кратной повторности со стандартными ошибками средних (±SEM). При статистической обработке полученных данных определяли доверительный интервал среднего арифметического для p = 0,05, используя пакет программ Statistica 6 («StatSoft, Inc.», США) и Microsoft Excel 2010. Разность двух средних величин признавалась статистически значимой при отсут- ствии перекрывания их доверительных интервалов.
1. Липолитическая активность (ЛА) в цен-трифугате культуральной жидкости при выращивании штаммов и изолятов (питательная среде ¹ 4)
Результаты . Было установлено, что только 23 из 110 дрожжевых изолятов, выращенных на ПС ¹ 1, способны утилизировать оливковое масло в качестве единственного источника углерода. По активности отобрали 12 изолятов дрожжевых культур (табл. 1), из которых наибольшей ЛА обладала КЖ изо-лята М10, выделенного с поверхности брикета сливочного масла. Этот изолят выбрали для дальнейших исследований. По морфологическим, культуральным и физиолого-биохимическим особенностям (табл. 2) штамм М10 был отнесен к роду Candida .
2. Морфологические, культуральные и физиолого-биохимические особенности изолята Candida sp. М10
Признак Описание
Морфологические характеристики
Морфология культуры на 1-е сут Клетки округлые или овальные, 2,5-4,5 мкм в ширину и 2,5-9,0 мкм в длину
Морфология культуры на 2-е сут Почкование большинства клеток; образование псевдомицелия. Культуральные признаки
Рост на агаризованной среде Сабуро Колонии круглые, с фестончатым краем; диаметр 1-7 мм; поверхность крупно-складчатая, профиль плоский, врастающий в субстрат; колонии блестящие, непрозрачные; цвет светлый грязноватобежевый; края волнистые; структура крупнозернистая; консистенция плотно-кожистая
Рост в жидкой среде Сабуро Помутнение; осадок и кольцо на стенках пробирки; пигментации среды нет; газообразования нет; запах дрожжевой
Спорообразование Отсутствует
Физиолого-биохимические признаки
Усвоение нитратов Отрицательно
Способность к росту в безвитамин- Положительно (сильным стимулятором роста является биотин) ной среде
Разжижение желатина Положительно
Гидролиз мочевины Положительно
Отношение к концентрации NaCl Интенсивный рост при 8 %, 10 %, 12 % NaCl
Отношение к рН среды Хороший рост при рН от 3 до 9
Отношение к температуре При 20 °С слабый рост; при 25-37 °С интенсивный рост; при 50 °С слабый рост
При молекулярно-генетической видовой идентификации штамма методом секвенирования вариабельных участков ДНК гена 18S рРНК получили следующую нуклеотидную последовательность:
CATACATGTCTAAGTATAAGCAATTATACAGTGAAACTGCGAATGGCTCATAAA-TCAGTTATCGTTTATTTGATAGTACCTTACTACTTGGATAACCGTGGTAATTCT-AGAGCTAATACATGCTTAAAATCCCGACTGTTTGGAAGGGATGTATTTATAGA-TAAAAAATCAATGCCTTCGGGCTCTTTGATGATTCATAATAACTGAATCACAT-GGCCTTGTGCTGGCGATGGTTCATTCAAATTTCTGCCCTCGATGGTAGGATA-GTGGCCTACCATGGTTTCAACGGGTAACGATAAGGGTTCGATTCCGGAGAG-GGAGCCTGAGAAACGGCTACACATCCAAGGAAGGCACAGGCGCCAAATTAC-CCAATCCCGACACGGGGAGGTAGTGACAATAAATAACGATCAGGGCCCTTTC-GGGTCTTGTAATTGGAATGAGTACAATGTAAATACCTTAACGAGGAACAATT GGAGGGCAAGTCTGGTGCGCAGCCGCGGTAATTCCAGCTCCAAAACGTATA-TTAAAGTTGTTGCAGCAGTTAAAAAGCTCGTAGTTGAACCTTGGGCCTTGGC-CTGCCCGG.
Первичный скрининг нуклеотидной последовательности с помощью базы данных GenBank и сервера ВLАSТ показал, что штамм М10 принадлежит к следующим систематическим группам: Eukaryota , Fungi , Ascomy-cota , Saccharomycotina , Saccharomycetes , Saccharomycetales , mitosporic Saccha-romycetales , Candida. Анализ вариабельных участков ДНК гена 18S рРНК позволял отнести исследуемый штамм к нескольким видам рода Candida с вероятностью менее 97 %, поэтому для идентификации до вида провели сравнительный анализ участков ДНК, кодирующих 5,8S рРНК и внутренние транскрибируемые спейсеры IТS1 и IТS2, и сравнительный анализ последовательностей гена 26S рРНК, кодирующих домен D1/D2.
При секвенировании участка ДНК, кодирующего ген 5,8S рРНК и внутренние транскрибируемые спейсеры IТS1 и ITS2, получили следующую нуклеотидную последовательность:
GCGGGGTAGTCTACCTGATTTGAGGTCGAATTTGGAAGAAGTTTTGGAGTTTG-TАССААTGAGTGGAAAAAACСTATCCATTAGТTTАТАСTCCGCCТТТСТТТСАА-GCААAСССAGCGTATCGCTCAACACCAAACCCGAGGGTTTGAGGGAGAAATG-АСGCTCAAACAGGCATGCCCTTTGGAATACCAAAGGGCGCAATGTGCGTTCAA-AGATTCGATGATTCACGAATATCTGCAATTCATATTACTTATCGCATTTCGCTG-CGTTCTTCATCGATGCGAGAACCAAGAGATCCGTTGTTGAAAGTTTTGACTATT-АAATAATCGGTTGACATTААAТАAAАТТTGGТТGАGТTTАTCTCTGGCAGGC-CCCATATAGAAGGCCTACCAAAGCAAAGTTTTCAAAAAAAGAAAAACACATG-TGTAAGAAAAAATGCAGTTAAGCACTTTTCATTCTGTAATGATCCTTCCGCAG-GTTCACCAGGAAGAATATTAAGAATGAAAAGTGCTTACTGCATTTTTTCTAAC-ATGTGTTTT.
Для участка гена 26S рРНК получили последовательность:
GGATTGCCTTAGTAGCGGCGAGTGAAGCGCAAAAAGCTCAAATTTGAAATCT-GGCACTTTCAGTGTCCCGAGTTGTAATTTGAAGAAGGTATCTTTGGGTCTTGC-TCTTGTCTATGTNTCTTGGAACAGAACGTCACAGAGGGTGAGAATCCCGTGC-GATGAGATGTCCCAGACCTATGTAAAGTTCCTTCGAAGAGTCGAGTTGTTGG-GAATGCAGCTCTAAGTGGGTGGTAAATTCCATCTAAAGCTAAATATTGGCGA-GAGACCGATAGCGAACAAGTACAGTGATGGAAAGATGAAAAGAACTTTGAAA-GAGAGTGAAAAAGTACGTGAAATTGTTGAAAGGGAAGGGCTTGAGATCAGA-CTTGGTATTTTGTATGTTACTCTCTCGGGGGTGGCCTCTACAGTTTACCGG-GCCAGCATCAGTTTGAGCGGTAGGATAAGTGCAAAGAAATGTGGGACTGCT-TCGGTAGTGTGTTATAGTCTTTGTCGATACTGCCAGCTTAGACTGAGGACTG-CGGCTTCGGCCTANGA.
Таким образом, согласно уточненным данным, штамм М10 близок к виду Candida parapsilosis (степень гомологии 99 %) (20). По результатам молекулярно-генетической идентификации штамм C. parapsilosis М10 депонирован во Всероссийскую коллекцию промышленных микроорганизмов ФГБУ ГосНИИгенетика под номером ВКПМ Y-4055.
Биосинтез ферментов микроорганизмом-продуцентом в основном зависит от состава ПС, физиологического состояния микроорганизма и условий его культивирования, а также от количества вносимого в среду посевного материала (21, 22). При глубинном культивировании штамма C. pa-rapsilosis М10 мы последовательно варьировали концентрации и вид источников углерода, азота, фосфора и микроэлементов в питательной среде ¹ 5, поскольку эти факторы способны повлиять на продукцию липаз (23).
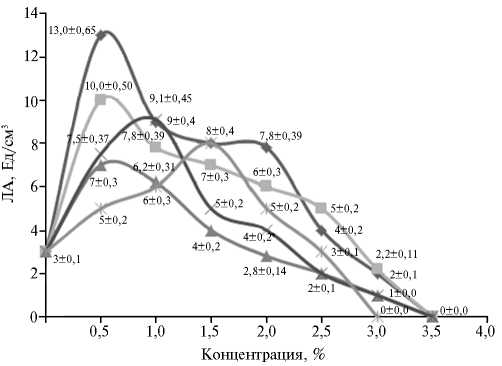
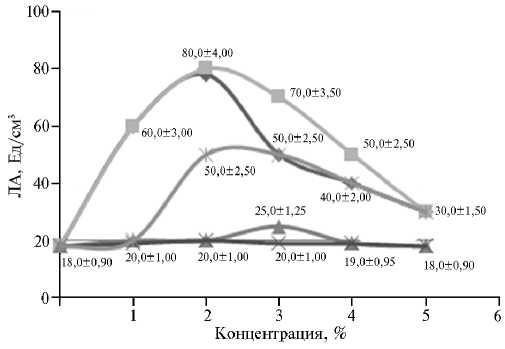
Рис. 1. Липолитическая активность (ЛА) штамма-продуцента Candida parapsilosis М10 при разных концентрациях источников углерода в питательной среде: —•— — глюкоза, —■— — сахароза, —*— — фруктоза, — — мальтоза, —f — галактоза.
В качестве источника углерода использовали разные сахара, концентрации которых изменяли при выращивании штамма М10 на ПС ¹ 5 (рис. 1). Максимальную ЛА отмечали в варианте с концентрацией глюко- зы 0,5 %, так как дрожжи из сахаров предпочитают глюкозу.
Рис. 2. Липолитическая активность (ЛА) штамма-продуцента Candida parapsilosis М10 в зависимости от вида и концентрации индуктора (масла) в питательной среде: —♦— — оливковое, -■- — горчичное, —*— — подсолнечное нерафинированное, — — подсолнечное рафинированное, —.— — льняное.
Известно, что различные растительные масла часто используют для индукции синтеза липаз и как дополнительный источник углерода. Сообщалось, что на среде с оливковым маслом, до полненной дрожжевым экстрактом, штамм Y. lipolytica DSM 3286 продуцировал липазу в количестве34,6±0,1 Ед/см3 (24).
В более ранней работе (25) установлено, что максимальная ЛА после 48 ч культивирования штамма C. rugosa (DSM 2031) составляла 4,43; 3,29; 2,86; 1,74; 1,23 и 1,03 Ед/см3 культуральной надосадочной жидкости соответственно для кунжутного, арахисового, подсолнечного, пальмового, кокосового и касторового масла. В своем исследовании мы тоже тестировали различные масла и варьировали их концентрации (рис. 2). Так, при добавлении в среду горчичного масла в концентрации 2 % ЛА штамма М10 составила 80 Ед/см3. Судя по результатам, горчичное масло содержит такие ЖК, которые индуцируют синтез липазы у C. parapsilosis М10.
P. Fickers с соавт. (26), изучая способность различных минеральных источников азота, например NH4Cl и (NH4)2SO4, и органических субстратов (казаминовые кислоты, триптон, мочевина, дрожжевой экстракт, различные пептоны) поддерживать рост и продукцию липазы у штамма
Y. lipolytica LgX64 81 показали, что обогащение среды минеральным азотом существенно не повлияло ни на рост клеток, ни на биосинтез фермента, но при добавлении некоторых источников органического азота образова- ние липазы заметно возрастало. Наибольший выход (увеличение продукции в 166 раз — до 484,7±59,1 Ед/см3) отмечали в присутствии гидролиза- та казеина с триптоном N1.
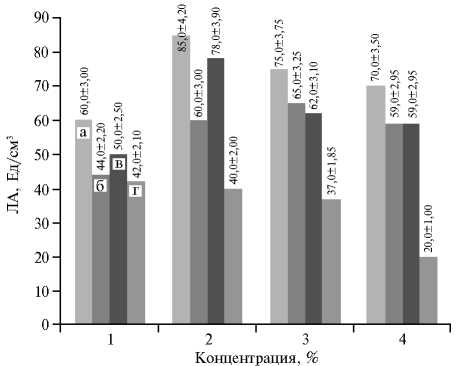
Рис. 3. Липолитическая активность (ЛА) штамма-продуцента Candida parapsilosis М10 в зависимости от вида и концентрации источника азота в питательной среде: а — дрожжевой экстракт, б — соевая мука, в — пептон, г — (NH 4 )H 2 PO 4 .
Мы использовали в качестве источника азота дрожжевой экстракт, соевую муку, пептон, NH4H2PO4 в разных концентрациях (рис. 3). Наибольшую липазную активность штамм-продуцент показал на питательной среде ¹ 5 с 2 % дрожжевого экстракта. Вероятно, причина в том,
что дрожжевой экстракт содержит незаменимые аминокислоты и витамины
группы В, необходимые для биосинтеза
ферментов.
Соевая мука, в состав которой входит до 30 % жиров, может оказать положительный эффект на биосинтез липазы (27). В
3. Липолитическая активность (ЛА) штамма-продуцента Candida parapsilosis М10 в зависимости от содержания соевой муки в питательной среде
|
Содержание, % |
ЛА, Ед/см3 |
|
0,5 |
80±4,0 |
|
1,0 |
90±4,5 |
|
1,5 |
85±4,3 |
|
2,0 |
70±3,5 |
получили на среде с добавлением 1,0 % соевой муки.
дополнительном эксперименте в ПС ¹ 5 с дрожжевым экстрактом (2,0 %) мы вносили разное количество соевой муки (табл. 3). Наибольшую активность продуцента
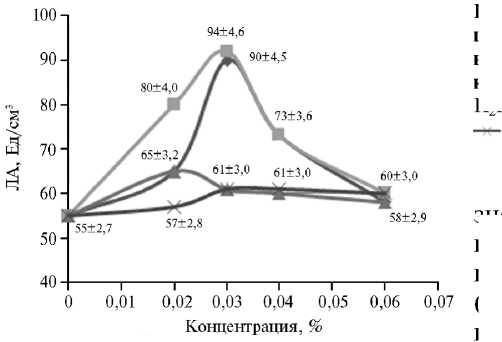
Рис. 4. Липолитическая активность (ЛА) штамма-продуцента Candida parapsilosis М10 в зависимости от концентрации источни- ков фосфора в питательной среде:
—
K 2 HPO 4, —■— — KH 2 PO 4 , —*— — (NH 4 ) 2 HPO 4 , — (NH 4 )H 2 PO 4 .
Фосфор необходим для жизнедеятельности микроорганизма и биосинтеза ферментов (28). Мы изучили влияние K2HPO4, KH2PO4, (NH 4 ) 2 HPO 4 и (NH 4 )H 2 PO 4 на ЛА центрифугата КЖ штамма C. para-psilosis М10 (рис. 4). Наилучшие показатели липазной активности отмечали на среде ¹ 5 с 0,03 % KH2PO4. По графику прослеживается и тот факт, что для биосинтеза липазы также необходимы ионы калия.
В результате оптимизации с помощью математического метода планирования эксперимента установили следующий состав ПС (¹ 6), %: горчичное масло — 2,6, дрожжевой экстракт — 1,8, соевая мука — 1, глюко- за — 0,5, Tween 80 — 0,42, СаСО3 — 0,3, КН2РО4 — 0,03, MgSO4 ■ 7H2O — 0,02, pH = 5,5±0,1. Благодаря оптимизированной ПС ЛА штамма C. para-psilosis М10 в КЖ увеличилась до 204 Ед/см3.
Концентрация фермента в микробной клетке может быть значительно повышена за счет изменения условий роста, посредством мутагенеза или генетических манипуляций (22, 23, 32). В результате УФ-мутагенеза штамма C. parapsilosis М10 был выделен мутант C. parapsilosis М10-10 с ЛА в КЖ 235 Ед/см3 (рис. 5). При этом УФ-воздействие, длившееся более 10 мин, отрицательно влияло на биосинтез фермента. Сходным образом J. Chen и соавт. (29) выделили из почвы штамм Trichosporon fermentans WU-C12, показывающий максимальную продуктивность (около 30 Ед/см3) при культивировании в течение 4 сут при 30 ° С, а затем посредством УФ-индуцированного мутагенеза и изменения состава среды получили штамм 2PU-18 с более высокой (до 70 Ед/см3) активностью фермента. Другие авторы в работе с Aspergillus niger в дополнение к УФ-обработке использовали в качестве мутагена азотную кислоту (оба метода применили дважды) и добились увеличения продукции липазы соответственно на 20,7 и 39,1 % после двойной обработки УФ и азотной кислотой по сравнению с родительским штаммом, имевшим выход 34,8 Ед/мл (30).
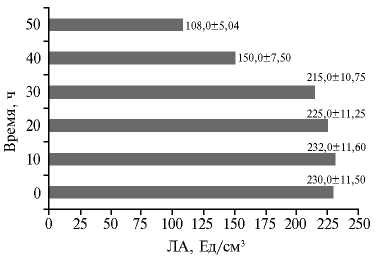
Рис. 5. Липолитическая активность (ЛА) штамма-продуцента Candida parapsilosis М10-10 в культуральной жидкости в зависимости от длительности УФ-облучения колоний.
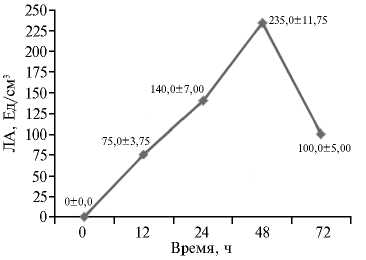
Рис. 6. Липолитическая активность (ЛА) штамма-продуцента Candida parapsilosis М10-10 в культуральной жидкости в зависимости от длительности культивирования.
4. Липолитическая активность (ЛА) Мы экспериментально уста- штамма-продуцента Candida par- новили, что при использовании по-apsilosis М10-10 в зависимости от севного материала М10-10 в коли-рН среды честве 5 % от объема питательной
|
pH среды |
ЛА, Ед/см3 |
среды липаза достигает наибольшей |
|
4,0 |
145±7,25 |
активности в КЖ к 48 ч культиви- |
|
4,5 5,0 |
170±8,50 220±11,00 |
рования (рис. 6). Культивирование |
|
5,5 6,0 6,5 |
235±11,75 230±11,50 228±11,40 |
штамма М10-10 необходимо проводить при температуре 30-40 ° С и рН |
|
7,0 7,5 |
200±10,00 150±7,50 |
питательной среды 5,5-6,5 (табл. 4). |
|
8,0 |
40±8,00 |
В результате культивирования в фер- |
|
ментере выход сухого ФП составил |
||
|
7,92 г/дм3 с |
активностью липазы |
30630 Ед/г. |
Сравнение ферментативной активности российских и зарубежных препаратов липаз и полученного ФП свидетельствует (табл. 5), что липаза М10-10 Г20½ по показателю ЛА не уступала другим ФП. Мы экспериментально установили следующие оптимальные условия ферментативного гидролиза масла с использованием ФП липазы М10-10 Г20½: количество фермента — 0,1 % (61,2 Ед/г липидов), соотношение масло:вода — 1:1, температура 37 °С, рН 5,5, длительность процесса — 4 ч.
-
5. Липолитическая активность (ЛА) препарата липазы, разработанного на основе Candida parapsilosis М10-10, и известных коммерческих препаратов
Наименование препарата
Коллекция, производитель
ЛА, Ед/г
Липаза М10-10 Г20½
Получен в настоящей работе
30630±18,5
Препарат на основе штамма Yarrowia lipolytica
Коллекция ФГБОУ ВО Московский государ-
2400±8,5
Po1d (30)
ственный университет пищевых производств
Препарат на основе штамма Saccharomyces
Коллекция ФГБОУ ВО Московский госу-
1800±6,7
cerevisiae FDS101 (31)
дарственный университет пищевых произ-
водств
Препарат на основе штамма Y. lipolytica ВКПМ
Коллекция ВКПМ ФГБУ ГосНИИгенетика,
2700±6,2
Y-3600 (32)
Россия
Lipase from Candida spp. L3170
«Sigma-Aldrich», США
5000
PLC lipase BD16449 (на основе штамма Pichia
Коллекция ФГБОУ ВО Московский госу-
205±0,7
pastoris DVSA-PLC-004) (33)
дарственный университет пищевых произ-
водств
Панкреатин
«Биосинтез», Россия
4300
Kreon® (10000 ЕД)
«Abbott Products GmbH», Германия
10000
Mezym® forte 10000
«Berlin-Chemie AG», Германия
10000
Novozym 435
«Sigma-Aldrich», США
24020±10,2
-
6. Содержание жировых компонентов и жирнокислотный состав растительных масел и модифицированных липидных продуктов, полученных в результате гидролиза липазой М10-10 Г20½
Компонент
Оливковое
Горчичное
Подсолнечное
Кокосовое
И
М
И
М
И
М
И М
ЖК
Ма 20,0±4,00
ссовая д
8,3±1,66
оля жи 14,3±2,86
ровых компонентов, %
3,1±0,62 12,0±2,40 4,1±0,82
89,1±17,82 60,8±12,16
ПНЖК
11,4±2,28
17,5±3,50
37,3±7,46
58,1±11,62 58,5±11,70 65,4±13,08
1,6±0,32
19,4±3,88
ПНЖК т -6
6,9±1,38
7,9±1,58
24,0±4,80
27,9±5,58
58,5±11,70 65,4±13,08
1,6±0,32
19,4±3,88
ПНЖК т -3
4,5±0,90
9,7±1,94
13,3±2,66
19,0±3,80
Каприновая С 10:0
Массов
ая доля
жирны
х ки сл от, %
7,3±1,46
2,3±0,46
Лауриновая С 12:0
1,3±0,26
45,3±9,06
35,2±7,04
Миристиновая С 14:0
21,2±4,24
18,3±3,66
Пальмитиновая С 16:0
15,5±3,10
6,8±1,36
9,4±1,88
1,4±0,28
7,7±1,54 1,3±0,26
12,3±2,46
10,7±2,14
Стеариновая С 18:0
4,2±0,84
1,6±0,32
3,1±0,62
1,8±0,36
4,0±0,80 2,7±0,54
3,0±0,60
2,8±0,56
Олеиновая С 18:1
61,3±12,26 64,7±12,94 34,5±6,90
38,3±7,66
26,3±5,26 27,6±5,52
9,3±1,86
19,9±3,98
Линолевая С 18:2
6,9±1,38
7,9±1,58
24,0±4,80
27,9±5,58
58,5±11,70 65,4±13,08
1,6±0,32
10,9±2,18
Линоленовая С 18:3
4,5±0,90
9,7±1,94
13,3±2,66
19,0±3,80
Определение жирнокислотной специфичности фермента показало, что максимальный выход свободных ЖК через 4 ч составил при обработке оливкового масла 30,0 %, горчичного — 30,5 %, подсолнечного — 32,2 %, кокосового — 35,6 % (от общего содержания кислот в маслах). На этом основании был сделан вывод о специфичности фермента липазы в отношении остатков насыщенных ЖК. Гидролиз с помощью липазы М10-10 Г20½ и последующая рафинация растительных масел достоверно позволили снизить относительное содержание насыщенных ЖК в 2,4; 4,6; 2,9 и 1,5 раза и увеличить относительное содержание ПНЖК в 1,5; 1,6; 1,1 и 12 раз соответственно для оливкового, горчичного, подсолнечного и кокосового масел (табл. 6). Следовательно, модификация растительных масел ферментным препаратом липазы М10-10 Г20½ в эмульсии масло:вода позволяет получить липидные продукты, которые обогащены м -3 и т -6 линолевой и линоленовой ПНЖК, ценными для здоровья человека.
Арахиновая
|
С 20:0 Гондоиновая |
0,3±0,06 |
0,6±0,12 |
0,4±0,08 |
|||||
|
С 20:1 Эруковая |
0,3±0,06 |
5,5±1,10 |
2,8±0,56 |
|||||
|
С 22:1 |
4,8±0,96 |
3,2±0,64 |
П р и м е ч а н и е. ЖК — жирные кислоты, ПНЖК — полиненасыщенные жирные кислоты; И — исходные, М — модифицированные продукты. Прочерки означают следовые количества или компонента.
В последние годы в качестве наиболее перспективных микробных продуцентов липазы с высокой активностью фермента рассматривают дрожжи рода Candida (например, штаммы C. antarctica , C. rugosa , C. tropi-calis , C. curvata , C. parapsilosis ), а также Galactomyces geotricum , Saccharomy-ces cerevisiae , Yarrowia lipolytica , Arxula adeninivorans , Trichosporon fermantans , T. asahii , Rhodotorula mucilaginosa , Aureobasidium pullulans (35, 36). Однако лишь некоторые из липаз коммерчески используются для массового производства (37). Это ферменты с высокой активностью и широкими температурным и рН оптимумами.
Активность новой липазы М10-10 Г20½ близка к таковой у препарата Novozym 435 («Sigma-Aldrich», США), полученного на основе штамма C. antarctica . Данные литературы подтверждают, что липазы, синтезируемые штаммами C. antarctica , проявляют высокую ЛА. Известна липаза CALB с активностью 117 Ед/г сухой массы (38), а также генно-инженерный штамм дрожжей Pichia pastoris , синтезирующий липазу С. antarctica CALB с активностью 220 Ед/г сухой массы (39). На основе этого же микроорганизма получают еще несколько коммерчески успешных ФП, таких как Chirazyme® L-2 («Boehringer Mannheim GmbH», Германия) и SP 525 («Novo-Nordisk A/S», Дания) (37).
В 2004 году на основе штамма Y. lipolytica W29 (АТСС 20460) были получены Y. lipolytica Pold (CLIB 139) и Y. lipolytica Polf (АТСС MYA-2613), широко используемые для метаболической инженерии (40). Также известны генно-инженерные штаммы Saccharomyces cerevisiae, продуцирующие липазы Lip7 и Lip8 Y. lipolytica с активностью 283 и 121 Ед/г сухой массы (41). В экспериментальных условиях оптимальное значение pH для гидролиза оливкового масла липазами Y. lipolytica составляет около 8,0. При температуре ниже 37 °С и pH в диапазоне от 4,5-8,0 эти ферменты остаются стабильными в течение 20 мин, а при 5 °С — в течение 22 ч. Липазы, синтезируемые C. rugosa, — одни из наиболее часто используемых в промышленности благодаря высокой ферментной активности. Исследователи из Индии выделили и охарактеризовали три различные формы липазы C. rugosa (4). Очищенные изоформы внеклеточной липазы (lipA, lipB и lipC) имели молекулярные массы 64, 62, 60 кДа и температурный оптимум в пределах 35-40 °С. Липазы Geotrichum candidum представляют промышленный интерес, поскольку проявляют высокую специфичность к молекулам длинноцепочечных цис-9-ненасыщенных жирных кислот в субстрате. G. can-didum известен как продуцент внеклеточной липазы, стабильной при рН 6,5-8,5 (42). G. Ciafardini с соавт. (43) установили, что штамм дрожжей Williopsis californica 1639, выделенный из оливкового масла первого отжима, продуцирует внеклеточную липазу, оптимум активности которой отмечают при pH 6. E. Boer с соавт. (44) клонировали ген AL1P1, кодирующий липазу дрожжей вида Arxula adeninivorans. Показано, что структурно фермент — это димер (молекулярная масса 100 кДа) с аминокислотной после- довательностью, схожей с таковой у липаз из C. albicans и C. parapsilosis. Он проявляет максимальную активность при температуре 30 °С и pH 7,5.
Коммерческие препараты липазы часто представляют собой смесь различных изоформ. Поэтому низкая воспроизводимость биокаталитиче-ских реакций при использовании коммерческих липаз, например С. rugosa (CRL), может быть связана именно с содержанием изоформ в препарате, что осложняет интерпретацию полученных результатов (45).
Проведенное нами исследование термо- и pH-стабильности ФП липазы M10-10 Г20½ показало, что препарат, в отличие от перечисленных выше, полностью сохраняет свою высокую активность в диапазоне температур 30-40 ° С и при pH в интервале 4,0-7,0, что может рассматриваться как его преимущество при промышленном производстве и применении в агропромышленном комплексе. Кроме того, возможности современной метаболической инженерии продуцентов липаз, рассмотренные в обсуждении, могут в дальнейшем быть применены и в работе с полученным нами штаммом.
Итак, выполненные исследования позволяют сделать следующие выводы. После УФ-облучения изолята, выделенного с поверхности брикета сливочного масла, получен новый дрожжевой продуцент липазы Candida parapsilosis М10-10 с липолитической активностью (ЛА) в культуральной жидкости (КЖ) 235 Ед/см3. Разработаны условия его выращивания для оптимального биосинтеза фермента. Получение ферментного препарата (ФП) включает глубинное культивирование штамма C. parapsilosis М10-10 в ферментере с последующим отделением культуральной жидкости, очистку ультрафильтрацией, стерилизующую фильтрацию и лиофилизацию. При выбранных условиях ферментации выход сухого ФП с ЛА 30630 Ед/г составил 7,92 г/дм3. ФП липазы М10-10 Г20½ имеет липолитическую активность, достаточную для обеспечения высокой степени гидролиза различных растительных масел. Препарат не уступает по активности отечественным и зарубежным аналогам — препаратам Novozym 435, Chirazyme® L-2, SP 525, липазам CALB и С. antarctica CALB. Созданный препарат может применяться для изменения или модификации сырьевого состава продуктов в агропромышленном производстве.
Список литературы УФ-индуцированный дрожжевой продуцент липазы с широкой субстратной специфичностью - селекция, свойства и получение ферментного препарата
- Ипатова Л.В., Кочеткова А.А., Нечаев А.П., Тутельян В.А. Жировые продукты для здорового питания. Современный взгляд. М., 2009.
- Raveendran S., Parameswaran B., Ummalyma S.B., Abraham A., Mathew A.K., Madhavan A., Rebello S., Pandey A. Applications of microbial enzymes in food industry. Food Technology and Biotechnology, 2018, 56(1): 16-30 ( ). DOI: 10.17113/ftb.56.01.18.5491
- Тутельян В.А., Нечаев А.П. Пищевые ингредиенты в создании современных продуктов питания. М., 2014.
- Benjamin S., Pandey A. Isolation and characterization of three distinct forms of lipases from Candida rugosa produced in solid state fermentation. Brazilian Archives of Biology and Technology, 2001, 44(2): 213-221 ( ). DOI: 10.1590/S1516-89132001000200016
- Olempska-Beer Z.S., Merker R.I., Ditto M.D., DiNovi M.J. Food-processing enzymes from recombinant microorganisms - a review. Regulatory Toxicology and Pharmacology, 2006, 45(2): 144-158 ( ). DOI: 10.1016/j.yrtph.2006.05.001
- Hasan F., Shah A.A., Hameed A. Industrial applications of microbial lipases. Enzyme and Microbial Technology, 2006, 39: 235-251 ( ).
- DOI: 10.1016/j.enzmictec.2005.10.016
- Lipase market - global forecast to 2020. Режим доступа: https://www.marketsandmarkets.com/Market-Reports/lipase-market-205981206.html. Дата обращения 15.06.2019.
- Jooyandeh H., Kaur A., Minhas K.S. Lipases in dairy industry: a review. Journal of Food Science and Technology-Mysore, 2009, 46(3): 181-189.
- Houde A., Kademi A., Leblank D. Lipases and their industrial applications. Appl. Biochem. Biotechnol., 2004, 118(1-3): 155-170 (doi: 10.1385/abab:118:1-3:155).
- Collins Y.F., McSweeney P.L., Wilkinson M.G. Evidence of a relationship between autolysis of starter bacteria and lipolysis in cheddar cheese during ripening. Journal of Dairy Research, 2003, 70(1): 105-113 ( ).
- DOI: 10.1017/s0022029902005915
- Guerrand D. Lipases industrial applications: focus on food and agroindustries. Oilseeds and fats, Crops and Lipids, 2017, 24(4): D403 ( ).
- DOI: 10.1051/ocl/2017031
- Sharma R., Chisti Y., Banerjee U.C. Production, purification, characterization, and applications of lipases. Biotechnology Advances, 2001, 19(8): 627-662 (
- DOI: 10.1016/s0734-9750(01)00086-6)
- Грачева И.М., Кривова А.Ю. Технология ферментных препаратов. М., 2000.
- Shukla P., Gupta K. Ecological screening for lipolytic molds and process optimization for lipase production Rhizopus oryzae KG-5. Journal of Applied Sciences in Environmental Sanitation, 2007, 2(2): 35-42.
- Sambrook J., Russell D.W. Molecular cloning: a laboratory manual. Cold Spring Harbor Laboratory Press, NY, 2001.
- Наумова Е.С., Серпова Е.В., Наумов Г.И. Молекулярная систематика дрожжей рода Lachancea. Биохимия, 2007, 72(12): 1659-1667.
- Esteve-Zarzoso В., Belloch C., Uruburu F., Querol A. Identification of yeasts by RFLP analysis of the 5.8S rDNA gene and two ribosomal internal transcribed spacers. International Journal of Systematic Bacteriology, 1999, 49(1): 329-337 ( ).
- DOI: 10.1099/00207713-49-1-329
- Полыгалина Г.В., Чередниченко B.C., Римарева Л.В. Определение активности ферментов. М., 2003.
- Оттавей Б.П. Обогащение пищевых продуктов и биологически активные добавки. М., 2010.
- Kuhn D.M., Mikherjee P.K., Clark T.A., Pujol C., Chandra J., Hajjeh R.A., Warnock D.W., Soil D.R., Ghannoum M.A. Candida parapsilosis characterization in an outbreak setting. Emerging Infectious Diseases, 2004, 10(6): 1074-1081 ( ).
- DOI: 10.3201/eid1006.030873
- Иванова Л.А., Войно Л.И., Иванова И.С. Пищевая биотехнология. Кн. 2. Переработка растительного сырья /Под ред. И.М. Грачевой. М., 2008.
- Treichel H., de Oliveira D., Mazutti M.A., di Luccio M., Oliveira J.V. A review on microbial lipases production. Food Bioprocess Technol., 2010, 3(2): 182-196 ( ).
- DOI: 10.1007/s11947-009-0202-2
- Maldonado R.R., Macedo G.A., Rodrigues M.I. Lipase production using microorganism from different agro-industrial by-product. International Journal of Applied Science and Technology, 2014, 4: 108-115.
- Darvishi F., Nahvi I., Zarkesh-Esfahani H., MomenbeikF. Effect of plant oils upon lipase and citric acid production in Yarrowia lipolytica yeast. Journal of Biomedicine and Biotechnology, 2009, 2009: article ID 562943 ( ).
- DOI: 10.1155/2009/562943
- Lakshmi B.S., Kangueane P., Abraham B., Pennathur G. Effect of vegetable oils in the secretion of lipase from Candida rugosa (DSM 2031). Letters in Applied Microbiology, 1999; 29: 66-70 ( ).
- DOI: 10.1046/j.1365-2672.1999.00578.x
- Fickers P., Nicaud J.M., Gaillardin C., Destain J., Thonart P. Carbon and nitrogen sources modulate lipase production in the yeast Yarrowia lipolytica. Journal of Applied Microbiology, 2004, 96(4): 742-749 ( ).
- DOI: 10.1111/j.1365-2672.2004.02190.x
- Vargas G.D.L.P., Treichel H., de Oliveira D., Beneti S.C., Freire D.M.G., Di Luccio M. Optimization of lipase production by Penicillium simplicissimum in soybean meal. J. Chem. Technol. Biotechnol., 2008, 83(1): 47-54 ( ).
- DOI: 10.1002/jctb.1776
- Dobrev G., Strinska H., Zhekova B., Dobreva V., Delchev N. Influence of the fermentation medium composition on lipase production by Rhizopus arrhizus. Bulgarian Journal of Agricultural Science, 2014, 20(Suppl.1): 42-45.
- Chen J., Shimura S., Kirimura K., Usami S. Enhancement of lipase production from hydrocarbons by mutation of Trichosporon fermentans. Appl. Microbiol. Biotechnol., 1993, 38(6): 714-718 ( ).
- DOI: 10.1007/BF00167133
- Sandana Mala J.G., Kamini N.R., Puvanakrishnan R. Strain improvement of Aspergillus niger for enhanced lipase production. The Journal of General and Applied Microbiology, 2001, 47(4): 181-186 ( ).
- DOI: 10.2323/jgam.47.181
- Pignède G., Wang H., Fudalej F., Gaillardin C., Seman M., Nicaud J.M. Characterization of an extracellular lipase encoded by LIP2 in Yarrowia lipolytica. Journal of Bacteriology, 2000, 182(10): 2802-2810 ( ).
- DOI: 10.1128/jb.182.10.2802-2810.2000
- Darvishi F. Expression of native and mutant extracellular lipases from Yarrowia lipolytica in Saccharomyces cerevisiae. Microbial Biotechnology, 2012, 5(5): 634-641 ( ).
- DOI: 10.1111/j.1751-7915.2012.00354.x
- Юзбашева Е.Ю., Юзбашев Т.В., Гордеева Т.Л., Лаптев И.А., Выборная Т.В., Синеокий С.П. Штамм дрожжей Yarrowia lipolytica - продуцент клеточно-связанной липазы. Патент РФ № RU 2475532 C1. Заявл. 09.02.2012. Опубл. 20.02.2013. Бюл. № 5.
- Dayton C.L.G., Galhardo F. Enzymatic degumming utilizing a mixture of PLA and PLC phospholipases. Patents US № US20080182322A1. Priority date 2007-01-30. Pub. Date 2008-07-31.
- Ciafardini G., Zullo B.A. Virgin olive oil yeasts: a review. Food Microbiology, 2018, 70: 245-253 ( ).
- DOI: 10.1016/j.fm.2017.10.010
- Gupta R., Kumari A., Syal P., Singh Y. Molecular and functional diversity of yeast and fungal lipases: their role in biotechnology and cellular physiology. Progress in Lipid Research, 2015, 57: 40-54 ( ).
- DOI: 10.1016/j.plipres.2014.12.001
- Faber K. Biotransformations in organic chemistry: a textbook. Springer Int. Publ., 2018 ( ).
- DOI: 10.1007/978-3-319-61590-5
- Tanino T., Aoki T., Chung W.Y., Watanabe Y., Ogino C., Fukuda H., Kondo A. Improvement of a Candida antarctica lipase B-displaying yeast whole-cell biocatalyst and its application to the polyester synthesis reaction. Appl. Microbiol. Biotechnol., 2009, 82(1): 59-66 ( ).
- DOI: 10.1007/s00253-008-1764-z
- Su G.D., Zhang X., Lin Y. Surface display of active lipase in Pichia pastoris using Sed1 as an anchor protein. Biotechnol. Lett., 2010, 32(8): 1131-1136 ( ).
- DOI: 10.1007/s10529-010-0270-4
- Madzak C., Gaillardin C., Beckerich J.M. Heterologous protein expression and secretion in the non-conventional yeast Yarrowia lipolytica: a review. Journal of Biotechnology, 2004, 109(1-2): 63-81 ( ).
- DOI: 10.1016/j.jbiotec.2003.10.027
- Liu W.S., Pan X.X., Jia B., Zhao H.Y., Xu L., Liu Y., Yan Y.J. Surface display of active lipases Lip7 and Lip8 from Yarrowial ipolytica on Saccharomyces cerevisiae. Appl. Microbiol. Biotechnol, 2010, 88: 885-891 ( ).
- DOI: 10.1007/s00253-010-2782-1
- Gopinath S.C.B., Hilda A., Lakshmi priya T., Annadurai G., Anbu P. Purification of lipase from Geotrichum candidum: conditions optimized for enzyme production using Box-Behnken design. World Journal of Microbiology and Biotechnology, 2003, 19(7): 681-689 (doi: 10.1023/A:1025119222925).
- Ciafardini G., Zullo B.A., Iride A. Lipase production by yeasts from extra virgin olive oil. Food Microbiology, 2006, 23(1): 60-67 ( ).
- DOI: 10.1016/j.fm.2005.01.009
- Böer E., Mock H.P., Bode R., Gellissen G., Kunze G. An extracellular lipase from the dimorphic yeast Arxula adeninivorans: molecular cloning of the ALIP1 gene and characterization of the purified recombinant enzyme. yeast, 2005, 22(7): 523-535 ( ).
- DOI: 10.1002/yea.1230
- Akoh C.C., Lee G.C., Shaw J.F. Protein engineering and applications of Candida rugosa lipase isoforms. Lipids, 2004, 39: 513-526 ( ).
- DOI: 10.1007/s11745-004-1258-7


