Углерод микробной биомассы альфегумусовых почв северо-запада России
Автор: Медведева М.В., Никитин Д.А., Семенов М.В., Ахметова Г.В.
Журнал: Бюллетень Почвенного института им. В.В. Докучаева @byulleten-esoil
Рубрика: Статьи
Статья в выпуске: 121, 2024 года.
Бесплатный доступ
Исследование проведено в сосняках черничных среднетаежной подзоны Карелии. Представлены результаты комплексных исследований микробоценоза подзолов иллювиально-железистых (Albic Podzols), сформировавшихся на флювиогляциальных отложениях. Для оценки углерода микробной биомассы (Смик) использовали методы люминесцентной микроскопии и субстрат-индуцированного дыхания. Для оценки микробиологической активности почв в отношении минерализации почвенного органического вещества определяли скорость базального дыхания, рассчитывали метаболический коэффициент. Показано, что изменение изучаемых показателей отражает природноклиматические условия и специфику почв альфегумусового генезиса. Наибольшие значения Смик и базального дыхания были отмечены в подгоризонтах лесной подстилки, а наименьшие - в элювиальном и иллювиальном горизонтах. Полученные результаты могут быть использованы в качестве микробиологических показателей при моделировании процессов круговорота углерода в альфегумусовых почвах лесных экосистем.
Биомасса микроорганизмов, субстрат-индуцированное дыхание, люминесцентная микроскопия, биологическая активность почв, базальное дыхание
Короткий адрес: https://sciup.org/143184037
IDR: 143184037 | УДК: 579.26:631.46, | DOI: 10.19047/0136-1694-2024-121-111-151
Текст научной статьи Углерод микробной биомассы альфегумусовых почв северо-запада России
Республика Карелия, 185910, Петрозаводск, ул. Пушкинская, 11, *, e-mail: , ****
2ФИЦ “Почвенный институт им. В.В. Докучаева”, Россия, 119017, Москва, Пыжевский пер, 7, стр. 2, **, ***
7 Bld. 2 Pyzhevskiy per., Moscow 119017, Russian Federation, **, ***
Леса покрывают около трети всей суши и являются наиболее распространенными наземными экосистемами на Земле (Perry et al., 2008). Более половины площади Северного полушария занято лесами, что делает их одним из ключевых компонентов биосферы (Goodale et al., 2002). В связи с исследованием биосферной роли лесов, их продуктивности и устойчивости в условиях глобального изменения климата возрос интерес к изучению процессов образования и поглощения парниковых газов почвой (Иванов и др., 2021; Gupta, 2022; Baldrian et al., 2023). Леса способны накапливать значительные объемы углерода в древесине и секве- стрировать его в стабильном почвенном органическом веществе (ПОВ), что становится особенно важным в эпоху усиления парникового эффекта (Perry et al., 2008; Иванов, Столбовой, 2019; Gupta, 2022). Запасы углерода во всех лесах планеты составляют около 861 Пг, из которых 44% находятся в почве, 42% – в над- и подземной биомассе, 8% – в валежной древесине и 5% – в подстилке (Lladó et al., 2017). Несмотря на то, что растения вносят основной вклад в поглощение углерода из атмосферы, микроорганизмы также влияют на углеродный баланс лесных экосистем (Lladó et al., 2017; Чернов и др., 2017; Иванов и др., 2021; Baldrian et al., 2023). Прокариоты и грибы играют важную роль в трансформации органического вещества (Кутовая и др., 2018), оказывая тем самым влияние на процессы секвестрации углерода наземными экосистемами (Baldrian et al., 2023). Кроме того, микробные сообщества почвы являются драйверами биогеохимических циклов (Чернов и др., 2017), поэтому понимание их роли в формировании углеродного баланса имеет важное значение для прогнозирования реакции лесов на изменения условий окружающей среды (Lladó et al., 2017).
Почвенное органическое вещество (ПОВ) является крупнейшим резервуаром органического углерода (С орг ), основой стабильности климата и экосистем (Семенов, Когут, 2015; Joergensen, Wichern, 2018; Jansson, Hofmockel, 2020; Иванов и др., 2021). Почва содержит в 2 раза больше углерода, чем атмосфера (Liang et al., 2020; Wang et al., 2021), и в 4–5 раз больше, чем растительность (Anthony et al., 2020). В этой связи незначительные изменения в запасах ПОВ могут оказать существенное влияние на концентрацию CO 2 в атмосфере и, соответственно, на парниковый эффект (Liang et al., 2017; Иванов и др., 2021). Однако до сих пор имеется недостаточно информации для прогнозирования, контроля и управления запасами ПОВ ввиду ограниченного понимания механизмов генезиса, трансформации и секвестрации С орг (Семенов, Когут, 2015; Liang et al., 2017).
Самой динамичной функциональной составляющей ПОВ является углерод микробной биомассы (Смик), который способен быстро реагировать на внешние воздействия (Семенов, Когут, 2015; Jansson, Hofmockel, 2020). Доля Смик в составе Сорг обычно составляет 1–5% (Семенов, Когут, 2015; Liang et al., 2019; Angst et al., 2021), однако именно активность микроорганизмов в почве является одним из важнейших факторов, определяющих темп и направленность трансформации ПОВ (Paul, 2016; Joergensen, Wichern, 2018; Никитин и др., 2022) и регулирующих потоки питательных веществ для роста и развития растений (Хитров и др., 2023; Никитин и др., 2023).
Одним из методов определения содержания С мик является люминесцентная микроскопия, основным достоинством которой является возможность прямого учета клеток прокариот и грибов в почве in situ (Звягинцев, 1991; Благодатская и др., 2016; Полянская и др., 2017, 2020). Этот метод позволяет определить не только значения С мик , но и структуру микробной биомассы (численность, размер и форму клеток, длину мицелия, соотношение мицелий : споры и грибы : бактерии), которые влияют на интенсивность минерализации ПОВ (Звягинцев, 1991; Добровольская и др., 2015; Семенов и др., 2023). Другим распространенным подходом определения С мик является метод субстрат-индуцированного дыхания (СИД). Он менее трудоемок, отличается высокой производительностью, а также менее субъективный по сравнению с люминесцентной микроскопией (Звягинцев, 1991; Гавриленко и др., 2011). Преимуществом метода СИД является также его широкое использование международным сообществом, что позволяет верифицировать данные, делает его удобным инструментом в экологических исследованиях (Курганова и др., 2021). Скорость базального дыхания (БД) отражает биологическую активность почвы и скорость минерализации ПОВ (Гавриленко и др., 2011; Курганова и др., 2021).
В условиях глобального изменения климата происходит изменение структурно-функциональной организации микробного сообщества, а также нарушение природных ритмов синтеза-распада ПОВ (Jansson, Hofmockel, 2020). Это становится триггером перераспределения углерода по трофическим цепям с уменьшением его иммобилизации в микробной биомассе (Medhi et al., 2021). Несмотря на то, что в литературе много данных о структуре микробной биомассы в почвах в различных экосистем (Никитин и др., 2022; Zhelezova et al., 2024), лесным ценозам уделяется не так много внимания (Tajik et al., 2020; Евдокимов и др., 2023; Mundra et al., 2021). В частности, несмотря на имеющиеся данные (Загу-ральская, 1993; Федорец, 1993; Федорец, 1993, 1997; Федорец, Бахмет, 2003; Медведева, Мошкина, 2004; Дубровина и др., 2021), масштабы и интенсивность процессов микробной трансформации углерода в таежных почвах Карелии до настоящего времени изучены не в полной мере. Вместе с тем использование различных методов и приемов позволяет независимо подтвердить получаемые результаты и выводы (Joergensen, Emmerling, 2006; Благодатская и др., 2016; Полянская и др., 2016; Семегов и др., 2019; Polyanskaya et al., 2020), более детально изучить особенности микробиоты почв. Почвы ненарушенных лесных экосистем могут быть эталоном качества природной среды, проведение исследований на которых наиболее ценно с точки зрения установления их нарушений в условиях глобального изменения климата.
Основная цель работы – провести оценку экологического состояния микробиоты почв ненарушенных сосняков черничных заповедника “Кивач” республики Карелия. Данная цель предусматривала решение следующих задач: установить биометрическую структуру прокариот и микроскопических грибов в исследуемых почвах; определить физиологические показатели микробиоты; провести сравнительный анализ микробиологических показателей в вертикально-ярусном распределении в почве и у разного возраста древостоев. Полученные данные могут быть использованы при мониторинговых исследованиях, являются основой при моделировании процессов круговорота углерода в альфегумусо-вых почвах лесных экосистем Восточной Фенноскандии.
ОБЪЕКТЫ И МЕТОДЫ
Общая характеристика рельефа, климата, почв и растительности. Исследование проводили на территории заповедника “Кивач”, расположенного в среднетаежной подзоне, в 45 км к северо-западу от Онежского озера на юге Карелии. Заповедник находится на высоте около 50–150 м над уровнем моря (Атлас, 2023). Исследуемый район входит в южный, наиболее теплый район Карелии. Температура самого холодного месяца составляет –10 °С, самого теплого – +16 °С. Продолжительность периодов со среднесуточной температурой воздуха выше +15 °С составляет до 40 дней. Количество осадков выпадает до 700 мм в год. Средние температуры почв в июле достигают +17.0 °С. Количество дней с температурой выше +10 °С доходит до 120. На климат большое смягчающее влияние оказывает Онежское озеро и река Суна.
В геологическом плане территория представлена нерасчле-ненными гранитоидными породами и магматитами, а также песчано-галечными флювиогляциальными отложениями, которые могут залегать на каменистых моренных суглинках. В отдельных локусах представлены ленточные глины, создающие контрастность эдафических условий, в которых формируются лесные биогеоценозы (Демидов и др., 2006). Рельеф заповедника неоднородный, отмечается сочетание водно-ледникового и денудационнотектонического; последний представлен грядово-холмистыми и грядовыми формами. Территория образована озерно-ледниковыми и озерными равнинами, нормально и кратковременно избыточно увлажненными, холмистыми, грядово-холмистыми.
Растительность заповедника представлена сосняками и ельниками, а на вырубках и залежах формируются березняки, осинники и ольшаники. В связи с неоднородностью рельефа почвенный покров также неоднороден. В автоморфных условиях распространены подзолы иллювиально-железистые, при увеличении гидроморфизма встречаются подзолы иллювиально-гумусовые, в условиях повышенного увлажнения – почвы гидроморфного ряда. Текстурно-дифференцированные почвы формируются на глинах, также встречаются пелоземы. Последние имеют слабодифференцированный профиль, который состоит из подстилочно-торфяного горизонта, залегающего непосредственно на рыхлых отложениях тяжелого гранулометрического состава.
В рамках работы научного консорциума “РИТМ углерода” для создания Российской системы климатического мониторинга на территории заповедника “Кивач” был организован тестовый полигон и заложено 30 постоянных пробных площадей в различных условиях фитоценотической среды. Была проведена детальная инвентаризация древостоев и почв: выделены наиболее представленные типы биогеоценозов (БГЦ), определены основные химические свойства почв. Результаты показали, что доминирую- щими БГЦ на исследуемой территории являются сосняки черничные, сформировавшиеся на подзолах иллювиально-железистых. Высокая представленность сосняков черничных в общем лесном фонде заповедника определила выбор участков для исследования. Таксационная характеристика древостоя приводится в таблице 1.
На исследуемых участках под черничным древостоем сформировались подзолы иллювиально-железистые песчаные (Albic Podzols), которые также широко распространены на заповедной территории. На каждой пробной площади производили отбор почв по генетическим горизонтам. Основные характеристики почв изучаемых участков представлены в таблице 2.
Методы исследования. В отобранных образцах определяли следующие основные показатели.
Кислотность почвы (рН вод ) определяли потенциометрическим методом (Hanna, Vöhringen, Germany).
Содержание углерода и азота в почве определяли на элементном анализаторе (CHNS/O-анализатор 2400 Series II (PerkinElmer, США) с использованием оборудования ЦКП “Аналитическая лаборатория” Института леса КарНЦ РАН.
Биомасса прокариот. Общая численность прокариот определена с помощью метода прямой микроскопии с использованием люминесцентного микроскопа Zeiss Axioskop 2 plus (Германия) (объектив ×100, масляная иммерсия). Пробу почвы массой 1 г помещали в колбу со 100 мл стерильной воды, которую обрабатывали ультразвуком, используя прибор “УДНЗ-1” (2 мин., 22 кГц, 0.44 А). Последующую окраску препаратов (акридин оранжевый) проводили по указанной методике (Звягинцев, 1991).
Расчет количества бактериальных клеток на 1 г субстрата производили по формуле (1):
N=S 1 ×a×n/V×S 2 ×C, (1)
где N – число клеток на 1 г субстрата; S 1 – площадь препарата (мкм2); a – количество клеток в одном поле зрения (усреднение производится по всем препаратам); n – показатель разведения бактериальной смеси (мл); V – объем капли, наносимой на стекло (мл); S 2 – площадь поля зрения микроскопа (мкм2); с – навеска субстрата (1 г).
Таблица 1. Таксационная характеристика древостоев изучаемых участков заповедника “Кивач”
Table 1. Physico-chemical properties of soils of pine stands of the Kivach Nature Reserve
|
Показатели |
П1 (ПП38*) |
П2 (ПП44*) |
П3 (ПП154*) |
П4 (ПП155*) |
П5 (ПП260*) |
|
Координаты |
34.005173 E |
34.007860 E |
34.016199 E |
34.003476 E |
34.018098 E |
|
участка |
62.296131 N |
62.295752 N |
62.288599 N |
62.288602 N |
62.281753 N |
|
Тип леса |
Сосняк |
Сосняк |
Сосняк |
Сосняк |
Сосняк |
|
черничный |
черничный |
черничный |
черничный |
брусничный |
|
|
Возраст древостоя |
190 |
190 |
190–240 |
180–280 |
180 |
|
Состав древостоя |
9.3 С 0.4Е |
10 С |
9.2 С |
9.6 С |
10 С |
|
Класс бонитета |
II |
III |
IV |
I |
III |
Примечание. * – в скобках приводится номер постоянной пробной площади (ППП) на территории тестового полигона, заложенного в рамках Важнейшего Инновационного проекта государственного значения “Единая национальная система мониторинга климатически активных веществ” (Консорциум № 4 “Углерод в экосистемах: мониторинг”, Соглашение № ВИП ГЗ/24-4 от 11 марта 2024 г.).
Note. * – the number in brackets is the number of the permanent sample area (PSA) on the territory of the test site established within the framework of the Most Important Innovative Project of State Importance “Unified National System for Monitoring of Climate Active Substances” (Consortium No. 4 “Carbon in Ecosystems: Monitoring”, Agreement No. VIP GZ/24-4, 11 March, 2024).).
Таблица 2. Физико-химические свойства почв сосновых древостоев заповедника “Кивач”
Table 2. The structure of microbial biomass of soils of the studied pine stands of the Kivach Nature Reserve
|
Горизонт почв |
Мощность горизонтов почв, см |
рН Н2О |
С, % |
N, % |
C/N |
|
П1 |
|||||
|
OL |
0–1 |
4.56 |
51.4 |
2.3 |
22.3 |
|
OFH |
1–6 |
3.85 |
40.0 |
1.7 |
23.5 |
|
Ehi |
3–5(8) |
3.95 |
2.9 |
0.4 |
7.3 |
|
BF |
5(8)–27(30) |
5.39 |
0.5 |
0.1 |
5.0 |
|
B2 |
27(30)–46 |
5.38 |
0.2 |
0.1 |
2.0 |
|
BC1 |
46–64(68) |
5.07 |
0.1 |
0.0 |
– |
|
П2 |
|||||
|
OL |
0–1 |
4.18 |
55.5 |
2.5 |
22.2 |
|
OFH |
1–5 |
4.12 |
41.0 |
1.8 |
22.7 |
|
E |
5–8 |
4.20 |
0.7 |
0.1 |
7.0 |
|
BF |
8–13(23) |
4.60 |
0.8 |
0.0 |
– |
|
B2 |
13(23)–40 |
5.25 |
0.2 |
0.1 |
2.0 |
|
B2 |
40–60 |
– |
0.1 |
0.1 |
1.0 |
|
BC |
60–75 |
5.57 |
0.2 |
0.1 |
2.0 |
|
П3 |
|||||
|
OL |
0–1 |
4.33 |
53.8 |
1.5 |
35.9 |
|
OF |
1–5 |
3.97 |
50.1 |
1.2 |
41.8 |
|
OH |
5–7 |
3.7 |
39.2 |
1.0 |
39.2 |
|
Ehi |
7–12 |
4.21 |
1.1 |
0.3 |
3.7 |
|
BF1 |
12–14(16) |
4.84 |
0.8 |
0.2 |
4.0 |
|
BF2 |
14(16)–22(24) |
5.30 |
0.4 |
0.1 |
4.0 |
|
П4 |
|||||
|
OL |
0–1 |
4.48 |
51.0 |
0.9 |
57.7 |
|
OF |
1–7 |
3.80 |
45.0 |
1.0 |
45.0 |
|
E |
7–12(14) |
4.54 |
0.4 |
0.0 |
– |
|
BF1 |
12(14)–23 |
5.27 |
0.4 |
0.1 |
4.0 |
|
BF2 |
23–37 |
5.98 |
0.2 |
0.0 |
– |
|
П5 |
|||||
|
OL |
0–3 |
4.23 |
51.4 |
1.1 |
46.7 |
|
OF |
3–10 |
3.75 |
36.9 |
1.4 |
26,4 |
|
E |
10–13 |
4.36 |
2.3 |
0.0 |
– |
|
B2 |
30–60 |
5.50 |
0.2 |
– |
– |
Длину актиномицетного мицелия в 1 г образца (NМА) определяли по формуле (2):
NМА=S 1 ×a×n/v×S 2 ×c×106, (2) где: S 1 – площадь препарата (мкм2); а – средняя длина фрагментов актиномицетного мицелия в поле зрения (мкм); n – показатель разведения суспензии (мл); v – объем капли, наносимой на стекло (мл); v – объем капли, наносимой на стекло (мл); S 2 – площадь поля зрения микроскопа (мкм2); с – навеска образца (г).
Биомасса грибов. Численность грибных пропагул и длину грибного мицелия определяли методом люминесцентной микроскопии на микроскопе Zeiss Axioskop 2 plus (Германия) при увеличении 400. Десорбцию клеток с почвы проводили при помощи вортекса “MSV-3500” (Латвия) при скорости 3 500 об./мин. в течение 10 мин. Препараты почвенной суспензии (разведение 1 : 100) окрашивали флуоресцентным красителем (калькофлуором белым), согласно методике (Звягинцев, 1991). Расчет количества грибных клеток на 1 г субстрата производили по формуле (3):
М=((4×a×n)/p)×1010, (3)
где М – количество клеток в 1 г почвы; а – среднее число клеток в поле зрения; р – площадь поля зрения (мкм2); n – показатель разведения.
Длину грибного мицелия в 1 г образца (NМА) определяли по формуле (4):
NМА=S 1 ×a×n/v×S 2 ×c×106, (4) где: S 1 – площадь препарата (мкм2); а – средняя длина фрагментов мицелия в поле зрения (мкм); n – показатель разведения суспензии (мл); v – объем капли, наносимой на стекло (мл); v – объем капли, наносимой на стекло (мл); S 2 – площадь поля зрения микроскопа (мкм2); с – навеска образца (г).
Расчет грибной биомассы (мг/г почвы) проводили, учитывая плотность спор равной 0.837 г/см3, плотность мицелия – 0.628 г/см3 (Полянская, Звягинцев, 2005).
Субстрат-индуцированное (СИД) и базальное (БД) дыхание. Перед проведением определений СИД и БД образцы почвы увлажняли до 50–55% полной влагоемкости и инкубировали в течение 7 суток при +20–22 °С. СИД почв оценивали по скорости начального максимального дыхания микроорганизмов после обогащения образца глюкозой (Гавриленко и др., 2011; Семенов и др., 2013). Навеску почв (1 г) помещали в пенициллиновый флакон (объем 10 мл), добавляли раствор глюкозы (по 10 мг сахара на каждый грамм почвы), герметично закрывали и фиксировали время. По окончании инкубации (4 ч, t +22 °С) исследовали газовую фазу (фиксируя время отбора) флакона с помощью газоанализатора LI-COR “LI-850” для определения концентрации СО2. Скорость БД соответствовала средней скорости выделения СО2 почвой за 24 ч. инкубации при температуре 22 °С и 60% полной влагоемко-сти (Гавриленко и др., 2011). Измерения скорости БД проводили аналогично тому, как определяли СИД, только вместо раствора глюкозы в почву вносили воду (0.2 мл/г почвы).
Скорость базального дыхания рассчитывается по формуле (5):
БД = .„.:. х о272 х 1Д177, (5)
Atxmacn где БД – скорость базального дыхания почвы (мкг С г-1 ч-1), СО2 почва – концентрация СО2 в газовой фазе флакона с почвой (% объемный); СО2воздух – концентрация СО2 в газовой фазе пустого флакона (% объемный); Vфл – объем воздушного пространства во флаконе с навеской почвы (мл); 60 – пересчет мин. в час; 10 – остаточное значение после сокращения при вычислении: 1000 (пересчет мл в мкл) / 100 (переход из об. % в единицы); ∆t – время от закрывания флакона до отбора газовой пробы, мин.; mасп, – масса абсолютно сухой навески почвы (г); 0.273 – содержание углерода в углекислом газе (соотношение массы С/СО2 – 12/44); 1.8177 – удельный вес СО2 при 22 °C (г л-1).
На основании результатов определения скоростей БД и СИД рассчитывали “метаболический” или “дыхательный” коэффициент согласно формуле (6):
qCO 2 =БД/СИД (6).
Статистическую обработку результатов исследований про- водили с использованием общепринятых программ. Для упорядочивания объектов (ПП) в сравнительно однородные группы использовали кластерный анализ. Для установления статистических различий между данными о микробоценозе почв, полученными на исследуемых участках, был применен анализ основных компонент (PCA), который позволил выявить тенденции изменения в основных характеристиках почвы, которые могут быть представлены широким спектром переменных. Статистический анализ полученных данных проводили с использованием статистического программного обеспечения Statistical 10.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Суммарная биомасса микроорганизмов (грибов и бактерий) варьировала от 0.021 до 2.225 мг/г почвы (рис. 1). Минимальные значения были выявлены в минеральных горизонтах почв всех пробных площадей, а максимальные – в подстилке. При этом выявлено экспоненциальное снижение биомассы микроорганизмов вниз по профилю. В отдельных профилях почв (П2, П4, П5) более высокие показатели микробной биомассы отмечены в ферментативно-гумусовом подгоризонте (OFH) подстилки по сравнению с листовым (OL). В целом микробная биомасса почвы снижалась в следующем ряду пробных площадей: П4 ˃П5 ˃ П3 ˃ П1 ˃ П2.
Основную часть (от 95.4 до 99.6%) биомассы микроорганизмов в изученных почвах составляли грибы (рис. 2). Минимальная доля грибов (95–97%) выявлена в элювиальных горизонтах, максимальная (98–100%) – в лесной подстилке. В целом доля микобиоты для большинства исследованных профилей почв снижалась от верхних к нижним горизонтам почв.
Биомасса грибов варьировала от 0.014 до 1.528 мг/г почвы (табл. 2). Максимум биомассы грибов типичен для поверхностных органогенных горизонтов (лесных подстилок). Наименьшие значения данного показателя характерны для минеральных горизонтов почв, где содержание органического углерода (С орг ) низкое. В общем биомасса микобиоты снижалась в ряду пробных площадей: П5 ˃ П3 ˃ П4 ˃ П1 ˃ П2.
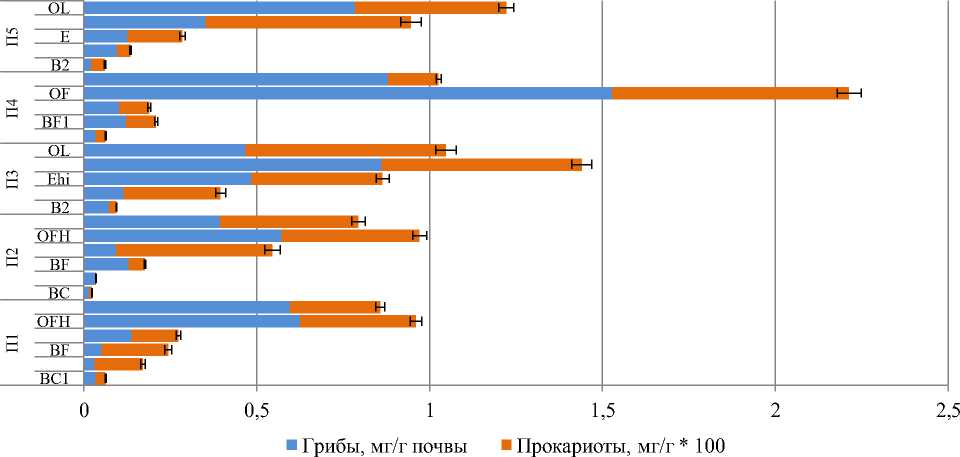
Рис. 1. Распределение биомассы микроорганизмов по профилю подзолов иллювиально-железистых заповедника “Кивач” в сосновых древостоях различного бонитета.
Fig. 1. Biomass of microorganisms in the illuvial-ferrugenous podzols of the Kivach Nature Reserve in the studied pine stands of various quality classes.
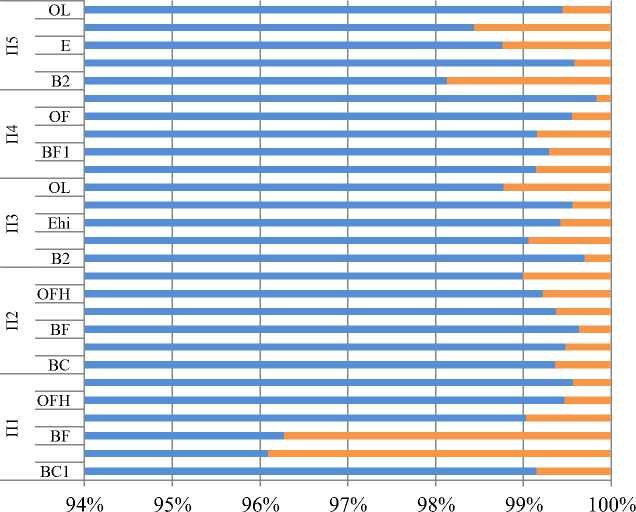
■ Грибы ■ Прокариоты
Рис. 2. Доля прокариот и грибов в микробной биомассе подзолов иллювиально-железистых заповедника “Кивач” в сосновых древостоях различного бонитета.
Fig. 2. The proportion of prokaryotes and fungi in the microbial biomass in the illuvial-ferrugenous podzols of the Kivach Nature Reserve in the studied pine stands of various quality classes.
Биомасса микобиоты состояла из мицелия (активного компонента грибной биомассы) и спор (покоящиеся клетки) (табл. 2). Доля мицелия в грибной биомассе варьировала в широком диапазоне от 12.1 до 78.2%. Максимальные значения характерны для большинства образцов подстилки и элювиальных горизонтов. Для основной части образцов доля мицелия грибов составляла от 30 до 60%.
Таблица 2. Структура микробной биомассы почв заповедника “Кивач” в сосновых древостоях различного бонитета
Table 2. The structure of microbial biomass of soils in the Kivach Nature Reserve in the studied pine stands of various quality classes
|
№ПП горизонт почв |
Биометрические параметры грибов |
||||||||
|
длина мицелия |
биомасса мицелия |
биомасса спор |
доля мицелия грибов |
доля спор грибов |
|||||
|
2 мкм |
3 мкм |
5 мкм |
7мкм |
% |
|||||
|
мкм |
мг/г почвы |
||||||||
|
П1 |
OL |
194.47 |
0.26 |
0.03 |
0.08 |
0.06 |
0.17 |
44.4 |
55.6 |
|
OFH |
196.31 |
0.26 |
0.05 |
0.09 |
0.02 |
0.19 |
42.8 |
57.1 |
|
|
Ehi |
79.04 |
0.11 |
0.02 |
0.02 |
0 |
0 |
78.3 |
21.7 |
|
|
BF |
16.54 |
0.03 |
0.02 |
0.03 |
0 |
0 |
46.0 |
54.0 |
|
|
BF2 |
10.26 |
0.013 |
0.01 |
0.01 |
0 |
0 |
42.3 |
57.6 |
|
|
BC1 |
8.09 |
0.01 |
0.005 |
0.005 |
0.01 |
0 |
32.6 |
67.3 |
|
|
П2 |
OL |
175.77 |
0.24 |
0.04 |
0.05 |
0.07 |
0.19 |
60.7 |
39.3 |
|
OFH |
330.02 |
0.42 |
0.05 |
0.09 |
0.001 |
0 |
73.2 |
26.8 |
|
|
E |
26.07 |
0.03 |
0.03 |
0.03 |
0 |
0 |
35.6 |
64.4 |
|
|
BF |
63.48 |
0.08 |
0.02 |
0.03 |
0 |
0 |
62.2 |
37.8 |
|
|
B2 |
3.17 |
0.004 |
0.01 |
0.02 |
0 |
0 |
12.1 |
87.8 |
|
|
BC |
0 |
0 |
0.003 |
0.01 |
0 |
0 |
0 |
100 |
|
Продолжение таблицы 2
Table 2 continued
|
№ПП горизонт почв |
Биометрические параметры грибов |
||||||||
|
длина мицелия |
биомасса мицелия |
биомасса спор |
доля мицелия грибов |
доля спор грибов |
|||||
|
2 мкм |
3 мкм |
5 мкм |
7мкм |
% |
|||||
|
мкм |
мг/г почвы |
||||||||
|
П3 |
OL |
130.4 |
0.18 |
0.03 |
0.08 |
0.06 |
0.12 |
39.1 |
60.8 |
|
OFH |
405.48 |
0.56 |
0.04 |
0.06 |
0.03 |
0.17 |
66.1 |
33.8 |
|
|
Ehi |
262.63 |
0.37 |
0.03 |
0.03 |
0.06 |
0 |
76.2 |
23.7 |
|
|
BF |
37 |
0.05 |
0.02 |
0.04 |
0 |
0 |
45.8 |
54.2 |
|
|
B2 |
30.04 |
0.04 |
0.02 |
0.02 |
0 |
0 |
58.3 |
41.6 |
|
|
П4 |
OL |
374.77 |
0.52 |
0.04 |
0.06 |
0.07 |
0.19 |
59.6 |
40.3 |
|
OF |
678.29 |
0.95 |
0.05 |
0.10 |
0.12 |
0.31 |
62.0 |
37.9 |
|
|
E |
35.72 |
0.06 |
0.01 |
0.03 |
0 |
0 |
59.8 |
40.1 |
|
|
BF1 |
40.56 |
0.069 |
0.02 |
0.04 |
0 |
0 |
56.6 |
43.4 |
|
|
BF2 |
9.68 |
0.016 |
0.01 |
0.01 |
0 |
0 |
47.6 |
52.4 |
|
|
П5 |
OL |
317.58 |
0.525 |
0.05 |
0.11 |
0.04 |
0.07 |
66.7 |
33.0 |
|
OFH |
139.24 |
0.23 |
0.04 |
0.08 |
0 |
0 |
65.4 |
34.5 |
|
|
E |
39.09 |
0.065 |
0.02 |
0.04 |
0 |
0 |
51.3 |
48.6 |
|
|
BF |
16.24 |
0.027 |
0.02 |
0.05 |
0.01 |
0 |
28.4 |
71.5 |
|
|
B2 |
5.67 |
0.009 |
0.01 |
0.004 |
0 |
0 |
42.9 |
57.1 |
|
Продолжение таблицы 2
Table 2 continued
|
№ПП. горизонт почв |
Биометрические параметры прокариот |
|||||
|
Актиномицеты |
Однокл прока |
точные иоты |
||||
|
длина мицелия |
масса мицелия |
доля мицелия |
масса |
доля |
||
|
мкм |
мг/г почвы |
% |
мг/г почвы |
% |
||
|
П1 |
OL |
12.37 |
0.18 |
6.7 |
2.43 |
93.2 |
|
OFH |
28.18 |
0.94 |
27.9 |
2.42 |
72.1 |
|
|
Ehi |
8.12 |
0.27 |
20.0 |
1.08 |
80.0 |
|
|
BF |
12.37 |
0.18 |
9.0 |
1.76 |
90.9 |
|
|
BF2 |
1.69 |
0.02 |
1.9 |
1.22 |
98.1 |
|
|
BC1 |
0 |
0 |
0 |
0.29 |
100 |
|
|
П2 |
OL |
103.66 |
1.46 |
36.5 |
2.54 |
63.5 |
|
OFH |
148.91 |
2.11 |
46.5 |
2.42 |
53.5 |
|
|
E |
11.84 |
0.17 |
28.4 |
0.42 |
71.6 |
|
|
BF |
15.24 |
0.22 |
45.3 |
0.26 |
54.7 |
|
|
B2 |
2.32 |
0.03 |
19.1 |
0.14 |
80.9 |
|
|
BC |
0 |
0 |
0 |
0.09 |
100 |
|
|
П3 |
OL |
81.19 |
1.14 |
19.7 |
4.66 |
80.3 |
|
OFH |
41.94 |
0.09 |
2.3 |
3.71 |
97.7 |
|
Продолжение таблицы 2
Table 2 continued
|
№ПП. горизонт почв |
Биометрические параметры прокариот |
|||||
|
Актиномицеты |
Однокл прока |
точные иоты |
||||
|
длина мицелия |
масса мицелия |
доля мицелия |
масса |
доля |
||
|
мкм |
мг/г почвы |
% |
мг/г почвы |
% |
||
|
Ehi |
16.64 |
0.55 |
19.5 |
2.27 |
80.5 |
|
|
BF |
0 |
0 |
0 |
1.08 |
100 |
|
|
B2 |
4.94 |
0.16 |
72.7 |
0.06 |
27.3 |
|
|
П4 |
OL |
78.52 |
1.11 |
75.5 |
0.36 |
24.5 |
|
OF |
448.3 |
6.31 |
92.0 |
0.55 |
8.1 |
|
|
E |
16.92 |
0.24 |
27.6 |
0.63 |
72.4 |
|
|
BF1 |
1.69 |
0.02 |
2.8 |
0.85 |
97.3 |
|
|
BF2 |
0 |
0 |
0 |
0.29 |
100 |
|
|
П5 |
OL |
119.98 |
1.69 |
38.7 |
2.68 |
61.3 |
|
OFH |
167.86 |
2.36 |
42.2 |
3.23 |
57.8 |
|
|
E |
32.69 |
0.46 |
28.9 |
1.13 |
71.1 |
|
|
BF |
17.41 |
0.25 |
46.7 |
1.31 |
53.3 |
|
|
B2 |
0 |
0 |
0 |
0.4 |
100 |
|
Длина грибных гиф изменялась в очень широком диапазоне от 3.17 до 678 м/г почвы. Минимальные значения длины мицелия микобиоты отмечены для более глубоких почвенных горизонтов, максимальные – для лесных подстилок. В целом длина гиф грибов снижалась в следующем ряду пробных площадей: П5 ˃ П3 ˃ П4 ˃ П1 ˃ П2. Интересно отметить, что в минеральном горизонте (ВС) почв, сформировавшихся на П2, мицелий грибов не выявлен. Их распределение в различных горизонтах отличалось. В лесных подстилках (OL подгоризонт) выявлено превалирование спор, размер которых достигал 7 мкм. В остальных горизонтах до 59% всех обнаруженных гиф грибов были представлены тонкими (2–3 мкм в диаметре) формами. Численность одноклеточных грибных пропа-гул (спор и дрожжей) составляла 104–105 клеток/г субстрата. Про-пагулы были представлены тремя размерными группами – 2, 3 и 5 мкм. Среди них преобладали (67–81%) мелкие формы (размер 2 и 3 мкм); 71% всех спор были округлой формы с гладкой поверхностью, 14% – округлые и шероховатые; 6% – овальные с гладкой поверхностью, 9% имели овальную форму с неровностями. Количество крупных пропагул (диметр 5 мкм) не превышало 102–103 клеток/г субстрата даже в лесных подстилках.
Численность клеток прокариот варьировала от 6.0 × 107 кле-ток/г почвы в минеральных горизонтах до 2.58 × 109 клеток/г почвы в лесных подстилках. В большинстве органогенных горизонтов почв (П2, П3 и П5) численность прокариот была максимальна в верхнем подгоризонте подстилки (OFH). Преобладающая часть исследуемых образцов (более 57% от всех) характеризовалась численностью прокариот порядка 107 клеток/г почвы. В целом численность клеток прокариот снижалась в следующем ряду пробных площадей: П4 ˃ П2 ˃ П1˃П5 ˃ П3.
Биомасса прокариот составляла соответственно от 0.09 до 9.04 мкг/г почвы. Более глубокие минеральные горизонты содержали десятые доли мкг/г почвы прокариот, а поверхностные органогенные слои – единицы мкг/г почвы. Наибольшие показатели отмечены для подстилок, наименьшие показатели – для элювиальных горизонтов. Биомасса прокариот была представлена одноклеточными формами и мицелием актиномицетов. Их доля варьировала от 8.0 до 98.1% и от 1.9 до 92% соответственно. Для боль- шинства почв доля мицелия актиномицетов не превышала 20– 50%. Основная часть мицелия актиномицетов сосредоточена в подстилках, где она составляла 70–98%. В наиболее глубоких минеральных горизонтах биомасса прокариот была представлена одноклеточными формами, составляющими 90–100%.
Длина мицелия актиномицетов составляла от 1.69 м/г почвы в элювиальных и иллювиальных горизонтах до 448 м/г почвы в подстилках. Для большинства исследуемых образцов длина гиф актиномицетов составляла не более 10–80 м/г почвы. В целом их длина снижалась в следующем ряду пробных площадей: П5 ˃ П3 = П2 ˃ П4 ˃ П1. Необходимо подчеркнуть, что мицелий актино-мицетов не выявлен в наиболее глубоких минеральных горизонтах почв всех пробных площадей.
Базальное дыхание (БД) почв изменялось от 0.1 до 39.6 мкг CO 2 -С/г/час (рис. 3). Минимальные значения (десятые доли мкг CO 2 -С/г/час) выявлены в минеральных горизонтах почв всех исследуемых пробных площадей, а максимальные (единицы и десятки мкг CO 2 -С/г/час) – в подстилке. Таким образом, установлено экспоненциальное снижение значений скорости БД от поверхностных горизонтов к глубинным. В целом скорость БД снижалась в следующем ряду пробных площадей: П4 ˃ П2 ˃ П1 ˃П5 ˃ П3.
Микробная биомасса, определенная методом субстрат-индуцированного дыхания (СИД), изменялась от 138 до 11 342 мкг С/г почвы (рис. 3). Наименьшая биомасса (сотни мкг С/г почвы) обнаружена в минеральных горизонтах почв всех пробных площадей, а наибольшая – в подстилке. Таким образом выявлено экспоненциальное снижение углерода микробной биомассы от поверхностных горизонтов почв к глубинным. В общем значения СИД снижались в ряду пробных площадей: П4 ˃ П1 ˃ П2 ˃ П3 ˃ П5.
Метаболический коэффициент (qCO2). Значения метаболического коэффициента (qCO 2 ) изменялись от 0.62 до 4.41 (рис. 3). Минимальные значения (десятые доли) выявлены в элювиальных и иллювиальных горизонтах, а максимальные – в подстилке.
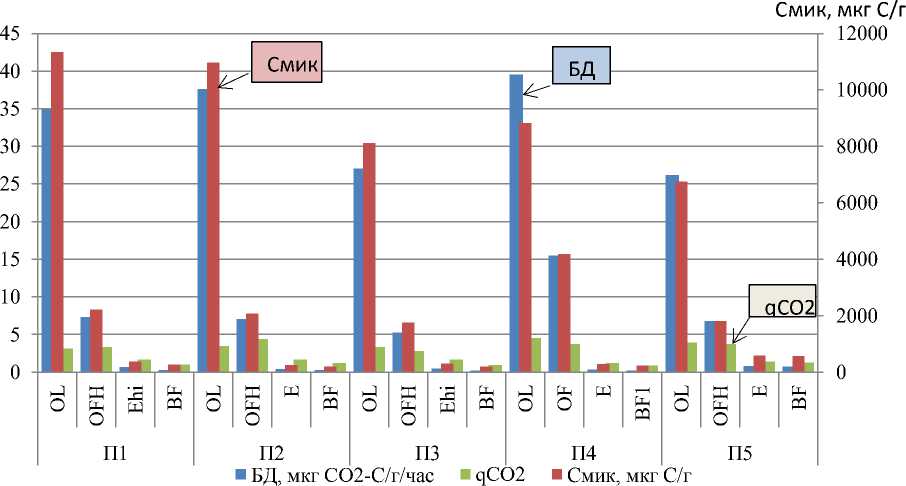
Рис. 3. Экофизиологические параметры состояния микробного сообщества подзолов иллювиально-железистых заповедника “Кивач” в сосновых древостоях различного бонитета.
Fig. 3. Ecophysiological parameters of the state of the microbial community in the illuvial-ferrugenous podzols of the Kivach Nature Reserve in the studied pine stands of various quality classes.
Полученные значения содержания микробной биомассы по методу люминесцентной микроскопии сопоставимы с результатами для дерново-подзолистых почв, сформировавшихся под лесной растительностью Подмосковья (Ананьева и др., 2010; Семенов и др., 2010). Однако полученные данные в 2 раза выше по сравнению с таковыми для почв полуострова Рыбачий, расположенного в Мурманской области (Korneykova et al., 2023). Основная часть микробной биомассы (от 95.4 до 99.6%) всех исследованных объектов заповедника “Кивач” представлена грибами. Это характерно для большинства зональных почв (Li, Dick, 2004; Никитин и др., 2023), которые характеризуются низкими значениями рН, невысокой емкостью катионного обмена и низким содержанием элементов питания. Процессы почвообразования происходят под влиянием опада растений, кислотообразуемые продукты минерализации которого оказывают разрушающее действие на минеральную толщу почв, определяя направленность подзолообразования. При этом биопленки, которые формируются на поверхности почвенных частиц, являются средой обитания микроорганизмов. Микробная биомасса, определяемая по методу люминесцентной микроскопии, позволила установить количественные показатели биологического матрикса, адсорбцию клеток на поверхности почвенных частиц. Было установлено, что биомасса в пересчете на органический углерод составляла от 11 до 750 мкгС/г почвы.
Ввиду того, что большая часть микробной биомассы в исследуемых объектах представлена грибами, основные закономерности ее вертикального и горизонтального распределения справедливы для биомассы микобиоты. В исследованных объектах заповедника “Кивач” биомасса грибов была в 1.5–2 раза больше, по сравнению с почвами полуострова Рыбачий (Korneykova et al., 2023), и в 3 раза выше, чем в зоне воздействия выбросов горнометаллургического комбината Печенганикель (Корнейкова, Никитин, 2023), а также почв города Апатиты Мурманской области (Korneykova et al., 2022). Преобладание в микробной биомассе грибов и высокие значения отношения грибы : прокариоты характерны для почв с большим секвестрирующим потенциалом и низким отношением C:N, а уменьшение этого отношения свидетельствует о малой секвестрации углерода (Семенов и др., 2023; Ники- тин и др., 2023).
Обычно микобиота в почве преимущественно состоит из мицелия (Polyanskaya et al., 2020). Однако образцы минеральных горизонтов исследуемых почв не содержали гиф, что может указывать на стрессовые условия в данных локусах (Wang et al., 2017; Joshi et al., 2021). Основная часть (до 72%) грибного мицелия была представлена тонкими формами до 3 мкм в диаметре, что характерно для субарктических регионов и, вероятно, является адаптацией к экстремальным условиям. В ходе исследования было выявлено мало гиф с базидиомицетными пряжками, что косвенно свидетельствует о низкой доле микоризных симбиозов и представителей отдела Basidiomycota (Wang et al., 2017) в почвах данного генезиса.
Эколого-эдафические условия, которые формируются в различных горизонтах почв, оказывают разное влияние на активность микроорганизмов. В минеральных горизонтах BF2 (П1) и BС (П2) среди одноклеточных пропагул были обнаружены округлые и продолговатые клетки. Судя по их специфической морфологии и почкованию, клетки являются дрожжами – одной из типичных жизненных форм грибов в полярных регионах (Buzzini et al., 2018). Как известно, неспецифичная морфология часто не позволяет достоверно отличить клетки дрожжей от покоящихся пропа-гул (спор, конидий и др.) (Никитин и др., 2017), однако методом посева было установлено присутствие дрожжей в микоценозе альфе-гумусовых почв.
Численность одноклеточных прокариот в проанализированных почвах заповедника “Кивач” на порядок была выше, по сравнению со значениями для почв полуострова Рыбачий (Korneykova et al., 2023), почв зоны воздействия выбросов горнометаллургического комбината Печенганикель (Корнейкова, Никитин, 2023) и почв города Апатиты Мурманской области (Korneykova et al., 2022). Этого следовало ожидать, так как в данных биогеоценозах процессы трансформации органического вещества идут более глубоко, роль прокариотического звена трофической цепи возрастает.
В исследованных почвах выявили присутствие актиномице-тов, которые редко обнаруживаются при посеве на элективные питательные среды. Как известно, мицелиальные прокариоты способны утилизировать трудногидролизуемые соединения. В этой связи их выявление в составе микробиценоза дает ценную информацию о важнейших этапах преобразования вещества, например, дублированности процессов, происходящих в почве.
Базальное дыхание (БД) в проанализированных образцах почв по порядку значений было сходным с таковым для аналогичных почв заповедника “Кивач” (Мамай, Мошкина, 2016), однако в 10 раз меньше для подстилочно-торфяных горизонтов почв Центральной Сибири (Grodnitskaya et al., 2013). Биомасса микроорганизмов, определенная методом СИД, для исследованных объектов соответствует по порядку значений таковой для аналогичных почв заповедника “Кивач” (Мамай, Мошкина, 2016), однако в 5 раз больше, по сравнению со значениями для почв лесных экосистем заповедника “Пасвик” в Кольской субарктике (Кадулин и др., 2017). Это еще раз подтверждает, с одной стороны, общий план строения микробоценоза почв, а с другой, указывает на специфику микробного сообщества различных генетических горизонтов почв, сформировавшихся в условиях бореального пояса.
Влияние экологических условий на микробоценоз можно проследить на основе анализа активности почвенной микробной биомассы. В изучаемых почвах значения БД и СИД микробиоты почв резко уменьшаются с увеличением глубины по почвенному профилю. Как известно, лимитирующим фактором развития микроорганизмов в почве является содержание элементов питания, температура, влажность и кислород. Возможно, что влияние на данные показатели оказывают снижение концентрации кислорода (Rusakov et al., 2019) и Сорг (Santruckova et al., 2018). Максимальные значения БД и СИД выявлены в верхнем органогенном горизонте почв, что может быть обусловлено высоким содержанием в них Сорг и повышенной температурой поверхностных горизонтов. Данные факторы могут существенно увеличивать микробиологическую активность и микробную биомассу в холодных субарктических экосистемах (Кадулин и др., 2017). Ввиду того, что распределение биомассы грибов по методу люминесцентной микроскопии хорошо коррелирует с пиками эмиссии СО2, предполагаем, что основной вклад в БД и СИД вносят именно грибы (Ananyeva et al., 2018).
Важное значение для установления вклада гетеротрофов в круговорот углерода в почве имеет “метаболический” коэффициент (qCO 2) . Он хорошо отражает эффективность преобразования гетеротрофными микроорганизмами С орг в микробную биомассу (Ананьева и др., 2010), поэтому может быть использован в качестве индикатора изменений качества почвы (Никитин и др., 2022). Результаты еще раз подтвердили, что в лесных почвах имеет место выраженное гетеротрофное преобразование растительных субстратов, поступающих на почву. Величина qCO 2 и скорость минерализации С орг в почве имеют решающее значение для характеристики углеродного цикла в наземных экосистемах (Гавриленко и др., 2011; Ананьева и др., 2010).
Для выделения в многомерном пространстве изучаемых признаков в отдельные группы использовали кластерный анализ, на основании которого построена дендрограмма взаимодействия признаков (рис. 4). Полученные данные показали, что пробные площади можно условно разделить на два основных кластера. В первый кластер выделена площадка П4 – высокобонитетный сосняк черничный. Во второй кластер определены площадки П1, П2, П3, П5, бонитет которых ниже. При этом второй кластер разделяется на два подкластера с группами П3 и П5, а также П1 и П2. Следует отметить, что эдафические условия и микробиологические показатели исследуемых участков практически не реагировали на продуктивность древостоя, изменение возрастной структуры, а также переход в климаксную фазу развития. Изменения были отмечены только при сравнении микробиологических характеристик почв в вертикально-ярусном континууме и различных горизонтов почв сосновых древостоев различной продуктивности.
Для комплексного и системного изучения и измерения воздействия факторов на величину результативного показателя, получения количественной и качественной оценки взаимодействия эдафо-фитоценотических показателей использовали метод многомерной статистики (рис. 5).
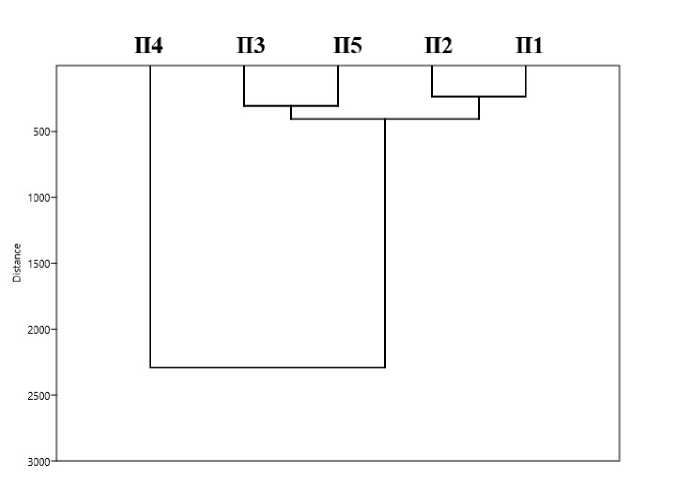
Рис. 4. Дендрограмма взаимодействий физико-химических и микробиологических свойств почв, сформировавшихся в различных условиях фитоценотической среды.
Fig. 4. A dendrogram of interactions of physico-chemical and microbiological properties of soils formed under various conditions of the phytocenotic environment.
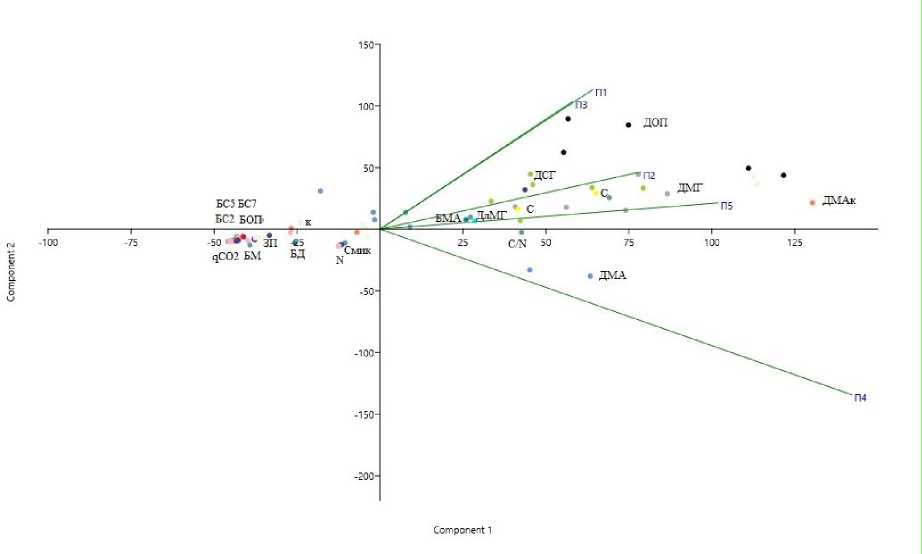
Рис. 5. Результаты многомерного анализа данных (PCA) исследуемых показателей почв сосняков черничных.
Fig. 5. Results of multivariate data analysis of the investigated soil indicators of blueberry pine forests.
На рисунке 5: ДлМГ – длина мицелия грибов, БМ – биомасса грибов, БС2 – биомасса спор грибов <2 мкм, БС3 – биомасса спор грибов <3 мкм, БС5 – биомасса спор грибов <5 мкм, БС7 – биомасса спор грибов <7 мкм, ДМГ – длина мицелия грибов, ДСГ – доля спор грибов, ДМА – длина мицелия актиномицетов, БМА – биомасса мицелия актиномицетов, БОП – биомасса одноклеточных прокариот, ДОП – доля одноклеточных прокариот, ДМА – доля мицелия актиномицетов, БД – базальное дыхание.
Используемые в работе химические и микробиологические показатели позволили воссоздать в факторном координатном пространстве облик изучаемого объекта и указать его характерные признаки и отличительные особенности. Выделены биометрические показатели (длина мицелия грибов и актиномицетов, доля грибов и актиномицетов, доля сопор грибов, биомасса актино-мицетов), расположенные справа от оси ОY. Остальные характеристики, которые позволяют более “глубоко” проанализировать микробоценоз, расположены слева от оси ОY. Именно их можно рекомендовать использовать при оценке микробного сообщества почв ненарушенных лесных экосистем. Также анализ основных компонентов о данных свойствах почв позволил идентифицировать благодаря близости точек в проекции PCA две области, которые имеют разные таксационные характеристики древостоя. На основании кластерного анализа это, как отмечено выше, ПП4 и ПП1, 2, 3, 5.
Таким образом, полученные данные еще раз продемонстрировали, с одной стороны, важность различных компонентов микробиоты в подзолообразовательном процессе, а, с другой, ее роль в установлении направленности трансформации органического вещества, элементом трофической цепи которой она является.
ЗАКЛЮЧЕНИЕ
Подзолы иллювиально-железистые, сформировавшиеся под сосняками черничными и имеющие альфегумусовый генезис, характеризуются высокой дифференциацией микробиологического профиля почв, в котором горизонты имеют отличающиеся биометрические и экофизиологические показатели микробного углерода и базального дыхания. В результате недостаточного поступ- ления солнечной энергии в экосистему почвообразованием охвачена небольшая мощность почвенной толщи, а численность и активность микроорганизмов оказывается невысокой. В почвах лесных экосистем преобладают грибы, которые в агрессивных (кислых) эдафических для прокариот условиях являются главными эдификаторами микробиоценоза. Для исследованных объектов выявлено активное развитие мицелия актиномицетов, которые осуществляют глубокую трансформацию почвенного органического вещества. Высокие экофизиологические показатели микробиоты в подстилке обусловлены обильным и постоянным поступлением свежего опада. Полученные данные об углероде микробной биомассы и базальном дыхании могут быть использованы в качестве микробиологических показателей при моделировании процессов круговорота углерода в альфегумусовых почвах лесных экосистем.
Список литературы Углерод микробной биомассы альфегумусовых почв северо-запада России
- Атлас Республики. Петрозаводск: Версо, 2023. 48 с.
- Благодатская Е.В., Семенов М.В., Якушев А.В. Активность и биомасса почвенных микроорганизмов в изменяющихся условиях окружающей среды. М.: Товарищество научных изданий КМК, 2016. 243 с.
- Воробьева Л.А. Химический анализ почв. М.: Изд-во Моск. ун-та, 1998. 271 c.
- Гавриленко Е.Г., Сусьян Е.А., Ананьева Н.Д., Макаров О.А. Пространственное варьирование содержания углерода микробной биомассы и микробного дыхания почв южного Подмосковья // Почвоведение. 2011. № 10. С. 1231-1245.
- Демидов И.Н., Лукашов А.Д., Ильин В.А. Рельеф заповедника “Кивач” и история геологического развития северо-западного Прионежья в четвертичном периоде // Тр. КарНЦ РАН. 2006. № 10. С. 22-23.
- Евдокимов И.В., Семенов М.В., Быховец С.С. Ризосферный эффект и структура бактериального сообщества в горизонтах подзолистой почвы под растениями ели обыкновенной (Picea abies L.) // Почвоведение. 2023. № 1. С. 35-45. https://doi.org/10.31857/S0032180X22700010.
- Звягинцев Д.Г. Методы почвенной микробиологии и биохимии. М.: Изд-во Моск. ун-та, 1991. 60 с.
- Иванов А.Л., Столбовой В.С. Инициатива “4 промилле” - новый глобальный вызов для почв России // Бюллетень Почвенного института имени В.В. Докучаева. 2019. Вып. 98. С. 185-202. https://doi.org/10.19047/0136-1694-2019-98-185-202.
- Иванов А.Л., Савин И.Ю., Столбовой В.С., Духанин Ю.А., Козлов Д.Н. Методологические подходы формирования единой Национальной системы мониторинга и учета баланса углерода и выбросов парниковых газов на землях сельскохозяйственного фонда Российской Федерации // Бюллетень Почвенного института им. В.В. Докучаева. 2021. № 108. С. 175-218. https://doi.org/10.19047/0136-1694-2021-108-175-218.
- Иванов А.Л., Савин И.Ю., Столбовой В.С., Духанин Ю.А., Козлов Д.Н., Баматов И.М. Глобальный климат и почвенный покровпоследствия для землепользования России. Бюллетень Почвенного института им. В.В. Докучаева. 2021. № 107. 5-32. https://doi.org/10.19047/0136-1694-2021-107-5-32.
- Кадулин М.С., Смирнова И.Е., Копцик Г.Н. Эмиссия диоксида углерода почвами лесных экосистем заповедника “Пасвик” в Кольской Субарктике // Почвоведение. 2017. № 9. С. 1098-1112.
- Корнейкова М.В. Почвенный микробиом в зоне воздействия выбросов горно-металлургического комбината Печенганикель (Мурманская область) // Почвоведение. 2023. № 5. С. 676-688. https://doi.org/10.31857/S0032180X22600883.
- Курганова И.Н., Телеснина В.М., Личко В.И., Караванова Е.И. Динамика пулов углерода и биологической активности агродерновоподзолов южной тайги в ходе постагрогенной эволюции // Почвоведение. 2021. № 3. С. 287-303.
- Кутовая О.В., Гребенников А.М., Тхакахова А.К., Исаев В.А., Гармашов В.М., Беспалов В.А., Чевердин Ю.И., Белобров В.П. Изменение почвенно-биологических процессов и структуры микробного сообщества агрочерноземов при разных способах обработки почвы // Бюллетень Почвенного института им. В.В. Докучаева. 2018. Вып. 92. С. 35-61. https://doi.org/10.19047/0136-1694-2018-92-35-61.
- Лебедева Т.Н., Соколов Д.А., Семенов М.В., Зинякова Н.Б., Удальцов С.Н., Семенов В.М. Распределение органического углерода между структурными и процессными пулами в серой лесной почве разного землепользования. Бюллетень Почвенного института имени ВВ Докучаева. 2024. Вып. 118. С. 79-127. https://doi.org/10.19047/0136-1694-2024-118-79-127.
- Мамай А.В., Мошкина Е.В. Влияние урбанизации на показатели биологической активности микробного сообщества автоморфных лесных почв Карелии // Международный журнал прикладных и фундаментальных исследований. 2016. №. 11-6. С. 1094-1099.
- Медведева М.В., Бахмет, О.Н., Ананьев В.А., Мошников С.А., Мамай А.В., Мошкина Е.В., Тимофеева В.В. Изменение биологической активности почв в хвойных насаждениях после пожара в средней тайге Карелии // Лесоведение. 2020. № 6. С. 560-574.
- Медведева М.В., Мошкина Е.В., Геникова Н.В., Карпечко А.Ю., Туюнен А.В., Мамай А.В., Кулакова Л.М. Биологическая активность почвы в условиях изменения режима землепользования в нечерноземной зоне России // Плодородие. 2022. № 3(126). С. 71-76.
- Никитин Д.А., Чернов Т.И., Железова А.Д., Тхакахова А.К., Никитина С.А., Семенов М.В., Кутовая О.В. Сезонная динамика биомассы микроорганизмов в дерново-подзолистой почве // Почвоведение. 2019. № 11. С. 1356-1364.
- Никитин Д.А., Садыкова В.С., Куварина А.Е., Дах А.Г., Бирюков М.В. Ферментативная и антимикробная активность полярных штаммов почвенных микроскопических грибов // Микология и фитопатология. 2021. С. 16.
- Никитин Д.А., Семенов М.В., Чернов Т.И. Микробиологические индикаторы экологических функций почв (обзор) // Почвоведение. 2022. № 2. С. 228-243. https://doi.org/10.31857/S0032180X22020095.
- Никитин Д.А., Семенов М.В., Ксенофонтова Н.А., Тхакахова А.К., Русакова И.В., Лукин С.М. Влияние внесения соломы на состояние микробиома дерново-подзолистой почвы // Почвоведение. 2023. № 5. С. 640-653. https://doi.org/10.31857/S0032180X22601189.
- Полянская Л.М., Приходько В.Е., Ломакин Д.Г., Чернов И.Ю. Численность и биомасса микроорганизмов в древних погребенных и современных черноземах разного землепользования // Почвоведение. 2016. № 10. С. 1191-1204.
- Семенов В.М., Когут Б.М. Почвенное органическое вещество. М.: Геос, 2015. 233 с.
- Семенов М.В., Стольникова Е.В., Ананьева Н.Д., Иващенко К.В. Структура микробного сообщества почвы катены правобережья р. Оки // Известия РАН. Серия биологическая. 2013. №3. С. 299-308. https://doi.org/10.7868/S0002332913030089.
- Семенов М.В., Манучарова Н.А., Краснов Г.С., Никитин Д.А., Степанов А.Л. Биомасса и таксономическая структура микробных сообществ в почвах правобережья р. Оки // Почвоведение. 2019. № 8. С. 974-985.
- Семенов М.В., Никитин Д.А., Степанов А.Л., Семенов В.М. Структура бактериальных и грибных сообществ ризосферного и внекорневого локусов серой лесной почвы // Почвоведение. 2019. № 3. С. 355-369. https://doi.org/10.1134/S0032180X19010131.
- Семенов М.В., Ксенофонтова Н.А., Никитин Д.А., Степанов А.Л., Семенов В.М. Микробиологические показатели дерново-подзолистой почвы и ее ризосферы в полувековом полевом опыте с применением разных систем удобрения // Почвоведение. 2023. № 6. С. 715-729. https://doi.org/10.31857/S0032180X22601220.
- Семенов М.В., Кравченко И.К., Семенов В.М., Кузнецова Т.В., Дулов Л.Е., Удальцов С.Н., Степанов А.Л. Потоки диоксида углерода, метана и закиси азота в почвах катены правобережья р. Ока (Московская область) // Почвоведение. 2010. № 5. С. 582-590.
- Семенов В.М., Лебедева Т.Н., Соколов Д.А., Зинякова Н.Б., Лопес де Гереню В.О., Семенов М.В. Измерение почвенных пулов органического углерода, выделенных био-физико-химическими способами фракционирования // Почвоведение. 2023. № 9. С. 1155-1172. https://doi.org/10.31857/S0032180X23600427.
- Хитров Н.Б., Никитин Д.А., Иванова Е.А., Семенов М.В. Пространственно-временная изменчивость содержания и запасов органического вещества почвы: аналитический обзор // Почвоведение. 2023. № 12. С. 1493-1521. https://doi.org/10.31857/S0032180X23600841.
- Чернов Т.И., Холодов В.А., Когут Б.М., Иванов А.Л. Методология микробиологических исследований почвы в рамках проекта “Микробиом России” // Бюллетень Почвенного института им. В.В. Докучаева. 2017. Вып. 87. С. 100-113. https://doi.org/10.19047/0136-1694-2017-87-100-113.
- Чернов Т.И., Тхакахова А.К., Лебедева М.П., Железова А.Д., Бгажба Н.А., Кутовая О.В. Микробиомы контрастных по засолению почв солонцового комплекса волго-уральского междуречья // Почвоведение. 2018. № 9. С. 1115-1124.
- Ananyeva N.D., Castaldi S., Stolnikova E.V., Kudeyarov V.N., Valentini R. Fungi-to-bacteria ratio in soils of European Russia // Arch. Agronomy Soil Sci. 2015. Vol. 61(4). P. 427-446. https://doi.org/10.1080/03650340.2014.940916.
- Angst G., Mueller K.E., Nierop K.G., Simpson M.J. Plant-or microbialderived? A review on the molecular composition of stabilized soil organic matter // Soil Biology and Biochemistry. 2021. Vol. 156. 108189.
- Anthony M.A., Crowthe T.W., Maynard D.S., van den Hoogen J., Averill C. Distinct assembly processes and microbial communities constrain soil organic carbon formation // One Earth. 2020. Vol. 2. P. 349-360.
- Buzzini P., Turchetti B., Yurkov A. Extremophilic yeasts: the toughest yeasts around? // Yeast. 2018. Vol. 35(8). P. 487-497. https://doi.org/10.1002/yea.3314.
- Čapek P., Diáková K., Dickopp J. E., Bárta J., Wild B., Schnecker J., Šantrůčková H. The effect of warming on the vulnerability of sub ducted organic carbon in arctic soils // Soil Biology and Biochemistry. 2015. Vol. 90. P. 19-29.
- Cui J., Zhu Z., Xu X., Liu S., Jones D.L., Kuzyakov Y., Shibistova O., Wu J., Ge T. Carbon and nitrogen recycling from microbial necromass to cope with C: N stoichiometric imbalance by priming // Soil Biol. Biochem. 2020. Vol. 142. P. 107-320. https://doi.org/10.1016/j.soilbio.2020.107720.
- Grodnitskaya I.D., Karpenko L.V., Knorre A.A., Syrtsov S.N. Microbial activity of peat soils of boggy larch forests and bogs in the permafrost zone of central Evenkia // Eurasian Soil Sci. 2013. Vol. 46(1). P. 61-73. https://doi.org/10.1134/S1064229313010043.
- Guo Z., Wang Y., Wan Z., Zuo Y., He L., Li D., Xu X. Soil dissolved organic carbon in terrestrial ecosystems: Global budget, spatial distribution and controls // Global ecology and biogeography. 2020. Vol. 29(12). P. 2159- 2175.
- Jansso J.K., Hofmocke K.S. Soil microbiomes and climate change // Nature Reviews Microbiology. 2020. Vol. 18(1). P. 35-46.
- Joergensen R.G., Emmerling C. Methods for evaluating human impact on soil microorganisms based on their activity, biomass, and diversity in agricultural soils // Journal of plant nutrition and soil science. 2006. Vol. 169. No. 3. P. 295-309.
- Joergensen R.G., Wichern F. Alive and kicking: why dormant soil microorganisms matter // Soil Biology and Biochemistry. 2018. Vol. 116. P. 419-430.
- Joshi S., Bajpai A., Johri B.N. Extremophilic fungi at the interface of climate change // Fungi Bio-Prospects in Sustainable Agriculture, Environment and Nano-technology. London: Academic Press. 2020. P. 1-22. https://doi.org/10.1016/B978-0-12-821925-6.00001-0.
- Korneykova M.V., Vasenev V.I., Nikitin D.A., Dolgikh A.V., Soshina A.S., Myazin V.A., Nakhaev M.R. Soil microbial community of urban green infrastructures in a polar city // Urban Ecosystems. 2022. Vol. 25(5). P. 1399- 1415.
- Korneykova M.V., Myazin V.A., Fokina N.V., Chaporgina A.A., Nikitin D.A., Dolgikh A.V. Structure of microbial communities and biological activity in tundra soils of the Euro-Arctic region (Rybachy peninsula, Russia) // Microorganism. 2023. Vol. 11(5). P. 1352.
- Li Y., Dick W.A., Tuovinen O.H. Fluorescence microscopy for visualization of soil microorganisms - a review // Biology and fertility of soils. 2004. Vol. 39(5). P. 301-311. https://doi.org/10.1007/s00374-004-0722-x.
- Liang C., Schimel J.D., Jastrow J.D. The importance of anabolism in microbial control over soil carbon storage // Nature Microbiology. 2017. Vol. 2. P. 17105.
- Liang C. Soil microbial carbon pump: Mechanism and appraisal // Soil Ecology Letters. 2020. Vol. 2. P. 241-254.
- Lundström U.S., van Breemen N., Bain D. The podzolization process. A review // Geoderma. 2000. Vol. 94. P. 91-107.
- Mundra S., Kjønaas O.J., Morgado L.N., Krabberød A.K., Ransedokken Y., Kauserud H. Soil depth matters: shift in composition and inter-kingdom cooccurrence patterns of microorganisms in forest soils // FEMS Microbiology Ecology. 2021. Vol. 6. P. 97.
- Paul E.A. The nature and dynamics of soil organic matter: Plant inputs, microbial transformations, and organic matter stabilization // Soil Biology and Biochemistry. 2016. Vol. 98. P. 109-126.
- Polyanskaya L.M., Yumakov D.D., Tyugay Z.N., Stepanov A.L. Fungi and Bacteria in the Dark-Humus Forest Soil // Eurasian Soil Science. 2020. Vol. 53(9). P. 1255-1259. https://doi.org/10.1134/S1064229320090124.
- Santruckova H., Kotas P., Barta J., Urich T., Capek P., Palmtag J. Significance of dark CO2 fixation in arctic soils // Soil Biol. Biochem. 2018. Vol. 119. P. 11-21.
- Semenov M.V., Chernov T.I., Tkhakakhova A.K., Zhelezova A.D., Ivanova E.A., Kolganova T.V., Kutovaya O.V. Distribution of prokaryotic communities throughout the Chernozem profiles under different land uses for over a century // Applied soil ecology. 2018. Vol. 127. P. 8-18.
- Tajik S., Ayoub, S., Lorenz N. Soil microbial communities affected by vegetation, topography and soil properties in a forest ecosystem // Applied Soil Ecology. 2020. Vol. 149. P. 306.
- Wang M., Tian J., Xiang M., Liu X. Living strategy of cold-adapted fungi with the reference to several representative species // Mycology. 2017. Vol. 8(3). P. 178-188. https://doi.org/10.1080/21501203.2017.1370429.
- Wang B., An S., Liang C., Liu Y., Kuzyakov Y. Microbial necromass as the source of soil organic carbon in global ecosystems // Soil Biology and Biochemistry. 2021. Vol. 162. 108422.
- Zhelezova A.D., Semenov V.M., Ksenofontova N.A., Krasnov G.S., Tkhakakhova A.K., Nikitin D.A., Semenov M.V. Effects of distinct manure amendments on microbial diversity and activity in Chernozem and Retisol // Applied Soil Ecology. 2024. Vol. 193. P. 105152.


