Угнетение противоопухолевой цитотоксической активности дендритных клеток у больных злокачественными лимфомами, обусловленное измененной экспрессией фактора некроза опухоли альфа
Автор: Тыринова Тамара Викторовна, Леплина Ольга Юрьевна, Тихонова Марина Александровна, Баторова Дарья Сергеевна, Ушакова Галина Юрьевна, Сергеевичева Вера Васильевна, Сизикова Светлана Анатольевна, Крючкова Ирина Валентиновна, Останин Александр Анатольевич, Черных Елена Рэмовна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 (71), 2015 года.
Бесплатный доступ
Исследования последних лет демонстрируют, что дендритные клетки (дК) обладают прямой противоопухолевой цитотоксической активностью и способны подавлять рост и пролиферацию опухолевых клеток. Целью настоящей работы явилось исследование взаимосвязи между цитотоксической активностью генерируемых в присутствии IFNα дендритных клеток (ИФН-дК) и экспрессией дендритными клетками TNFα у больных злокачественными лимфомами. Показано, что ИФН-дК больных злокачественными лимфомами обладают слабой цитотоксической активностью против опухолевых клеток НЕр-2, что ассоциируется с низкой экспрессией траснмембранной формы tmTNFα (tmTNFα) и высоким уровнем продукции растворимой формы TNFα (sTNFα). Установлено, что угнетение цитотоксической активности дК и низкая экспрессия tmTNFα в культурах ИФН-дК характерны в большей степени для лимфом Ходжкина. При этом ИФН-дК больных неходжкинскими лимофомами обладают сохранной цитотоксичностью против клеток НЕр-2, а экспрессия tmTNFα на дК сопоставима с аналогичным показателем в культурах ИФН-дК здоровых доноров. Установлено, что увеличение экспрессии tmTNFα в культурах IFN-дК исследуемых больных, индуцированное добавлением на этапе конечного созревания дК ингибитора TNFα-конвертирующего фермента, ассоциируется с усилением цитотоксической активности ИФН-дК против клеток НЕр-2.
Дендритные клетки, интерферон альфа, фактор некроза опухоли альфа, злокачественные лимфомы
Короткий адрес: https://sciup.org/14056580
IDR: 14056580 | УДК: 616-006.441-002.4:612.014
Текст научной статьи Угнетение противоопухолевой цитотоксической активности дендритных клеток у больных злокачественными лимфомами, обусловленное измененной экспрессией фактора некроза опухоли альфа
Дендритные клетки (ДК) являются высокоспециализированными антигенпрезентирующими клетками, способными индуцировать иммунный ответ против различных антигенов, включая опухолевые антигены [2]. Наряду с запуском адаптивного иммунного ответа ДК обладают непосредственной эффекторной функцией и способны подавлять рост и пролиферацию опухолевых клеток за счет прямого цитотоксического и цитостатического эффектов [7, 20]. Цитотоксическая активность ДК против опухолевых клеток может опосредоваться с вовлечением различных проапоптогенных лигандов, в том числе и молекулы фактора некроза опухоли альфа (TNFα) [12]. Известно, что TNFα может существовать в двух формах: экспрессироваться на клеточной мембране в виде трансмембранной формы (tmTNFα), а также секретироваться в виде растворимой формы (sTNFα) [9]. Обе формы могут связываться с рецептором TNF-R1 и индуцировать апоптоз в клетках-мишенях [19].
Проведенные нами ранее исследования показали, что ДК здоровых доноров, генерированные в культуре in vitro в присутствии IFNα (ИФН-ДК), лизируют TRAIL-резистентные опухолевые клетки НЕр-2 через TNF/TNF-R1-сигнальный путь [18]. Кроме того, нами было показано, что ИФН-ДК больных злокачественными лимфомами (ЗЛ) характеризуются низким цитотоксическим потенциалом против клеток НЕр-2 [1], что может свидетельствовать о нарушении TNFα-медиируемого механизма цитотоксичности ДК у больных ЗЛ. Учитывая также данные о том, что цитотоксический эффект ДК доноров против клеток НЕр-2 не воспроизводился при замене ДК на их супернатанты [11], было высказано предположение, что выявленный у больных ЗЛ дефект цитотоксической функции ДК против клеток HЕp-2 обусловлен в большей степени снижением экспрессии tmTNFα.
Целью исследования явилось подтверждение факта угнетения цитотоксической функции ИФН-
ДК больных ЗЛ против TRAIL-резистентных опухолевых клеток НЕр-2, а также изучение связи нарушения цитотоксической активности ДК с уровнем экспрессии дендритными клетками TNFα.
Материал и методы
В исследование были включены 15 больных: 6 мужчин и 9 женщин, в возрасте от 21 до 59 лет (медиана – 34 года), проходивших лечение в отделении гематологии и трансплантации костного мозга клиники иммунопатологии НИИ фундаментальной и клинической иммунологии. У 6 пациентов диагностировали неходжкинскую лимфому (НХЛ) и у 9 – лимфому Ходжкина (ЛХ). Количество курсов полихимиотерапии 1-й линии, проведенных у обследуемых пациентов со злокачественными лимфомами, варьировало от 2 до 13 (в среднем 7,1 ± 0,9), 2-й линии – от 1 до 9 (в среднем 3,4 ± 0,6). В качестве контрольной группы было обследовано 22 сопоставимых по полу и возрасту здоровых донора. Забор крови и все иммунологические исследования проводили после получения письменного информированного согласия пациентов.
Мононуклеарные клетки (МНК) получали центрифугированием гепаринизированной венозной крови в градиенте плотности фиколла-верографина. ДК получали путем культивирования прилипающей фракции МНК в 6-луночных планшетах (Nunclon, Дания) в течение 3–4 сут в среде RPMI-1640 (Sigma-Aldrich, США), дополненной 0,3 мг/мл L-глютамина, 5 мМ HEPES-буфера, 100 мкг/мл гентамицина и 5 % сыворотки плодов коровы (FCS, БиолоТ, Россия, г. Санкт-Петербург), в присутствии GM-CSF (40 нг/мл, Sigma-Aldrich) и IFNα (1000 Ед/мл, Роферон-А, Roche, Швейцария) с последующим дозреванием в течение 24 ч с липополисахаридом (10 мкг/мл, ЛПС Е.colli 0114:B4, Sigma-Aldrich). Клеточный выход составлял в среднем (1,3 ± 2,2) × 106 ДК и (0,4 ± 0,2) × 106 ДК в группах здоровых доноров и больных ЗЛ соответственно.
Уровень экспрессии tmTNFα на ДК определяли методом проточной цитофлюориметрии в гейте HLA-DR+клеток методом двойного окрашивания с использованием АРС-коньюгированных анти-TNFα-антител и FITC- или PerCP-коньюгированных анти-HLA-DR-антител (BD PharMingen, США). Для исключения возможности связывания моноклонального анти-TNFα-антитела с комплексом sTNFα-TNFR ДК предварительно в течение 15 мин в темноте при комнатной температуре обрабатывали глициновым буфером Gly-HCl (pH=3,0). Глициновый буфер способствовал диссоциации комплекса sTNFα-TNFR и удалению с мембранной поверхности клетки sTNFα. Далее ДК инкубировали с анти-TNFα- и анти-HLA-DR-антителами согласно стандартной методике. Концентрацию продуцируемого цитокина TNFα в супернатантах ЛПС-стимулированных ИФН-ДК определяли методом иммуноферментного анализа, используя соответствующую тест-систему производства «Вектор-Бест» (г. Новосибирск).
Оценка цитотоксической активности ДК против опухолевых клеток НЕр-2 (карцинома гортани человека) проводилась с помощью МТТ-теста в течение 24 ч в соотношении эффектор/мишень 1:1. Расчет цитотоксической активности проводился по стандартной формуле:
[1-(ОПэ + м-ОПэ)/ОПм] × 100 %, где ОПэ+м – значение оптической плотности в опытных сериях; ОПэ – значение оптической плотности в лунках с эффекторами; ОПм – значение оптической плотности в лунках с мишенями. Оптическая плотность измерялась при длине волны 492 нм на мульти-луночном спектрофотометре (Thermo Scientific Multiskan FC, Finland). В отдельной серии экспериментов в культуры ДК больных злокачественными лимфомами совместно с ЛПС добавляли синтетический ингибитор металлопротеиназ TAPI-0 (25 мкг/мл, Calbiochem, США).
Статистическую обработку данных проводили при помощи пакета прикладных программ Statistica 6.0 для Windows. Данные представлены в виде средних значений (m) и стандартной ошибки (SE). Для выявления значимых различий сравниваемых показателей использовали непараметрический U-критерий Вилкоксона – Манна – Уитни. Для анализа взаимосвязей между исследуемыми параметрами использовали коэффициент корреляции Спирмана. Различия считали достоверными при уровне значимости p<0,05.
Результаты и обсуждение
Оценка цитотоксической активности ДК против опухолевых TRAIL-резистентных клеток НЕр-2 с помощью МТТ-теста показала (рис. 1), что ИФН-ДК здоровых доноров обладали выраженной противоопухолевой активностью (в среднем 42,5 ± 5,6 %). У больных ЗЛ этот показатель был значимо ниже и составлял в среднем 24,7 ± 6,2 % (pU=0,05) (рис. 1А). Поскольку ЗЛ представляют собой гетерогенную группу и включают лимфомы Ходжкина (ЛХ) и неходжкинские лимфомы (НХЛ), была проведена сравнительная оценка изучаемого показателя с учетом типа лимфомы (рис. 1Б). Обе группы больных были сопоставимы по количеству проведенных курсов 1-й и 2-й линий химиотерапии. ИФН-ДК пациентов с НХЛ обладали относительно сохранным уровнем цитотоксической активности (39,1 ± 5,1 %), тогда как в группе больных с ЛХ ИФН-ДК проявляли слабую цитотоксичность (14,4 ± 8,1 %).
Сравнительная оценка экспрессии tmTNFα показала (рис. 2А), что популяция ИФН-ДК доноров содержала в среднем 5,84 ± 0,27 % tmTNFα-позитивных клеток, тогда как для ИФН-ДК больных ЗЛ этот показатель был значимо ниже и составлял в среднем 4,29 ± 0,68 % (pU=0,02). Ана-
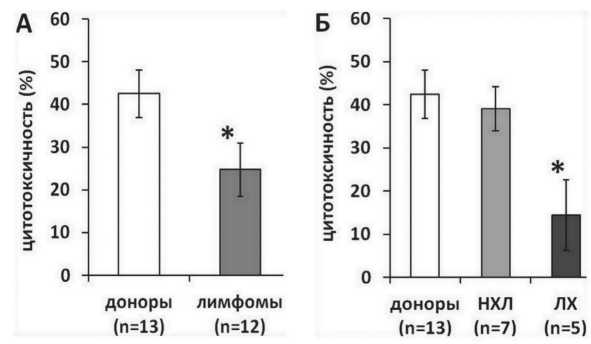
Рис. 1. Цитотоксическая активность ИФН-ДК больных злокачественными лимфомами против клеток линии HEp-2. Представлены средние значения (m ± SE) цитотоксической активности в МТТ-тесте ЛПС-стимулированных ИФН-ДК доноров и больных злокачественными лимфомами против опухолевой линии Ер-2 в соотношении 1:1.
Примечание: * – различия между группами больных и доноров статистически значимы (рU<0,05)
лиз пациентов с учетом типа лимфом (рис. 2Б, В) показал, что ИФН-ДК больных ЛХ характеризовались достоверно низкой экспрессией tmTNFα по сравнению с группой доноров (3,4 ± 0,8 % vs 5,84 ± 0,27 %; pU=0,01). В то же время относительное количество tmTNFα-позитивных клеток в культурах ИФН-ДК пациентов с НХЛ было сопоставимо с аналогичным показателем в культурах ИФН-ДК доноров (5,48 ± 1,07 % и 5,84 ± 0,27 % соответственно).
На следующем этапе было проведено сравнительное исследование продукции sTNFα в культурах ДК доноров и больных лимфомами.
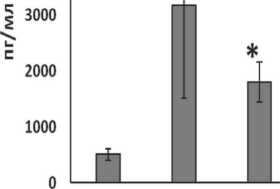
Принимая во внимание тот факт, что клеточный выход при генерации ДК у больных ЗЛ был ниже по сравнению со здоровыми донорами, анализ уровня продукции sTNFα в цельных супернатантах культур ИФН-ДК проводился в пересчете на 105 ДК. Как видно из рис. 3А, ИФН-ДК больных ЗЛ отличались более высокой, по сравнению с ИФН-ДК доноров, продукцией sTNFα/105ДК (pU=0,004). Кроме того, аналогичные различия наблюдались при сравнении культур ДК больных ЛХ и здоровых доноров (pU=0,002, рис. 3Б). Различия в продукции sTNFα/105ДК в культурах ДК доноров и больных НХЛ проявлялись в виде тенденции (pU=0,19).
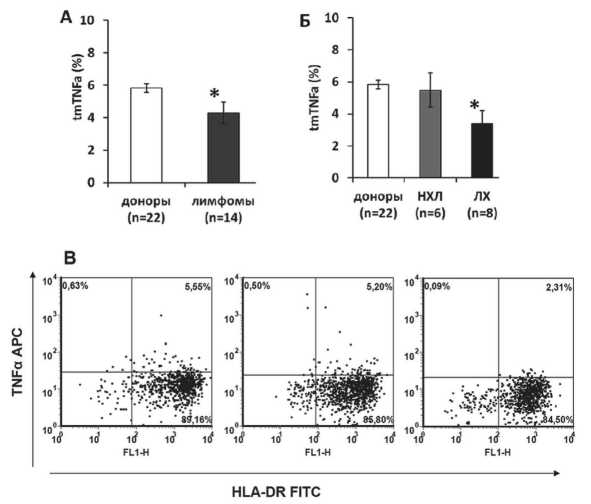
Рис. 2. Экспрессия мембранной формы TNFα в культурах ИФН-ДК больных злокачественными лимфомами: А, Б – средние значения (m ± SE) экспрессии tmTNFα (%) в культурах ЛПС-стимулированных ИФН-ДК доноров и больных злокачественными лимфомами; В – индивидуальные DotPlot гистограммы распределения ДК по флуоресценции FITC-меченных анти-HLA-DR-антител и APC-меченных анти-TNFα-антител у здорового донора (левый DotPlot график), больного НХЛ (в центре) и больного ЛХ (правый DotPlot график). Относительное содержание HLA-DR+ tmTNFα + ДК – правый верхний квандрат.
Примечание: * – различия показателей ИФН-ДК в группах больных и доноров статистически значимы (рU<0,05)
A 5000
Б
I 3000 c 2000

доноры НХЛ ЛХ
(n=13) (n=6) (n=9)
доноры лимфомы
(n=13) (n=15)
Рис. 3. Продукция растворимой формы TNFα в культурах ИФН-ДК больных злокачественными лимфомами. Представлены средние значения (m ± SE) продукции sTNFα/105 (пкг/мл) в супернатантах ЛПС-стимулированных ИФН-ДК доноров и больных злокачественными лимфомами.
Примечание: * – различия между группами больных и доноров статистически значимы (рU<0,05)
Для того чтобы выяснить роль мембранной и секретируемой форм TNFα в реализации цитотоксической активности ИФН-ДК против клеток НЕр-2, была проведена серия экспериментов с использованием синтетического ингибитора TAPI-0, блокирующего активность TNFα-конвертирующего фермента (ТАСЕ). ТАСЕ участвует в образовании sTNFα из tmTNFα [3]. Поскольку блокирование фермента ТАСЕ может приводить к снижению продукции sTNFα и накоплению на поверхности клетки tmTNFα, данный подход позволил оценить, как изменение соотношения sTNFα и tmTNFα ассоциировано с изменением цитотоксической активности ИФН-ДК больных ЗЛ. Как видно из рис. 4, добавление TAPI-0 в дозе 25 мкг/мл на этапе конечного созревания ДК совместно с ЛПС действительно приводило к увеличению tmTNFα-позитивных клеток в культурах ИФН-ДК исследуемых больных. При этом продукция sTNF в культурах ИФН-ДК значимо снижалась.
Анализ индивидуальных значений цитотоксической активности ИФН-ДК больных ЗЛ (табл. 1) показал, что повышение экспрессии tmTNFα, обусловленное действием ингибитора, в 3 из 4 случаев было ассоциировано с увеличением цитотоксической активности ИФН-ДК. Однако у одного пациента с НХЛ (больной 3), несмотря на увеличение экспрессии дендритными клетками tmTNFα с 3,47 до 10,2 % при добавлении TAPI-0, возрастания цитотоксичности не наблюдалось.
Двойственная функция дендритных клеток как непосредственных эффекторов врожденного иммунитета и индукторов/регуляторов адаптивного иммунного ответа придает им особую значимость в противоопухолевой защите. Цитотоксическая активность ДК, направленная на элиминацию опухолевых клеток, может обеспечить более успешное поглощение опухолевых антигенов ДК и, следовательно, способствовать более раннему развитию эффективного противоопухолевого
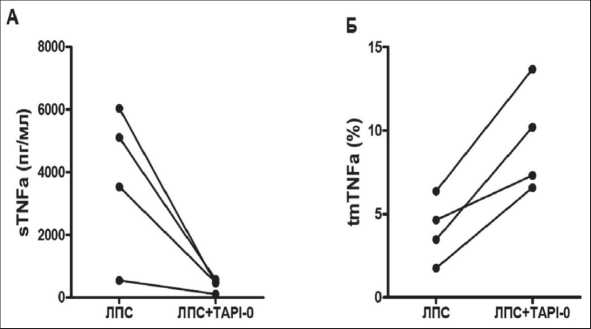
Рис. 4. Влияние TAPI-0 на экспрессию tmTNFα и продукцию sTNFα в культурах ЛПС-стимулированных ИФН-ДК больных с онкопатологией.
Представлены средние значения (m ± SE) концентрации sTNFα/105 (пкг/мл) в супернатантах цельных культур (А) и относительного количества клеток, экспрессирующих tmTNFα (%), в интактных ЛПС-стимулированных и TAPI-0-обработаных культурах ИФН-ДК больных злокачественными лимфомами (Б)
Таблица 1
Влияние TAPI-0 на цитотоксическую активность ИФН-ДК больных против опухолевых клеток НЕр-2
|
Пациент |
Диагноз |
Цитотоксическая активность |
|
|
ЛПС |
ЛПС+TAPI-0 |
||
|
Больной 1 |
ЛХ |
10,05 |
29,6 |
|
Больной 2 |
НХЛ |
27,4 |
28,9 |
|
Больной 3 |
НХЛ |
28 |
25,4 |
|
Больной 4 |
ЛХ |
25,3 |
31,8 |
Примечание: представлены индивидуальные значения цитотоксической активности (%) в МТТ-тесте интактных ЛПС-стимулированных и обработанных TAPI-0 ИФН-ДК больных злокачественными лимфомами против опухолевой линии НЕр-2 в соотношении 1:1.
иммунного ответа, индуцированного презентацией опухолевых антигенов Т-клеткок. Настоящее исследование показало, что ИФН-ДК больных ЗЛ действительно обладают слабой цитотоксической активностью против TRAIL-резистентных опухолевых клеток НЕр-2. Проведенные нами предыдущие исследования выявили дефект цитотоксической активности ИФН-ДК против клеток НЕр-2 у больных с внутримозговыми глиальными опухолями высокой степени злокачественности [18]. При этом ДК больных этой категории проявляли высокую цитотоксическую активность против TRAIL- и FasL-чувствительных опухолевых клеток. Важно отметить, что больные злокачественными глиомами со слабой цитотоксической активностью ДК характеризовались низкими показателями выживаемости, тогда как пациенты с сохранной цитотоксической активностью ДК – более высокими показателями выживаемости. Полученные результаты позволяют предположить, что дефектность цитотоксической функции ДК может иметь патогенетическую значимость при опухолевом росте.
Согласно полученным нами данным, ДК больных ЗЛ характеризуются низкой экспрессией tmTNFα и высокой продукцией sTNFα/105 ДК. Поскольку sTNFα образуется из tmTNFα при участии мембраносвязанной металлопротеиназы TACE [3], можно предположить, что обнаруженное нами нарушение экспрессии TNFα в сторону увеличения секреторной формы связано с повышенной активностью ТАСЕ. Известно, что функциональная активность ТАСЕ подвержена позитивной и негативной регуляции. Так, например, стимулирующим эффектом на ТАСЕ обладают ЛПС, polyI:C, ИФНγ, тогда как ИЛ-10, наоборот, ингибирует шеддинг TNFα [4, 10]. Описаны случаи измененной активности ТАСЕ при ряде патологий. Так, например, показано, что ЛПС-стимулированные моноциты при миелоидном лейкозе отличаются от моноцитов здоровых доноров повышенной каталитической активностью ТАСЕ [15]. Исследования D.J. O’Callagha et al. указывают на то, что при сепсисе высокая активность ТАСЕ в моноцитах сохраняется и при их дифференцировке в макрофаги [16]. По-видимому, если низкая экспрессия tmTNFα в ДК больных ЗЛ связана с повышенной активностью фермента ТАСЕ, то подобные изменения действительно могут быть обусловлены дефектом самих моноцитарных предшественников ДК.
При анализе пациентов с учетом типа лимфом нами были обнаружены различия в противоопухолевой цитотоксической активности ИФН-ДК между больными ЛХ и НХЛ. Эти различия ассоциировались с уровнем экспрессии tmTNFα в оппозитных группах. Для культур ИФН-ДК больных ЛХ, проявляющих слабую цитотоксическую активность против клеток НЕр-2, была характерна низкая экспрессия tmTNFα и высокая продукция sTNFα/105 ДК по сравнению с донорскими значениями. ИФН-ДК больных НХЛ, обладающие относительно сохранной цитотоксичностью против НЕр-2, экспрессировали tmTNFα на уровне, сопоставимом с аналогичным показателем в культурах ИФН-ДК здоровых доноров, и характеризовались высокой продукцией sTNFα/105 ДК. Данных об экспрессии TNFα в ДК при ЛХ и НХЛ в литературе нет. Однако показано, что при НХЛ, несмотря на выраженные иммунные дисфункции, в том числе сниженный пролиферативный ответ лимфоцитов на аллоантигены [6], низкую антителозависимую и НК-клеточную цитотоксическую активность [14], моноциты больных этой категории сохраняют способность к продукции TNFα и проявляют выраженную цитотоксическую активность против TNFα-чувствительных опухолевых клеток [8]. Следует отметить, что уровень экспрессии мРНК TNFα в самих опухолевых клетках при ЛХ значительно ниже, чем при НХЛ [17]. Можно предположить, что различия в регуляции экспрессии данной молекулы на транскрипционном уровне (за счет активации сигнальных путей, вовлеченных в синтез мРНК TNFα) и посттрансляционном уровне, обусловленные реципрокными или иными взаимодействиями, влияют на функции иммунокомпетентных клеток.
Предыдущие исследования показали, что супернатанты ИФН-ДК доноров не обладают кил-лерной активностью против клеток НЕр-2 [11], что указывает на клеточно-контактный механизм реализации цитотоксической активности ИФН-ДК против клеток НЕр-2. По-видимому, выявленные различия между донорами и больными в продукции sTNFα в данном случае не имеют значения, а цитотоксичность ДК детерминирована уровнем tmTNFα.
Согласно полученным нами данным, увеличение экспрессии tmTNFα в культурах ИФН-ДК больных ЗЛ и подавление продукции sTNFα, индуцированное ингибицией фермента ТАСЕ, ассоциируются с усилением противоопухолевой цитотоксической активности ИФН-ДК. Полученные нами результаты подтверждают ведущую роль tmTNFα в реализации цитотоксической активности против клеток НЕр-2. В литературе имеются лишь единичные данные о том, что tmTNFα обладает более выраженной апоптоз-индуцирующей активностью против опухолевых мишеней [5, 13]. Также показано, что созревание ИЛ4-индуцированных ДК сопровождается снижением экспрессии tmTNFα и повышением sTNFα в супернатантах ДК. Эти изменения ассоциируются с более низкой цитотоксической активностью зрелых ДК по сравнению с незрелыми ДК против различных опухолевых линий [12]. Отсутствие стимулирующего эффекта TAPI-0 на цитотоксическую активность ДК одного из исследуемых нами больных можно объяснить возможным участием других TNFα-независимых механизмов реализации цитотоксического эффекта ИФН-ДК. Можно предположить, что в этом случае цитотоксическая активность ИФН-ДК не связана
Список литературы Угнетение противоопухолевой цитотоксической активности дендритных клеток у больных злокачественными лимфомами, обусловленное измененной экспрессией фактора некроза опухоли альфа
- Леплина О.Ю., Насонова Г.В., Тихонова М.А., Крючкова И.В., Лисуков И.А., Останин А.А., Черных Е.Р. IFN-α-индуцированные дендритные клетки у больных множественной миеломой//Сибирский онкологический журнал. 2009. № 6. С. 37-43
- Banchereau J., Steinman R.M. Dendritic cells and the control of immunity//Nature. 1998. Vol. 392 (6673). P. 245-252
- Black R.A., Rauch C.T., Kozlosky C.J., Peschon J.J., Slack J.L., Wolfson M.F., Castner B.J., Stocking K,L., Reddy P., Srinivasan S., Nelson N., Boiani N., Schooley K.A., Gerhart M., Davis R., Fitzner J.N., Johnson R.S., Paxton R.J., March C.J., Cerretti D.P. A metalloproteinase disintegrin that releases tumour-necrosis factor-alpha from cells//Nature. 1997. Vol. 385 (6618). P. 729-733
- Brennan F.M., Green P., Amjadi P., Robertshaw H.J., Alvarez-Iglesias M., Takata M. Interleukin-10 regulates TNF-α-converting enzyme (TACE/ADAM-17) involving a TIMP-3 dependent and independent mechanism//Eur. J. Immunol. 2008. Vol. 38. P. 1106-1117. doi: 10.1002/eji.200737821
- Gruss H.J. Molecular, structural, and biological characteristics of the tumor necrosis factor ligand superfamily//Int. J. Clin. Lab. Res. 1996. Vol. 26 (3). P. 143-159
- Healy F., Rees R.C., Hancock B.W. An assessment of natural cell-mediated cytotoxicity in patients with malignant lymphoma//Eur. J. Cancer Clin. Oncol. 1985. Vol. 21 (7). P. 775-783
- Janjic B.M., Lu G., Pimenov A., Whiteside T.L., Storkus W.J., Vujanovic N.L. Innate direct anticancer effector function of human immature dendritic cells. I. Involvement of an apoptosis-inducing pathway//J. Immunol. 2002. Vol. 168 (4). P. 1823-1830
- Jhaver K., De A., Advani S., Nadkarni J. Production of interleukin-1 and tumour necrosis factor in non-Hodgkin’s lymphoma patients//Cancer Immunol. Immunother. 1991. Vol. 34 (2). P. 123-127
- Kriegler M., Perez C., DeFay K., Albert I., Lu S.D. A novel form of TNF/cachectin is a Cell surface cytotoxic transmembrane protein: ramifications for the complex physiology of TNF//Cell. 1988. Vol. 53 (1). P. 45-53
- Le Gall S.M., Maretzky T., Issuree P.D., Niu X.D., Reiss K., Saftig P., Khokha R., Lundell D., Blobel C.P. ADAM17 is regulated by a rapid and reversible mechanism that controls access to its catalytic site//J. Cell Sci. 2010. Vol. 123. P. 3913-3922 DOI: 10.1242/jcs.069997
- Leplina O., Tyrinova T., Tikhonova M., Shevela E., Stupak V., Mishinov S., Pendyurin I., Sadovoy M., Ostanin A., Chernykh E. Direct Antitumor Activity of Interferon-Induced Dendritic Cells of HealthyDonors and Patients with Primary Brain Tumors//Glioma -Exploring Its Biology and Practical Relevance. NTECH Open Access Publisher. 2011. P. 325-342.
- Lu G., Janjic B.M., Janjic J., Whiteside T.L., Storkus W.J., Vujanovic N.L. Innate Direct Anticancer Effector Function of Human Immature Dendritic Cells. II. Role of TNF, Lymphotoxin-α1β2, Fas ligand, and TNF-related apoptosis-inducing ligand//J. Immunol. 2002. Vol. 168. P. 1831-1839 DOI: 10.4049/jimmunol.168.4.1831
- Luettiq B., Decker T., Lohmann-Matthes M.L. Evidence for the existence of two forms of membrane tumor necrosis factor: an integral protein and a molecule attached to its receptor//J. Immunol. 1989. Vol. 143 (12). P. 4034-4038
- Mehta B.A., Advani S.H., Nadkarni S.J. Natural killer activity and antibody-dependent cellular cytotoxicity in patients with non-Hodgkin’s lymphoma//Neoplasma. 1988. Vol. 35 (1). P. 61-68
- Moreira-Tabaka H., Peluso J., Vonesch J.L., Hentsch D., Kessler P., Reimund J.M., Dumont S., Muller C.D. Unlike for human monocytes after LPS activation, release of TNF-α by THP-1 cells is produced by a TACE catalytically different from constitutive TACE//PLoS ONE. 2012. Vol. 7 (3). e34184 DOI: 10.1371/journal.pone.0034184
- O’Callagha D.J., O’Dea K.P., Takata M., Gordon A.C. Monocyte TACE activity profile during sepsis and systemic inflammatory response syndrome//Intensive Care Medicine Experimental. 2014. Vol. 2 (Suppl. 1). P. 6 DOI: 10.1186/2197-425X-2-S1-P6
- Sappino A.P., Seelentag W., Pelte M.F., Alberto P., Vassalli P. Tumor necrosis factor/cachectin and lymphotoxin gene expression in lymph nodes from lymphoma patients//Blood. 1990. Vol. 75 (4). P. 958-962
- Tyrinova T.V., Leplina O.Y., Mishinov S.V., Tikhonova M.A., Shevela E.Y., Stupak V.V., Pendyurin I.V., Shilov A.G., Alyamkina E.A., Rubtsova N.V., Bogachev S.S., Ostanin A.A., Chernykh E.R. Cytotoxic activity of ex-vivo generated IFNα-induced monocyte-derived dendritic cells in brain glioma patients//Cell. Immunol. 2013. Vol. 284 (1-2). P. 146-153 DOI: 10.1016/j.cellimm.2013.07.013
- Vandenabeele P., Declercq W., Beyaert R., Fiers W. Two tumor necrosis factor receptors: structure and function//Trends Cell. Biol. 1995. Vol. 5 (10). P. 392-399
- Vanderheyde N., Vandenabeele P., Goldman M., Willems F. Distinct mechanisms are involved in tumoristatic and tumoricidal activities of monocyte-derived dendritic cells//Immunol. Lett. 2004. Vol. 91 (2-3). P. 99-101.


