Ультразвуковая дезинтеграция микроорганизмов с использованием волокнистого наполнителя
Автор: Шестаковский Л.Я.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.17, 2007 года.
Бесплатный доступ
В этой статье представлены результаты исследования процесса дезинтеграции микроорганизмов с использованием волокнистого наполнителя в объеме дезинтеграционной камеры. Ультразвуковая дезинтеграция клеток Esherihia coli и Methilocystis echinoides в проточной камере ультразвукового дезинтегратора, заполненной стеклянным волокном с силированной поверхностью и объемом волокна 0.1-0.7 от объема камеры, обеспечила более высокую степень дезинтеграции, выход белка, активность ферментов по сравнению с дезинтеграцией без волокнистого наполнителя при одинаковых значениях остальных условий и режимов дезинтеграции. Снижается электрическая мощность, затрачиваемая на дезинтеграцию.
Короткий адрес: https://sciup.org/14264515
IDR: 14264515 | УДК: 579.22]:
Текст научной статьи Ультразвуковая дезинтеграция микроорганизмов с использованием волокнистого наполнителя
Одной из задач дезинтеграции микроорганизмов на ультразвуковом дезинтеграторе с использованием волокнистого наполнителя камеры дезинтегратора является полное исключение кавитации, которая приводит к дополнительному химическому воздействию на биологические структуры, вероятно, механической природы (микрокрекинг макромолекул, образование свободных радикалов и др.), включая намол материала сосудов, в которых проводят дезинтеграцию микроорганизмов.
Исследования показали, что при определенных отношениях суммарной поверхности волокнистого наполнителя к объему озвучиваемой суспензии микроорганизмов кавитация полностью подавляется даже при сравнительно высоких интенсивностях ультразвука. Одновременно возрастает интенсивность акустических течений [1]. Возрастают эффективность дезинтеграции микроорганизмов (увеличивается процент разрушенных клеток) и выход белка.
МАТЕРИАЛЫ И МЕТОДЫ
Клетки Esherihia coli были выращены в минеральной среде. В логарифмической фазе роста клетки были отделены центрифугированием на 5000 об/мин в течение 10 мин, дважды промыты раствором 0.14 моль NaCl в 0.01 моль трис-НСl буфере, рН 7.5, cодержащем 0.01 моль MgCl 2 при температуре 4 °С. Для дезинтеграции клеток использовалась их суспензия в 0.01 моль трис-HCl буфере, рН 7.5,содержащая 0.01 моль MgCl 2 .
Клетки Methylocystis echinoides выращены на минеральной среде в атмосфере метан—воздух (1:1) до середины экспоненциальной фазы при температуре 30 °С.
Состав среды, г/л:
KNO 3 — 1; KH 2 PO 4 — 0.7; Na 2 HPO 4 ·12H 2 O — 1.3; MgSO 4 — 0.2; CaCl 2 — 0.02.
Микроэлементы — 1 мл/л.
Состав микроэлементов, г/л:
трилон Б — 5.0;
FeSO 4 ·7H 2 O, ZnSO 4 ·7H 2 O, MgCl 2 ·4H 2 O — 0.03;
CaCl 2 ·6H 2 O — 0.2; CuCl 2 ·6H2O — 0.01;
NiCl 2 ·6H 2 O — 0.02; NaMnO 4 — 0.03.
Вода дистиллированная — 1 л.
Клетки центрифугировались на частоте вращения 5000 об/мин и отмывались калий-фосфатным буфером 0.05 моль, рН 7.5.
Дальнейшие условия одинаковы для обеих культур. 9
-
■ Концентрация суспензии — 15^10 9 клт./мл.
-
■ Объем дезинтегрируемой суспензии — 60 мл.
-
■ Режим протока — циркуляция.
-
■ Объемный расход суспензии — 60 мл/мин.
-
■ Время дезинтеграции — 10 мин.
-
■ Температура суспензии поддерживалась в пределах от 2 до 8 °С.
-
■ Частота колебаний наконечника — 22 кГц, амплитуда — 14÷16 мкм, мощность дезинтеграции — 100 Вт.
Дезинтеграция проводилась в специальной камере, конструкция которой описана ниже. Камера была заполнена волокнистым наполнителем (рис. 1). Волокнистый наполнитель представляет собой стеклянные волокна диаметром 8–12 мкм с силированной поверхностью, 0.1–0.7 от объема камеры.
Для сравнения проводилась дезинтеграция суспензий этих же культур при аналогичных условиях, но без наполнителя. Определялась оптическая плотность исходных суспензий и дезинтеграта. Концентрация клеток рассчитывалась по калибровочным кривым.
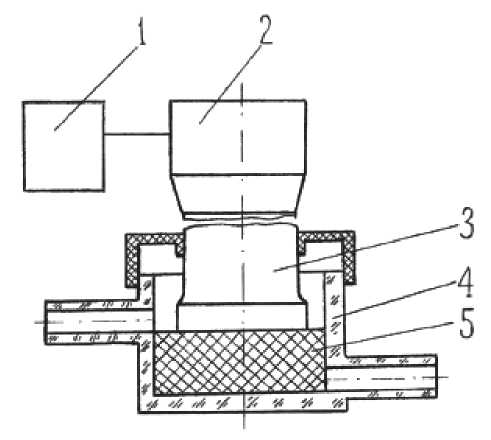
Рис. 1. Схема установки для ультразвуковой дезинтеграции в камере с волокнистым наполнителем.
1 — ультразвуковой генератор; 2 — концентратор; 3 — наконечник; 4 — камера; 5 — волокнистый наполнитель
Процент разрушения клеток определялся фотометрическим способом. Определения концен-
трации белка в дезинтеграте и активности ферментов в супернатанте производились после центрифугирования дезинтеграта в течение 10 мин. Белок определялся по методу Лоури [2].
Активность NН 4 -зависимых дегидрогеназ метанола и формальдегида, NН 4 -независимых дегидрогеназ формальдегида и формиата определялась по восстановлению 2.6-дихлорфенолиндофенола на 600 нм [3].
Активность NAD-зависимой формиатдегидрогеназы определялась по восстановлению NAD на 300 нм [4].
Активность NADН-оксидазы определялась по окислению NADН на 340 нм [3].
Активность сукцинатдегидрогиназы определялась по восстановлению дихлорфенолиндофенола на 600 нм [5].
Активность АТФ определялась по скорости восстановления АТФ до АДФ и ортофосфата. Ортофосфат определялся по методу Беренблюма и Чейна [6] в модификации Грина [7].
Проверка влияния волокнистого наполнителя на потребляемую при дезинтеграции мощность проводилась в камере вместимостью 50 мл. Проток воды, имитирующий суспензию микроорганизмов, — 70 мл/мин; температура воды — 4 °С.
Для сравнения проводилось озвучивание воды при указанных выше условиях, но без наполнителя (контрольный опыт).
Табл. 1. Результаты дезинтеграции клеток Methylocystis echinoides
|
Характеристика |
Способ дезинтеграции |
||
|
Без наполнителя |
С волокнистым наполнителем |
||
|
Выход белка (по Лоури), мг/мл |
0.1 |
0.36 |
|
|
Эффективность дезинтеграции, % |
6 |
19 |
|
|
Активность ферментов, МЕ/мг белка/мин |
Метанолдегидрогеназа |
0 |
15 |
|
Формальдегиддегидрогеназа |
0 |
14 |
|
|
Формиатдегидрогеназа (NAD) |
0 |
143 |
|
|
Формиатдегидрогеназа (ФМС) |
23 |
183 |
|
|
Сукцинатдегидрогеназа |
0 |
9 |
|
Табл. 2. Результаты дезинтеграции клеток Escherihia coli
|
Способ дезинтеграции |
Эффективность дезинтеграции, % |
Белок (по Лоури) |
Активность АТФ, МЕ/мг белка/ мл |
|
Без наполнителя |
47 |
0.34 |
77.8 |
|
С волокнистым наполнителем |
56 |
0.55 |
86.6 |
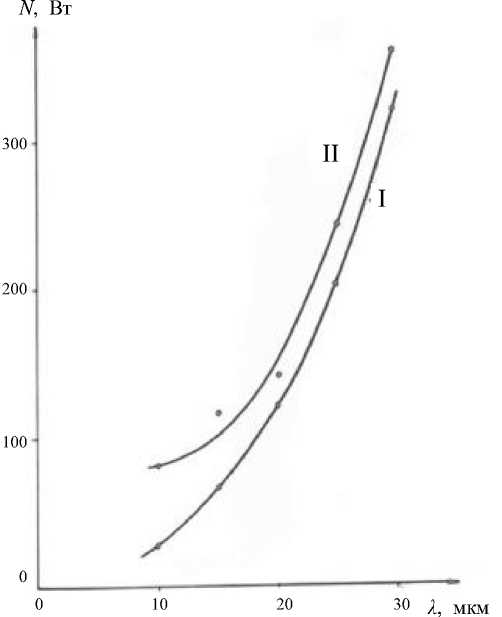
Рис. 2. График зависимости мощности от амплитуды колебаний наконечника.
I — камера с волокнистым наполнителем; II — камера без наполнителя
ОБОРУДОВАНИЕ И ПРИНАДЛЕЖНОСТИ
Используемые приборы: спектрофотометры ФЭК-60П, СФ-16 (изготовитель СССР), Spekord UV VIS (изготовитель ГДР); исследовательский биологический микроскоп Биолам И-1 (ЛОМО).
Исследования были проведены на ультразвуковом дезинтеграторе микроорганизмов UDM-10, разработанном приборостроительной фирмой Tehpan (Польша). Дезинтегратор оснащен устройством термостатирования и протока жидкости
УТП, поддерживающим заданный предел температур в камере дезинтегратора и время дезинтеграции, разработанным в ИБП РАН (НПО "Биоприбор" АН СССР).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты дезинтеграции приведены в табл. 1 и 2. Влияние волокнистого наполнителя на потребляемую мощность показано на графике рис. 2).
Проведение ультразвуковой дезинтеграции в камере с волокнистым наполнителем показывает, что при уменьшенной в 2 раза амплитуде колебаний вибратора (8 мкм), эффективность дезинтеграции возрастала в 1.2–3 раза. При этом мощность оставалась на одном уровне с контрольными опытами (без наполнителя), а выход белка увеличивался в 1.5 раза. Для клеток с более прочными оболочками эффективность использования волокнистого наполнителя еще выше.
Использование при дезинтеграции волокнистого наполнителя приводит к снижению мощности в 1.2–3.5 раза по сравнению с контролем. И чем меньше амплитуда колебаний вибратора, тем больше снижается мощность за счет использования волокнистого наполнителя.


