Ультразвуковая оценка репаративных процессов в зоне установки титановых сетчатых имплантов после лапароскопической паховой герниопластики
Автор: Чиников М.А., Марущак Е.А., Файбушевич А.Г., Тархани М.К.М., Аль-арики М., Джуманов А.К.
Журнал: Московский хирургический журнал @mossj
Рубрика: Абдоминальная хирургия
Статья в выпуске: 2 (84), 2023 года.
Бесплатный доступ
Введение. Использование в герниологии различных имплантов диктует необходимость изучения качества их интеграции. В данном аспекте выполнение морфологических исследований у пациентов часто невозможно. Цель исследования. Оценка репаративных процессов в зоне установки импланта в зависимости от его материала. Материалы и методы исследования. В исследование включено 25 больных паховой грыжей, всем выполнена лапароскопическая герниопластика. 11 больным установлен титановый сетчатый имплант (1-я группа), 14 больным - полипропиленовый (2-я группа). Ультразвуковая оценка зоны установки импланта выполнялась через 13 суток, 2 недели, 2, 6 и 12 месяцев после операции. Результаты исследования. Через 2 недели после операции остаточная экссудация в зоне установки имплантов выявлена у 35,7 % больных 2 группы. У пациентов 1 группы выявлено более раннее прорастание ячеек импланта соединительной тканью (через 2 недели после операции), чем во 2 группе пациентов (через 6 месяцев). Спустя 12 месяцев после операции у пациентов 1 группы формировался более толстый периимплантационный рубец, чем у пациентов 2 группы (2,5 ± 0,2 мм против 1,25 ± 0,1 мм, при р
Паховая грыжа, лапароскопическая герниопластика, тарр, титановый имплант, репарация, ультразвуковое исследование, рубец
Короткий адрес: https://sciup.org/142238577
IDR: 142238577 | УДК: 006.617-089 | DOI: 10.17238/2072-3180-2023-2-59-67
Текст научной статьи Ультразвуковая оценка репаративных процессов в зоне установки титановых сетчатых имплантов после лапароскопической паховой герниопластики
В настоящее время лечение больных грыжами передней брюшной стенки связано с применением различных по структуре и материалу имплантов. Важным вопросом современной герниологии является оценка отдалённых результатов лечения в свете использования имплантов.
С учетом очевидных сложностей выполнения у пациентов морфологических исследований в месте установки имплантов, в последние годы активно развиваются инструментальные способы, позволяющие охарактеризовать эффективность протезирующих герниопластик. Так Petter-Puchner A. с соавт. в эксперименте использовали ультразвуковую биомикроскопию и сканирующую акустическую микроскопию, определяя скорость регенерации в месте фиксации импланта и степень его интеграции [8]. Методика, примененная авторами, с оценкой размера ячеек импланта и идентификацией грануляционной или рубцовой ткани, позволила получить данные сопоставимые с результатами гистологического исследования.
Доступным методом исследования зоны установки имплантов после хирургического лечения грыж передней брюшной стенки является ультразвуковое исследование [5, 6, 7]. По данным С. В. Харитонова с соавт., этот метод позволяет визуализировать мышечно-апоневротические структуры зоны операции, расположение импланта и развитие местных осложнений [3, 4]. Авторы указывают, что степень выраженности экссудативной реакции тканей в ответ на имплантацию синтетического сетчатого импланта определяется его физико-химическими свойствами.
На значимую роль ультразвукового сканирования при исследовании топических характеристик строения тканей, объемных соотношений органов брюшной полости и структур передней брюшной стенки указывает Ю. С. Винник с соавт. [1]. Авторами проведено исследование, направленное на анализ степени вживляемости различных синтетических имплантов после герниопластик у больных послеоперационными вентральными грыжами. Ультразвуковое исследование с высокой эффективностью позволило оценить степень прорастания ячеек имплантов соединительной тканью, а также выявить развитие местных осложнений. Ультразвуковой метод для изучения регенераторного процесса после протезирующей герниопластики использовал Б.Б. Капустин с соавт. [2].
Цель исследования. оценка репаративных процессов в зоне установки импланта после лапароскопической паховой гернио-пластики в зависимости от материала используемого импланта.
Материалы и методы
В исследование были включены больные односторонней или двусторонней паховой грыжей, оперированные по плановым показаниям в рамках единой для групп исследования, стандартной лапароскопической процедуры. Во всех случаях больным выполнялась односторонняя или двусторонняя лапароскопическая трансабдоминальная преперитонеальная герниопластика (TAPP) по единому протоколу.
Для реализации цели исследования были выделены две группы больных, оперированных в Центральной клинической больнице Российской Академии наук (клиническая база кафедры госпитальной хирургии с курсом детской хирургии ФГАОУ ВО РУДН) (Москва) за период с апреля 2017 года до февраля 2021 года.
В первую группу (11 больных) были включены пациенты, у которых оперативное вмешательство выполнялось с применением титанового сетчатого импланта «Титановый шелк» (НПФ
«Темп», г. Екатеринбург, Россия), вторую группу (14 больных) составили пациенты, оперированные с использованием полипропиленового сетчатого импланта «Эсфил стандартный» (ООО «Линтекс», г. Санкт-Петербург, Россия).
Основные характеристики применяемых сетчатых имплантов показаны в таблице (табл. 1).
Таблица 1
Характеристики применяемых имплантов
Characteristics of the implants used
Table 1
|
Показатель Indicator |
Титановый сетчатый имплант, 1 группа Titanium mesh implant, Group 1 |
Полипропиленовый сетчатый имплант, 2 группа Polypropylene Mesh Implant, Group 2 |
|
Толщина нити, мкм Thread thickness, microns |
130 |
120 |
|
Толщина импланта, мкм Implant thickness, microns |
250–500 |
300–400 |
|
Объемная пористость, % Volumetric porosity, % |
96 |
80–85 |
|
Поверхностная плотность, г/м2 Surface density, g/m2 |
55–120 |
65–80 |
|
Размер ячейки, мм Cell size, mm |
0,5–2,0 |
1,0–2,0 |
Как следует из таблицы 1, применяемые импланты были сопоставимы по основным исходным структурным свойствам.
Для оценки репаративных процессов в зоне установки сетчатых имплантов применяли ультразвуковое исследование мягких тканей. Исследование выполнялось одним специалистом на аппарате экспертного уровня Voluson E8 (GE Healthcare, США) с использованием линейного датчика частотой 6–15 мГц /В-режим/ в первые дни (от 1 до 3 суток) после вмешательства, далее через 2 недели, а также через 2, 6 и 12 месяцев после операции.
Изучению подвергались пациенты, не имевшие в раннем послеоперационном периоде клинических признаков местных послеоперационных осложнений, с заживлением раны первичным натяжением. Кроме того, с целью лучшей визуализации зоны установки сетчатого импланта для ультразвукового исследования мы отбирали больных с первичной паховой грыжей и нормальной массой тела (индекс массы тела 18–24 кг/м2, толщина кожно-жировой складки на животе не более 2,5 см).
Ультразвуковые исследования в 1–3 сутки после операции выполняли в стационарных условиях, в более отдалённые сроки – амбулаторно.
При проведении ультразвукового исследования оценивалось состояние зоны установки импланта, характер воспалительных изменений с подтверждением или исключением осложнений в области размещения сетчатого импланта, а также оценка его самого импланта, в том числе – наличие или отсутствие визуализации ячеек импланта, размер ячеек импланта, толщина сформированного вокруг импланта соединительнотканного рубца. За «размер ячеек импланта» мы принимали расстояние между визуализируемыми при ультразвуковом исследовании узлами плетения изучаемых сетчатых имплантов (рис. 1, 2) или формирующимися вокруг соседних узлов плетения имплантов участками разрастания соединительной ткани (рис. 4, 6).
Каждому из 25 больных, вошедших в исследование, ультразвуковая оценка зоны установки сетчатого импланта выполнена во всех пяти контрольных временных точках, описанных выше.
Полученные данные обработаны методами вариационной статистики Фишера-Пирсона χ2 для номинальных данных, при общепринятом уровне значимости = 0,05. Для расчета достоверности различий в результатах использовали точный критерий Фишера для малых выборок. Результаты считали достоверными при р < 0,05. Статистический анализ основывали на результатах компьютерной обработки данных с использованием пакета статистических программ Microsoft Office Excel 2010 (Microsoft Corporation, США) и StatSoft STATISTICA Ver. 10 (StatSoft Inc., США).
Основные характеристики изучаемых групп больных указаны в таблице (табл. 2).
Таблица 2
Сравнительная характеристика групп
Comparative characteristics of groups
Table 2
|
Признак Sign |
1 группа, Group 1 |
2 группа, Group 2 |
р |
|
Пол: муж/жен Gender: male / female |
11/0 |
14/0 |
> 0,05 |
|
Средний возраст, лет Average age, years |
62,0±2,3 (от 53 до 71 года, from 53 to 71 years old) |
62,3±2,5 (от 54 до 81 лет, from 54 to 81 years old) |
> 0,05 |
|
Локализация паховой грыжи Localization of inguinal hernia |
|||
|
Правосторонняя Right - sided |
5 (45,5 %) |
7 (50 %) |
> 0,05 |
|
Левосторонняя Left - sided |
5 (45,5 %) |
6 (42,9 %) |
|
|
Двусторонняя Two-sided |
1 (9 %) |
1 (7,1 %) |
|
|
Размер грыжевых ворот, см Size of the hernia gate, cm |
|||
|
≤ 1,5 |
4 (36,4 %) |
5 (35,8 %) |
> 0,05 |
|
1,5–3,0 |
6 (54,6 %) |
8 (57,1 %) |
|
|
> 3,0 |
1 (9 %) |
1 (7,1 %) |
|
Продолжение Таблицы 2
|
Распределение по шкале ASA 1 Distribution by scale ASA 1 |
|||
|
I |
2 (18,1 %) |
1 (7,1 %) |
> 0,05 |
|
II |
5 (45,5 %) |
7 (50 %) |
|
|
III |
4 (36,4 %) |
6 (42,9 %) |
|
|
Продолжительность операции, мин. The duration of the operation, min. |
|||
|
Односторонняя герниопла-стика Unilateral hernioplasty |
68,1±7,7 (от 45 до 95, from 45 to 95) |
64,7±8,4 (от 50 до 100, from 50 to 100) |
> 0,05 |
|
Двусторонняя герниопластика Bilateral hernioplasty |
78 |
85 |
|
|
Продолжительность послеоперационного стационарного лечения, сут. The duration of postoperative inpatient treatment, day |
|||
|
Односторонняя герниопла-стика Unilateral hernioplasty |
3,1±0,3 (от 2 до 4, from 2 to 4) |
3,6±0,5 (от 2 до 4, from 2 to 4) |
> 0,05 |
|
Двусторонняя герниопластика Bilateral hernioplasty |
3 |
3 |
|
1 ASA – Американская ассоциация анестезиологов
1 ASA – American Association of Anesthesiologists
Как показано в таблице 2, статистически значимых отличий основных параметров изучаемых групп больных выявлено не было (р> 0,05), что говорит о сопоставимости групп.
Сочетанные операции больным этих групп не выполнялись, интраоперационных осложнений и конверсий доступа, а также послеоперационных осложнений в обеих группах не было.
Результаты
В первые трое суток после операции ультразвуковое исследование в обеих группах позволяло визуализировать структуру импланта в предбрюшинном пространстве, а также дифференцировать его ячейки (рис. 1, 2). Зона имплантации отличалась неоднородным и нечетким контуром, с участками гипоэхогенных включений.
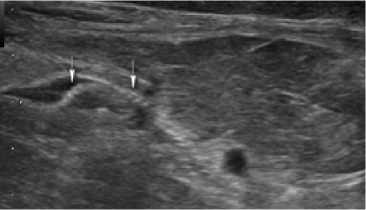
Рис. 1. Сонограмма зоны установки импланта в 1-е сутки после операции у больного М. 1-й группы (стрелками показаны ячейки титанового сетчатого импланта)
Fig. 1. Sonogram of the implant placement zone on the 1st day after surgery in a patient M. of group 1 (the arrows show the cells of the titanium mesh implant)
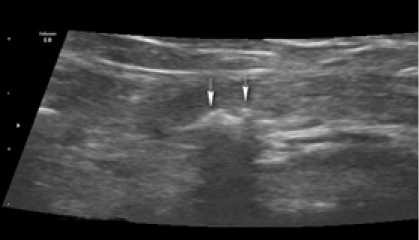
Рис. 2. Сонограмма зоны установки импланта в 1-е сутки после операции у больного Ф. 2-й группы (стрелками показаны ячейки полипропиленового сетчатого импланта)
Fig. 2. Sonogram of the implant placement zone on the 1st day after surgery in patient F. of group 2 (the arrows show the cells of the polypropylene mesh implant)
У 3 (27,3 %) больных 1-й группы и у 4 (28,6 %) больных 2-й группы в зоне установки импланта визуализировался экссудат в виде гипоэхогенных жидкостных зон с четкими контурами толщиной от 0,5 до 1,2 мм.
Повторный осмотр больных изучаемых групп был проведен через 2 недели после герниопластики. В обеих группах на этом сроке после вмешательства можно было выявить линейный эхосигнал, соответствующий размещенному импланту, а также оценить его структуру.
В группе больных, у которых был использован титановый сетчатый имплант, уже через 2 недели после операции ячейки этого импланта при ультразвуковом исследовании не дифференцировались (рис. 3), что позволяет предположить раннее начало репаративного процесса и интеграции импланта в ткани пациента. При разрастании соединительной ткани вокруг титановых сетчатых имплантов и выполнении ею ячеек имплантов сетчатая структура этих имплантов переставала визуализироваться на сонограммах.
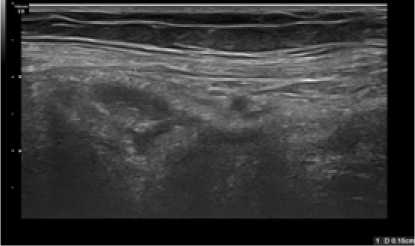
Рис. 3. Сонограмма зоны установки импланта через 2 недели после операции у больного П.1-й группы (в зоне имплантации определяется линейная структура без визуализации ячеек импланта)
Fig. 3. Sonogram of the implant placement zone 2 weeks after surgery in a patient Р. of group 1 (in the implantation zone, a linear structure is determined without visualization of the implant cells)
У больных, оперированных с применением полипропиленового сетчатого импланта, через 2 недели после вмешательства при ультразвуковом исследовании ячейки импланта были видны, при этом можно было оценить их размер (рис. 4) указано стрелками.
Через 2 месяца после операции эхогенность зоны установки импланта была сходна с эхогенностью соединительной ткани (рис. 5, 6). Зона периимплантационного рубца имела достаточно четкие контуры, при сохранившейся неоднородности структуры.
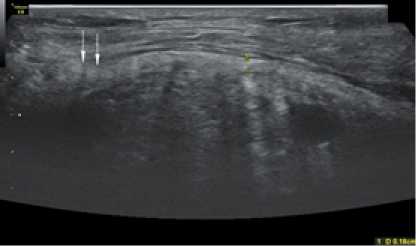
Рис. 4. Сонограмма зоны установки импланта через 2 недели после операции у больного П. 2-й группы (объяснение в тексте)
Fig. 4. Sonogram of the implant placement zone 2 weeks after surgery in a patient Р. of group 2 (explanation in the text)
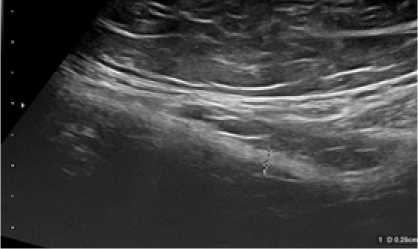
Рис. 5. Сонограмма зоны установки импланта через 2 месяца после операции у больного Г.1-й группы (объяснение в тексте)
Fig. 5. Sonogram of the implant placement zone 2 months after surgery in a patient G. of group 1 (explanation in the text)
Как показано на рисунках 3 и 4, вокруг импланта в обеих группах сохранялись признаки асептического воспаления, неоднородность ткани и нечеткость контуров воспалительного инфильтрата с наличием гипоэхогенных участков.
У больных 1-й группы через 2 недели после операции ни в одном случае не было сонографических изменений, которые можно было расценить как осложнение хирургического вмешательства. Напротив, у 5 больных 2-й группы (35,7 %) на этом сроке после операции были выявлены участки экссудации в области семенного канатика, в том числе с эхонеоднородной ячеистой структурой, размерами от 3,0×2,0×1,0 до 8,2×3,0×4,0 см, при этом клинических проявлений у этих больных не было. Всем этим 5 больным 2 группы выполнена пункция жидкостных скоплений с эвакуацией от 5 до 80 мл прозрачного экссудата. Одного пациента пунктировали дважды, у остальных 4 пациентов пункция выполнялась однократно.
Соответственно, применение при лапароскопической паховой герниопластике полипропиленовых сетчатых имплантов сопровождается у 35,7 % пациентов появлением в зоне имплантации остаточной экссудации через 2 недели после вмешательства, в отличие от аналогичных операций с использованием титановых сетчатых имплантов, где в эти сроки ни у одного из обследованных пациентов остаточной экссудации в зоне имплантации не наблюдалось.
Таким образом, отсутствие через 2 недели после лапароскопической паховой герниопластики с применением титанового сетчатого импланта визуализации ячеек импланта и зон остаточной экссудации, говорит о более раннем начале репаративных процессов при использовании этого типа имплантов, в сравнении с пациентами, у которых применяли полипропиленовый сетчатый имплант.
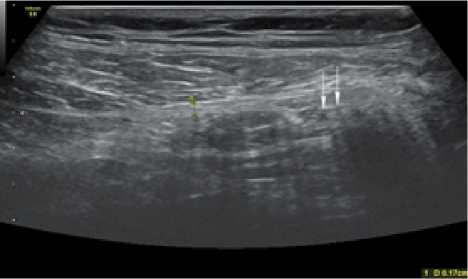
Рис. 6. Сонограмма зоны установки импланта через 2 месяца после операции у больного К. 2-й группы (объяснение в тексте)
Fig. 6. Sonogram of the implant placement zone 2 months after surgery in patient K. of group 2 (explanation in the text)
У пациентов 2 группы в указанном сроке после операции всё ещё сохранялась визуализация ячеек импланта, (рис. 6) указанная стрелками. Эхо-признаков местных осложнений перенесенной операции через 2 месяца после вмешательства не было, в том числе не было выявлено признаков остаточной экссудации вокруг семенного канатика у больных 2-й группы, описанных ранее.
Через 6 месяцев после лапароскопической паховой гер-ниопластики периимплантационный рубец в обеих группах визуализировался в виде гиперэхогенной структуры линейной, либо слегка волнообразной формы (рис. 7, 8). Только к данному сроку у пациентов 2 группы отсутствовала визуализация ячеек полипропиленовых имплантов (рис. 8). Прерывистый ход периимплантационного рубца в обеих группах пациентов отсутствовал.
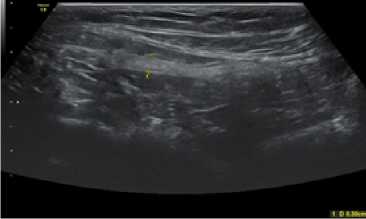
Рис. 7. Сонограмма зоны установки импланта через 6 месяцев после операции у больного К. 1-й группы (объяснение в тексте)
Fig. 7. Sonogram of the implant placement zone 6 months after surgery in patient K. of group 1 (explanation in the text)
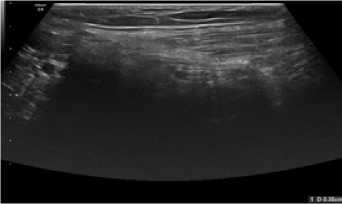
Рис. 8. Сонограмма зоны установки импланта через 6 месяцев после операции у больного П. 2-й группы (объяснение в тексте)
Fig. 8. Sonogram of the implant placement zone 6 months after surgery in a patient К. of group 2 (explanation in the text)
Как видно на рисунках 7 и 8, через 6 месяцев после вме- шательства при ультразвуковом исследовании зона установки имплантов не отличалась между группами, т.е. сонографическая картина к данному сроку была схожей при применении сетчатых имплантов из разных материалов (титановый сплав или полипропилен).
Спустя значительные сроки после лапароскопической паховой герниопластики (12 месяцев) в обеих изучаемых группах периимплантационный рубец визуализировался в виде гиперэхогенной структуры волнообразной или линейной формы. Примеры сонограмм пациентов обеих групп через 12 месяцев после операции показаны на рисунках 9 и 10.
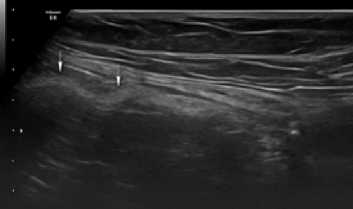
Рис. 9. Сонограмма зоны установки импланта через 12 месяцев после операции у больного П.1-й группы (объяснение в тексте) Fig. 9. Sonogram of the implant placement zone 12 months after surgery in a patient Р. of group 1 (explanation in the text)
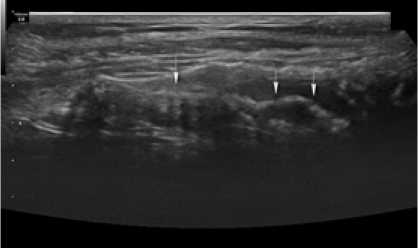
Рис. 10. Сонограмма зоны установки импланта через 12 месяцев после операции у больного Г. 2-й группы (объяснение в тексте) Fig. 10. Sonogram of the implant placement zone 12 months after surgery in a patient G. of group 2 (explanation in the text)
Как можно видеть на рисунке 9, через 12 месяцев после установки титанового сетчатого импланта вокруг последнего формировался однородный соединительнотканный рубец, чётко визуализируемый при ультразвуковом исследовании.
В отличии от этого, у 4 (28,6 %) больных 2-й группы в зоне имплантации выявлялись эхонеоднородные участки, а также отмечался прерывистый ход контура периимплантационного рубца (рис. 10) указанного стрелками, что косвенно свидетельствует о продолжающихся регенераторных процессах через 12 месяцев после операции в случае использования полипропиленовых сетчатых имплантов и говорит о неполной интеграции полипропиленовых имплантов в ткани пациента.
Обобщённые результаты сравнительного ультразвукового исследования, проведенного во всех пяти контрольных временных точках после лапароскопической трансабдоминальной преперитонеальной паховой герниопластики (ТАРР), показаны в таблице (табл. 3).
Как следует из представленной таблицы 3, ячейки титановых сетчатых имплантов (1 группа больных) переставали визуализироваться уже через 2 недели после операции, а полипропиленовых сетчатых имплантов (2 группа больных) – только через 6 месяцев после вмешательства. По толщине формирующегося периимплантационного рубца статистически значимые отличия между изучаемыми группами пациентов получены только через 12 месяцев после операции: вокруг титановых сетчатых имплантов формировался более толстый соединительнотканный рубец (р < 0,05).
Заключение
Полученные результаты ультразвукового исследования зон установки имплантов показали, что оба сравниваемых в исследовании сетчатых импланта обеспечивают хорошую репарацию тканей с формированием периимплантационно-го рубца однородной линейной или слегка волнообразной структуры, но скорость репаративных процессов в случае применения титанового сетчатого импланта выше. Использование титановых сетчатых имплантов сопровождалось более ранним прорастанием ячеек импланта соединительной тканью (через 2 недели после операции), что говорит о лучшей интеграции этого типа имплантов в ткани организма, в сравнении с полипропиленовыми сетчатыми имплантами (ячейки этого типа имплантов переставали дифференцироваться при ультразвуковом исследовании только через 6
месяцев после вмешательства). Проведенный анализ выявил формирование остаточной экссудации у 35,7 % пациентов в ранние сроки (через 2 недели) после операции при использовании полипропиленового сетчатого импланта, причем клинических проявлений скопления экссудата ни в одном случае выявлено не было. Через 2 месяца после операции скоплений экссудата в зоне установки полипропиленовых сетчатых имплантов не зафиксировано.
Таблица 3
Результаты ультразвуковой оценки зоны установки импланта в различные сроки после лапароскопической паховой герниопластики
Results of ultrasound evaluation of the implant placement area at various times after laparoscopic inguinal hernioplasty
Table 3
|
Сроки после операции Timing after surgery |
Группа больных Group of patients |
Визуализация ячеек импланта Visualization of implant cells |
Размер ячеек импланта, мм /М±м/ The size of the implant cells, mm /М±м/ |
Толщина периимплантационного рубца, мм /М±м / (мин. – макс.) Thickness of the peri-implantation scar, mm /М±м / (min – max) |
|
1-е – 3-и сутки 1st – 3rd day |
1 |
Да Yes |
0,7±0,15 (от 0,4 до 1,0, from 0,4 to 1,0) |
1,7±0,2 (от 1,4 до 2,0, from 1,4 to 2,0)** |
|
2 |
Да Yes |
0,8±0,2 (от 0,5 до 1,2, from 0,5 to 1,2) |
1,6±0,15 (от 1,3 до 1,9, from 1,3 to 1,9)** |
|
|
2 недели 2 weeks |
1 |
Нет No |
– |
2,5±0,3 (от 1,8 до 4,0, from 1,8 to 4,0) |
|
2 |
Да Yes |
0,6±0,3 (от 0,2 до 1,1, from 0,2 to 1,1) |
2,0±0,2 (от 1,7 до 2,7, from 1,7 to 2,7) |
|
|
2 мес. 2 months |
1 |
Нет No |
– |
2,6±0,4 (от 1,8 до 4,0, from 1,8 to 4,0) |
|
2 |
Да Yes |
0,6±0,3 (от 0,2 до 1,0, from 0,2 to 1,0) |
2,1±0,3 (от 1,7 до 2,7, from 1,7 to 2,7) |
|
|
6 мес. 6 months |
1 |
Нет No |
– |
3,0±0,3 (от 2,4 до 3,6, from 2,4 to 3,6) |
|
2 |
Нет No |
– |
2,8±0,2 (от 2,1 до 3,2, from 2,1 to 3,2) |
|
|
12 мес. 12 months |
1 |
Нет No |
– |
2,5*±0,2 (от 2,0 до 3,1, from 2,0 to 3,1) |
|
2 |
Нет No |
– |
1,25±0,1 (1,1–1,5 от 1,1 до 1,5, from 1,1 to 1,5) |
* – р < 0,05 между группами 1 и 2 на данном сроке исследования
* – р < 0,05 between groups 1 and 2 at this time of the study
** – толщина зоны имплантации
** – thickness of the implantation zone
В отдаленные сроки после вмешательства (через 12 месяцев) использование титанового сетчатого импланта обеспечивает, по данным ультразвукового исследования, формирование более толстого и однородного периимплантационного рубца, в отличие от пациентов 2-й группы, у 28,6 % из которых были выявлены эхо-признаки продолжающихся репаративных процессов вокруг установленного полипропиленового сетчатого импланта, а контур периимплантационного рубца был прерывистым.
Полученные при ультразвуковом исследовании данные говорят о преимуществе титановых сетчатых имплантов над полипропиленовыми при выполнении лапароскопической герниопластики у больных паховыми грыжами.
Список литературы Ультразвуковая оценка репаративных процессов в зоне установки титановых сетчатых имплантов после лапароскопической паховой герниопластики
- Винник Ю. С., Петрушко С. И., Миллер С. В., Яковлев А. В., Назарьянц Ю. А. Сравнительная характеристика вживаемости сетчатых эндопротезов в лечении послеоперационных вентральных грыж. // Сибирское медицинское обозрение, 2007. № 4 (45). С. 32-35.
- Капустин Б. Б., Мингазова Г. Ф., Елхов И. В., Анисимов А. В. Ультразвуковой мониторинг регенеративного процесса у пациентов с протезирующей герниопластикой. Современные проблемы науки и образования, 2012. № 2. С. 76.
- Харитонов С. В., Зинякова М. В. Эхосемиотика неосложненного раневого процесса после пластики пахового канала различными видами синтетических имплантатов. Хирургия. Журнал им. Н. И. Пирогова, 2012. № 12. С. 27-33.
- Харитонов С. В., Кузнецов Н. А., Зинякова М. В. Роль ультразвукового сканирования в определении вида пластики передней брюшной стенки у больных с вентральными грыжами. Хирург, 2013. № 4. С. 17-23.
- Bloemen A., van Dooren P., Huizinga B. F., Hoofwijk A. G. Comparison of ultrasonography and physical examination in the diagnosis of incisional hernia in a prospective study. Hernia, 2012, Feb; 16 (1), рр. 53-57.
- den Hartog D., Dur A. H., Kamphuis A. G., Tuinebreijer W. E., Hermans J. J., Kreis R. W. Pre-, intra-, and postoperative sonography of the abdominal wall in patients with incisional hernias repaired via a three-layered operative suture method. J Clin Ultrasound, 2009, Sep; № 37 (7). рр. 394-398.
- Jamadar D. A., Jacobson J. A., Girish G., Balin J., Brandon C. J., Caoili E. M., Morag Y., Franz M. G. Abdominal wall hernia mesh repair: sonog-raphy of mesh and common complications. J Ultrasound Med, 2008, Jun; № 27 (6), рр. 907-917.
- Petter-Puchner A., Gruber-Blum S., Walder N., Fortelny R. H., Redl H., Raum K. Ultrasound biomicroscopy (UBM) and scanning acoustic microscopy (SAM) for the assessment of Hernia mesh integration: a comparison to standard histology in an experimental model. Hernia, 2014, Aug; № 18 (4), рр. 579-585.


