Ультразвуковое исследование при планировании операций по поводу меланомы кожи конечностей
Автор: Максимова Наталья Александровна, Пржедецкий Юрий Валентинович, Хохлова Ольга Викторовна, Позднякова Виктория Вадимовна, Ильченко Мария Геннадьевна, Максимова Мария Игоревна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 1 т.18, 2019 года.
Бесплатный доступ
Проведен ретроспективный анализ ультразвуковых исследований у 42 больных меланомой кожи конеч-ностей при планировании закрытия кожного дефекта островковыми кожно-фасциальными лоскутами на перфорантных сосудах. Вначале выполнялось УЗИ первичного очага меланомы для уточнения характе-ристик кожи, опухоли, прилежащих тканей. Затем осуществлялся поиск перфорантных сосудов для их маркировки и определения расположения островковых лоскутов. УЗИ выполнены на экспертных аппаратах «IU 22 PHILIPS», GE «Logiq E9», «Supersonic imagine AIxPLORER multi Wave» линейными мультичастот-ными датчиками (5-17 мГц) в В-режиме, цветовом и энергетическом картировании кровотока. Уточнены критерии необходимых и достаточных параметров по результатам сонодопплерографической визуализации для хирургического лечения меланомы кожи конечностей по предлагаемому способу в предоперацион-ном периоде и мониторинг состояния лоскутов после операции. Было установлено, что перемещение лоскутов на перфорантных сосудах не приводило к нарушениям кровотока в них: до операции средняя скорость артериального кровотока составила 13,1±4,7 см/с, после операции - 12,8±5,4 см/с. Максималь-ная венозная скорость до операции в среднем была 7,0±1,3 см/с, после операции - 6,2±0,8 см/с. Таким образом, триплексное сканирование значительно облегчает выбор и индивидуальный дизайн лоскута с включением в него питающих сосудов достаточного потенциала, существенно помогает в планировании операции, снижет риск неудач и способствует улучшению результатов лечения. Данный метод способ-ствует повышению радикальности хирургического вмешательства с одновременным снижением риска послеоперационных осложнений, ускорением медицинской и социальной реабилитации больных.
Ультразвуковое исследование, кожно-фасциальный лоскут, перфорантные сосуды, меланома кожи, реконструктивно-пластическая операция, сонодопплерография, перфорантные лоскуты, послеоперационный период, триплексное уз сканирование
Короткий адрес: https://sciup.org/140254029
IDR: 140254029 | УДК: 616.5-006.81-089.844-073.43 | DOI: 10.21294/1814-4861-2019-18-1-95-102
Текст научной статьи Ультразвуковое исследование при планировании операций по поводу меланомы кожи конечностей
Меланома кожи является одной из самых агрессивных злокачественных опухолей человека с непредсказуемым течением. Хотя удельный вес ее составляет не более 10 % среди всех форм ЗНО кожи, она является причиной 80 % летальных ис‑ ходов в данной группе пациентов [1, 2]. Частота возникновения злокачественной меланомы в раз‑ личных странах мира возрастает в среднем в 2 раза каждые 15 лет [3].
Ведущим этапом комплексного лечения мела‑ номы кожи является хирургический метод. При широком иссечении меланомы кожи зачастую появляются сложности закрытия возникающего дефекта [2]. Наиболее проблемной зоной для пластического закрытия кожного дефекта явля‑ ется область верхних и нижних конечностей, при том, что доля больных с данной локализацией опухоли составляет 73,4 % . Местных тканей, как правило, оказывается недостаточно, а выполнение свободной кожной пластики ограничено из‑за не‑ благоприятных условий приживления свободного лоскута, обусловленных особенностями ложа трансплантата и трудностями иммобилизации и фиксации лоскута [4].
Сохранение жизнеспособности перемещен‑ ных тканевых фрагментов с их первичным при‑ живлением в воспринимающем ложе – одна из стратегических задач пластической операции. Ее эффективное решение в значительной степе‑ ни зависит от точной оценки кровообращения в перемещаемых тканях, а также от тщательности планирования операции [5].
В зарубежной литературе встречается много со‑ общений об успешном применении перфорантных лоскутов для закрытия мягкотканных дефектов конечностей [6]. Немаловажно, что формирование таких лоскутов не связано с большой травматиза‑ цией донорской зоны, а значит, сопровождается не‑ продолжительным послеоперационным периодом. Сложность затрагиваемой проблемы инициировала поиск наиболее оптимальных хирургических вме‑ шательств при данной локализации опухоли. Для подобных ситуаций возможно применение способа замещения возникающих дефектов островковыми кожно‑фасциальными лоскутами на перфорантных сосудах.
Лоскуты произвольной формы являются наи‑ более частыми видами пластического материала, используемого для реконструкции на уровне под‑ кожного жира (эпифасциальные) или на уровне фасции (субфасциальные) . Их артериальное кро‑ воснабжение осуществляется перфорирующими мышечно‑кожными сосудами основания лоскута, исходящими из сегментарных сосудов, лежащих под мышцей, и проникающими через фасцию в подкожный слой. Кровоток в свободной части лоскута обеспечивается анастомозами между глубоким дермально‑субдермальным сплетением и более поверхностным сплетением сосочкового слоя дермы. От точности представлений о лока‑ лизации питающих лоскут сосудов могут зависеть продолжительность операции, ее травматичность и даже возможность успешного выделения ком‑ плекса тканей [5].
Цель исследования – изучение возможностей ультразвукового исследования в планировании этапов хирургического лечения меланомы кожи конечностей.
Материал и методы
В исследовании 42 больным меланомой кожи конечностей закрытие кожного дефекта выполня‑ лось островковыми лоскутами на перфорантных сосудах. Критериями отбора пациентов были размеры опухоли, по ширине не превышающие 1/3 диаметра конечности, наличие перфорантных сосудов в зонах интереса. Большинство пациентов составили женщины – 24 (57,2 %), мужчины – 18 (42,8 %). Возраст больных находился в диапазоне от 23 до 78 лет. Поверхностная форма меланомы наблюдалась у 5 (11,9 %) больных, узловая форма – у 37 (88,1 %). По локализации злокачественных новообразований кожи конечностей больные были распределены следующим образом: голень – 19 (45,2 %) больных, предплечье – 12 (28,5 %), плечо – 7 (16,6 %), бедро – 4 (9,5 %) пациента. Стадия про‑ цесса уточнялась после гистологического исследо‑ вания первичного очага меланомы. В зависимости от уровня инвазии по Clark и толщины опухоли по
Breslow I стадия диагностирована – у 6 (14,3 %) пациентов, II стадия – у 14 (33,3 %), III стадия – у 22 (52,4 %) больных.
Ультразвуковые исследования первичного очага меланомы и предлагаемой донорской зоны – поиск перфорантных сосудов с оценкой кровоснабжения будущих лоскутов, а также в послеоперационном периоде, на 5–7‑е сут, в режимах ЦДК, ЭДК, ДМ выполнялись на аппаратах «IU 22 PHILIPS», GE «Logiq E9», «Supersonic imagine AIXPLORER multi Wave» широкополосными линейными муль‑ тичастотными датчиками с диапазоном частот 5–17 МГц. При планировании операции оценку будущего раневого дефекта осуществляли на осно‑ вании принципов онкохирургии с учетом размеров, формы, глубины инвазии опухоли и состояния тканей с учетом перенесенных операций, лучевой терапии и других факторов.
При УЗИ первичного очага на первом этапе оценивали: 1) толщину неизмененной кожи в зоне локализации образования; 2) форму образования, (округлая, правильная, неправильная), глубину инвазии опухоли – эпидермальная, внутрикожная, подкожная; 3) размеры образования – ширина, толщина; 4) эхогенность и структуру образования; 5) нижнюю границу образования (без инвазии, инвазия в кожу или подкожную клетчатку); 6) ка‑ чественные и количественные гемодинамические параметры кровотока сосудов внутри опухоли. При ЦДК и ЭДК оценивалось количество локусов кро‑ вотока (цветовых пикселей), топография зон нео‑ васкуляризации (центральная, периферическая, смешанная) и интенсивность кровотока (гипоин‑ тенсивная, изоинтенсивная, гиперинтенсивная). При спектральной допплерографии изучались такие показатели кровотока, как максималь‑ ная систолическая скорость (МАС) (низкая – до 5 см/с, средняя – 5,1–10,0 см/с, высокая – от 10,1 см/с и более) и тип кровотока (артериальный, венозный) (рис. 1–4) [7].
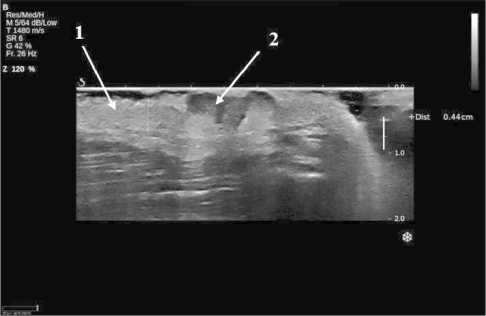
Рис. 1. Эхограмма в В-режиме мягких тканей левого плеча. Измерение толщины интактной кожи вблизи образования (0,44 см). Интактная кожа (стрелка 1), образование (стрелка 2)
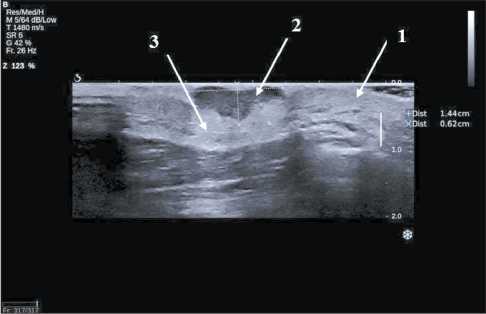
Рис. 2. Эхограмма новообразования кожи в В-режиме. Форма образования округлая неправильная с внутрикожной локализацией, размеры образования 1,44×0,63 см, пониженная эхогенность, неоднородная эхо-структура, нижняя граница образования достигает клетчатки. Интактная кожа (стрелка 1), образование (стрелка 2), подкожная жировая клетчатка (стрелка 3)
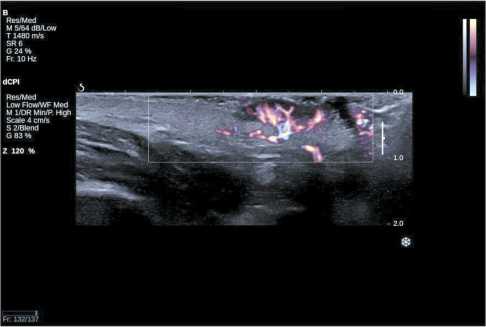
Рис. 3. Эхограмма образования кожи в режиме ЭДК: гиперваскуляризация в центральной и периферической зонах образования, перифокальных латеральных и горизонтальных областях
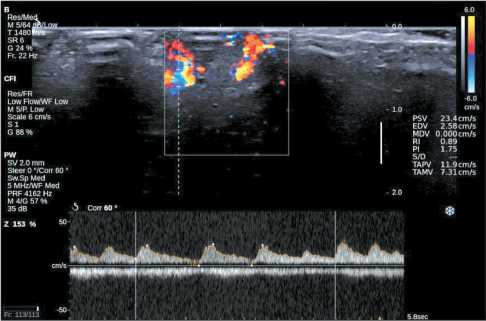
Рис. 4. Эхограмма образования кожи в режиме ЦДК при ДГ: регистрируется артерио-артериальный кровоток с высокой МАС в сосудах опухоли (23,4 см/с)
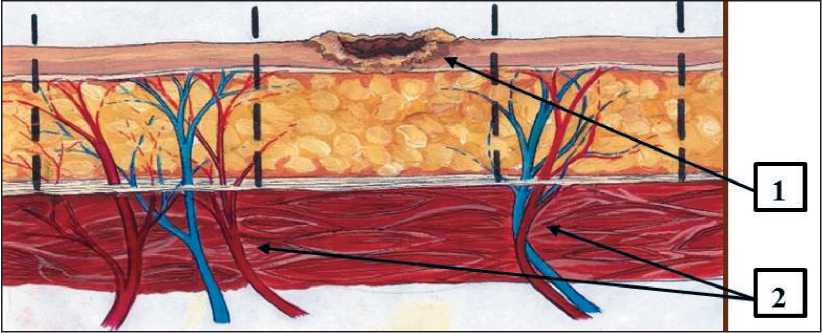
Рис. 5. Предоперационная разметка с учетом ангиоархитектоники донорской зоны. Опухоль (стрелка 1), перфорантные сосуды (стрелка 2)
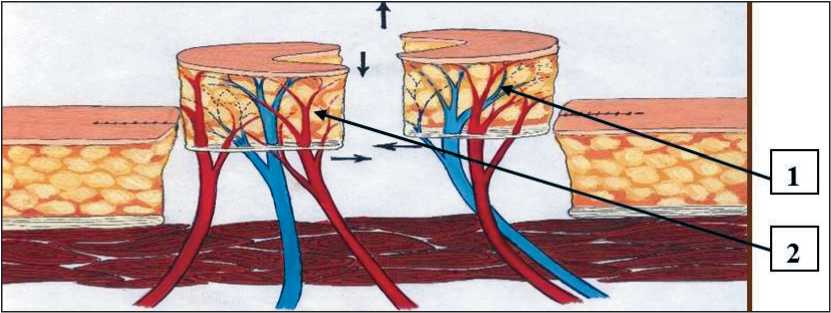
Рис. 6. Удален патологический очаг, выкроены и мобилизованы подковообразные лоскуты на перфорантных сосудах. Стрелками 1, 2 указаны кожно-мышечные лоскуты на перфорантных сосудах
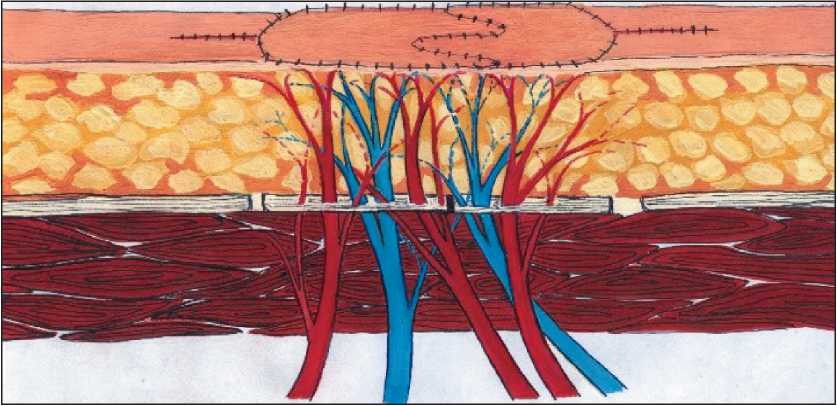
Рис. 7. Послеоперационный дефект закрыт, донорские раны ушиты
В предоперационном периоде выполняли пред‑ варительную разметку. Принимая во внимание непостоянство сосудистой анатомии конечностей, непосредственно перед операцией выполняли уль‑ тразвуковую допплерографию и допплерометрию предполагаемой донорской зоны с целью детекции перфорантных сосудов. При визуализации пер‑ форанта, используя цветовое и энергетическое допплеровское картирование, изучались качествен‑ ные и количественные параметры гемодинамики предполагаемой донорской зоны (размеры, число и тип сосудов). При этом применялась методика мультилокусной допплерометрии с учетом параме‑ тров максимальных артериальных (максимальная артериальная скорость – МАС) и венозных потоков (максимальная венозная скорость – МВС). Далее производили маркировку выявленных перфора‑ торов на коже под УЗ‑контролем, корректировали разметку лоскутов, принимая во внимание ангио‑ архитектонику донорской зоны (рис. 5).
Под местной анестезией производили иссече‑ ние патологического очага, отступя на расстояние, обеспечивающее радикальность его удаления. На противоположных сторонах дефекта, учитывая расположение перфорантных сосудов, выкраива‑ ли треугольные или подковообразные лоскуты. Лоскуты подвергались дальнейшей мобилизации путем просечения клетчатки и мышечной фасции, затем тупым путем отделяли кожно‑фасциальный лоскут от подлежащих тканей с сохранением целостности питающих сосудов (рис. 6).
Осуществляли тщательный гемостаз в бипо‑ лярном режиме. Это принципиальное положение, так как использование монополярной коагуляции неизбежно повлечет коагуляцию питающих пер‑ форантных сосудов. Состояние кровообращения выделенных на сосудистых ножках лоскутов опре‑ деляли с помощью двух основных клинических симптомов: цвета кожи и капиллярного ответа на пальцевое прижатие. После этого лоскуты смещали к центру, укрывали область дефекта прямо или со смещением и сшивали одиночными швами между собой. Края донорской раны мобилизовывали, дистальные отделы ушивали одиночными швами, до появления легкого натяжения, далее лоскуты вшивали одиночными швами в оставшийся раневой дефект (рис. 7). Пространство под лоскутами дре‑ нировали резиновыми выпускниками для предот‑ вращения компрессии сосудистой ножки раневым отделяемым. Швы снимали на 12–16‑е сут.
В ходе исследования мы пришли к выводу, что наиболее экономичным является циркулярный разрез, так как он позволяет отступить от патологи‑ ческого очага на равное расстояние со всех сторон без напрасного удаления интактных окружающих тканей.
На 5–7‑е сут послеоперационного периода в режимах ЦДК, ЭДК производилась регистрация параметров пульсовой волны в перемещенных ло‑ скутах, что давало возможность оценить функцию перфорантных сосудов.
Результаты и обсуждение
Меланомы кожи характеризовались пони‑ женной эхогенностью в 100 % наблюдений. УЗИ первичного очага меланомы кожи позволило определить степень распространенности опухоли и глубину инвазии по Breslow (точность – 92,3 %) [8]. Поверхностно‑распространяющиеся меланомы кожи в 100 % наблюдений имели аваскулярный тип изображения в режимах ЦДК, ЭДК. Узловые фор‑ мы меланомы кожи характеризовались наличием артерио‑артериального типа кровотока (100 %) вы‑ сокой и средней интенсивности (95 %). Типичным изображением в режимах ЦДК, ЭДК для узловых меланом кожи был специфический ультразвуко‑ вой признак – разветвленная сосудистая сеть с множественными сосудами разнокалиберных диа‑ метров с патологическими анастомозами и псев‑ допульсацией, типичными для неоангиогенеза. У пациентов с узловой формой меланомы диапазон максимальных артериальных скоростей составил от 5,3 до 47,8 см/с с индексом периферического со‑ судистого сопротивления 0,2–0,7 (среднее значение ИР – 0,45). Данные допплеровские критерии рас‑ ценены как надежные диагностические признаки узловой меланомы кожи.
Нами чаще использовались непостоянные перфорантные сосуды, что было связано с много‑ образием локализации патологического процесса, а также меньшим постоянством сосудистой топо‑ графии конечностей по сравнению с туловищем. Таким образом, планировать реконструктивно‑ пластическую операцию без предварительного допплерографического контроля сосудов донор‑ ской области невозможно, результат может ока‑ заться непредсказуемым. Наиболее постоянными перфорантными сосудами топографически в ходе исследования явились следующие:
-
1) на передней поверхности бедра – перфоранты бедренной и коленных артерий;
-
2) на латеральной поверхности бедра – перфо‑ ранты глубокой бедренной артерии;
-
3) на задней поверхности бедра – перфоранты подколенной артерии и медиальной артерии, оги‑ бающей бедренную кость (табл. 1).
Внутренний диаметр перфорантных сосудов колебался от 1 до 3 мм (рис. 8) (табл. 2, 3). Нами использовались артериальные перфоранты, диа‑ метр которых превышал 1 мм. Линейная скорость кровотока варьировала от 5 см/с до 28 см/с (в среднем – 13,1 ± 4,7 см/с), МВС – от 5 до 9 см/с
Особенности топографической анатомии перфорантных артерий конечностей
таблица 1
Распределение перфорантных артерий по диаметру
Диаметр перфорантных артерий, мм
1,0–1,6
1,7–2,3
2,4–3,0
Абсолютное число перфорантных артерий (n=110)
58 (52,7 %)
38 (34,6 %)
14 (12,7 %)
таблица 3
Распределение перфорантных вен по диаметру
Диаметр перфорантных вен, мм
Абсолютное число перфорантных артерий (n=106)
1,0–1,6
1,7–2,3
2,4–3,0
43 (40,6 %)
42 (39,6 %)
21 (19,8 %)
таблица 4
Допплерометрические параметры максимальной артериальной скорости кровотока в перфорантных артериях до и после операции
Допплерометрические параметры максимальной венозной скорости кровотока в перфорантных венах до и после операции
|
Максимальная венозная скорость, см/с |
До операции (n=106) |
После операции (n=106) |
|
5 |
7 |
8 |
|
6 |
29 |
28 |
|
7 |
34 |
35 |
|
8 |
32 |
31 |
|
9 |
4 |
4 |
|
Среднее значение |
7,0 ± 1,3 |
6,2 ± 0,8 |
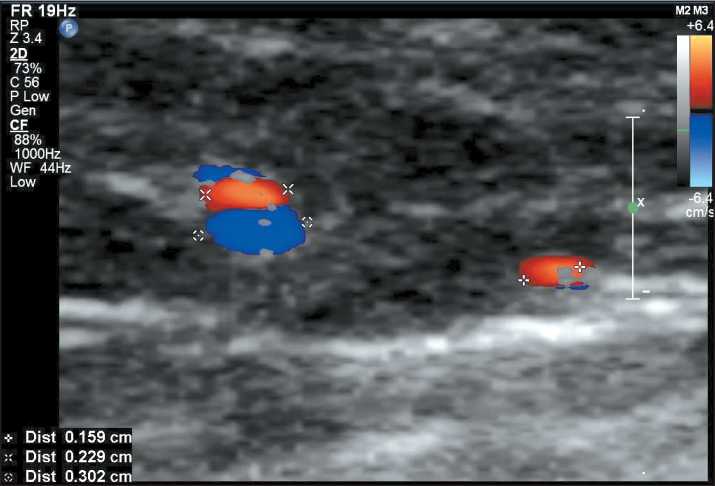
Рис. 8. Эхограмма мягких тканей плеча в режиме ЦДК: визуализируются три перфоратных сосуда, диаметром 0,16, 0,23 и 0,3 см
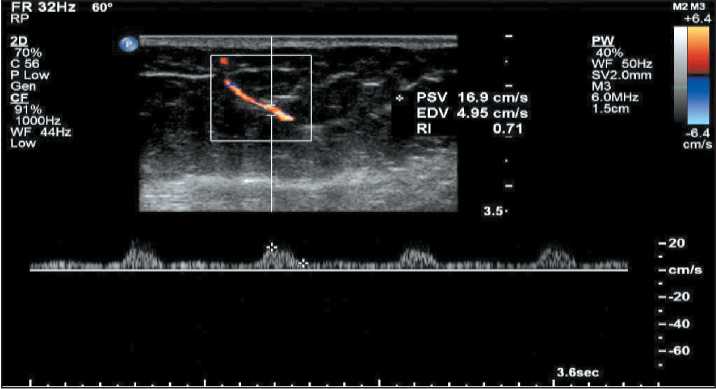
Рис. 9. Эхограмма перфорантной артерии в режиме ЦДК – пиковая систолическая скорость (PSV) 16,9 см/с, конечная диастолическая скорость (EDV) 4,95 см/с, ИР=0,71
(в среднем – 7,0 ± 1,3 см/с), ИР – от 0,7 до 1,0 (в среднем – 0,8 ± 0,14) (рис. 9).
В послеоперационном периоде на 5–7‑е сут проводили контрольное УЗИ с определением па‑ раметров кровотока перфорантных сосудов. После операции не наблюдалось гемодинамически значи‑ мых нарушений кровотока (табл. 4, 5).
При оценке хирургических результатов учиты‑ вались послеоперационные осложнения. Из них наиболее частыми явились преходящая тотальная ишемия одного из встречных лоскутов, которая развилась в 5 (11,9 %) наблюдениях, и краевой некроз дистального лоскута – в 3 (7,1 %) случаях. Ишемия во всех случаях была ликвидирована на 5–7‑е сут. Вероятно, основной причиной ишеми‑ ческих изменений при этом способе пластики явилось нарушение трофики лоскутов вследствие атеросклеротической трансформации и/или на‑ тяжения сосудов. При этом во всех случаях раны зажили без дополнительных хирургических вме‑ шательств. На функциональные и косметические результаты эти осложнения повлияли незначитель‑ но. Полного некроза лоскута не наблюдалось.
При оценке эстетических результатов пред‑ ложенного метода можно отметить, что пациенты были в большей степени удовлетворены внешним видом послеоперационных рубцов (92,8 %). Как правило, формировался нормотрофический эла‑ стичный рубец, ширина которого после созревания не превышала 0,3 см.
В онкологии одним из основных критериев оценки эффективности любого метода лечения являются результаты безрецидивной выживаемо‑ сти. В данном случае в течение 2 лет ни в одном наблюдении не возникли местные рецидивы.
Таким образом, предлагаемый способ исполь‑ зует площадь окружающей кожи на 100 %. При этом удаляется только потенциально скомпроме‑ тированная кожа вокруг патологического очага. Лоскуты, васкуляризированные перфорантными сосудами, обладают высокой жизнеспособностью, идентичны по цвету и текстуре коже реципиент‑ ной области. Непосредственная близость к вос‑ принимающей зоне способствует минимальной деформации донорской области.
В настоящее время УЗИ с режимами ЭДК, ЦДК является основным методом предоперационной диагностики зон выхода перфораторов из мышцы в жировую клетчатку, так как является доступным, информативным, недорогим, неинвазивным иссле‑
Список литературы Ультразвуковое исследование при планировании операций по поводу меланомы кожи конечностей
- Пак Д.Д., Лазутина Т.Н. Опухоли кожи. Онкология, национальное руководство. М., 2014. 848-863. [Pak D.D., Lazutina T.N. Skin Tumors. Oncology, National Guideline. Moscow, 2014. 848-863. (in Russian)].
- Кит О.И., Дашкова И.Р., Ващенко Л.Н. Использование реконструктивно-пластических операций в лечении злокачественных опухолей. Новочеркасск. 2017; 192-202. [Kit O.I., Dashkova I.R., Vashchenko L.N. The use of reconstructive plastic surgery in the treatment of malignant tumors. Novocherkassk. 2017; 192-202. (in Russian)].
- Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2015. CA Cancer J Clin. 2015 Jan-Feb; 65 (1): 5-29. DOI: 10.3322/caac.21254
- Азимова Р.Б., Соболевский В.А. Перфорантные лоскуты в хирургическом лечении злокачественных опухолей кожи и мягких тканей голени и стопы. Саркомы костей, мягких тканей и опухоли кожи. 2016; 2: 54-60. [Azimova R.B., Sobolevsky V.A. Propeller perforator flaps in distal lower leg: evolution and clinical applications. Sarcomas of Bones, Soft Tissues and Skin Tumors. 2016; 2: 54-60. (in Russian)].
- Гарелик Е.И., Гилева К.С., Абдуллаев К.Ф., Васильев Е.А., Орлова Е.В. Топографо-анатомическое исследование переднебокового лоскута бедра на перфорантных сосудах. Анналы пластической, реконструктивной и эстетической хирургии. 2016; 4: 20-26. [Garelik E.I., Gileva K.S., Abdullaev K.F., Vasiliev E.A., Orlova E.V. Anatomic exploration of the anterolateral thigh perforator flap. Annals of Plastic, Reconstructive and Aesthetic Surgery. 2016; 4: 20-26. (in Russian)].
- Hwang K.T., Kim Y.H. Double skin perforator flaps for aesthetic resurfacing of extensive limb defects. J Plast Reconstr Aesthet Surg. 2015 Feb; 68 (2): e47-9. DOI: 10.1016/j.bjps.2014.10.051
- Максимова Н.А., Позднякова В.В., Курышова М.И., Ильченко М.Г. Ультразвуковая диагностика меланоцитарных образований кожи. Современные проблемы науки и образования. 2015; 3: 182. [Maksimova N.A., Pozdnyakova V.V., Kuryshova M.I., Ilchenko M.G. Ultrasound diagnosis of melanocytic skin neoplasms. Modern Problems of Science and Education. 2015; 3: 182. (in Russian)].
- Аллахвердян Г.С., Чекалова М.А. Дооперационная диагностика первичной меланомы кожи при ультразвуковом исследовании. Ультразвуковая и функциональная диагностика. Приложение к журналу. Тезисы VII Съезда Ро ссийской ассоциации специалистов ультразвуковой диагностики в медицине. Часть I. 2015; 4: 16. [Allakhverdyan G.S., Chekalova M.A. Preoperative diagnosis of primary melanoma of the skin with ultrasound. Ultrasound and Functional Diagnostics. Supplement. Part I. 2015; 4: 16. (in Russian)].


