Управление деструкцией и гумификацией пожнивных остатков зерновых культур с использованием микробиологического препарата экстрасол
Автор: Петров В.Б., Чеботарь В.К.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Растительно-микробные взаимодействия
Статья в выпуске: 3 т.47, 2012 года.
Бесплатный доступ
Испытывали эффективность микробиологического препарата экстрасол на основе штамма Ч-13 Bacillus subtilis при введении в агроценоз южного чернозема для управления процессами трансформации органического вещества. Показано повышение численности и активности всех ключевых групп микроорганизмов, ответственных за деструкцию лигноцеллюлозных субстратов и их вовлечение в процесс гумусообразования. В составе гумуса возрастает содержание гуминовых кислот первой фракции, увеличивается оптическая плотность всего комплекса гуминовых кислот.
Органическое вещество почвы, пожнивные остатки, лигноцеллюлозный субстрат, гумификация, зерновые культуры, микробиологический препарат, почвенные микроорганизмы
Короткий адрес: https://sciup.org/142133303
IDR: 142133303 | УДК: 631.147
Текст научной статьи Управление деструкцией и гумификацией пожнивных остатков зерновых культур с использованием микробиологического препарата экстрасол
Макромолекулы гумусовых веществ обеспечивают полноценную жизнедеятельность биоты, устойчивые физические, обменные и энергетические характеристики почвы. При этом сам процесс гумификации до сих пор не до конца изучен (1-3). На всех этапах в нем участвуют различные группы микроорганизмов, в первую очередь актинобактерии и грибы. Гумус образуется из нескольких органических источников — надземного и подземного опада, корневых экссудатов растений, продуктов жизнедеятельности почвенной биоты и т.д. (в агроценозах — в основном из удобрений и пожнивных остатков культур) (4).
Солома зерновых имеет высокое содержание целлюлозы, гемицеллюлозы, лигнина при широких пределах варьирования соотношения C:N (70-80:1), что существенно влияет на характер и скорость ее разложения. Целлюлозоразлагающие микроорганизмы для старта активной жизнедеятельности испытывают высокую потребность в азоте, поэтому оптимальным для процессов деструкции соломы в почве считается соотношении C:N 20-30:1 (5). В России, несмотря на повсеместную нехватку органических удобрений, за последние 20 лет устоялась практика сжигания пожнивных остатков. При этом наряду с явным ущербом от уничтожения потенциального источника почвенной органики происходит дальнейшее упрощение уже деформированной избытком пестицидов и агрохимикатов структуры почвенной микрофлоры. Заделка в почву измельченной соломы (еще один распространенный метод утилизации пожнивных органических остатков зерновых) тоже небезопасна, поскольку на подобных субстратах хорошо развивается и благополучно переживает зиму микрофлора (гнилостная сапрофитная, патогенная грибная и бактериальная), что активизирует процессы иммобилизации почвенного азота, в том числе из гумусовых веществ. Также достаточно часто применяется пролив пожнивных остатков водными растворами азотных удобрений (6), однако этот агроприем в первую очередь инициирует процесс минерализации почвенной органики до газообразных, жидких и балластных продуктов метаболизма. Сведения
Работа поддержана Государственным контрактом Минобрнауки № П760 от 20.05.2010, Государственным контрактом Минобрнауки № 16.М04.11.0013 от 29.04.2011. Работа выполнена с использованием оборудования ЦКП «Геномные технологии и клеточная биология» ГНУ ВНИИСХМ ОЗ Россельхозакадемии в рамках Государственного контракта № 16.552.11.7047.
об усилении процессов гумификации при внесении в солому малых доз азота не находят экспериментального и практического подтверждения.
В настоящее время активно разрабатываются и внедряются в практику альтернативные методы утилизации пожнивных остатков, предполагающие их более полное вовлечение в биологический круговорот с применением современных комплексных микробиологических препаратов (МБП). Методологические основы, технологии производства и применения спектра таких микробных препаратов разработаны во Всероссийском НИИ сельскохозяйственной микробиологии, в частности группа средств создается на основе комплексов грибов и бактерий (7-9). Однако этот подход становится экономически мало оправданным при переходе с опытных малообъемных установок на посевные площади, поскольку сложные микробиологические композиции обычно нестабильны, а их масштабное применение технологически сложно.
Нашей целью было изучение эффективности использования бактериального препарата экстрасол для усиления процессов биодеструкции и гумификации органического вещества пожнивных остатков зерновых культур как одного из биопрепаративных приемов управления почвенным плодородием.
Методика . В предварительном лабораторном опыте анализировали изменение целлюлазной активности в образце южного чернозема (ЗАО «Нива», Веселовский р-н, Ростовская обл.) в зависимости от наличия стартового азотного питания (раствор мочевины из расчета 20 мг на чашку Петри), добавления измельченной соломы (2 г на чашку Петри), а также применения бактериальных препаратов на основе штаммов Bacillus subtilis 4-13 (экстрасол) (10) и TR-6 из расчета 0,5 мг на чашку Петри. Целлюлазную активность определяли на жидкой среде Гетчинсона с использованием фильтровальной бумаги (11, 12) по разнице массы фрагментов бумаги до и после инкубации в течение 72 ч при 20 ° C (повторность 6-кратная). Для производственной апробации предлагаемой технологии в августе 2009 года в ЗАО «Нива» (Веселовский р-н, Ростовская обл.) на площади 58 га был заложен полевой опыт (почва — южный чернозем старопахотный среднесуглинистый на карбонатных лессовидных суглинках). Для обработки 1 га пашни (опыт) использовали баковую смесь, состоящую из 500 л воды, 1 л бактериального препарата экстрасол и 25 кг д.в. азота (в виде мочевины). Солому, измельченную до фрагментов длиной 5-7 см, сразу после опрыскивания баковой смесью заделывали в почву. Контролем служил участок поля площадью 116 га, где пожнивные остатки сжигали. В июле 2010 года на опытном и контрольном участках отбирали репрезентативные смешанные образцы почвы из пахотного горизонта (0-32 см) для исследований. В схеме опыта под биодеструкцией подразумевали запашку соломы, обработанной препаратом экстрасол со стартовой дозой азотного питания, под сжиганием — сжигание пожнивных остатков.
Стандартный микробиологический анализ и идентификацию микроорганизмов в образцах (11, 12) выполняли при посеве глубинным методом с использованием серийных разведений почвенной суспензии (10 г на 100 мл воды). Методом предельных разведений учитывали численность основных групп микроорганизмов: микромицетов — на среде 4апека с молочной кислотой, протеолитических (аммонифицирующих) бактерий — на МПА (мясо-пептонный агар), амилолитических бактерий и актинобактерий — на КАА (крахмал-аммиачный агар), азотфиксирующих бактерий — на среде Эшби, педобактерий, участвующих в процессах конверсии гумуса, — на нитритном агаре. Для определения направленности первичных 104
процессов преобразования органического вещества пожнивных остатков в почве измеряли содержание общего углерода и азота (по Тюрину), содержание I (плюс 1а фракции для фульвокислот) и II фракций гумусовых веществ в щелочной (0,1 н. NaOH) и пирофосфатной (0,1 М Na4P2O7 + 0,1 н. NaOH) вытяжках (по Кононовой-Бельчиковой), коэффициент оптической плотности гуминовых кислот с одним светофильтром при X = 430 нм (по
Плотниковой-Пономаревой), содержание лабильных водорастворимых ор ганических веществ (по Шульцу-Кершенсу) (13-15).
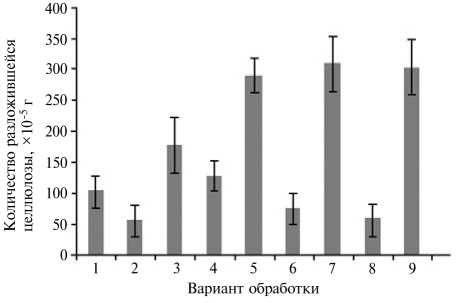
Изменение целлюлазной активности в условиях лабораторного опыта в образцах южного чернозема (П) при разложении соломы (2 г/чашка Петри) озимой пшеницы (С) на фоне стартового азотного питания в виде мочевины (М) (20 мг/чашка Петри) и применения микробиологических препаратов (0,5 мг/чашка Петри) , содержащих культуры Bacillus subtilis (Э — экстрасол, препарат на основе штамма 4-13; Б — препарат на основе штамма TR-6): 1 — П; 2 — П + С; 3 — П + С + М; 4 — П + Э; 5 — П + Э + М; 6 — П + С + Э; 7 — П + С + Э + М; 8 — П + С + Б; 9 — П + С + Б + М.
Результаты . В лабораторном опыте на чашках Петри введение в почву с измельченной соломой двух препаратов B . subtilis на фоне стартовой дозы мочевины увеличивало целлюлазную активность более чем в 3 раза (рис.).
В производственном опыте визуальный контроль за разложением запаханной соломы на протяжении весны—лета 2010 года показал практически полное исчезновение различимых фрагментов пожнивных остатков при обработке экстрасолом. Существенные различия в микробном пейзаже почвы в изучаемых вариантах были обнаружены на среде 4апека
(табл. 1): наблюдался рост популяции микромицетов Penicillium, Trichoderma и Fusarium — важнейших деструкторов растительных остатков в почве (их общее число в варианте с обработкой экстрасолом было в 2 раза больше, чем в контроле, когда остатки сжигали). 4исло актино- и азотфиксирующих
1. Численность микроорганизмов в почвенных образцах (х)03 КОЕ/г) при различных способах утилизации пожнивных остатков на южных черноземах (ЗАО «Нива», Веселовский р-н, Ростовская обл., 2010 год)
|
Группа микроорганизмов | |
Биодеструкция |
Сжигание |
|
Микромицеты |
19 |
9 |
|
Протеолитики |
11 670 |
6560 |
|
Азотфиксаторы |
60 |
63 |
|
Амилолитические бактерии |
35 360 |
18 650 |
|
Актинобактер ии |
1373 |
1727 |
|
Гуматмодификаторы |
3330 |
1312 |
|
Общее число бактерий |
53 812 |
31 366 |
П р и м е ч а н и е. Биодеструкция — запашка соломы, обработанной препаратом экстрасол со стартовой дозой мочевины.
бактерий по вариантам значимо не различалось. На среде МПА, где учитывали аммонифицирующие бактерии, отмечали рост представителей трех видов с преобладанием флуоресцирующих псевдомонад. Общая численность бактерий в опыте была в 1,72 раза выше, чем в контроле, что свидетельствует об усилении процессов аммонификации. При использовании экстрасола число амилолитических бактерий и гуматмодификаторов повышалось соответственно в 1,90 и 2,54 раза по сравнению с контролем.
Целлюлазная активность почвы при внесении измельченной соло мы, обработанной экстрасолом и мочевиной (опыт), оказалась в 3,3 раза выше, чем при сжигании пожнивных остатков (контроль). Иными словами, применение экстрасола активизировало почвенный микробный комплекс, интенсифицировало процессы трансформации растительных остатков и биоконверсии азота в почве. Почвы с опытного и контрольного участков по количеству и качеству органического вещества и коэффициенту гумификации соответствовали окультуренным южным черноземам (содержание общего углерода — 2,2 %, сумма гуминовых кислот и фульвокислот — 0,8 %, показатель обогащенности органического вещества азотом — 9,3-10,0).
Несмотря на практически одинаковое количество общего углерода, в исследуемых образцах значительно различалось содержание наиболее подвижной и активной I фракции гуминовых веществ (табл. 2). Увеличение этой фракции при обработке экстрасолом может указывать на активизацию трансформации и гумификации органического материала, в том числе пожнивных остатков.
2. Фракционно-групповой состав гумуса в почвенных образцах при различных способах утилизации пожнивных остатков на южных черноземах (ЗАО «Нива», Веселовский р-н, Ростовская обл., 2010 год)
Фракция
|
Вариант |
гуминовых кислот |
фульвокислот |
||||
|
I |
1 II 1 |
сумма |
Iа + I |
1 II 1 |
сумма |
|
|
Биодеструкция |
0,11 |
0,49 |
0,60 |
0,16 |
0,05 |
0,21 |
|
5,0 |
22,2 |
27,2 |
7,2 |
2,3 |
9,5 |
|
|
Сжигание |
0,08 |
0,52 |
0,60 |
0,15 |
0,09 |
0,24 |
|
3,6 |
23,3 |
26,9 |
6,7 |
4,0 |
10,7 |
|
П р и м е ч а н и е. То же, что в таблице 1. Над чертой — абсолютные значения, г/100 г почвы; под чертой — величина относительно С общ. , %.
3. Коэффициент оптической плотности (Есмг/мё) в вытяжках почвенных образцов при различных способах утилизации пожнивных остатков на южных черноземах (ЗАО «Нива», Веселовский р-н, Ростовская обл., 2010 год)
|
Вариант |
Гуминовые кислоты + фульвокислоты |
Гуминовые кислоты |
|||
|
1 |
1 2 |
3 |
2 |
3 |
|
|
Биодеструкция |
2,24 |
5,39 |
9,18 |
10,63 |
22,71 |
|
Сжигание |
2,18 |
3,74 |
8,31 |
5,43 |
21,12 |
П р и м е ч а н и е. То же, что в таблице 1; 1 — водная вытяжка (лабильные формы), 2 — вытяжка 0,1 н. NaOH (лабильные формы), 3 — вытяжка 0,1 М Na 4 P 2 O 7 + 0,1 н. NaOH.
В исследованных почвенных образцах также существенно различались значения коэффициента оптической плотности — важного показателя химической зрелости гумусовых кислот (табл. 3). В наибольшей степени это касалось гуминовых кислот I фракции. Выявленное усиление ароматизации молекул гуминовых веществ после обработки экстрасолом позволяет сделать вывод об интенсификации процессов трансформации пожнивных остатков и углублении процесса гумификации уже на начальном этапе. Увеличение коэффициента оптической плотности комплекса гумусовых веществ на фоне возрастания как относительного, так и абсолютного содержания гуминовых кислот I фракции — важные позитивные эффекты предлагаемой технологии биоразложения пожнивных остатков. Дефицит именно этих ценных для плодородия органических соединений приводит к структурной деградации гумуса и общей дегумификации обрабатываемых черноземов юга России.
При введении в агроценоз микробных препаратов возможны следующие события. Во-первых, бактерии B. subtilis, продуцирующие различные антибиотические вещества, проявляют высокую конкурентную способность в процессе колонизации растений, их надземного и корневого опада (10). На фоне обогащения свежей органикой реставрируются существовавшие и формируются новые межорганизменные ассоциации, в том числе ответственные за целлюлозолитические, лигниндеструктивные и гу-мификационные процессы. Присутствие B. subtilis в агроценозе усложняет структуру микробного сообщества в однолетнем и многолетнем циклах. Уже при однократном проливе почвы экстрасолом через 60 сут число мор-фотипов бактерий в пахотном горизонте возрастало на 32-70 %. Положительное последействие экстрасола на микрофлору и плодородие почвы сохранялось на протяжении не менее чем двух вегетационных периодов (16, 17). Бациллярные препараты с контролируемыми функциями поэтапно обеспечивают продуктивную жизнедеятельность комплекса почвенных микроорганизмов, трансформирующих органическое вещество, — создаются стартовые условия и вытесняется функционально бесполезная микрофлора; осуществляется снабжение сбалансированными энергетическими потоками и питательными субстратами (в том числе за счет ассоциативной азотфиксации); стабилизируется процесс деструкции и гумификации. Во-вторых, при внесении в почву микробных препаратов могут формироваться микробные сообщества (генно-метаболические сети — ГМС) микроми-цетов, актинобактерий и эубактерий (при ведущей роли почвенных грибов), которые последовательно разлагают исходные субстраты, снабжая друг друга энергией и питательными веществами (18-20). В деструктивную деятельность ГМС могут вовлекаться фитопатогенные микроорганизмы, которые оказываются неспособными осуществлять агрессию по отношению к растениям (21). Вероятность спонтанного образования эффективной ГМС мала, но на основе воспроизведения условий, при которых микроорганизмы объединяются в гумификационную ГМС, создан биопрепарат баркон для разложения опилок, коры и древесины хвойных пород (8, 22).
Описанные механизмы по существу непротиворечивы. После применения обоих препаратов отмечали увеличение общей численности микробиоты и значительную активизацию микромицетов, целлюлозолитических и гуматразлагающих микроорганизмов. Наиболее существенное различие касалось роли протеолитических и амилолитических бактерий. Согласно второй гипотезе, ГМС дополняют деятельность грибов и их роль вспомогательная. В опыте с экстрасолом значительное абсолютное увеличение численности наблюдали именно во вспомогательных группах микроорганизмов и, согласно первой гипотезе, функция B . subtilis (как и иных протеолитических и амилолитических бактерий, участвующих в регуляции состава микробоценоза, пополнении пищевых и энергетических ресурсов для всей процессной микрофлоры) первостепенна. Управление трансформацией пожнивной органики зерновых мы связываем в первую очередь с внедрением жидких бациллярных препаратов. В проведенном полевом опыте (ЗАО «Нива», 2010 год) урожайность озимой пшеницы увеличилась в среднем на 3 ц/га при повышении содержания клейковины на 2,5-3,0 %.
Таким образом, успешно апробированный способ позднелетней (для озимых культур) либо осенней (для яровых) обработки полей экстрасолом совместно с внесением мочевины, используемой в качестве стартового азотного питания, позволяет превратить нежелательные пожнивные остатки в полноценное органическое удобрение с высоким коэффициентом гумификации. Препарат совместим с удобрениями в баковых смесях. Предлагаемая технология экономична, безопасна и может быть рекомендована для управления процессами деструкции и гумификации пожнивных остатков.
Л И Т Е Р А Т У Р А
-
1. О р л о в Д.С. Гумусовые кислоты почв. М., 1974.
-
2. Л ы к о в А.Д. Гумус и плодородие почвы. М., 1985.
-
3. К и р ю ш и н В.И. Экологизация земледелия и технологическая политика. М., 2000.
-
4. Т е й т Р. Органическое вещество почвы: биологические и экологические аспекты. М., 1991.
-
5. К о н о н о в а М.М. Органическое вещество целинных и освоенных почв. М., 1972: 7-69.
-
6. Приказ Управления по экологии и природопользованию Воронежской обл. от 12.03.2007 № 132 «Об утверждении рекомендаций по утилизации пожнивных остатков и соломы».
-
7. С в и р и д о в а О.В., Т у е в Н.А., С а к у л и н а Г.Г. и др. Способ разложения древесины. АС № 1792974 от 8 октября 1992 года. Бюл. изобр. № 5, 1993.
-
8. С в и р и д о в а О.В., В о р о б ь е в Н.И., П е т р о в В.Б. Микробиологическая деструкция древесных отходов и вовлечение лигнинсодержащих компонентов в агроэкосистему. Мат. науч. конф. «Постгеномная эра в биологии и проблемы биотехнологии» (Казань, 17-18 июня 2004 года). Казань, 2005: 75-76.
-
9. С в и р и д о в а О.В., В о р о б ь е в Н.И., П е т р о в В.Б. и др. Информационное взаимодействие микромицетов и бактерий в экологических нишах с лигноцеллюлозными субстратами. Тез. докл. 2-го съезда микологов России «Современная микология в России». М., 2008: 233-234.
-
10. Ч е б о т а р ь В.К., 3 а в а л и н А.А., К и п р у ш к и н а Е.Н. Эффективность применения биопрепарата экстрасол. М., 2007.
-
11. Некоторые новые методы количественного учета почвенных микроорганизмов и изучение их свойств: Метод. реком. ВНИИСХМ. Л., 1987.
-
12. Т е п п е р Е.З., Ш и л ь н и к о в а В.К., П е р е в е р з е в а Г.И. Практикум по микробиологии. М., 1987.
-
13. П о н о м а р е в а В.В., П л о т н и к о в а Т.А. Методические указания по определению содержания и состава гумуса в почвах. Л., 1975.
-
14. О р л о в а Н.Е., Б а к и н а Л.Г., О р л о в а Е.Е. Методы изучения содержания и свойств гумуса. СПб, 2007.
-
15. Рекомендации для исследования баланса и трансформации органического вещества при сельскохозяйственном использовании и интенсивном окультуривании почв. М., 1984.
-
16. П е т р о в В.Б., Ч е б о т а р ь В.К., К а з а к о в А.Е. Микробиологические препараты в биологизации земледелия России. Достижения науки и техники АПК, 2002, 10: 16-20.
-
17. П е т р о в В.Б., К о в а л е в а Н.М., С в и р и д о в а О.В. и др. Управление свойствами агроценоза Северо-Запада России с применением спектра новейших микробиологических препаратов. Мат. межрегион. науч.-практ. конф. «Почвенные ресурсы северо-запада России: их состояние, охрана и рациональное использование». СПб, 2008: 167-175.
-
18. К о л ч а н о в Н.А., А н а н ь к о Е.А., К о л п а к о в Ф.А., П о д к о л о д н а я О.А., И г н а т ь е в а Е.В., Г о р я ч к о в с к а я Т.Н., С т е п а н е н к о И.Л. Генные сети. Молекулярная биология, 2000, 34(4): 533-544.
-
19. К о л ч а н о в Н.А., С у с л о в В.В., Г у н б и н К.В. Моделирование биологической эволюции: регуляторные генетические системы и кодирование сложности биологической организации. Вестник ВОГиС, 2004, 2: 86-99.
-
20. Л и х о ш в а й В.А., М а т у ш к и н Ю.Г., Ф а д е е в С.И. О связи графа генной сети с качественными режимами ее функционирования. Молекулярная биология, 2001, 35(6): 1080-1087.
-
21. Т е р е х о в а В.А. Микромицеты в экологической оценке водных и наземных экосистем. М., 2007.
-
22. С в и р и д о в а О.В., В о р о б ь е в Н.И., П е т р о в В.Б. и др. Технология приготовления биодеструктора БАРКОН для получения органических удобрений из древесных отходов хвойных деревьев. Мат. Межд. конгр. «Биотехнология — состояние и перспективы развития». М., 2003, ч. 1: 227-228.
ГНУ Всероссийский НИИ сельскохозяйственной Поступила в редакцию микробиологии Россельхозакадемии, 20 декабря 2010 года
MANAGEMENT OF DESTRUCTION AND HUMIFICATION OF THE POST-HARVEST RESTS OF CEREAL CROPS USING MICROBIOLOGICAL PREPARATION EXTRASOL
V.B. Petrov, V.K. Chebotar’
S u m m a r y
Introduction into the soil of the wheat straw treated with microbial preparation Extrasol produced on the basis of Bacillus subtilis strain Ch-13 results in increase of activity of all main groups of microorganisms responsible for destruction and involvement of lignocellulotic compounds into the process of humus formation. In the humus structure the content of first fraction of humic acids and optic density of all complex of humic acids are mainly increasing.


