Упреждающая селекция: использование молекулярных маркеров при создании доноров устойчивости картофеля (Solanum tuberosum L.) к фитофторозу на основе сложных межвидовых гибридов
Автор: Фадина О.А., Бекетова М.П., Соколова Е.А., Кузнецова М.А., Сметанина Т.И., Рогозина Е.В., Хавкин Э.Е.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Картофелеводство: наука и технологии
Статья в выпуске: 1 т.52, 2017 года.
Бесплатный доступ
Наиболее серьезной агрономической и экономической проблемой картофелеводства остается фитофтороз, вызываемый оомицетом Phytophthora infestans Mont. de Bary. Уникальная скорость эволюции этого патогена и его миграция - основные препятствия при создании сортов картофеля с долговременной устойчивостью к фитофторозу. Лучший способ противостоять такой угрозе - это упреждающая селекция на основе доноров, которые несут гены устойчивости к широкому спектру рас возбудителя. Объединение несколько генов устойчивости к фитофторозу в одном растении (пирамидирование генов) делает устойчивость долговременной. Наиболее перспективным подходом при получении таких доноров служит интрогрессивная селекция, то есть создание межвидовых гибридов картофеля с генами устойчивости, перенесенными из его дикорастущих сородичей - клубненосных видов Solanum L. Молекулярные маркеры, позволяющие надежно различать гены устойчивости разной специфичности и эффективно контролировать их перенос в процессах скрещивания и отбора, резко повышают эффективность интрогрессивной селекции на устойчивость к фитофторозу. Мы исследовали 39 сложных гибридов, которые были получены во Всероссийском НИИ картофельного хозяйства им. А.Г. Лорха (Московская обл.), Всероссийском институте генетических ресурсов растений им. Н.И. Вавилова (г. Санкт-Петербург) и Всероссийском НИИ защиты растений (г. Санкт-Петербург) с участием 16 клубненосных видов Solanum и поддерживаются в виде клонов. Каждый из этих клонов несет генетический материал, полученный от 2-8 дикорастущих видов - источников устойчивости к фитофторозу. Большинство клонов из года в год проявляют высокую устойчивость к фитофторозу в полевых испытаниях в условиях естественного заражения и в лабораторных исследованиях при инфицировании отделенных листьев высоковирулентным и агрессивным изолятом P. infestans. SCAR (sequence-characterized amplified region) маркеры, которые представляют собой фрагменты R генов расоспецифичной (вертикальной) устойчивости к фитофторозу, найденных у различных видов Solanum, были использованы для изучения клонов межвидовых гибридов. С устойчивостью клонов к фитофторозу сопоставили сведения о присутствии SCAR маркеров шести R генов - R1 (5-я хромосома), R2 / Rpi-blb3 (4-я хромосома), R3a и R3b (11-я хромосома), RB / Rpi-blb1 = Rpi-sto1 (8-я хромосома) и Rpi-vnt1.3 (9-я хромосома). Сравнение показателей у клонов межвидовых гибридов и сортов картофеля, не содержащих маркеров R генов, свидетельствует о значимом вкладе R генов в общую устойчивость растений картофеля к фитофторозу. При этом увеличение числа маркеров R генов в одном растении сопровождалось существенным повышением устойчивости к фитофторозу. Можно ожидать, что применение молекулярных маркеров для пирамидирования R генов в процессе гибридизации обеспечит направленную интрогрессивную селекцию и ускорит получение сортов картофеля с долговременной устойчивостью к фитофторозу, которые будут способны сохранять продуктивность даже при значительных изменениях в популяциях P. infestans.
Фитофтороз картофеля, межвидовые гибриды картофеля, клоновые коллекции, интрогрессивная селекция, r гены устойчивости к фитофторозу, avr гены p. infestans
Короткий адрес: https://sciup.org/142214017
IDR: 142214017 | УДК: 635.21:632.4:631.524:577.21 | DOI: 10.15389/agrobiology.2017.1.84rus
Текст научной статьи Упреждающая селекция: использование молекулярных маркеров при создании доноров устойчивости картофеля (Solanum tuberosum L.) к фитофторозу на основе сложных межвидовых гибридов
Фитофтороз (возбудитель — оомицет Phytophthora infestans Mont. de Bary) остается важнейшей в экономическом отношении болезнью картофеля: ежегодно с ней связаны потери не менее 15 % урожая, а глобальный экономический ущерб, включая расходы на химическую борьбу с патогеном, оценивается в 10 млрд долларов США (1). Эпидемии фитофтороза,
∗ Работа выполнена при финансовой поддержке МНТЦ (проект ¹ 3714п), РФФИ (проекты ¹ 13-0400163/14, ¹ 14-04-31613а и ¹ 16-04-00098) и Министерства образования и науки Российской Федерации (Госконтракт ¹ 16.М04.12.0007). Получение межвидовых гибридов картофеля, фитопатологическая оценка изолятов Phytophthora infestans , оценка устойчивости картофеля к фитофторозу и маркерный анализ генотипов картофеля выполнены в рамках Государственных заданий 0662-2014-0018, 0598-2015-0018, 0598-20150016 и 0574-2014-0020.
вызванные появлением новых рас P. infestans вследствие эволюции и миграции патогена, периодически уничтожают до 70-100 % урожая (2-4). Поэтому для устойчивого картофелеводства требуются сорта с долговременной (durable) высокой устойчивостью к широкому кругу рас P. infestans , гарантирующей существенное сохранение продуктивности растений при изменении расового состава патогена в агроценозе. Создание таких сортов можно назвать упреждающей селекцией.
Определяющую роль в этой стратегии играют источники устойчивости к P. infestans — виды Solanum L. (секция Petota Dumort.). Гены устойчивости найдены у многих представителей рода Solanum из Северной и Южной Америки (5), но лишь небольшое их число имеется у коммерческих сортов картофеля . Одним из первых примеров интрогрессии таких расоспецифичных генов вертикальной устойчивости (R генов) от дикорастущего вида было создание межвидовых гибридов на основе S. demissum (6, 7), но достигнутая таким образом устойчивость быстро преодолевалась новыми расами P. infestans (8). Горизонтальная устойчивость к фитофторозу (8-10), присущая широкому кругу клубненосных видов Solanum, контролируется многочисленными расонеспецифичными генами. В значительной мере они картированы только как локусы количественных признаков (QTL) и исследованы значительно слабее, чем расоспецифичные гены (5, 11, 12). То обстоятельство, что проявление расонеспецифичных генов сильно зависит от внешних факторов, серьезно усложняет работу по селекции на горизонтальную устойчивость к фитофторозу.
Привлечение генетических источников для создания доноров селекционно ценных признаков происходит на этапе предбридинговой селекции. Во Всероссийском институте генетических ресурсов растений им. Н.И. Вавилова (ВИР, г. Санкт-Петербург) собрана одна из крупнейших мировых коллекций культурных и дикорастущих клубненосных видов Solanum , установлены генетические центры формирования фитофтороустойчивых видов (13), разработаны генетические основы получения межвидовых гибридов-доноров (14) и отбора образцов, пригодных для межвидовой гибридизации.
Сложные межвидовые гибриды с генетическим материалом сразу нескольких дикорастущих видов Solanum могут стать лучшими донорами для создания устойчивых сортов картофеля (10, 15, 16), а пирамидирование (объединение) разных генов устойчивости к фитофторозу в одном растении делает эту устойчивость долговременной. Как правило, дикорастущие сородичи картофеля и гибриды с их участием содержат по несколько R генов разной расоспецифичности (17), для распознавания которых традиционно используют наборы рас P . infestans , у которых факторы вирулентности установлены с помощью сортов-дифференциаторов Мастен-брока-Блека (7, 18). Эти расы-дифференциаторы выявляют только 11 R генов S . demissum (причем далеко не все из них клонированы) и не распознают другие гены, которые могут присутствовать у видов Solanum . У части таких растений-дифференциаторов имеется более одного R гена (19), а у рас-дифференциаторов P . infestans ген авирулентности ipiO , опознающий ген RB / Rpi-blb1 у картофеля, характерный для S . bulbocastanum , но отсутствующий у S . demissum (20), представлен двумя классами.
Многие подобные затруднения были преодолены благодаря созданию моногенных растений-дифференциаторов (21). Но и в этом случае использование рас P. infestans с известными генами вирулентности, вероятно, не даст ту же точность идентификации R генов, какую обеспечивает их прямое обнаружение с помощью молекулярных маркеров. Таким образом, эффективный поиск генов устойчивости, специфичных в отношении ши- рокого круга рас P. infestans, и их пирамидирование опираются в первую очередь на молекулярное маркирование.
Для обследования больших генетических коллекций и контроля результатов на этапах селекции наиболее удобны маркеры, которые представляют собой фрагменты самих генов устойчивости. Такие SCAR (sequence characterized amplified region) маркеры, в отличие от фланкирующих маркеров, полностью сохраняют информативность даже при значительной рекомбинации генетического материала в геномах гибридов. Основная проблема, возникающая при использовании этих маркеров, заключается в необходимости различать функционально активные гены и их неактивные структурные гомологи. Отметим, что более специфичное распознавание R генов устойчивости у растения обеспечивают методы эффекторомики (22): индивидуальные гены авирулентности патогена ( Avr гены) вводят в растение в составе вектора, и хорошо наблюдаемая реакция сверхчувствительности свидетельствует о присутствии соответствующего R гена. Этот методический подход тоже имеет ограничения, и лучшие результаты достигаются при сочетании двух взаимодополняющих технологий.
В настоящей работе мы впервые систематизировали данные многолетнего изучения коллекций сложных межвидовых гибридов и сортов картофеля, входящих в родословные таких гибридов либо используемых как стандарты при оценке устойчивости к фитофторозу (частично результаты представлялись ранее на рабочих совещаниях Европейской сети исследователей фитофтороза — EuroBlight Workshops, 2013, 2015; . Сделанное обобщение позволило нам предложить новый подход к получению сортов с длительной устойчивостью к фитофторозу. Этот подход основан на создании методами направленной интрогрессивной селекции сложных межвидовых гибридов картофеля, высокая устойчивость которых к фитофторозу достигнута благодаря пирамидированию R генов устойчивости под контролем молекулярных маркеров этих генов. Большой пул таких гибридов, используемых в качестве селекционных доноров, позволяет оперативно реагировать на изменения в составе популяции патогена.
Ниже мы проиллюстрируем применение подхода, ориентированного на упреждающую селекцию, и связанные с ним затруднения на примере двух групп межвидовых гибридов.
Методика . Исследовали 10 сортов (Alpha, Desiree, Bintje, Early Rose, Eesterling, Escort, Gloria, Елизавета, Свитанок киевский и Sarpo Mira), дигаплоид сорта Atzimba и 39 клонов сложных межвидовых гибридов картофеля, полученных во Всероссийском НИИ картофельного хозяйства им. А.Г. Лорха (Московская обл.), Всероссийском институте генетических ресурсов растений им. Н.И. Вавилова (ВИР, г. Санкт-Петербург) и Всероссийском НИИ защиты растений (г. Санкт-Петербург) с участием 16 клубненосных видов Solanum из разных центров происхождения.
Устойчивость листьев к фитофторозу оценивали в многолетних полевых опытах в двух регионах России — Северо-Западном (ВИР) и Центральном (Всероссийский НИИ фитопатологии, ВНИИФ) при естественном заражении. Стандартами служили сорта Елизавета, Удача, Наяда и Петербургский (ВИР) или Alpha, Bintje, Eesterling, Escort, Gloria, Robijn и Sarpo Mira (ВНИИФ). В лабораторных опытах отделенные листья растений, выращенных в теплице, заражали высоковирулентным и агрессивным изолятом P . infestans (расы 1-11) из коллекции ВНИИФ, используя в качестве стандарта сорт Sant e (23).
Геномную ДНК выделяли из молодых листьев с помощью набора AxyPrep™ Multisource Genomic DNA Miniprep Kit («Axygen Biosciences», 86
США). Концентрацию ДНК измеряли при λ = 260 нм на нанофотометре UV/Vis NanoPhotometer P300 («IMPLEN», Германия). Методы амплификации геномной ДНК, клонирования и секвенирования ампликонов описаны нами ранее (24). ПЦР проводили в амплификаторе DNA Engine PTC-200 («Bio-Rad», США) с 1,0 ед. Taq ДНК-полимеразы («Fermentas», США), а в случае маркера R2-2500 — с 2,5 ед. Pfu ДНК-полимеразы («Fermentas», США). Для элюирования целевых фрагментов ДНК использовали набор QIAquick Gel Extraction Kit («Qiagen N.V.», Германия), для клонирования — pGEM-T Easy Vector System I («Promega», США); в случае маркера R22500 применяли набор Thermo Scientific™ CloneJET™ PCR Cloning Kit и вектор pJet («Fermentas», США). Секвенирование выполняли с помощью анализаторов ABI PRISM 3130xl («Applied Biosystems», США) или Нанофор 05 («Институт аналитического приборостроения РАН», Россия). Праймеры были синтезированы ЗАО «Синтол» (Россия). Секвенированные фрагменты собирали с помощью пакета SeqMan, Lasergene 7.0 (доступно по .
Анализ корреляций выполняли в программе Statistica 6.0 («StatSoft Inc.», США; доступна на , оценивая параметрическую корреляцию по Пирсону, ранговую корреляцию по Спирмену, а также используя непараметрический критерий Вилкоксона. Все коэффициенты корреляции были значимыми на уровне p < 0,05.
Результаты . Работа с клоновыми коллекциями гибридов и сортов картофеля (15), которые поддерживаются в ВИР и ВНИИФ, позволяет сравнивать результаты независимых испытаний в нескольких лабораториях и существенно повышает воспроизводимость экспериментов. Каждый из изученных нами межвидовых клонов несет генетический материал разных источников устойчивости к фитофторозу и имеет в родословной от 2 до 8 дикорастущих видов картофеля (их значительная часть представлена ниже).
В полевых условиях при естественном заражении P . infestans большинство изученных клонов межвидовых гибридов из года в год проявляли высокую устойчивость к фитофторозу, сопоставимую с таковой у эталонного сорта Sarpo Mira (8 баллов). Высокую устойчивость клонов (до 7 баллов) регистрировали и в лабораторных исследованиях.
Различия в результатах полевого испытания и лабораторного теста (1-3 балла) для подавляющего большинства клонов гибридов и сортов картофеля можно объяснить более благоприятными условиями для развития патогена в лабораторном тесте (3) и вкладом других органов растения в общую устойчивость (25). Там, где эти различия особенно велики, можно также ожидать заметной активности расонеспецифичных генов устойчивости. Показатели полевой и лабораторной устойчивости тесно связаны (коэффициент корреляции Пирсона 0,963 значим при p < 0,01).
Для скрининга мы отобрали хорошо верифицированные SCAR маркеры шести R генов расоспецифичной устойчивости к фитофторозу, которые локализованы на шести из 12 хромосом картофеля: R1 (5-я хромосома), R2 / Rpi-blb3 (4-я хромосома), R3a и R3b (11-я хромосома), RB / Rpi-blb1 = Rpi-sto1 (8-я хромосома) и Rpi-vnt1.3 (9-я хромосома) (табл. 1). Эти маркеры были сконструированы для R генов устойчивости к фитофторозу, исходно охарактеризованных у четырех видов Solanum — S . bulbocastanum , S . demissum , S . stoloniferum и S . venturii .
Для иллюстрации результатов скрининга мы отобрали две контрастные группы генотипов картофеля (табл. 2): гибриды, у которых высокой устойчивости к фитофторозу соответствует присутствие 3-4 маркеров R генов устойчивости (такие формы составляют большинство исследован- ных нами межвидовых гибридов) и гибриды с высокой устойчивостью и малым числом маркеров.
1. Характеристика SCAR (sequence-characterized amplified region) маркеров R генов устойчивости картофеля (Solanum L.) к фитофторозу, использованных в работе Ген Маркер с указанием длины (-п.н.) Температура отжига, °С Прямой (F) и обратный (R) праймеры (5'^3') Ссылка Rpi-blb1 Rpi-blb1-820 62 F: AACCTGTATGGCAGTGGCATG R: GTCAGAAAAGGGCACTCGTG (27) Rpi-sto1 = Rpi-blb1 Rpi-sto1-890 65 F: ACCAAGGCCACAAGATTCTC R: CCTGCGGTTCGGTTAATACA (28) R1 R1-1205 65 F: CACTCGTGACATATCCTCACTA, R: GTAGTACCTATCTTATTTCTGCAAGAAT (24) R2 R2-2500 62 F: ATGGCTGATGCCTTTCTATCATTTGC R: TCACAACATATAATTCCGCTTC (19) R3a R3-1380 64 F: TCCGACATGTATTGATCTCCCTG R: AGCCACTTCAGCTTCTTACAGTAGG (24) R3b R3b-378 64 F: GTCGATGAATGCTATGTTTCTCGAGA R: ACCAGTTTCTTGCAATTCCAGATTG (29) Rpi-vnt1.3 Rpi-vnt1.3-612 65 F: CCTTCCTCATCCTCACATTTAG R: GCATGCCAACTATTGAAACAAC (30) 2. Распределение SCAR (sequence-characterized amplified region) маркеров R генов в двух группах межвидовых гибридов картофеля (Solanum L.) разного происхождения с высокой устойчивостью к фитофторозу Генотип Маркер Число Устойчивость, балл Дикие виды 1 2 3 4 5 6 7 маркеров полевая лабораторная в родословной
|
Ги |
бриды |
с |
известными R |
генами |
устойчивости |
|
|
2372-60 |
1 |
0 1 |
1 |
0 0 0 3 |
8 |
6,0 adg, chc, dms, sto |
|
12/1-09 |
0 |
1 0 |
0 |
1 1 0 3 |
7 |
6,0 adg, dms, mcd, plt = sto, |
|
15/13-09 |
0 |
1 0 |
1 |
1 0 0 3 |
6 |
pnt, sto, vlm 6,0 adg, dms, mcd, plt = sto, |
|
16/27-09 |
1 |
0 0 |
0 |
1 1 0 3 |
7 |
sto, vlm 7,0 adg, ber, dms, mcd, phu, |
|
111 (38 КВА) |
0 |
0 1 |
1 |
1 1 0 4 |
7 |
plt = sto, sto, vlm 6,5 adg, dms, mcd, plt = sto, |
|
39-1-2005 |
0 |
0 0 |
1 |
1 0 1 3 |
7 |
sto 6,0 aln, dmsа, б |
|
134-6-2006 |
0 |
0 1 |
1 |
0 0 1 3 |
6 |
5,0 aln = brcб |
|
139 |
1 |
0 0 |
0 |
1 1 0 3 |
9 |
6,0 adg, aln, ber, dms, mcd, |
|
135-1-2006 |
0 |
1 1 |
1 |
0 0 1 4 |
7 |
plt = sto, pnt, sto, vlm 5,0 aln = brcб |
|
Гибриды, |
предположительно несущ |
ие неизвестные |
||||
|
2585-80 |
1 |
0 0 |
1 |
гены устой 0 0 0 2 |
чивости 7 |
6,0 dms |
|
2585-67 |
0 |
0 1 |
1 |
0 0 0 2 |
7 |
6,0 dms |
|
106 (171-3) |
0 |
0 0 |
1 |
0 0 0 1 |
7 |
6,0 adg, dms, ryb |
|
113 (50/1 КВА) |
0 |
0 0 |
0 |
0 0 0 0 |
7 |
6,0 adg, dms, phu, sto, vrn и |
|
118 (118-5) |
0 |
0 1 |
1 |
0 0 0 2 |
8 |
смесь пыльцы гибридов 6,0 adg, dms, ryb |
|
24-1 |
0 |
0 0 |
1 |
0 0 1 2 |
8 |
6,5 aln = brcб |
|
134-2-2006 |
1 |
0 0 |
0 |
0 0 1 2 |
7 |
6,0 aln = brcб |
|
Дигаплоид сорта Atzimba |
0 |
0 0 |
0 |
0 0 0 0 |
7 |
Нет данных Не известны |
|
Примечание. 1 |
— R1-1205, 2 |
— R2-2500, 3 — R3a- |
1380, 4 — R3b-378, 5 — Rpi-blb1-820, 6 — Rpi-sto1, |
|||
7 — Rpi-vnt1.3; а — неясен источник маркера Rpi-blb1-820, б — неясен источник маркера Rpi-vnt1.3; adg —
S. andigenum , aln — S. alandiae , ber — S. berthaultii , brc — S. brevicaule , chc — S. chacoense , dms — S. demissum , mcd — S. microdontum , phu — S. phureja , plt — S. polytrichon = S. stoloniferum , pnt — S. pinnatisectum , ryb — S. rybinii = S. phureja , sto — S. stoloniferum , vlm — S. vallis-mexiсi , vrn — S. vernei .
Примененные нами маркеры были сконструированы для R генов устойчивости к фитофторозу, исходно охарактеризованных у четырех видов Solanum — S. bulbocastanum , S. demissum , S. stoloniferum и S. venturii . Сравнение клонов межвидовых гибридов картофеля с дикорастущими видами Solanum , использованными при создании этих гибридов (24, 26), подтвердило, что состав R генов у гибридов в основном соответствовал их родословным. Маркеры генов R1 , R2 , R3a и R3b с наибольшей вероятностью перенесены из S . demissum , однако, как показал скрининг обширной 88
коллекции дикорастущих видов из секции Petota (24), их источником могли быть и другие дикорастущие виды, отмеченные в родословных. Генетический материал S . bulbocastanum не использовали в создании исследованных гибридов, и там, где мы находим маркер гена Rpi-blb1 , он был перенесен из S . stoloniferum — тетраплоидного вида, один из геномов которого, по всей видимости, происходит от S . bulbocastanum (27). Неплохо согласуются результаты скрининга с маркерами Rpi-blb1-820 и Rpi-sto1-890, которые соответствуют двум далеко отстоящим друг от друга участкам гена Rpi-blb1 = Rpi-sto1 . Присутствие гена R1 у S . stoloniferum подтверждено подробными исследованиями этого вида (31), в том числе клонированием полноразмерного ортолога R1 (GenBank accession number KU302613, National Center for Biotechnology Information — NCBI, США); кроме того, присутствие функционального гена R1 у S . stoloniferum засвидетельствовано методом эффекторомики (32).
В некоторых случаях мы не можем интерпретировать полученные данные без дальнейших углубленных исследований. Это относится к маркерам Rpi-blb1-820 и Rpi-sto1, присутствовавшим у гибридов, в родословных которых не значился вид S . stoloniferum . Мы также обнаружили маркер гена Rpi-vnt1.3 у большого числа гибридов, происхождение которых не связано с S . venturii . Это согласуется с недавним сообщением (30) о присутствии структурных гомологов указанного гена у S . microdontum ssp. gi-gantophyllum и S . phureja (NCBI GenBank accession numbers GU338312, GU338337). Выполненное нами клонирование SCAR маркеров R генов из межвидовых гибридов показало, что по нуклеотидным последовательностям эти маркеры на 98-100 % идентичны генам-прототипам. Там, где наблюдаются расхождения, их можно связать с видовым (аллельным) разнообразием R генов в пределах полиморфной секции Petota (33). По всей видимости, исследованные R гены распространены за пределами видов, в которых они были впервые описаны, то есть шире, чем ранее предполагалось. Это же подтверждали результаты скрининга дикорастущих видов Sol-anum , выполненного нами ранее (17, 24, 26, 33). Аналогичные результаты получены H . Rietman методом эффекторомики (32).
Самый важный вопрос при маркерном анализе дикорастущих и культурных форм картофеля заключается в том, указывает ли присутствие маркера на наличие функционального R гена. Даже полное сходство последовательности маркера с геном-прототипом не служит доказательством функциональной активности: структурные различия могут находиться за границами маркера, а для изменения функции продукта R гена — киназы достаточно одной нуклеотидной замены (34). Возможно, более определенный ответ даст использование специфичных Avr генов, различающих функциональные R гены и их неактивные гомологи (22).
Косвенным доказательством функциональности R генов, выявленных при помощи SCAR маркеров, служит взаимосвязь между присутствием этих маркеров и устойчивостью растений к фитофторозу. На рисунке показана зависимость полевой и лабораторной устойчивости 40 гибридов и сортов картофеля от числа маркеров R генов устойчивости в одном растении как характеристики пирамидирования генов устойчивости к фитофторозу. Для расчетов были взяты 40 генотипов — 10 сортов с низкой и высокой устойчивостью и все гибриды, кроме форм с предположительно неизвестными генами устойчивости (см. табл. 2, нижняя часть). Действительно, в этом случае устойчивость растений по результатам полевых и лабораторных тестов тесно связана с присутствием маркеров R генов: соответствующие коэффициенты параметрической корреля- ции Пирсона (0,74 и 0,67) и ранговой корреляции Спирмена (0,66 и 0,64) были значимы на уровне p < 0,01, а связь по критерию Вилкоксона — при p < 0,05. Эти данные свидетельствуют о несомненном вкладе расоспецифичных генов в устойчивость картофеля к фитофторозу (12).
Устойчивость возрастала с увеличением числа маркеров R генов, перенесенных методом гибридизации (рис.). Отсюда следует, что дальнейшие накапливающие скрещивания и отбор лучших сочетаний генов устойчивости под контролем маркеров R генов позволят объединить в одном растении больше генов устойчивости, чем современные технологии генной инженерии (1).
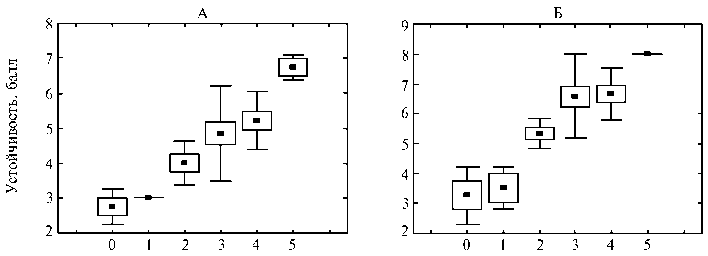
Число маркеров на одно растение
Связь лабораторной (А) и полевой (Б) устойчивости растений картофеля ( Solanum tuberosum L.) к фитофторозу с числом маркеров R генов: ■ — среднее, О — cpegHee±SEM, I— cpegHee±SD .
Особый интерес представляет небольшая группа межвидовых гибридов картофеля, которую мы оставили за пределами описанного выше статистического анализа. Они обладают высокой устойчивостью к фитофторозу, но не содержат ожидаемого большого числа маркеров R генов (см. табл. 2). Как оказалось, к этим формам относится и дигаплоид сорта Atzimba. Вероятно, такие формы несут расоспецифичные и расонеспецифичные гены устойчивости, не выявляемые с помощью примененных маркеров. В настоящее время нами ведется работа по созданию маркеров этих генов и их валидации для селекционного скрининга.
Таким образом, лучший способ противостоять появлению новых рас P . infestans — упреждающая селекция: создание селекционных доноров к фитофторозу на основе межвидовых гибридов с генами устойчивости, перенесенными из дикорастущих сородичей картофеля. Долговременная устойчивость этих гибридов определяется пирамидированием нескольких R генов (в совокупности они обеспечивают распознавание рас патогена с широким спектром специфичности и возможность оперативно реагировать даже на быстрые изменения в популяциях P . infestans ). Задача решается за счет поиска нового исходного материала среди культурных и дикорастущих форм Solanum L. секции Petota (особый интерес представляют дикорастущие виды, ранее не вовлекавшиеся в скрещивания) и создания пула межвидовых гибридов-доноров с несколькими генами устойчивости посредством интрогрессивной маркер-опосредованной селекции.
К настоящему времени в этом пуле, который поддерживается в виде клоновых коллекций в ВИР, ВНИИ картофельного хозяйства и ВНИИ фитопатологии, насчитывается более 60 межвидовых гибридов картофеля, охарактеризованных морфофизиологическими, фитопатологическими и молекулярными методами, которые уникальны по составу хозяйственно ценных генов и представляют собой готовый селекционный материал для создания сортов в сжатые сроки. Они получены традиционными методами гибридизации, что более трудоемко и затратно по времени, чем генетическая трансформация двумя-тремя генами устойчивости с широкой специфичностью. Однако по числу хозяйственно ценных генов в одном растении и способности противостоять большему числу рас P. infestans описанные клоны превосходят формы, полученные с помощью генно-инженерных технологий. Еще одно преимущество селекционных доноров на основе межвидовых гибридов — сохранение сложившегося в родительских формах генетического окружения (включая гены горизонтальной устойчивости) для интрогрессированных генов расоспецифичной устойчивости. Это стабилизирует создаваемые сорта и замедляет отбор более приспособленных форм патогена в посадках.
Итак, использование молекулярных маркеров генов устойчивости в интрогрессивной селекции означает переход к принципиально новому конструированию селекционных доноров. На примере гибридов картофеля, несущих генетический материал нескольких дикорастущих видов Solanum , нами показан значимый вклад R генов в устойчивость картофеля к фитофторозу, которая заметно возрастает при пирамидировании генов разной специфичности. Наши исследования клонов межвидовых гибридов с помощью маркеров шести R генов позволили выделить две группы генотипов: уникальные доноры для создания новых сортов и гибриды, которые несут редкие аллели генов устойчивости и поэтому перспективны прежде всего в качестве исходного материала для поиска и выделения не известных ранее R генов. Дальнейшее пирамидирование генов устойчивости посредством накапливающих скрещиваний с использованием детально охарактеризованных доноров и молекулярных маркеров позволит в ближайшем будущем создать сорта картофеля, способные сохранять продуктивность даже при значительных изменениях в популяциях Phytophthora infestans . Для этого, в свою очередь, требуется изучение специфичности генов устойчивости и конструирование надежных маркеров для массового селекционного скрининга.
Авторы благодарят Центр коллективного использования оборудования «Биотехнология» (Всероссийский НИИ сельскохозяйственной биотехнологии) за секвенирование фрагментов геномов Solanum.
Список литературы Упреждающая селекция: использование молекулярных маркеров при создании доноров устойчивости картофеля (Solanum tuberosum L.) к фитофторозу на основе сложных межвидовых гибридов
- Haverkort A.J., Boonekamp P.M., Hutten R., Jacobsen E., Lotz L.A.P., Kessel G.J.T., Vossen J.H., Visser R.G.F. Durable late blight resistance in potato through dynamic varieties obtained by cisgenesis: Scientific and societal advances in the DuRPh project. Potato Res., 2016, 59(1): 35-66 ( ) DOI: 10.1007/s11540-015-9312-6
- Cooke D., Cano L., Raffaele S., Bain R., Cooke L., Etherington G.J., Deahl K.L., Farrer R.A., Gilroy E.M., Goss E.M., Grữnwald N.J., Hein I., MacLean D., McNicol J.W., Randall E., Oliva R.F., Pel M.A., Shaw D.S., Squires J.N., Taylor M.C., Vleeshouwers V.G., Birch P.R., Lees A.K., Kamoun S. Genome analyses of an aggressive and invasive lineage of the Irish potato famine pathogen. PLoS Pathol., 2012, 8(10): e1002940 ( ) DOI: 10.1371/journal.ppat.1002940
- Fry W.E. Phytophthora infestans: New tools (and old ones) lead to new understanding and precision management. Annu. Rev. Phytopathol., 2016, 54: 529-547 ( ) DOI: 10.1146/annurev-phyto-080615-095951
- Lees A.K., Stewart J.A., Lynott J.S., Carnegie S.F., Campbell H., Roberts A.M. The effect of a dominant Phytophthora infestans genotype (13_A2) in Great Britain on host resistance to foliar late blight in commercial potato cultivars. Potato Res., 2012, 55(2): 125-134 ( ) DOI: 10.1007/s11540-012-9214-9
- Śliwka J., Zimnoch-Guzowska E. Resistance to late blight in potato. In: Translational genomics for crop breeding: biotic stress/R.K. Varshney, R. Tuberosa (eds.). John Wiley & Sons Ltd, Chichester, UK, 2013, V. 1: 221-240 ( ) DOI: 10.1002/9781118728475.ch12
- Ross H. Potato breeding: problems and perspectives. Paul Parey, Berlin, 1986.
- Bradshaw J. Potato breeding at the Scottish Plant Breeding Station and the Scottish Crop Research Institute: 1920-2008. Potato Res., 2009, 52(2): 141-172 ( ) DOI: 10.1007/s11540-009-9126-5
- Wastie R.L. Breeding for resistance. Adv. Plant Pathol., 1991, 7: 193-224.
- Колобаев В.А. Принципы и методы создания высокоэффективных доноров горизонтальной устойчивости картофеля к фитофторозу. СПб, 2001.
- Яшина И.М., Прохорова О.А., Кукушкина Л.Н. Оценка гибридных популяций картофеля для использования в селекции на полевую устойчивость к фитофторозу. Достижения науки и техники АПК, 2010, 12: 17-21.
- Danan S., Veyrieras J.-B., Lefebvre V. Construction of a potato consensus map and QTL meta-analysis offer new insights into the genetic architecture of late blight resistance and plant maturity traits. BMC Plant Biol., 2011, 11: 16 ( ) DOI: 10.1186/1471-2229-11-16
- Gebhardt C. Bridging the gap between genome analysis and precision breeding in potato. Trends Genet., 2013, 29(4): 248-256 ( ) DOI: 10.1016/j.tig.2012.11.006
- Будин К.З. Внутривидовая изменчивость и генцентры формирования фитофтороустойчивых видов рода Solanum секции Petota. Сельскохозяйственная биология, 1999, 5: 9-14.
- Будин К.З. Генетические основы создания доноров картофеля. СПб, 1997.
- Рогозина Е.В., Хавкин Э.Е., Соколова Е.А., Кузнецова М.А., Гавриленко Т.А., Лиманцева Л.А., Бирюкова В.А., Чалая Н.А., Джонс Р.В., Дил К.Л. Клоновая коллекция диких клубненосных видов и межвидовых гибридов картофеля, изученная фитопатологическим методом и с помощью ДНК-маркеров. Труды по прикладной ботанике, генетике и селекции (ВИР), 2013, 174: 23-32.
- Кузнецова М.А., Прохорова О.А., Рогожин А.Н., Сметанина Т.И., Хавкин Э.Е., Яшина И.М. Способ отбора гибридов картофеля с высокой полевой устойчивостью к фитофторозу. Патент RU № 2560725 C2, 2015. Дата приоритета 29.04.2013.
- Khavkin E.E., Fadina O.A., Sokolova E.A., Beketova M.P., Drobyazina P.E., Rogozina E.V., Kuznetsova M.A., Yashina I.M., Jones R.W., Deahl K.L. Pyramiding R genes: genomic and genetic profiles of interspecific potato hybrids and their progenitors. In: PPO-Special Report no. 16/H.T.A.M. Schepers (ed.). Wageningen, 2014: 215-220.
- Black W., Mastenbroek C., Mills W.R., Peterson L.C. A proposal for an international nomenclature of races of Phytophthora infestans and of genes controlling immunity in Solanum demissum derivatives. Euphytica, 1953, 2(3): 173-179 ( ) DOI: 10.1007/BF00053724
- Kim H.-J., Lee H.-R., Jo K.-R., Mortazavian S.M.M., Huigen D.J., Evenhuis B., Kessel G., Visser R.G.F., Jacobsen E., Vossen J.H. Broad spectrum of late blight resistance in potato differential set plants MaR8 and MaR9 is conferred by multiple stacked R genes. Theor. Appl. Genet., 2012, 124(5): 923-935 ( ) DOI: 10.1007/s00122-011-1757-7
- Pankin A., Kinash E., Rogozina E., Kozlovskaya I., Kuznetsova M., Khavkin E. Are simple Phytophthora infestans races that simple? In: PPO-Special Report. Wageningen, 2012, V. 15: 205-211.
- Zhu S., Vossen J.H., Bergervoet M., Nijenhuis M., Kodde L., Kessel G.J.T., Vleeshouwers V., Visser R.G.F., Jacobsen E. An updated conventional and a novel GM potato late blight R gene differential set for virulence monitoring of Phytophthora infestans. Euphytica, 2015, 202(2): 219-234 ( ) DOI: 10.1007/s10681-014-1276-0
- Du J., Vleeshouwers V.G. The do’s and don’ts of effectoromics. In: Plant-pathogen interactions: methods and protocols/P. Birch, J. Jones, J. Bos (eds.). Springer, NY, 2014: 257-268 ( ) DOI: 10.1007/978-1-62703-986-4_19
- Kuznetsova M.A., Spiglazova S.Yu., Rogozhin A.N., Smetanina T.I., Filippov A.V. New approaches for measuring potato susceptibility to Phytophthora infestans. In: PPO-Special Report no. 16/H.T.A.M. Schepers (ed.). Wageningen, 2014: 223-232.
- Sokolova E., Pankin A., Beketova M., Kuznetsova M., Spiglazova S., Rogozina E., Yashina I., Khavkin E. SCAR markers of the R-genes and germplasm of wild Solanum species for breeding late blight-resistant potato cultivars. Plant Genetic Resources, 2011, 9(2): 309-312 ( ) DOI: 10.1017/S1479262111000347
- Orłowska E., Llorente B., Cvitanich C. Plant integrity: an important factor in plant-pathogen interactions. Plant Signal. Behav., 2013, 8(1): e22513 ( ) DOI: 10.4161/psb.22513
- Sokolova E.A., Fadina O.A., Khavkin E.E., Rogozina E.V., Kuznetsova M.A., Jones R.W., Deahl K.L. Structural homologues of CC-NBS-LRR genes for potato late blight resistance in wild Solanum species. In: PPO-Special Report no. 16/H.T.A.M. Schep-ers (ed.). Wageningen, 2014: 247-253.
- Wang M., Allefs S., van den Berg R.G., Vleeshouwers V.G., van der Vossen E.A., Vosman B. Allele mining in Solanum: conserved homologues of Rpi-blb1 are identified in Solanum stoloniferum. Theor. Appl. Genet., 2008, 116(7): 933-943 ( ) DOI: 10.1007/s00122-008-0725-3
- Haesaert G., Vossen J.H., Custers R., de Loose M., Haverkort A., Heremans B., Hutten R., Kessel G., Landschoot S., Van Droogenbroeck B., Visser R.G.F., Gheysen G. Transformation of the potato variety Desiree with single or multiple resistance genes increases resistance to late blight under field conditions. Crop Protect., 2015, 77, 163-175 ( ) DOI: 10.1016/j.cropro.2015.07.018
- Rietman H., Bijsterbosch G., Cano L.M., Lee H.R., Vossen J.H., Jacobsen E., Visser R.G., Kamoun S., Vleeshouwers V.G. Qualitative and quantitative late blight resistance in the potato cultivar Sarpo Mira is determined by the perception of five distinct RXLR effectors. Mol. Plant-Microbe Interact., 2012, 25(7): 910-919 ( ) DOI: 10.1094/MPMI-01-12-0010-R
- Pel M.A., Foster S.J., Park T.H., Rietman H., van Arkel G., Jones J.D., Van Eck H.J., Jacobsen E., Visser R.G.F., Van der Vossen E.A. Mapping and cloning of late blight resistance genes from Solanum venturii using an interspecific candidate gene approach. Mol. Plant-Microbe Interact., 2009, 22(5): 601-615 ( ) DOI: 10.1094/MPMI-22-5-0601
- Beketova M., Pankin A., Sokolova E., Rogozina E., Kuznetsova M., Khavkin E. Two orthologues of late blight resistance gene R1 in wild Solanum species and derived potato varieties and hybrids. In: PPO-Special Report no. 17/H.T.A.M. Schepers (ed.). Wageningen, 2015: 213-220.
- Rietman H. Putting the Phytophthora infestans genome sequence at work; multiple novel avirulence and potato resistance gene candidates revealed. PhD thesis. Wageningen University, Wageningen, 2011.
- Fadina O.A., Beketova M.P., Belyantseva T.V., Kuznetsova M.A., Rogozina E.V., Khavkin E.E. Marker profiles of late blight resistance genes in complex interspecific potato hybrids. In: PPO-Special Report no. 17/H.T.A.M. Schepers (ed.). Wageningen, 2015: 195-201.
- Segretin M.E., Pais M., Franceschetti M., Chaparro-Garcia A., Bos J.I., Banfield M.J., Kamoun S. Single amino acid mutations in the potato immune receptor R3a expand response to Phytophthora effectors. Mol. Plant-Microbe Interact., 2014, 27(7): 624-637 ( ) DOI: 10.1094/MPMI-02-14-0040-R


