Уровень малондиальдегида в крови женщин, подвергшихся радиационному воздействию в результате Чернобыльской аварии
Автор: Иванова Т.И., Дзиковская Л.А., Хорохорина В.А., Мкртчян Л.С., Крикунова Л.И., Иванов С.А., Шегай П.В., Каприн А.Д.
Рубрика: Научные статьи
Статья в выпуске: 4 т.32, 2023 года.
Бесплатный доступ
При хроническом радиационном воздействии в организме возможно развитие окислительного стресса, ассоциированного со многими заболеваниями. Малондиальдегид (МДА) плазмы - общепринятый маркер окислительного стресса. Целью работы являлся анализ уровня МДА в крови жительниц районов радиоактивного загрязнения Калужской и Брянской областей спустя 28-30 лет после аварии на ЧАЭС в оценке патологий со стороны женского здоровья. Исследованы зависимости показателя МДА от возраста, величины средней накопленной за 1986-2016 гг. эффективной дозы (СНЭД) облучения, наличия доброкачественных заболеваний органов женской репродуктивной системы и щитовидной железы. Концентрацию МДА определяли по методу Темирбуланова в образцах замороженной плазмы 455 женщин (384 - территории радиоактивного загрязнения; 71 - здоровые, Обнинск (контроль)). В двух возрастных группах (£37 лет, 120 человек и >37 лет, 264 человека) оценивался уровень МДА у больных и здоровых жительниц загрязнённых районов. Статистический анализ проводили с помощью пакета программ GraphPad Prism 8.0.1, MedCalc 14.8.1. Вычисляли AUC (площадь под кривой) - показатель эффективности маркера. Значимых различий между концентрациями МДА в контроле и у здоровых жительниц загрязнённых территорий не обнаружено; корреляции содержания МДА со СНЭД не выявлены. Уровень МДА в группе женщин >37 лет значимо выше по сравнению с группой £37 лет и значимо выше у больных по сравнению со здоровыми лицами в обеих возрастных подгруппах. Интенсивность перекисного окисления липидов сопоставима при разных патологиях женской репродуктивной системы, щитовидной железы, либо их сочетаниях. В группах £37 лет и >37 лет AUC равен 0,730 (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Малоновый диальдегид, плазма крови, возраст, индекс массы тела, окислительный стресс, радиоактивное загрязнение, авария на чернобыльской аэс, доброкачественные заболевания, женская репродуктивная система, щитовидная железа, предсказательная эффективность
Короткий адрес: https://sciup.org/170201871
IDR: 170201871 | УДК: 616-055.2:616.151.11:614.876(470.3) | DOI: 10.21870/0131-3878-2023-32-4-79-93
Текст научной статьи Уровень малондиальдегида в крови женщин, подвергшихся радиационному воздействию в результате Чернобыльской аварии
После аварии на Чернобыльской атомной электростанции (ЧАЭС) в атмосферу были выброшены значительные объёмы радиоактивных веществ, включая долгоживущие радионуклиды цезия, стронция, плутония [1]. Воздействие радиоактивности на организм может вызывать окислительный стресс (ОС) – дисбаланс между производством свободных радикалов и способностью организма нейтрализовать их. Это приводит к повреждениям клеток и тканей. Регулярное обследование женщин на «постчернобыльском» пространстве актуально, поскольку репродуктивная система чувствительна к воздействию радиации. Есть реальная опасность ухудшения здоровья и развития онкологических заболеваний, сопровождаемых ОС, который индуцируется как облучением, так и гормональным дисбалансом. Редокс-статус играет важную роль в синтезе ДНК,
Иванова Т.И.* – вед. науч. сотр., к.б.н.; Дзиковская Л.А. – ст. науч. сотр., к.б.н.; Хорохорина В.А. – вед. науч. сотр., к.б.н.; Мкртчян Л.С. – вед. науч. сотр., д.м.н.; Крикунова Л.И. – гл. науч. сотр., д.м.н.; Иванов С.А. – директор, чл.-корр. РАН, д.м.н., проф. кафедры РУДН. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Шегай П.В. – зам. ген. директора, зав. центром, к.м.н.; Каприн А.Д. – ген. директор, директор МНИОИ им. П.А. Герцена, зав. каф. РУДН, акад. РАН, д.м.н., проф. ФГБУ «НМИЦ радиологии» Минздрава России.
передаче клеточных сигналов, экспрессии генов, ферментативной активности и определяется наследственными факторами и факторами внешней среды. Нарушения в редокс-гомеостазе лежат в основе патогенеза многих заболеваний, таких как рак, диабет, астма, атеросклероз, болезнь Альцгеймера и Паркинсона [2]. Малоновый диальдегид (малондиальдегид, МДА) плазмы является общепринятым маркером ОС, характеризуется как биологически активное соединение, имеющее физиологическое и патологическое значение. Измерение уровня MДA в плазме крови жителей территорий, загрязнённых после аварии на ЧАЭС, может быть одним из методов оценки ОС в организме и возможных патологий, которые могут быть вызваны радиацией и другими факторами. МДА является одним из наиболее изученных продуктов перекисного окисления липидов (ПОЛ) и служит маркером повреждения мембран клеток под воздействием свободных радикалов.
По мере увеличения возраста и индекса массы тела (ИМТ) интенсифицируются свободнорадикальные процессы, которые часто являются причиной заболеваний, в том числе онкологических. Ранняя диагностика, профилактика и принятие обоснованных стратегий лечения распространённых доброкачественных новообразований у молодых женщин являются актуальными, так как от их решения зависит сохранение репродуктивной функции. У женщин любого возраста интенсификация ОС может оказаться промежуточной стадией в ряду патологических изменений, приводящих к раку [3]. В связи с этим необходимо учитывать ассоциации экзогенных и эндогенных факторов, включая радиоактивное загрязнение окружающей среды, окислительно-восстановительный гомеостаз, возраст с патологическими процессами организма. В настоящее время активность ПОЛ и связанного с ним ОС оценивается в значительной степени по уровню МДА в крови. Исследования в этой области могут иметь важное значение для понимания индивидуальной восприимчивости к ОС, разработки персонализированных подходов к лечению и предотвращению заболеваний, связанных с ОС.
Целью работы являлся анализ уровня МДА в плазме крови женщин, проживающих в районах радиоактивного загрязнения Калужской и Брянской областей, спустя 28-30 лет после аварии на ЧАЭС в оценке патологий со стороны женской репродуктивной системы (ЖРС) и щитовидной железы (ЩЖ).
Материалы и методы
Исследование было выполнено в рамках Программы совместной деятельности по преодолению последствий чернобыльской катастрофы в рамках Союзного государства России и Беларуси. Объектом исследования была гепаринизированная замороженная плазма периферической крови 455 женщин в возрасте от 19 до 75 лет без онкологических заболеваний в анамнезе, среди которых 384 – жительницы загрязнённых районов и 71 – здоровые женщины доноры сходного возраста, проживающие в Калужской области (г. Обнинск) на чистых территориях (группа контроля).
Всем женщинам проводилось обследование (осмотр онкогинеколога, онкомаммолога, эндокринолога, ультразвуковое исследование органов малого таза, молочной и щитовидной желёз) сотрудниками МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России в ходе выездных скрининговых мероприятий на территориях Калужской и Брянской областей, в разной степени загрязнённых радионуклидами в результате аварии на ЧАЭС спустя 28-30 лет. Одновременно обследуемые подписывали форму информированного согласия на участие в исследовании, которое было одобрено Этической комиссией МРНЦ им. А.Ф. Цыба. В Калужской области представлены жительницы г. Людиново, где средняя накопленная эффективная доза (СНЭД) суммарного облучения за 1986-2016 гг. составила 4,99 мЗв [4]. Из Брянской области, в основном, представлены женщины, проживающие в гг. Клинцы и Новозыбков, где медиана СНЭД составила 23,32 мЗв [5]. Дозы были установлены с помощью математической модели с учётом соответствующей радиоэкологической информации. Доля женщин моложе 38 лет, проживающих на загрязнённых территориях, составляла 37% (120 человек из 384). На момент аварии лица данной категории находились или в раннем детском возрасте, или ещё не родились. У 85% (327 человек из 384) женщин в ходе осмотра выявлены доброкачественные заболевания органов ЖРС: миома матки, гиперплазия эндометрия, цервицит, дисплазия шейки матки, аденомиоз, эндометриоз, кисты яичников, мастопатия; а также ЩЖ: узловые образования, диффузный зоб, аутоимунный тиреоидит.
Определение МДА осуществлялось с помощью фотометрического определения окрашенного комплекса, образующегося в результате взаимодействия продуктов ПОЛ с тиобарбитуровой кислотой (ТБК) [6]. Концентрации ТБК продуктов расcчитывали по показателям оптической плотности при 532 нм. Данные получены после проведения дополнительного окисления проб ионами двухвалентного железа и применения марганцевокислого калия по методу Темирбуланова, Селезнёва [7].
Для оценки степени соответствия массы тела росту использовали рекомендованный ВОЗ показатель ИМТ, вычисляемый по формуле: I=m / h 2 (кг/м²), где m – масса тела в кг; h – рост в м. ИМТ позволяет определять степень отклонения от нормальной массы тела (18,5-25) и классифицировать людей с избыточной массой тела (25≤ИМТ<30). Симптомом ожирения является ИМТ≥30 [8].
Статистический анализ проводили стандартными методами с помощью пакета программ Exсel 2010, GraphPad Prism 8.0.1, MedCalc 14.8.1 с проверкой распределения данных на нормальность. Был выполнен корреляционный анализ с расчётом коэффициентов корреляции Спирмена. Для обнаружения различий между средними значениями двух выборок, внутри которых показатели нормально распределены, применяли t-критерий для независимых выборок. В случае, когда распределение не соответствовало нормальному, использовали непараметрические тесты Манн-Уитни и Краскел-Уоллиса. С помощью ROC (Receiver Operating Characteristic) анализа определены прогностические показатели МДА для классификации здоровых и женщин с доброкачественными заболеваниями органов ЖРС, включая молочную железу (МЖ), ЩЖ в двух возрастных группах.
Результаты и обсуждение
Проведённый анализ корреляций выявил значимую положительную связь уровня МДА с возрастом (r s =0,428; p<0,0001), ИМТ (r s =0,277; p<0,0001), наличием доброкачественных заболеваний органов ЖРС, ЩЖ (r s =0,340; p<0,0001). Значимых корреляций МДА со СНЭД не выявлено (r s =0,019; p=0,716).
Одним из механизмов, приводящих к повышению уровня МДА с возрастом, считают увеличение продукции активных форм кислорода (АФК) в митохондриях и уменьшение активности ферментов, инактивирующих АФК. Во время старения происходит накопление мутаций митохондриальной ДНК (мтДНК) и соматических мутаций [9]. Мутации мтДНК нарушают функцию дыхательной цепи, что приводит к дальнейшему увеличению продукции АФК. Устойчивый избыток АФК и недостаток в организме веществ, нейтрализующих свободные радикалы, индуцируют ОС, вызывая повреждение макромолекул клетки, деструкцию мембран и образование продуктов ПОЛ, одним из которых является МДА.
Окислительно-восстановительный гомеостаз также зависит от гормональной регуляции. Так, с повышением возраста происходит снижение синтеза мелатонина – основного гормона эпифиза, регулирующего циркадные ритмы организма. Установлено, что он эффективен в ослаблении воздействия свободных радикалов, образующихся в результате ПОЛ, а также в защите от радиационного воздействия [10]. В ходе возрастной инволюции женского организма угасает репродуктивная функция. Показано, что постменопаузальный дефицит эстрогенов связан с повышенным ОС, в то время как регулярные колебания уровня эстрогенов во время менструального цикла на него не влияют [11].
В нашей работе уровни МДА у здоровых и больных доброкачественными заболеваниями ЖРС и ЩЖ женщин были определены в двух возрастных группах: ≤37 лет и старше 37 лет (рис. 1, табл. 1). Группа молодых женщин представлена жительницами, которые ещё не были рождены или чей возраст на момент аварии не превышал 7 лет. Оценка статуса ОС у них является особенно актуальной, поскольку для лиц, облучённых в детском возрасте, избыточный относительный риск (ERR) развития рака значительно выше, чем у взрослых, особенно в отношении рака ЩЖ.
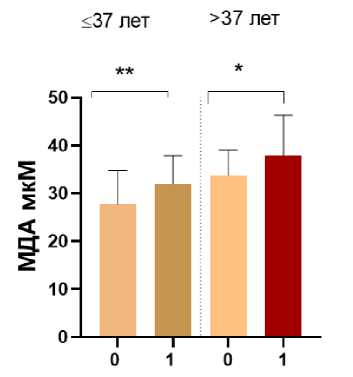
Статус здоровья
Рис. 1. Уровень МДА у здоровых (статус здоровья=0) и больных женщин (статус здоровья=1) ≤37 лет и старше 37 лет, проживающих на загрязнённых радионуклидами территориях.
Показаны значимые различия (* p=0,02; ** p=0,001).
Уровень МДА у больных женщин значимо превышает таковой у здоровых в обеих возрастных категориях (рис. 1). Известно, что при многих патологических состояниях содержание МДА повышено [12]. У здоровых женщин старшего возраста уровни МДА повышены по сравнению со здоровыми молодыми женщинами (33,76±5,29 мкМ и 27,69±7,08 мкМ соответственно, р<0,001). Аналогичные отличия с высоким уровнем значимости по показателю МДА наблюдаются и между возрастными группами пациенток (пациентки старшего возраста – 37,88±8,42 мкМ, молодые – 31,97±5,90 мкМ, р<0,001) (табл. 1). В нашем исследовании отличительной особенностью группы лиц старшего возраста является избыточный вес как у здоровых, так и у больных женщин.
Средний показатель ИМТ у здоровых женщин старшей группы составляет 30,1±5,8 кг/м2 и 28,9±5,8 кг/м2 у больных, между собой значения ИМТ значимо не различаются (р>0,05). В группе молодых женщин средний уровень ИМТ равен 23,6±4,8 кг/м2 у здоровых женщин и 24,9±5,00 у больных. Между собой значения ИМТ, как и в старшей группе, значимо не различаются (р>0,05). Наблюдаемый избыточный вес у женщин старшего возраста – типичное явление. По оценкам ВОЗ распространённость избыточной массы тела и ожирения в Европейском регионе достигла масштабов эпидемии и продолжает расти. Причины избыточной массы тела и ожирения намного сложнее, чем комбинация нездорового питания и гиподинамии. Известно, что увеличение массы тела регистрируется между 50 и 59 годами у большинства женщин, что связано с возрастной спецификой метаболизма в сочетании со смещением баланса андрогены/эстрогены в сторону андрогенов. Избыточная масса тела ассоциирована с рядом серьёзных заболеваний, среди которых установлена связь со злокачественными заболеваниями МЖ, матки и яичников, в частности [13]. К числу основных механизмов, связывающих между собой ожирение и рак, относятся дисре-гуляция метаболизма половых гормонов, а также воспаление, вызванное жировой тканью [14]. Хроническое воспаление при ожирении выявляется по увеличению содержания маркеров воспаления и цитокинов (интерлейкин 8, интерлейкин 6, фактор некроза опухоли α). Они стимулируют производство АФК макрофагами и моноцитами, приводя к ОС. Следовательно, уровень МДА увеличивается независимо от наличия доброкачественных заболеваний. Значения ИМТ между двумя возрастными группами больных и здоровых женщин различаются на высоком уровне значимости (р<0,0001). В пределах обеих возрастных групп показатели ИМТ значимо не отличались между больными и здоровыми женщинами (р>0,05). Однако, было выявлено значимое превышение показателей МДА в группах больных лиц по сравнению со здоровыми. Особенно значимые различия наблюдались у молодых женщин (рис. 1, табл. 1). Уровень МДА может различаться в зависимости от степени тяжести и характеристик заболевания.
Таблица 1 Показатели МДА в двух возрастных группах ≤37 лет и >37 лет у здоровых женщин и пациенток с доброкачественными заболеваниями, проживающих на территориях, отнесённых к зонам радиоактивного загрязнения
|
Показатель |
Здоровые |
Заболевания |
р1 |
р2 |
Общая группа больных |
|||
|
ЩЖ |
МШЯ |
МЖ |
сочетания ЩЖ и/или МШЯ и/или МЖ у одной пациентки |
|||||
|
≤37 лет |
||||||||
|
N МДА, мкМ |
30 27,7±7,1 |
9 28,5±4,3 |
26 33,0±6,3 * |
15 33,2±5,1 * |
40 31,7±6,1* |
0,005 |
0,186 |
90 32,0±5,9 * |
|
ИМТ |
23,6±4,8 |
24,0±4,9 |
26,2±5,9 |
24,4±5,0 |
24,5±4,6 |
0,553 |
0,634 |
24,9±5,0 |
|
>37 лет |
||||||||
|
N |
27 |
41 |
33 |
19 |
144 |
0,029 |
0,149 |
237 |
|
МДА, мкМ |
33,8±5,3 |
38,6±8,5 * |
34,9±7,3 |
36,5±7,2 |
38,6±8,7 * |
37,9±8,4 * |
||
|
ИМТ |
30,1±5,8 |
29,9±5,5 |
29,8±7,0 |
27,9±5,6 |
28,6±5,5 |
0,420 |
0,438 |
28,9±5,8 |
|
р3 |
0,0006 |
0,001 |
0,292 |
0,150 |
<0,0001 |
- |
- |
<0,0001 |
Примечание: N – число обследованных лиц; ЩЖ – щитовидная железа; МШЯ – патологии матки, шейки матки, яичников; МЖ – молочная железа; ИМТ – индекс массы тела; МДА – малоновый диальдегид. Данные представлены в виде среднего арифметического ± стандартное отклонение. Уровень значимости отличий: р1 – при сравнении здоровых лиц и 4 групп пациенток, Краскел-Уоллис тест; р2– при сравнении между четырьмя группами пациенток, Краскел-Уоллис тест; р3 – при сравнении уровней МДА в младшей и старшей возрастных группах; * – отличия статистически достоверны (р≤0,02) по сравнению со здоровыми женщинами соответствующей возрастной группы.
С целью оценки интенсивности ОС при разных патологиях было проведено исследование уровня МДА в группах здоровых и больных лиц в зависимости от типа заболевания (патологии ЖРС, включающие заболевания матки, шейки матки, яичников (МШЯ) и МЖ; ЩЖ; наличие двух или трёх разных заболеваний среди патологий ЖРС, МШЯ, ЩЖ у одного индивида). Показатели МДА между четырьмя группами больных с разными патологиями значимо не отличались между собой как среди молодых, так и среди женщин старшего возраста (Краскел-Уоллис тест, p=0,186 и р=0,149 соответственно) (табл. 1).
У молодых женщин патологии ЩЖ представляли собой узловые образования, при которых функция ЩЖ обычно не нарушена. В этой группе лиц уровень МДА значимо не отличался от контроля (р>0,05). У женщин старшего возраста патологии ЩЖ (многоузловой зоб, эутиреоз, тиреои-диты) ассоциированы с воспалением ЩЖ и нарушением её функций. В данной группе обнаружены максимальные значения МДА (38,6±8,5 мкМ), значимо превышающие возрастной контроль. Являясь частью эндокринной системы, ЩЖ играет ключевую роль в регуляции обмена веществ в организме, поэтому заболевания ЩЖ ведут к серьёзным сбоям не только окислительно-восстановительного гомеостаза, но и других жизненно важных физиологических процессов.
В старшей возрастной категории показатель МДА выше во всех исследуемых группах по сравнению с молодыми женщинами. Различия значимы за исключением женщин с патологиями ЖРС. В случае патологий МШЯ показатель МДА (34,9±7,3 мкМ) значимо не отличался как по сравнению с контролем своей возрастной группы (33,8±5,3 мкМ), так и по сравнению с аналогичной группой больных молодых женщин (33,0±6,3 мкМ). У женщин старшего возраста при заболеваниях МЖ уровень МДА составлял 36,5±7,2 мкМ и, хотя и был выше, но значимо не отличался от уровней МДА здоровых женщин своего возраста и молодых жительниц загрязнённых районов с патологиями МЖ (33,2±5,1 мкМ). Заболевания ЖРС включают гормональные, воспалительные, вирусные патологии, которые часто сопутствуют друг другу у одной и той же женщины. Ранее проведённые клинико-диагностические исследования в загрязнённых районах Брянской и Тульской областей обнаружили, что в структуре заболеваемости репродуктивной системы преобладали гормонозависимые патологии (миома матки, кистозные изменения яичников, нарушения менструального цикла, эндометриоз) [15]. В нашем исследовании доли молодых женщин с воспалительными и гормональными гинекологическими заболеваниями составляли по 46%. В старшей группе у 80% больных женщин обнаружены гормональные патологии, среди которых подавляющее большинство составляли миомы матки. Структура гормонозависимых гинекологических заболеваний между лицами двух возрастных категорий также различалась: миомы матки составляли 25% среди молодых женщин и 79% у женщин старшего возраста. По 17% приходилось на доли кистозных изменений яичников и эндометриоза у молодых и по 4% – в старшей возрастной группе.
Показатели МДА при заболеваниях МШЯ, вызванных гормональным дисбалансом у молодых и женщин старшего возраста, оказались сопоставимы между собой (34,7±7,28 мкМ и 34,6±7,11 мкМ соответственно). Известно, что гормональные заболевания МШЯ у молодых женщин приводят к существенным сдвигам окислительного гомеостаза, приводящим к усилению интенсивности ПОЛ, сопоставимой с таковой у больных женщин старшего возраста. При воспалительных заболеваниях уровень МДА в старшей группе выше (36,8±7,31 мкМ) по сравнению с группой молодых женщин (31,8±5,5 мкМ). Различия не достигли уровня статистической значимости. Возможно, это обусловлено тем, что доли женщин с воспалительными заболеваниями отличались между двумя возрастными группами больных женщин. В старшей группе доля лиц с воспа- лительными заболеваниями была меньше в 2 раза по сравнению с группой молодых женщин. Можно ожидать, что в случае большей выборки лиц с воспалительными заболеваниями различия в уровне МДА могли бы достичь статистической значимости.
Ранее полученные данные клинических исследований обнаружили, что в патогенезе доброкачественных опухолей ЖРС активация ПОЛ играет важную роль. Показано, что содержание МДА в сыворотке крови было выше у больных миомой матки, эндометриозом, с простой и сложной гиперплазией эндометрия по сравнению со здоровыми женщинами [16].
Патологии ЩЖ и МЖ, связанные с нарушением функций и возникающие на фоне гормонального дисбаланса, также ассоциированы с интенсификацией ОС. В ранее проведённых исследованиях было обнаружено повышение уровня МДА у пациентов с доброкачественными заболеваниями МЖ [17], при которых были выявлены изменения активности ферментов антиоксидантной защиты. Другие исследования показывают, что у пациентов с некоторыми заболеваниями ЩЖ (хронический тиреоидит, аутоиммунный тиреоидит, гипотиреоз) увеличен уровень МДА в плазме крови [18, 19]. В нашей работе аналогичные закономерности выявлены для молодых женщин в случае патологий ЖРС и для женщин старшего возраста при заболеваниях ЩЖ. В обеих возрастных группах уровень МДА в случае выявления сочетаний нескольких патологий (ЩЖ и/или МШЯ и/или МЖ) у одной женщины был значимо выше по сравнению с таковым у здоровых лиц (р≤0,01) (табл. 1).
Корреляционный анализ не обнаружил связи между показателями МДА плазмы крови и СНЭД у жительниц загрязнённых районов спустя 30 лет после аварии. В ранее проведённом исследовании нами также не было выявлено значимой зависимости МДА от величины накопленной эффективной дозы на 2014 г. и от наличия дицентриков, являющихся маркерами радиационного воздействия [20]. В другом исследовании нами было показано отсутствие различий в частоте ди-центриков между жительницами районов с разными уровнями радионуклидных загрязнений (г. Клинцы, Брянская область и г. Людиново, Калужская область) [21]. Сравнение показателей МДА между здоровыми жительницами загрязнённых территорий и контролем (чистые районы) не выявило значимых различий (р>0,05) как у молодых, так и у женщин старшего возраста (табл. 2). Таким образом, у здоровых лиц одного возраста интенсивность ПОЛ не отличается между жительницами чистых и загрязнённых территорий. Межвозрастные различия показателей МДА значимы (p<0,01) в группах здоровых лиц, населяющих загрязнённые и незагрязнённые районы.
Таблица 2
Показатели МДА в двух возрастных группах (≤37 лет и старше) у здоровых женщин в контроле и жительниц населённых пунктов Брянской, Калужской областей, отнесённых к зонам радиоактивного загрязнения (среднее±станд. отклонение)
|
Показатель |
Обнинск |
Загрязнённые территории |
||||
|
Возраст Число лиц МДА, мкМ |
≤37 лет 36 26±5,7 |
>37 лет 35 32,65±7,1 |
р 0,0001 |
≤37 лет 30 27,69±7,1 |
>37 лет 27 33,72±5,8 |
р 0,0004 |
Известно, что уровень МДА в плазме крови зависит от загрязнения окружающей среды, образа жизни, курения, употребления алкоголя, генетических факторов. Поэтому для более точной оценки вклада радиационного воздействия на интенсивность ОС у жителей загрязнённых после аварии на ЧАЭС территорий требуется проведение комплексных исследований и анализ других биомаркеров оксидативного статуса. Так, японскими учёными изучалась взаимосвязь между уровнями внутриклеточных АФК (H2O2 и O2•-) в клетках крови или субпопуляциях Т-клеток у лиц (2495 человек), переживших атомную бомбардировку в Хиросиме. Было показано, что уровни внутриклеточного O2•- в моноцитах, гранулоцитах и лимфоцитах, особенно в CD8+ T-клетках увеличивались с дозой облучения. Авторы продемонстрировали усиление ОС, обусловленное не только возрастными изменениями, но и радиационным воздействием [22].
Таким образом, анализ уровня МДА в плазме крови жительниц загрязнённых после аварии на ЧАЭС территорий, не выявил интенсификацию ОС, обусловленную радиационным воздействием. Обнаружено, что ОС у молодых женщин, населяющих загрязнённые территории, активируется при заболеваниях ЖРС, а также в случае их сочетаний друг с другом или с заболеваниями ЩЖ. При узловых заболеваниях ЩЖ у молодых женщин не выявлено повышения интенсивности ОС. У женщин старшего возраста интенсификация ОС стресса обусловлена избыточным весом и наличием доброкачественных заболеваний ЩЖ, а также наличием разных сочетаний патологий ЖРС и ЩЖ у одного индивида.
В настоящее время проводятся исследования, направленные на оценку возможности использования показателей ОС в качестве биологических маркеров опухолевого процесса. Была показана возможность использования уровня МДА, измеренного как в сыворотке крови, так и в фолликулярной жидкости, в качестве неинвазивного диагностического биомаркера эндометриоза у женщин моложе 40 лет [16]. Однако, повышенный уровень МДА характерен также для широкого спектра заболеваний, ассоциированных с ОС и воспалением. Поэтому более корректным представляется его использование в качестве маркера-классификатора здоровых и лиц, в отношении которых имеется настороженность по поводу наличия заболеваний и нуждающихся в комплексном обследовании. Маркеры-классификаторы часто используют при массовом скрининге для первичной клинической оценки с целью исключения лиц, не имеющих заболеваний [23]. Мы провели ROC (Receiver Operator Characteristic) анализ для оценки эффективности уровня МДА плазмы как потенциального биомаркера для классификации здоровых и больных (доброкачественные заболевания ЖРС, ЩЖ) женщин, проживающих на загрязнённых территориях. ROC кривые широко используются в медицине, они позволяют визуализировать, систематизировать и выбирать классификаторы на основе их эффективности. AUC (Area Under Curve) – площадь под ROC кривой, интегральный показатель прогностической эффективности маркера, представляет собой вероятность отличить больного от здорового, ориентируясь на маркер [23]. Значения AUC меньше 0,6 свидетельствуют о непригодности потенциального маркера для решения поставленной задачи, больше 0,7 – оценивают маркер как хороший классификатор. В нашем случае AUC отражает вероятность того, что уровень МДА у случайно выбранной больной женщины будет выше, чем у случайно выбранной здоровой женщины. Анализ проводился как в общей группе обследованных женщин, так и в каждой возрастной подгруппе (≤37 лет и >37 лет). В проведённом исследовании показатели МДА были сопоставимы при разных патологиях ЖРС, ЩЖ и их сочетаниях в обеих возрастных подгруппах женщин, т.е. не обнаружено значимых различий в интенсивности ОС между этими патологиями. Однако, отличия общей группы и отдельно взятых обеих возрастных подгрупп пациенток от здоровых женщин были статистически значимы. В общей группе, объединяющей женщин всех возрастов, величина AUC равна 0,718; р<0,0001, доверительный интервал (ДИ) 0,675-0,759. Точкой отсечения является уровень МДА, превышающий 30,46 мкМ, чувствительность и специфичность равны 77% и 55,5% соответственно (табл. 3).
В группе молодых женщин показатель AUC выше и составляет 0,730, р<0,0001, ДИ 0,653-0,798. Точкой отсечения является уровень МДА, превышающий 27,69 мкМ, при котором чувствительность и специфичность равны 76,7% и 60,6% соответственно. В старшей возрастной группе показатель AUC ниже и составляет 0,666, р<0,0001, ДИ 0,609-0,719. При значениях, превышающих уровень 39,92 мкМ, чувствительность и специфичность равны 39% и 92%. Можно предположить, что уровень МДА является хорошим маркером-классификатором больных (повышенный уровень при доброкачественных заболеваниях ЖРС и ЩЖ) и здоровых женщин, проживающих на загрязнённых территориях. Показано, что точки отсечения концентраций МДА между группами женщин ≤37 лет и >37 лет различны и равны 27,69 мкМ и 39,92 мкМ соответственно. В зависимости от возраста женщин специфичность и чувствительность МДА в одной и той же концентрации будет разной. Так, для женщин старшего возраста при уровне МДА больше 27,7 мкМ (точка отсечения для молодых) специфичность равна 24%, при значениях МДА выше 30,46 мкМ (точка отсечения суммарной группы) специфичность составляет 35,5%, а при показателе МДА >39,92 мкМ (точка отсечения в группе лиц старшего возраста) специфичность равна 92%. Специфичность у молодых женщин при уровне МДА, соответствующему точке отсечения в общей группе больных женщин (30,46 мкМ), равна 74,2%, а в случае превышения значений 39,92 мкМ (точка отсечения старшей возрастной группы) – 95,5%.
Таблица 3
Показатели предсказательной эффективности МДА плазмы жительниц загрязнённых районов в определении здоровых лиц и группы риска (наличие заболеваний ЖРС, ЩЖ)
|
Показатель |
≤37 лет |
> 37 лет |
Сумма |
|
AUC (95% ДИ) |
0,730 (0,653-0,798) |
0,666 (0,609-0,719) |
0,718 (0,675-0,759) |
|
р |
<0,0001 |
<0,0001 |
<0,0001 |
|
Точка отсечения |
>27,69 мкМ |
>39,92 мкМ |
>30,46 мкМ |
|
Чувствительность, % |
76,7 |
39 |
77 |
|
Специфичность, % |
60,6 |
92 |
55,5 |
Примечание: ЖРС – женская репродуктивная система; ЩЖ – щитовидная железа; AUC (Area Under Curve) – площадь под ROC кривой, показатель прогностической эффективности маркера.
Следует отметить, что уровень МДА только один из многих параметров, которые могут использоваться для первичной оценки статуса здоровья и классификации на «больные» и «здоровые». Интерпретация результатов требует комплексного подхода и учёта других факторов, которые могут влиять на уровни маркеров ОС в организме. Для точной диагностики и лечения необходимо обращаться к врачам, которые проведут комплексное обследование и подберут оптимальное лечение для каждого конкретного случая.
Заключение
В течение 30 лет после аварии на ЧАЭС проводился мониторинг здоровья жительниц районов радиоактивного загрязнения Брянской и Калужской областей. В числе многих показателей была проведена количественная оценка содержания МДА плазмы крови в зависимости от возраста, статуса здоровья, ИМТ, СНЭД. Было обнаружено, что уровень МДА повышается по мере старения организма, с увеличением ИМТ, а также при наличии доброкачественных заболеваний
ЖРС, ЩЖ, или их сочетаний (у одной женщины). Показано, что ОС у молодых женщин, населяющих загрязнённые территории, активируется при заболеваниях ЖРС, а также в случае их сочетаний друг с другом или с заболеваниями ЩЖ. Пороговая концентрация МДА у молодых женщин ниже по сравнению с таковой у женщин старшего возраста. Не выявлено значимых отличий в интенсивности ПОЛ между женщинами с доброкачественными заболеваниями ЖРС, ЩЖ, либо имеющими их сочетания. Не обнаружено связи между показателями МДА плазмы крови и СНЭД. Установление факта повышенного уровня МДА в плазме крови может заслуживать пристального внимания в отношении наличия патологических состояний и показанием для комплексного обследования. Определение концентрации МДА плазмы может быть использовано для первичной классификации здоровых и лиц с различными заболеваниями, связанными с ОС. Полученные данные могут иметь важное значение для понимания индивидуальной восприимчивости к ОС, разработки персонализированных подходов к лечению и предотвращению заболеваний, связанных с ОС. Необходимо дальнейшее проведение исследований уровня МДА и других маркеров ОС плазмы крови для верификации данных и с целью получения точных и эффективных инструментов в оценке статуса здоровья населения.
Список литературы Уровень малондиальдегида в крови женщин, подвергшихся радиационному воздействию в результате Чернобыльской аварии
- Экологические последствия аварии на Чернобыльской АЭС и их преодоление: двадцатилетний опыт. Доклад экспертной группы «Экология» Чернобыльского форума. Вена: МАГАТЭ, 2008. 180 с. [Электронный ресурс]. URL: https://www-pub.iaea.org/MTCD/publications/PDF/Pub1239r_web.pdf.
- Giustarini D., Dalle-Donne I., Tsikas D., Rossi R. Oxidative stress and human diseases: origin, link, measurement, mеchanisms, and biomarkers //Crit. Rev. Clin. Lab. Sci. 2009. V. 46, N 5-6. P. 241-281.
- Doherty M.T., Sanni O.B., Coleman H.G., Cardwell C.R., McCluggage W.G., Quinn D., McMenamin Ú.C. Concurrent and future risk of endometrial cancer in women with endometrial hyperplasia: a systematic review and meta-analysis //PLoS One. 2020. V. 15, N 4. P. e0232231. DOI: 10.1371/journal.pone.0232231.
- Брук Г.Я., Базюкин А.Б., Братилова А.А., Власов А.Ю., Громов А.В., Жеско Т.В., Кадука А.Н., Кадука М.В., Кравцова О.С., Романович И.К., Сапрыкин К.А., Степанов В.С., Титов Н.В., Яковлев В.А. Средние накопленные за 1986-2016 годы эффективные дозы облучения жителей населённых пунктов Российской Федерации, отнесённых к зонам радиоактивного загрязнения по постановлению Правительства Российской Федерации от 08.10.2015 № 1074 «Об утверждении Перечня населённых пунктов, находящихся в границах зон радиоактивного загрязнения вследствие катастрофы на Чернобыльской АЭС» //Радиационная гигиена. 2017. Т. 10, № 2. С. 57-105.
- Власов О.К., Брук Г.Я., Щукина Н.В. Разработка и верификация технологии реконструкции эффективных доз облучения населения России после аварии на ЧАЭС //Радиация и риск. 2017. Т. 26, № 3. С. 28-45.
- Рябченко Н.И., Иванник Б.П,, Хорохорина В.А., Дзиковская Л.А., Синькова Р.В., Рябченко В.И., Грошева И.П., Дегтярева Е.В. Влияние предварительного адаптирующего облучения на содержание продуктов перекисного окисления липидов в сыворотке крови и повреждение ДНК в тимусе облучённых мышей //Радиационная биология. Радиоэкология. 2000. Т. 40, № 6. С. 659-661.
- Темирбуланов Р.А., Селезнёв Е.Н. Метод повышения интенсивности свободнорадикального окисления липидосодержащих компонентов крови и его диагностическое значение //Лабораторное дело. 1981. №. 4. С. 209-211.
- WHO European Regional Obesity Report 2022. Copenhagen: WHO Regional Office for Europe, 2022. 220 p. [Электронный ресурс]. URL: https://apps.who.int/iris/bitstream/handle/10665/353747/9789289057738-eng.pdf.
- Tiwari P., Wankhede, N., Badole, S., Umare, M., Taksande, B., Upaganlawar A., Umekar M., Kale M. Mitochondrial dysfunction in ageing: involvement of oxidative stress and role of melatonin //Bull. Env. Pharmacol. Life Sci. 2021. V. 10, N 2. P. 156-172.
- Yang H.L., Zhou W.J., Gu C.J., Meng Y.H., Shao J., Li D.J., Li M.Q. Pleiotropic roles of melatonin in endometriosis, recurrent spontaneous abortion, and polycystic ovary syndrome //Am. J. Reprod. Immunol. 2018. V. 80, N 1, P. e12839. DOI: 10.1111/aji.12839.
- Ishikawa A., Matsushita H., Shimizu S., Morita N., Hanai R., Sugiyama S., Watanabe K., Wakatsuki A. Impact of menopause and the menstrual cycle on oxidative stress in Japanese women //J. Clin. Med. 2023. V. 12, N 3. P. 829. DOI: 10.3390/jcm12030829.
- Tsikas D. Assessment of lipid peroxidation by measuring malondialdehyde (MDA) and relatives in biological samples: analytical and biological challenges //Anal. Biochem. 2017. V. 524. P. 13-30.
- IARC handbooks of cancer prevention. Volume 16: body fatness. Geneva: WHO, 2016. [Электронный ресурс]. URL: https://www.iarc.who.int/featured-news/media-centre-iarchandbooks16/.
- Renehan A.G., Zwahlen M., Egger M. Adiposity and cancer risk: new mechanistic insights from epidemiology //Nat. Rev. Cancer. 2015. V. 15, N 8. P. 484-498.
- Крикунова Л.И., Мкртчян Л.С., Замулаева И.А., Рябченко Н.И., Киселева В.И., Иванова Т.И., Мельницкая Т.Б., Хорохорина В.А. Роль специализированной и высокотехнологичной медицинской помощи в выявлении и профилактике онкопатологии гинекологической сферы //Медицинские радиоло-гические последствия Чернобыля: прогноз и фактические данные спустя 30 лет. М: Геос, 2015. С. 220-241.
- Nasiri N., Moini A., Eftekhari-Yazdi P., Karimian L., Salman-Yazdi R., Arabipoor A. Oxidative stress statues in serum and follicular fluid of women with endometriosis //Cell J. 2017. V. 18, N 4. P. 582-587.
- Karki K., Pande D., Negi R., Khanna S., Khanna R.S., Khanna H.D. Correlation of serum toll like receptor 9 and trace elements with lipid peroxidation in the patients of breast diseases //J. Trace Elem. Med. Biol. 2015. V. 30. P. 11-16.
- Mseddi M., Ben Mansour R., Gargouri B., Mnif F., El Ghawi S., Hammami B., Ghorbel A., Abid M., Lassoued S. Proteins oxidation and autoantibodies' reactivity against hydrogen peroxide and malondialdehyde-oxidized thyroid antigens in patients' plasmas with Graves' disease and Hashimoto Thyroiditis //Chem. Biol. Interact. 2017. V. 272. P.145-152.
- Cheserek M.J., Wu G.R., Ntazinda A., Shi Y.H., Shen L.Y., Le G.W. Association between thyroid hormones, lipids and oxidative stress markers in subclinical hypothyroidism //J. Med. Biochem. 2015. V. 34, N 3. P. 323-331.
- Иванова Т.И., Фесенко Э.В., Дзиковская Л.А., Дегтярёва Е.С., Мкртчян Л.С., Овсянникова Н.С., Хорохорина В.А., Крикунова Л.И. Исследование аберраций хромосом и маркеров оксидативного стресса (малоновый диальдегид, общая антиоксидантная активность плазмы) у жительниц загрязнённых после аварии на ЧАЭС территорий //Радиация и риск. 2018. Т. 27, № 2. С. 46-61.
- Иванова Т.И., Мкртчян Л.С., Антощина М.М., Фесенко Э.В., Хорохорина В.А., Овсянникова Н.С., Паршин В.С., Сыченкова Н.И., Рагулин Ю.А., Жарикова И.А., Рябченко Н.И., Крикунова Л.И. Цитогенетические показатели у больных и здоровых жительниц загрязнённых радионуклидами районов Брян-ской и Калужской областей //Радиационная биология. Радиоэкология. 2018. Т. 58, № 2. С. 117-125.
- Hayashi T., Furukawa K., Morishita Y., Hayashi I., Kato N., Yoshida K., Kusunoki Y., Kyoizumi S., Ohishi W. Intracellular reactive oxygen species level in blood cells of atomic bomb survivors is increased due to aging and radiation exposure //Free Radic. Biol. Med. 2021. V. 171. P. 126-134.
- Рубанович А.В., Хромов-Борисов Н.Н. Теоретический анализ показателей предсказательной эффективности бинарных генетических тестов //Экологическая генетика. 2013. Т. XI, № 1. С. 77-90.


