Уровень оксидативного стресса в эндотелиальных клетках, культивируемых в присутствии митомицина С
Автор: Синицкий М.Ю., Синицкая А.В., Шишкова Д.К., Асанов М.А., Хуторная М.В., Понасенко А.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 3 т.37, 2022 года.
Бесплатный доступ
Обоснование. Атеросклероз - одна из ведущих патологий сердечно-сосудистой системы. Показано, что одним из факторов риска данного заболевания является повреждение ДНК эндотелиальных клеток, приводящее к эндотелиальной дисфункции и вызванное воздействием на клетки мутагена митомицина С (ММС). ММС оказывает алкилирующее действие на ДНК и вовлечен в процесс формирования оксидативного стресса, также являющегося фактором риска развития атеросклероза.Цель исследования: оценить уровень маркеров оксидативного стресса в культурах первичных эндотелиальных клеток человека, экспонированных мутагеном алкилирующего механизма действия ММС.Материал и методы. Материалом исследования послужили коммерческие культуры первичных эндотелиальных клеток коронарной (HCAEC) и внутренней грудной (HITAEC) артерий человека, культивируемые в присутствии 500 нг/мл ММС (экспериментальная группа) и без мутагенной нагрузки (контрольная группа). Уровень активных форм кислорода, азота и 8-OH-дезоксигуанозина (8-OHdG) определяли в культуральной среде методом иммуноферментного анализа (ИФА). Относительную длину теломерных участков ДНК эндотелиальных клеток, а также экспрессию генов TERT и POT1 оценивали с помощью метода количественной полимеразной цепной реакции (кПЦР) с детекцией продуктов амплификации в режиме реального времени. Статистическую обработку результатов исследования проводили в программе GraphPad Prism 9.Результаты. В результате проведенной работы установлено, что концентрация активных форм кислорода, реактивных форм азота (NO2 -, NO3 -, NO2 -/NO3 -) и 8-OHdG статистически значимо не различалась в экспериментальной и контрольной группах клеток HCAEC и HITAEC. При этом в экспонированных ММС клетках HCAEC и HITAEC отмечено уменьшение относительной длины теломерных участков ДНК по сравнению с неэкспонированным контролем (10,97 против 27,03 в клетках HCAEC, p = 0,002 и 9,12 против 25,64 в клетках HITAEC, p = 0,001). Кроме того, в экспонированных ММС клетках HCAEC установлено 1,75-кратное повышение экспрессии гена POT1 относительно контроля (p = 0,019). Ген TERT не экспрессировался ни в одной из изученных групп.Заключение. Мутаген алкилирующего механизма действия ММС в эксперименте in vitro не вызывает выраженный оксидативный стресс в культурах первичных эндотелиальных клеток человека. Формирование эндотелиальной дисфункции, ассоциированной с экспозицией клеток ММС, обусловлено, главным образом, генотоксическим стрессом, связанным с алкилированием ДНК эндотелиальных клеток.
Эндотелиальная дисфункция, оксидативный стресс, мутагенез, атерогенез, теломеры, теломераза
Короткий адрес: https://sciup.org/149141427
IDR: 149141427 | УДК: 577.152.1:611-018.74:57.086.83 | DOI: 10.29001/2073-8552-2022-37-3-121-127
Текст научной статьи Уровень оксидативного стресса в эндотелиальных клетках, культивируемых в присутствии митомицина С
Согласно статистике, патологии сердечно-сосудистой системы на настоящий момент занимают лидирующую позицию в структуре заболеваемости и смертности как во всем мире, так и в России, с тенденцией к росту в 2030 г. до 23 млн случаев. При этом причиной абсолютного большинства смертей среди всех патологий сердечно-сосудистого континуума является атеросклероз [1], представляющий собой мультифакторное воспалительное заболевание, в основе которого лежит развитие эндотелиальной дисфункции, факторами риска которой является гиперхолистеремия, артериальная гипертензия, сахарный диабет, курение и ряд других [2]; обсуждается также роль повреждения ДНК в атерогенезе [3].
В последнее десятилетие активно изучалась связь между воспалением, оксидативным стрессом, мутагенезом и атерогенезом [3]. Так, известно, что некоторые факторы риска развития атеросклероза (например, сахарный диабет и курение), а также ряд экзогенных токсических веществ способствуют образованию активных форм кислорода в сосудистом русле, участвующих в атерогене-зе [4]. Отмечается повышенный уровень ароматических ДНК-аддуктов, являющихся маркерами оксидативного стресса, в клетках атеросклеротических бляшек, таких как макрофаги, гладкомышечные и эндотелиальные клетки, по сравнению со здоровыми тканями [5]. В экспериментальных работах показано, что экспозиция культур первичных эндотелиальных клеток человека мутагеном митомицином С (ММС) приводит к выраженному воспалительному ответу и развитию эндотелиальной дисфункции [6]. Известно, что ММС способен вызвать генотоксический стресс за счет образования поперечных сшивок молекулы ДНК в результате реакции N-алкилирования, что приводит в конечном итоге к нарушению процессов транскрипции, трансляции и гибели клеток путем апоптоза [7]. Кроме этого, ММС способен вызвать и оксида-тивный стресс за счет циклического одноэлектронного восстановления молекулы ММС с последующим окислением молекулярным кислородом, в результате чего образуется супероксидный радикал – чрезвычайно активная частица, относящаяся к активным формам кислорода. Активные формы кислорода оказывают повреждающее действие на различные типы биологических молекул, таких как ДНК, липиды и белки, что приводит к инактивации ферментов, повреждению ДНК, дисфункции и гибели клеток [8]. Таким образом, понимание ведущего механизма действия ММС на эндотелиальные клетки, приводящего к развитию эндотелиальной дисфункции, является чрезвычайно актуальным для современной сосудистой биологии и внесет вклад в понимание фундаментальных аспектов атерогенеза.
Цель исследования: оценить уровень маркеров окси-дативного стресса в культурах первичных эндотелиальных клеток человека, экспонированных мутагеном алкилирующего механизма действия ММС.
Материал и методы
Материалом исследования послужили коммерческие культуры первичных эндотелиальных клеток коронарной (Human Coronary Artery Endothelial Cells, HCAEC) и внутренней грудной (Human Internal Thoracic Endothelial Cells, HITAEC) артерий (Cell Applications, США). Данные клеточные линии были выбраны в связи с их разной по-ражаемостью атеросклерозом: так, атеросклеротическое поражение коронарной артерии встречается наиболее часто, в том время как внутренняя грудная артерия практически не подвержена атеросклерозу [9]. Все работы с клеточными культурами проводили в асептических условиях. Клетки культивировали в условиях повышенной влажности, 5%-го содержания CO2 и при температуре 37 ˚C в среде для роста клеток Human MesoEndo Cell Growth Medium (Cell Applications, США) до достижения 80% конфлюентности, после чего пересевали в 6-лу-ночные культуральные планшеты, содержащие по 2 мл среды для роста клеток в каждой лунке, и культивировали еще сутки. После окончания культивирования старую среду для роста клеток удаляли и приливали в каждую лунку 2 мл свежей среды, содержащей 500 нг/мл алкилирующего мутагена ММС (AppliChem, Испания) (экспериментальная группа) или 0,9% раствор NaCl (контрольная группа). Экспериментальные и контрольные планшеты культивировали в стандартных условиях в течение 6 ч, после этого проводили замену культуральной среды на чистую и культивировали клетки еще сутки, после чего выводили из эксперимента. Выбор концентрации ММС и времени культивирования в условиях мутагенной нагрузки был обусловлен имеющимися рекомендациями по моделированию мутагенеза in vitro и результатами собственных исследований [6].
Относительная длина теломерных (ОДТ) участков ДНК оценивалась методом количественной полимеразной цепной реакции (кПЦР) с детекцией продуктов амплификации в режиме реального времени с использованием SYBR Green праймеров, изготовленных компанией ЗАО «Евроген» (Москва, Россия). В качестве референса был использован ген HBG1 . Характеристика праймеров, использованных для оценки ОДТ, представлена в таблице 1.
Таблица 1. Характеристика праймеров, использованных для оценки относительной длины теломер
Table 1. Characteristics of primes used for relative telomere length assessment
Праймер Primer
Telo
HBG1
Последовательность Sequence
F:GGTTTTTGAGGGTGAGGGTGAGGGTGAGGGTGA GGGT
R:TCCCGACTATCCCTATCCCTATCCCTATCCCTATCC CTA
F:GCTTCTGACACAACTGTGTTCACTAGC R:CACCAACTTCATCCACGTTCACC
Примечание: ОДТ – относительная длина теломер, F – прямой праймер, R – обратный праймер.
Note: RLT – relative telomere length, F – forward primer, R – reverse primer.
Из экспериментальных и контрольных клеток HCAEC и HITAEC выделяли геномную ДНК по стандартному протоколу фенол-хлороформной экстракции и оценивали ее качество на спектрофотометре NanoDrop 2000 (Thermo Scientific, США). ПЦР проводили на амплификаторе ViiA 7 (Applied Biosystems, США) в 96-луночном планшете, включающем в себя изучаемые образцы, пять стандартов с двукратным разведением и отрицательный контроль, анализируемые в трех технических повторах. Для проведения амплификации на каждый образец готовили по 10 мкл реакционной смеси, содержащей 5 мкл мастер-микса PowerUp SYBR Green Master Mix (Applied Biosystems, США), по 500 нМ прямого и обратного праймеров (ЗАО «Евроген», Москва) и 5 мкл раствора геномной ДНК (либо деионизированной воды в случае с отрицательным контролем). Амплификацию проводили по следующей программе: 2 мин при 50 °C (1 цикл), 2 мин при 95 °C (1 цикл), 15 с при 95 °C и 60 с при 60 °C (40 циклов). ОДТ рассчитывалась по следующей формуле:
ОДТ = [2 Ct (Telo) /2 Ct (HBG1) ] –1 [10].
Для оценки экспрессии генов POT1 и TERT было проведено выделение общей РНК из эндотелиальных клеток при помощи коммерческого набора RNeasy Plus Universal Mini Kit (Qiagen, Германия) по протоколу производителя. Количество и чистота выделенной РНК определяли на спектрофотометре NanoDrop 2000 (Thermo Scientific, США), а ее качество – на флуориметре Qubit
4 (Invitrogen, США) путем оценки индекса RIQ (RNA Integrity and Quality) с использованием набора реагентов Qubit RNA IQ Assay Kit (Invitrogen, США). Далее на основе выделенной РНК с помощью реакции обратной транскрипции и набора High Capacity cDNA Reverse Transcription Kit (Applied Biosystems, США) была синтезирована молекула комплиментарной ДНК (кДНК). Генная экспрессия оценивалась с помощью метода кПЦР с использованием SYBR Green праймеров, изготовленных компанией ЗАО «Евроген» (Москва, Россия), на амплификаторе ViiA 7 (Applied Biosystems, США). Нормирование результатов ПЦР проводилось с помощью трех референсных генов на ампли-фикаторе ViiA 7 (Applied Biosystems, США), таблица 2.
Таблица 2. Характеристика праймеров, использованных для оценки генной экспрессии
Table 2. Characteristics of primers used for gene expression assessment
|
Праймер Primer |
Последовательность Sequence |
|
POT1 |
F:GCAAAAGGAGTATTCTAACAAACAG R:TCACGCTTACACCAAAATCG |
|
TERT |
F:TTTCTGGAGCTGGTTGGGAA R:GAAGAGCCTGAGCAGCTCGA |
|
HPRT1 |
F:TTGCTTTCCTTGGTCAGGCA R:TCGTGGGGTCCTTTTCACCA |
|
GAPDH |
F:AGCCACATCGCTCAGACAC R:GCCCAATACGACCAAATCC |
|
B2M |
F:TCCATCCGACATTGAAGTTG R:CGGCAGGCATACTCATCTT |
Примечание: F – прямой праймер, R – обратный праймер.
Note: F – forward primer, R – reverse primer.
Методика приготовления реакционной смеси и программа амплификации были аналогичны описанным в разделе по оценке ОДТ. Уровень экспрессии генов POT1 и TERT рассчитывали по методу ΔCt (Уровень экспрессии = 2Ct [среднее геометрическое референсных генов] -Ct [ген интереса]) и выражали в виде условных единиц (у. е.). Оценку генной экспрессии проводили в строгом соответствии с существующими стандартами [11].
Статистический анализ результатов исследования выполняли в программе StatSoft STATISTICA 10. Для количественных показателей рассчитывали медиану ( m ) и межквартильный размах (IQR), сравнение двух независимых групп проводили с помощью U- критерия Манна – Уитни. Различия между группами считали статистически значимыми при значениях p < 0,05.
Результаты
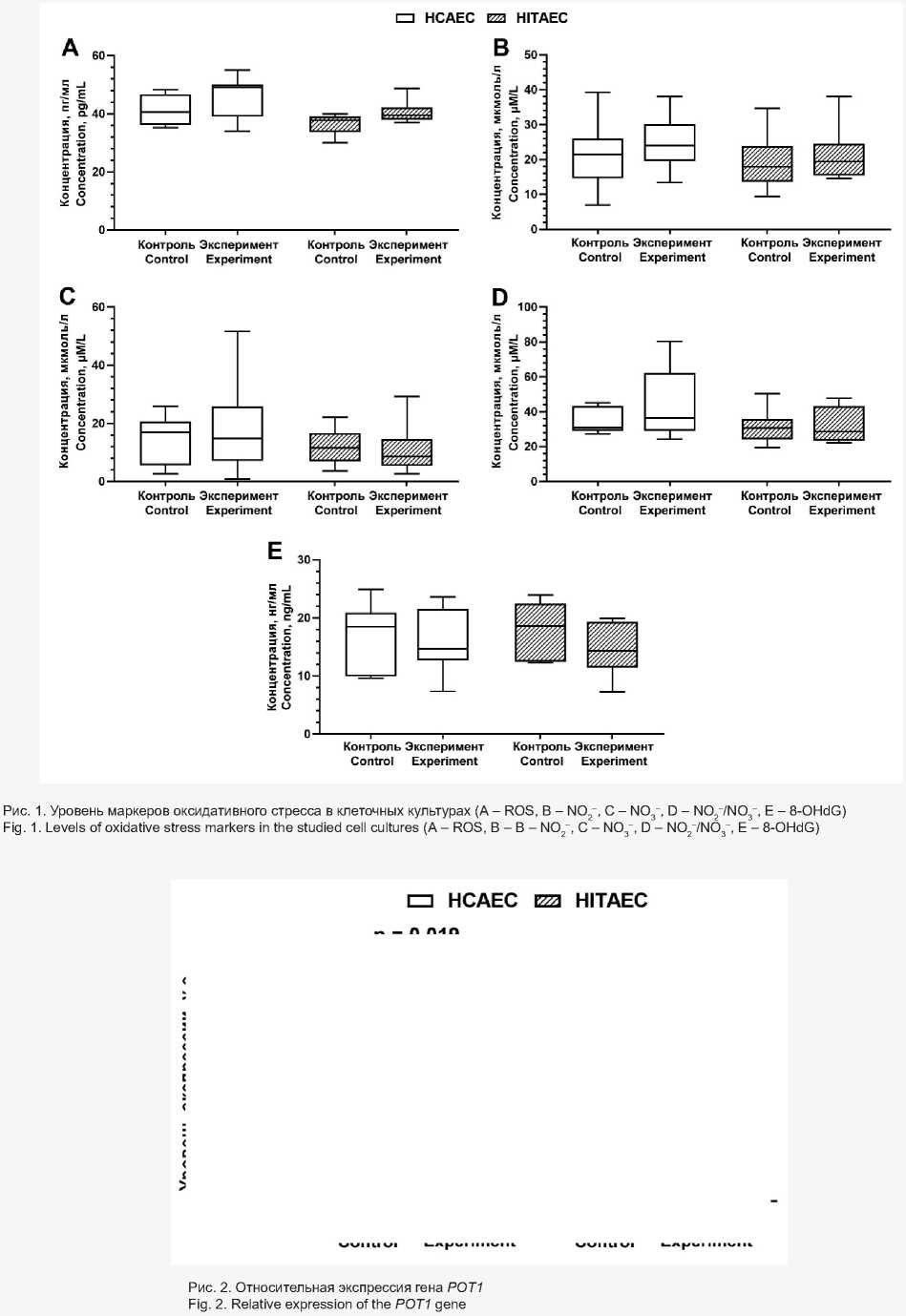
В результате оценки уровня маркеров оксидативно-го стресса в клеточных культурах, таких как ROS, NO2–, NO3–, NO2–/NO3– и 8-OHdG, не обнаружено статистически значимого изменения изученных показателей в клетках HCAEC и HITAEC, экспонированных ММС, по сравнению с контрольной группой (рис. 1).
Одновременно с этим в экспонированных ММС клетках HCAEC и HITAEC было отмечено уменьшение ОДТ по сравнению с неэкспонированным контролем (10,97 против 27,03 в клетках HCAEC, p = 0,002 и 9,12 против 25,64 в клетках HITAEC, p = 0,001). Кроме того, в клетках HCAEC было обнаружено статистически значимое 1,75-кратное увеличение уровня экспрессии гена POT1 (Protection Of
Telomeres 1) на уровне p = 0,019, в то время как в клетках HITAEC данный ген экспрессировался на одинаковом уровне и в экспериментальной, и в контрольной группах (рис. 2). Ген TERT (Telomerase Reverse Transcriptase) в изученных клеточных культурах не экспрессировался.
Обсуждение
Вместе с тем токсическое действие ММС на биологические молекулы, в том числе и на ДНК, может проявляться и посредством активации оксидативного стресса, в результате чего происходит образование гидроксильного радикала (•OH), который вовлечен в большинство путей оксидативного повреждения молекулы ДНК [13]. Образование •OH зачастую сопровождается активацией NO-синтаз, стимулирующих образование оксида азота (•NO), который может взаимодействовать с анион-ради-калом с образованием достаточно мощного окислителя пероксинитрита (ONOO-), относящегося к реактивным формам азота и также участвующего в повреждении ДНК [14]. Для оценки свободнорадикального повреждения ДНК наиболее часто используется такой маркер, как 8-OHdG [15].
В результате проведенного нами исследования в эндотелиальных клетках различных артерий, in vitro экспонированных мутагеном алкилирующего механизма действия ММС, не выявлено повышения активных форм кислорода, реактивных форм азота и 8-OHdG по сравнению с неэкспонированным контролем. Вместе с тем существующие исследования на моделях лабораторных животных показывают, что пораженная атеросклерозом аорта характеризуется уменьшением уровня оксидатив-ных повреждений ДНК от интимы к адвентиции, при этом в интиме уровень 8-OHdG в 2,8 раза выше, чем в медии, что объясняется хронической экспозицией эндотелиального монослоя сосудов мутагенами окружающей среды, циркулирующими в кровотоке [5].
Несмотря на отсутствие повышения уровня свободных радикалов в экспонированных ММС клеточных культурах, в нашем эксперименте было обнаружено значительное снижение ОДТ эндотелиальных клеток из экспериментальной группы. Длина теломер поддерживается за счет фермента теломеразы, кодируемого геном TERT . Показано, что изменение длины теломер ассоциировано с воспалением и оксидативным стрессом [16].
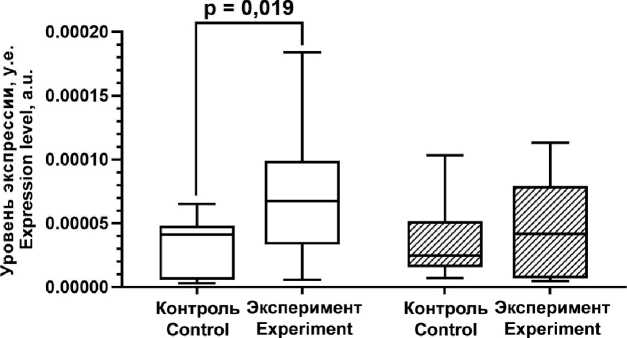
Оксидативный стресс способствует разрушению теломерных участков хромосом в процессе клеточного деления in vitro и также стимулирует выработку провоспалительных цитокинов [17]. Интересно, что в нашем эксперименте в экспонированных ММС эндотелиальных клетках наблюдается снижение ОДТ с одновременным отсутствием выраженного оксидативного стресса (уровень активных форм кислорода, реактивных форм азота и 8-OHdG в экспериментальной и контрольной группах находился на одном и том же уровне). Вероятным объяснением этого может служить деградация теломерных участков ДНК в результате прямого действия ММС, а также воздействие на теломеры провоспалительных цитокинов, активно синтезирующихся в результате экспозиции клеточных культур ММС и участвующих в клеточном старении, при котором также отмечается уменьшение длины теломер [18]. Наблюдаемое в экспонированных ММС клетках HCAEC (более чувствительных к действию ММС в сравнении с клетками HITAEC) повышение экспрессии гена POT1, кодирующего белок, защищающий теломеры от повреждения за счет подавления ATR-сигнального пути и привлечения теломеразы к теломерам для их восстановления [19], вероятно, является компенсаторным механизмом на действие мутагена, играющим важную физиологическую роль, заключающуюся в поддержании стабильности хромосом эндотелиальных клеток, культивируемых в условиях генотоксической нагрузки. Необходимо отметить, что нам не удалось оценить экспрессию гена TERT в изученных группах, что, вероятно, связанно с чрезвычайно низким уровнем экспрессии теломеразы в зрелых клетках [20].
Следует отметить, что представленное исследование имеет ряд ограничений. В частности, результаты, полученные в ходе эксперимента in vitro , должны быть проверены в экспериментах на лабораторных животных для того, чтобы смоделировать изучаемые эффекты не только в клеточных культурах, но и в условиях живого организма. Использование in vivo моделей позволит смоделировать хроническую экспозицию клеток мутагеном.
Заключение
В результате проведения исследования установлено, что мутаген алкилирующего механизма действия ММС в эксперименте in vitro не вызывает выраженный оксидатив-ный стресс в культурах первичных эндотелиальных клеток человека. Формирование эндотелиальной дисфункции, ассоциированной с экспозицией клеток ММС, обусловлено, главным образом, генотоксическим стрессом, связанным с алкилированием ДНК эндотелиальных клеток.
Список литературы Уровень оксидативного стресса в эндотелиальных клетках, культивируемых в присутствии митомицина С
- Global, regional, and national age-sex-specific mortality for 282 causes of death in 195 countries and territories, 1980-2017: A systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2018;392(10159):1736-1788. DOI: 10.1016/S0140-6736(18)32203-7.
- Libby P. The changing landscape of atherosclerosis. Nature. 2021;592(7855):524-533. DOI: 10.1038/s41586-021-03392-8.
- Кутихин А.Г., Синицкий М.Ю., Понасенко А.В. Роль мутагенеза в развитии атеросклероза. Комплексные проблемы сердечно-сосуди-стыхзаболеваний. 2017;(1):92-101. DOI: 10.17802/2306-1278-20171-92-101. Kutikhin A.G., Sinitsky M.Y., Ponasenko A.V. The role of mutagenesis in atherosclerosis. Complex Issues of Cardiovascular Diseases. 2017;(1):92-101. (In Russ.). DOI: 10.17802/2306-1278-2017-1-92-101.
- Borghini A., Cervelli T., Galli A., Andreassi M.G. DNA modifications in atherosclerosis: From the past to the future. Atherosclerosis. 2013;230(2):202-209. DOI: 10.1016/j.atherosclerosis.2013.07.038.
- Nair J., De Flora S., Izzotti A., Bartsch H. Lipid peroxidation-derived etheno-DNA adducts in human atherosclerotic lesions. Mutat. Res. 2007;621(1-2):95-105. DOI: 10.1016/j.mrfmmm.2007.02.013.
- Синицкий М.Ю., Цепокина А.В., Кутихин А.Г., Шишкова Д.К., Понасенко А.В. Профиль генной экспрессии в эндотелиальных клетках, культивируемых в присутствии митомицина С. Биомедицинская химия. 2021;67(3):130-136. DOI: 10.18097/PBMC20216702130. Sinitsky M.Y., Tsepokina A.V., Kutikhin A.G., Shishkova D.K., Ponasenko A.V. The gene expression signature in endothelial cells exposed to mitomycin C. Biomedical Chemistry. 2021;67(3):130-136. (In Russ.). DOI: 10.18097/PBMC20216702130.
- Lee Y.J., Park S.J., Ciccone S.L., Kim C.R., Lee S.H. An in vivo analysis of MMC-induced DNA damage and its repair. Carcinogenesis. 2006;27(3):446-453. DOI: 10.1093/carcin/bgi254.
- Klaunig J.E., Wang Z., Pu X., Zhou S. Oxidative stress and oxidative damage in chemical carcinogenesis. Toxicol. Appl. Pharmacol. 2011;254(2):86-99. DOI: 10.1016/j.taap.2009.11.028.
- Sims F.H. A comparison of coronary and internal mammary arteries and implications of the results in the etiology of atherosclerosis. Am. Heart J. 1983;105(4):560-566.
- Cawthon R.M. Telomere measurement by quantitative PCR. Nucleic Acids Res. 2002;30(10):e47. DOI: 10.1093/nar/30.10.e47.
- Bustin S.A., Benes V., Garson J.A., Hellemans J., Huggett J., Kubista M. et al. The MIQE guidelines: Minimum information for publication of quantitative real-time PCR experiments. Clin. Chem. 2009;55(4):611-622. DOI: 10.1373/clinchem.2008.112797.
- Gnad-Vogt S.U., Hofheinz R.D., Saussele S., Kreil S., Willer A., Willeke F. et al. Pegylated liposomal doxorubicin and mitomycin C in combination with infusional 5-fluorouracil and sodium folinic acid in the treatment of advanced gastric cancer: Results of a phase II trial. Anticancer Drugs. 2005;16(4):435-440. DOI: 10.1097/00001813-200504000-00010.
- Cadet J., Davies K.J.A., Medeiros M.H., Di Mascio P., Wagner J.R. Formation and repair of oxidatively generated damage in cellular DNA. Free Radic. Biol. Med. 2017;107:13-34. DOI: 10.1016/j.freerad-biomed.2016.12.049.
- Radi R. Peroxynitrite, a stealthy biological oxidant. J. Biol. Chem. 2013;288(37):26464-26472. DOI: 10.1074/jbc.R113.472936.
- Shekaftik O.S., Nasirzadeh N. 8-Hydroxy-2'-deoxyguanosine (8-OHdG) as a biomarker of oxidative DNA damage induced by occupational exposure to nanomaterials: А systematic review. Nanotoxicology. 2021;15(6):850-864. DOI: 10.1080/17435390.2021.1936254.
- Kiecolt-Glaser J.K., Epel E.S., Belury M.A., Andridge R., Lin J., Glaser R. et al. Omega-3 fatty acids, oxidative stress, and leukocyte telomere length: A randomized controlled trial. Brain Behav. Immun. 2013;28:16-24. DOI: 10.1016/j.bbi.2012.09.004.
- Lipcsey M., Soderberg E., Basu S., Larsson A., Sjolin J., Astrom M. et al. F2-isoprostane, inflammation, cardiac function and oxygenation in the endotoxaemic pig. Prostaglandins Leukot. Essent. Fatty Acids. 2008;78(3):209-217. DOI: 10.1016/j.plefa.2008.01.006.
- Wang L., Yu X., Liu J.P. Telomere damage response and low-grade inflammation. Adv. Exp. Med. Biol. 2017;1024:213-224. DOI: 10.1007/978-981-10-5987-2_10.
- Aramburu T., Plucinsky S., Skordalakes E. POT1-TPP1 telomere length regulation and disease. Comput. Struct. Biotechnol. J. 2020;18:1939-1946. DOI: 10.1016/j.csbj.2020.06.040.
- Zvereva M.I., Shcherbakova D.M., Dontsova O.A. Telomerase: Structure, functions, and activity regulation. Biochemistry (Mosc.). 2010;75(13):1563-1583. DOI: 10.1134/s0006297910130055.


