Усиленная радиосенсибилизация опухолевых клеток с помощью сочетанного воздействия гипертермии и ингибиторов протеасом
Автор: Кабаков А.Е., Мосина В.А., Хохлова А.В.
Рубрика: Научные статьи
Статья в выпуске: 4 т.29, 2020 года.
Бесплатный доступ
Гипертермия применяется в комбинации с лучевой терапией для усиления радиационного ответа опухоли-мишени. Однако многие опухоли оказываются терморезистентными, что делает термо-радиосенсибилизацию неэффективной. В данной работе изучалась возможность усиления радиосенсибилизирующего действия гипертермии на раковые клетки в случае комбинирования прогрева с обработкой ингибиторами протеасомальной деградации белков. Объектами исследования были клеточные линии HeLa, MCF-7 и РС-3, происходящие из человеческих карцином различной локализации. Перед облучением (2-6 Гр) культуры клеток подвергали тепловому стрессу (42-44 °С в течение 20-60 мин) без или в присутствии ингибиторов протеасом (MG132, бортезомиб). Гибель и выживание обработанных клеток оценивали по уровню апоптоза/некроза, по клоногенности, а также в МТТ-тесте. Протеотоксичность воздействий и субклеточное перераспределение белков теплового шока исследовали с помощью фракционирования клеток, электрофореза и иммуноблоттинга. Полученные результаты показывают, что по сравнению с гипертермией сочетанное воздействие (гипертермия + ингибитор протеасом) значительно усиливало радиосенсибилизацию раковых клеток, что проявлялось в интенсификации их пострадиационной гибели и значительном подавлении клоногенности. Таким образом, комбинация гипертермии с ингибиторами протеасом (например, с бортезомибом, который применяется в клинике) может помочь сенсибилизировать радиорезистентные опухоли к лучевой терапии.
Опухолевая радиорезистентность, радиационный ответ, тепловой стресс, протеотоксичность, g-излучение, белки теплового шока, шапероны, деградация белков, раковые клетки, велькейд, лучевая терапия
Короткий адрес: https://sciup.org/170171449
IDR: 170171449 | УДК: 616-006.04-092.18:615.832.8:577.156 | DOI: 10.21870/0131-3878-2020-29-4-118-125
Текст научной статьи Усиленная радиосенсибилизация опухолевых клеток с помощью сочетанного воздействия гипертермии и ингибиторов протеасом
Лучевую терапию часто применяют при лечении солидных опухолей. Однако многие злокачественные новообразования оказываются радиорезистентными; кроме того, генетическая и эпигенетическая вариабельность раковых клеток способствует селекции радиорезистентных фенотипов в опухоли-мишени, что снижает эффективность лучевой терапии. Поэтому важной задачей является разработка клинически применимых способов радиосенсибилизации опухолей.
Гипертермия иногда используется для этой цели, поскольку локальное термическое воздействие на опухоль вызывает тепловую денатурацию многих внутриклеточных белков, в том числе и тех, которые обеспечивают клеточную радиорезистентность (ферменты репарации ДНК, регуляторы клеточного цикла, компоненты сигнальных путей, факторы устойчивости к апоптозу и пр.) [1-4]. Показано, что радиосенсибилизирующее действие теплового стресса определяется степенью его протеотоксичности (т.е. уровнем инактивации и агрегации клеточных белков), что коррелирует с замедлением репарации разрывов ДНК и усилением апоптоза в прогретых и облучённых раковых клетках [5]. К сожалению, для многих злокачественных опухолей характерны высокие уровни конститутивной экспрессии и функциональной (шаперонной) активности белков теплового шока (БТШ), которые работают как цитопротекторы, ослабляя протео-токсичность и радиосенсибилизирующие эффекты гипертермии [3]. Кроме того, гипертермиче-
Кабаков А.Е.* – зав. лаб., к.б.н.; Мосина В.А. – научн. сотр.; Хохлова А.В. – научн. сотр. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
ская обработка опухолевых клеток может спровоцировать в них индукцию дополнительных БТШ и тем самым, ещё больше повысить их устойчивость к цитотоксическим воздействиям, включая радио- и химиотерапию.
Мы предлагаем минимизировать эту проблему путём комбинированного применения гипертермии с обработкой фармакологическим ингибитором протеасом. В клетке протеасомы осуществляют протеолитическую деградацию старых или повреждённых белков [6]; эта функция особенно востребована после теплового стресса, когда цитоплазма и органеллы наполняются термически денатурированными белковыми молекулами, которые должны быть либо ре-натурированы (этим занимаются шапероны, т.е. БТШ), либо подвергнуты деградации (в основном, это задача протеасом, но им ассистируют БТШ). Согласно нашей идее, вызванная ингибитором дисфункция протеасом на фоне тепловой денатурации множества клеточных белков после гипертермии должна значительно усилить протеотоксический стресс в обработанных клетках; в результате, избыток БТШ, характерный для многих опухолей, окажется рекрутирован новыми (дополнительно появившимися) субстратами, а именно теми повреждёнными нагреванием белками, которые теперь не деградируют на протеасомах из-за действия добавленного ингибитора. Мы полагаем, что такое комбинированное воздействие усилит радиосенсибилизацию опухолевых клеток, поскольку, благодаря истощению в них шаперонного пула, репарация тепловых и радиационных повреждений будет задержана, а вероятность апоптотической гибели, напротив, возрастёт.
Чтобы проверить наши предположения, мы исследовали эффекты гипертермии (42-44 °С, 20-60 мин) и её комбинирования с обработкой известными ингибиторами протеасом (MG132 и бортезомиб [6]) на радиочувствительность опухолевых клеток человека.
Материалы и методы
Объектами исследования были охарактеризованные клеточные линии, происходящие из карцином молочной железы (MCF-7), шейки матки (HeLa) и предстательной железы (РС-3) человека (получены от В.Л. Габая, Университет Бостона, Бостон, США). Клеточные культуры выращивались в среде DMEM с добавлением 10% телячьей фетальной сыворотки, 2 моль/л L-глютамина и 10000 IU/мл пенициллин/стрептомицина (Hyclone, США), в инкубаторе с влажной атмосферой и 5% СО 2 при 37 °C.
Коммерчески доступные ингибиторы протеасом MG132 и бортезомиб (велькейд) (оба от Biomol, США) были растворены в диметилсульфоксиде (ДМСО) и добавлялись в среду роста к клеточным культурам в концентрациях 5-1000 нМ за 2 ч до гипертермического воздействия. Аликвоты ДМСО вносились в контрольные образцы.
Гипертермию проводили, помещая герметично закрытые чашки Петри с клетками в термостатированную водяную баню (RC6 LAUDA, Германия) с температурой 42-44 °C на 20-90 мин. Отклонения от заданной температуры не превышали 0,2 °C. Пластиковые чашки Петри с распластанными клетками подвергали прямому воздействию γ-фотонов на радиотерапевтиче-ской установке с γ-источником 60Со. Цитотоксические эффекты облучения и пострадиационное выживание культивируемых клеток оценивали в МТТ-тесте и по вырастанию клеточных колоний (тест на клоногенность), как описано ранее [7]. Величины «факторов изменения дозы» (ФИД) рассчитывали из кривых роста выживших колоний для 10% выживания. Фракции апоптотиче-ских и некротических клеток определяли на проточном цитофлуориметре после двойного окрашивания ФИТЦ-меченным аннексином-V и йодистым пропидием [7].
Протеотоксичность того или иного воздействия оценивали по изменениям относительного содержания БТШ90, БТШ70 и БТШ27 в цитозольной (Тритон Х-100-растворимой) фракции и в содержащей белковые агрегаты ядерно-цитоскелетной (Тритон Х-100-нерастворимой) фракции, что определялось с помощью иммуноблоттинга и последующего сканирования блотов [5]. После теплового стресса клетки инкубировали в присутствии циклогексимида (50 мкг/мл), чтобы исключить de novo синтез БТШ.
Все количественные результаты представлены как усреднённые данные (±отклонение) 4-6 независимых экспериментов с 4-мя параллелями для каждой точки. Статистическую обработку результатов проводили по критерию Манна-Уитни с помощью программы “Statistica 6.0” (“Microcal Softcare, Inc.”).
Результаты и обсуждение
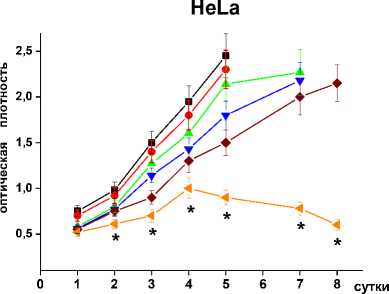
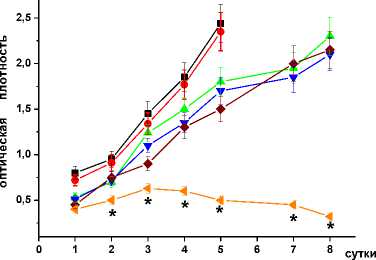
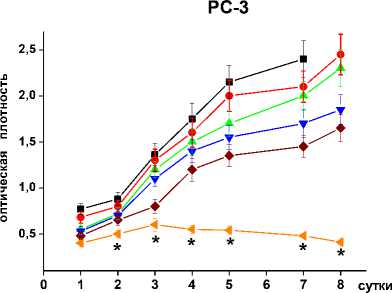
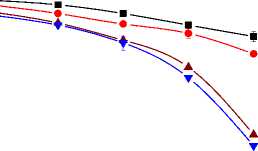
Результаты МТТ-теста, представленные на рис. 1, демонстрируют, что и облучение (4 Гр), и гипертермия, и даже их комбинация вызывали лишь временное падение жизнеспособности обработанных опухолевых клеток, после чего их пролиферативная активность восстанавливалась, и плотность культуры постепенно приближалась к контрольному уровню. Однако, при сочетании прогрева с обработкой 20-50 нМ бортезомибом и последующим облучением, падение клеточной жизнеспособности и убыль клеток во всех 3-х культурах становились необратимыми, хотя сам по себе ингибитор протеасом не оказывал заметных цитотоксических эффектов (рис. 1). Аналогичные результаты получались с 300-1000 нМ MG132 (данные не приводятся).
MCF-7
-
— ■ — контроль
-
— •— бортезомиб
-
— ▲— гипертермия
-
— ▼— 4 Гр
-
— ♦— гипертермия + 4 Гр
-
— ◄ — гипертермия + 4 Гр + бортезомиб
Рис. 1. Результаты МТТ-теста, показывающие усиление радиосенсибилизации опухолевых клеток при совместном действии гипертермии (44 °С, 30 мин) и ингибиторов протеасом.
* – достоверное отличие от других значений по вертикали, р<0,05.
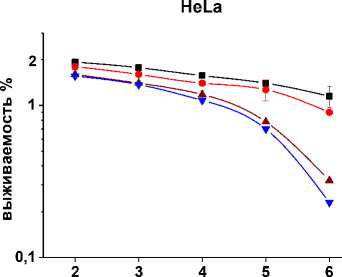
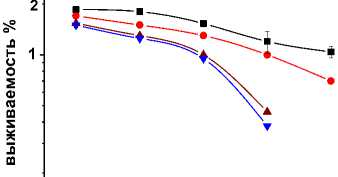
Данные, полученные в МТТ-тесте (рис. 1), полностью согласуются с данными по клоногенности (рис. 2, табл. 1). Сочетание гипертермии с обработкой клеток ингибиторами протеасом оказывало мощные радиосенсибилизирующие эффекты, значительно понижая клоногенный потенциал во всех трёх опухолевых культурах (рис. 2). Даже при нелетальных для клеток условиях прогрева (44 °С, 30 мин), ингибиторы протеасом существенно увеличивали значения ФИД (табл. 1). Всё это свидетельствует о резком усилении радиосенсибилизирующего действия в случае искусственного подавления протеасомальной функции в раковых клетках, прогретых перед облучением.
MCF-7
0,1 J----------1---------------------1---------------------1---------------------1---------------------1------
2 3 4 5 6 Гр
PC-3
0,1 J--------1------------------1------------------1------------------1-----------------Г"
-
■ — контроль
'♦— гипертермия i— гипертермия + 400 hM MG 132
t— гипертермия + 50 нМ бортеюмиб
Рис. 2. Результаты теста на клоногенность, показывающие значительное усиление радиосенсибилизации опухолевых клеток при совместном действии гипертермии (44 °С, 30 мин) и ингибиторов протеасом.
Таблица 1
Увеличение значений ФИД при комбинировании гипертермии с обработкой ингибиторами протеасом
|
Воздействие/ клетки |
Гипертермия: 44 °С, 30 мин |
Гипертермия + 400 нМ MG132 |
Гипертермия + 50 нМ бортезомиб |
|
HeLa |
ФИД = 1,26 |
ФИД = 1,55 |
ФИД = 1,6 |
|
MCF-7 |
ФИД = 1,35 |
ФИД = 1,62 |
ФИД = 1,7 |
|
РС-3 |
ФИД = 1,4 |
ФИД = 1,68 |
ФИД = 1,74 |
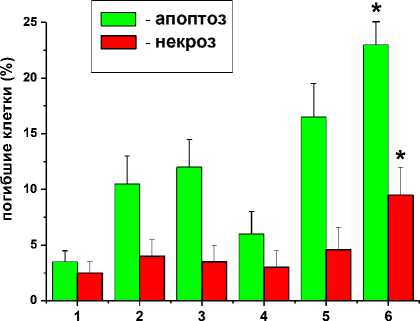
Учитывая результаты наших предыдущих исследований [5, 8], логично было предположить, что ингибирование протеасом в сочетании с гипертермией замедляет восстановление опухолевых клеток, повреждённых после теплового стресса и облучения, что приводит к запус- канию в них «самоубийственного» механизма апоптоза. Позже часть апоптотических клеток может переходить в состояние некроза (так называемый вторичный некроз) [5]. Действительно, цитофлуориметрический анализ клеточной гибели с окрашиванием аннексином V и йодистым пропидием показал достоверное усиление пострадиационного апоптоза и вторичного некроза в образцах клеток, подвергнутых перед облучением комбинированной обработке ингибитором протеасом и гипертермией (рис. 3). Данные, представленные на рис. 3, вполне соответствуют результатам МТТ-теста (рис. 1) и данным по выживанию колоний (рис. 2, табл. 1): спровоцированная дисфункцией протеасом интенсификация апоптоза должна приводить к уменьшению количества жизнеспособных клеток и падению клоногенности, что и наблюдалось в наших экспериментах.
-
1. контроль
-
2. облучение 4 Гр
-
3. гипертермия (44 С 30 минут)
-
4. борте )омиб
-
5. 4 Гр + гипертермия
-
б. 4 Гр 4 гипертермия 4борте}омиб
Рис. 3. Усиление клеточной гибели (апоптоз + некроз) в образцах опухолевых клеток HeLa, подвергнутых сочетанному воздействию гипертермии и ингибитора протеасом (50 нМ бортезомиб) перед облучением.
* – значимое отличие от других значений соответствующего цвета, р<0,05. Аналогичный эффект также наблюдался на культурах MCF-7 и PC-3 (данные не приводятся).
Ранее мы показывали, что радиосенсибилизирующие эффекты гипертермии коррелируют со степенью её протеотоксичности, которую отражает истощение цитозольного пула шаперонов БТШ90, БТШ70 и БТШ27 [5]. Согласно нашей рабочей гипотезе, ингибирование протеасомаль-ной деградации клеточных белков, повреждённых тепловым стрессом, должно приводить к более продолжительному истощению «свободных» шаперонов, поскольку в клетке появляется избыток субстратов для связывания БТШ, а именно термо-денатурированные белки, которые теперь не утилизируются из-за дисфункции протеасом. Чтобы проверить эту гипотезу, мы исследовали эффекты ингибиторов протеасом на динамику восстановления цитозольного пула БТШ90, БТШ70 и БТШ27 в клетках после прогрева. Для этого сравнивалось относительное содержание БТШ в Тритон Х-100-растворимой и Тритон Х-100-нерастворимой клеточных субфракциях [5]. Сразу после гипертермии большая часть (60-80%) цитозольных БТШ90, БТШ70 и БТШ27 оказывается в Тритон Х-100-нерастворимой субфракции из-за их связывания с агрегатами термо-денатурированных белков; затем шапероны высвобождаются по мере дезагрегации, ренатурации или деградации повреждённых белковых молекул, и поэтому содержание БТШ в Тритон-Х-100-нерастворимой субфракции постепенно падает (табл. 2). Данные в табл. 2 показывают, что бортезомиб и MG132 действительно замедляли уход шаперонов (БТШ90,
БТШ70 и БТШ27) из содержащей белковые агрегаты Тритон Х-100-нерастворимой субфракции прогретых HeLa клеток. Очень похожие эффекты наблюдались с этими же ингибиторами протеа-сом на культурах клеток MCF-7 и РС-3, подвергнутых тепловому стрессу (данные не приводятся).
Таблица 2
Эффекты ингибиторов протеасом на содержание БТШ90, БТШ70 и БТШ27 в Тритон Х-100-нерастворимой субфракции клеток HeLa в разные периоды времени после гипертермии (ГТ)
|
Воздействие |
0,5 часа |
3 часа |
8 часов |
||||||
|
БТШ90 |
БТШ70 |
БТШ27 |
БТШ90 |
БТШ70 |
БТШ27 |
БТШ90 |
БТШ70 |
БТШ27 |
|
|
ГТ (44 °С 30 мин) |
80±9% |
72±9% |
61±8% |
55±8% |
50±7% |
44±6% |
20±5% |
24±5% |
20±4% |
|
ГТ + 50 нМ бортезомиб |
82±9% |
75±8% |
64±7% |
77±9% |
69±7% |
55±6% |
56±6% |
50±6% |
35±4% |
|
ГТ + 400 нМ MG132 |
83±10% |
73±9% |
62±7% |
75±8% |
68±7% |
57±7% |
54±6% |
48±5% |
36±4% |
Такой искусственно продлённый дефицит «свободных» шаперонов, по-видимому, оказывается фатальным для многих облучённых клеток, поскольку «занятые» термо-денатурирован-ными субстратами БТШ90, БТШ70 и БТШ27 не могут блокировать эффекторы апоптоза, чтобы противодействовать выполнению «самоубийственного» сценария. Это предположение подтверждается тем фактом, что предлагаемая комбинация гипертермия + ингибитор протеасом действительно усиливала пострадиационный апоптоз в опухолевых культурах (см. рис. 3). Здесь важно подчеркнуть, что значительное усиление радиосенсибилизации происходило при наномо-лярных (т.е. клинически достижимых) концентрациях бортезомиба, который уже применяется в химиотерапии как противоопухолевый препарат [6, 9]. Следует также отметить, что в 2013 г. группа польских учёных опубликовала результаты математического моделирования, предсказывающие высокую эффективность комбинирования гипертермии с бортезомибом для радиосенсибилизации опухолей [10]. Основываясь на наших экспериментальных данных, мы тоже полагаем, что аналогичный подход можно будет успешно применять для усиления радиационного ответа опухолей, устойчивых к лучевой терапии; однако, сначала необходимо провести подтверждающие исследования на моделях in vivo .
Заключение
По сравнению с эффектами одной только гипертермии сочетанное воздействие гипертермия + ингибитор протеасом значительно усиливало радиосенсибилизацию раковых клеток, что проявлялось в интенсификации их пострадиационного апоптоза и подавлении клоногенности. На молекулярном уровне обнаруженный феномен обусловлен, по-видимому, увеличением про-теотоксичности, когда многие термо-денатурированные белки не деградируют на протеасомах и поэтому надолго связывают цитозольные шапероны БТШ90, БТШ70 и БТШ27, лишая их возможности участвовать в восстановлении повреждений и защите от апоптоза. Таким образом, комбинация гипертермии с ингибиторами протеасом (например, с уже применяемым в клинике бортезомибом) может более эффективно сенсибилизировать злокачественные опухоли к лучевой терапии.
Список литературы Усиленная радиосенсибилизация опухолевых клеток с помощью сочетанного воздействия гипертермии и ингибиторов протеасом
- Datta N.R., Ordonez S.G., Gaipl U.S., Paulides M.M., Crezee H., Gellermann J., Marder D., Puric E., Bodis S. Local hyperthermia combined with radiotherapy and-/or chemotherapy: recent advances and promises for the future //Cancer Treat. Rev. 2015. V. 41, N 9. P. 742-753.
- Hyperthermic oncology from bench to bedside /Eds.: S. Kokura, T. Yoshikawa, T. Ohnishi. Springer, 2016. 444 p.
- Peeken J.C., Vaupel P., Combs S.E. Integrating hyperthermia into modern radiation oncology: what evidence is necessary? //Front. Oncol. 2017. V. 7, Article 132. P. 1-17. DOI: 10.3389/fonc.2017.00132
- Кабаков А.Е., Анохин Ю.Н., Лебедева Т.В. Реакции нормальных и опухолевых клеток и тканей на гипертермию в сочетании с ионизирующей радиацией. Обзор //Радиация и риск. 2018. Т. 27, № 4. С. 141-154. DOI: 10.21870/0131 - 3878 - 2018 - 27 - 4 - 141 - 154
- Кабаков А.Е., Кудрявцев В.А., Хохлова А.В., Макарова Ю.М., Лебедева Т.В. Апоптоз в опухолевых клетках, подвергнутых сочетанному действию гипертермии и облучения: исследование молекулярных механизмов и мишеней //Радиация и риск. 2018. Т. 27, № 2. С. 62-75.
- Thibaudeau T.A., Smith D.M. A practical review of proteasome pharmacology //Pharmacol. Rev. 2019. V. 71, N 2. P. 170-197.
- Kabakov A.E., Gabai V.L. Cell death and survival assays //Methods Mol. Biol. 2018. V. 1709. P. 107-127.
- Кудрявцев В.А., Макарова Ю.М., Кабаков А.Е. Термосенсибилизация опухолевых клеток ингибиторами активности и экспрессии шаперонов //Биомедицинская химия. 2012. Т. 58, № 6. С. 662-672.
- Cengiz Seval G., Beksac M. The safety of bortezomib for the treatment of multiple myeloma //Expert Opin. Drug Saf. 2018. V. 17, N 9. P. 953-962.
- Rybinski M., Szymanska Z., Lasota S., Gambin A. Modelling the efficacy of hyperthermia treatment //J. R. Soc. Interface. 2013. V. 10, N 88. P. 20130527. DOI: 10.1098/rsif.2013.0527


