Ускоренное гиперфракционирование дневной дозы облучения в схеме химиолучевого лечения больных раком ротоглотки и полости рта
Автор: Раджапова М.У., Гулидов И.А., Мардынский Ю.С., Семин Д.Ю.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 (70), 2015 года.
Бесплатный доступ
Основные неудачи терапии рака ротоглотки и полости рта связаны в первую очередь с лечением поздних (III-IV) стадий заболевания, частота выявления которых в нашей стране крайне высока. С увеличением агрессивности противоопухолевой терапии возрастает токсичность лечения и качество жизни снижается, поэтому поиск консервативных методов лечения данной патологии, оптимальных с точки зрения эффективность - токсичность, остается актуальным. Клинические наблюдения представлены 233 больными первичным раком слизистой оболочки ротоглотки и полости рта, которым проводили одновременную химиолучевую терапию ускоренным гиперфракционированием дневной дозы облучения и стандартное лучевое лечение. После химиолучевой терапии в режиме 1 Гр+1,5 Гр и 1 Гр+2 Гр с 4-6-часовым интервалом до СОД 60 Гр частота объективных ответов (сумма полных и частичных регрессий) была существенно выше по сравнению со стандартным лучевым лечением (97,8; 100 и 61,9 % наблюдений соответственно). В процессе химиолучевой терапии с дроблением дозы 1 Гр + 1,5 Гр и 1 Гр + 2 Гр частота тяжелых мукозитов (3-й степени) составила 40,5 и 77,8 % (р0,05). Непосредственные результаты лечения больных и анализ выживаемости показали статистически значимые различия в пользу химиолучевого лечения ускоренным гиперфракционированием дневной дозы облучения по сравнению со стандартной лучевой терапией без увеличения поздней местной токсичности. Все больные завершили запланированный курс лечения, несмотря на большую частоту мукозитов 3-й степени при методике дробления дозы 1 Гр + 2 Гр, благодаря своевременной и адекватной тактике симптоматической терапии.
Объективный ответ, ускоренное гиперфракционирование, химиолучевая терапия, поздние лучевые повреждения, мукозит
Короткий адрес: https://sciup.org/14056555
IDR: 14056555 | УДК: 616.321+616.31]-006.6-08:615.28:615.849.1
Текст научной статьи Ускоренное гиперфракционирование дневной дозы облучения в схеме химиолучевого лечения больных раком ротоглотки и полости рта
Повышение эффективности лечения больных раком ротоглотки и полости рта остается актуальной проблемой клинической онкологии. Основные неудачи терапии данной патологии связаны в первую очередь с лечением поздних (III–IV) стадий заболевания, частота выявления которых в нашей стране крайне высока [3]. Недопустимо высокие показатели запущенности отмечены при диагностике новообразований даже визуально наблюдаемых локализаций. Так, в 2012 г. III–IV стадия заболевания диагностирована у 61,7 % больных раком полости рта [5]. Показатель летальности уже на первом году после постановки диагноза у данной категории пациентов составляет более 40 %, а трех- и пятилетняя выживаемость: для рака ротоглотки – 24 и 14 %; полости рта – 41 и 30 % соответственно [3, 6, 14].
Следует отметить, что анатомия и физиология органов, расположенных в орофарингеальной зоне, представляют собой уникальный комплекс. Выполнение основных функций – речь, жевание,
глотание – зависит от слаженной работы этих органов. К тому же особенности внешности людей зависят от формы и структуры тканей на лице, и особенно критично оцениваются как самим человеком, так и окружающими. Вот почему проблема повышения эффективности противоопухолевой терапии данной патологии приобретает важное и социальное значение, а поиск эффективных консервативных методов лечения данной категории больных по-прежнему актуален.
Клинический опыт отечественных и зарубежных исследователей свидетельствует о том, что наибольшего прогресса в терапии злокачественных опухолей ротоглотки и полости рта удалось достичь благодаря сочетанию облучения и химиотерапии при различной последовательности методов воздействия [1, 2, 4, 17]. Однако основным лечебным подходом в большинстве случаев считается одновременная химиолучевая терапия [7, 13, 17], но ее реализация ограничивается токсичностью, величина которой прямо пропорциональна интенсивности лечения [8, 18]. Наиболее частым и ранним токсическим осложнением химиолучевого лечения, ограничивающим его радикальность, являются тяжелые мукозиты 3–4-й степени, частота развития которых достигает 70 % и более [18]. Из поздних токсических эффектов заслуживают внимания лучевые повреждения нормальных тканей и органов в зоне облучения, в частности остеорадионекрозы нижней челюсти, на долю которых приходится от 5 до 15 % случаев [15, 16]. Степень тяжести и выраженные симптомы токсических осложнений значительно снижают качество жизни больных при хорошей эффективности противоопухолевой терапии [11, 12].
В контексте этой проблемы перспективным является направление по оптимизации лучевого компонента в программах химиолучевой терапии больных раком ротоглотки и полости рта. На наш взгляд, улучшить эффективность лучевого лечения можно путем нетрадиционного фракционирования дневной дозы облучения, направленного на увеличение терапевтического интервала с целью подведения к опухоли радикальной туморицид-ной дозы при снижении лучевого повреждения здоровых тканей.
Целью настоящего исследования является улучшение результатов лечения рака ротоглотки и полости рта без увеличения токсичности за счет использования методик ускоренного гиперфракционирования (УГФ) дневной дозы облучения при химиолучевой терапии больных с данной патологией.
Материал и методы
При проведении данной работы строго соблюдались требования биомедицинской этики. Все участники исследования подписали информированное согласие. Клинические наблюдения представлены 233 пациентами с морфологически подтвержденным диагнозом первичного рака слизистой оболочки ротоглотки и полости рта. В рамках данной работы были проведены проспективное контролируемое исследование (1994–2009 гг., n=136) и ретроспективный клинический анализ (до 1994 г., n=97) больных, получавших химиолучевое и в самостоятельном варианте лучевое лечение (исторический контроль) соответственно. Среди них рак ротоглотки диагностирован у 92 (39,5 %) пациентов, полости рта – у 141 (60,5 %). Мужчин было 193 (82,8 %), женщин – 40 (17,2 %), соотношение 4,8:1. Возраст пациентов варьировал от 21 до 81 года; в 60,3 % случаев диагноз установлен у лиц трудоспособного возраста от 40 до 60 лет. В структуре клинических наблюдений преобладали рак дна полости рта (28,8 %), языка (26,6 %), тонзиллярной области (17,5 %) и корня языка (16,2 %). Поражение ретромоллярной области, задней и боковой стенок глотки встречалось в 5,2 и 5,7 % случаев соответственно.
Всем больным проводилась гистологическая верификация диагноза. В 93,2 % случаев выявлен плоскоклеточный рак различной дифференцировки.
Стадию заболевания устанавливали в соответствии с международной классификацией TNM (6-е изд., 2002 г.) на основании общепринятых стандартных методов обследования, а также неинвазивных методов лучевой диагностики – спиральной компьютерной томографии головы и шеи. Опухолевый процесс III и IV стадий диагностирован у 75,1 % пролеченных больных. Метастазы в регионарные лимфатические узлы обнаружены в 49,3 % наблюдений. Распределение больных в зависимости от распространенности опухолевого процесса приведено в табл. 1.
В зависимости от метода лечения пациенты были распределены на три группы. Больным первой группы (n = 97) проводилась стандартная лучевая терапия (СЛТ) в самостоятельном варианте – разовая очаговая доза 2 Гр пять раз в неделю до суммарной очаговой дозы (СОД) 60 Гр. Остальным пациентам проводили одновременную химиолучевую терапию ускоренным гиперфракционированием дневной дозы облучения. При этом во второй группе (n=91) использовали дробление дозы на две фракции 1 и 1,5 Гр, а в третьей (n=45) применили фракционирование в режиме 1 Гр + 2 Гр с 4–6-часовым интервалом до СОД 60 Гр.
Дистанционная лучевая терапия проводилась на гамма-терапевтических установках типа «Агат» и «Рокус-АМ». Первичную опухоль с лимфатическими узлами первого регионарного барьера облучали через противолежащие боковые поля. Границы и размеры полей облучения подбирали индивидуально в зависимости от локализации и степени распространенности опухоли и регионарных метастазов. Среднюю и нижнюю группы лимфатических узлов шеи облучали через прямое переднее и заднее поле с экранированием хрящей гортани и спинного мозга. Интактные лимфатические узлы облучали до СОД в диапазоне 44–46 Гр, метастатические – 56–60 Гр. Пациентам с неполной регрессией регионарных метастазов выполнялось плановое иссечение лимфатических узлов через 4–5 нед после завершения противоопухолевой терапии.
В схему стандартной полихимиотерапии были включены два препарата: цисплатин и 5-фторурацил. В первый день лечения, до начала лучевой терапии, внутривенно на фоне гипергидратации вводили цисплатин из расчета 100–120 мг/м2 площади поверхности тела в течение 30 мин, затем начинали внутривенное введение 5-фторурацила в дозе 3000 мг непрерывно в течение 72 ч при помощи инфузионного шприцевого насоса. Всего одновременно с лучевой терапией проводили два цикла полихимиотерапии с интервалом в 21 день. Расщепление курса лучевой и химиолучевой терапии проведено у пациентов с симптомами мукозита 3-й степени.
Клиническую оценку состояния слизистой оболочки полости рта и ротоглотки (степень мукозита) и поздних лучевых повреждений нормальных тканей и органов в зоне облучения проводили в соответствии со шкалой RTOG/EORTC. Также фиксировали длительность перерыва, в течение которого происходила регенерация слизистой оболочки, и величину СОД, которая была подведена к опухоли до перерыва. Клиническую регрессию первичной опухоли оценивали эндоскопическим, рентгенологическим, ультразвуковым методами исследования в соответствии с рекомендациями ВОЗ.
Статистический анализ данных проводили с использованием программ Statistica 6.0 и SPSS 17.0. Для данных, отвечающих критериям нормального распределения, применяли параметрические методы, и они представлены в виде среднего арифметического ± стандартная ошибка. В остальных случаях использовали непараметрический критерий χ 2. Анализ выживаемости проводился путем построения таблиц дожития с графическим изображением кривых выживаемости по методу Каплана – Мейера. Сравнение кривых выживаемости выполняли с помощью логрангового критерия. Величину уровня значимости принимали равной p<0,05.
Результаты и обсуждение
Опухоли головы и шеи характеризуются высокой скоростью пролиферации клеток, для подавления которой требовалось бы увеличить суммарную дозу, превышающую толерантность нормальных тканей. Поэтому для снижения риска острых и отдаленных лучевых реакций и повреждений целесообразно использование потенциала восстановления только нормальных тканей. Этого можно достигнуть применением схем фракционирования с разделением дневной дозы на несколько фракций, подводимых через 4–6 ч. Радиобиологическое обоснование различных режимов фракционирования послужило основой для выбора методик облучения в схеме химиолучевого лечения в нашем исследовании [9, 10]. Мы посчитали целесообразным применение УГФ дневной дозы облучения при химиолучевой терапии больных раком ротоглотки и полости рта. В связи с этим были разработаны две методики лучевой терапии с использованием неравномерного дробления дневной дозы облучения на две фракции: 1 Гр+1,5 Гр и 1 Гр+2 Гр с 4–6-часовым интервалом между фракциями. Следует отметить, что УГФ оправдано при лучевой терапии опухолей, характеризующихся высокой пролиферативной активностью, в расчете на максимальное повреждение быстро делящихся клоногенных опухолевых клеток. Отдаленные реакции слабо пролиферирующих нормальных тканей при этом усиливаются в меньшей степени благодаря лучшей репарации радиационных повреждений в клетках этих тканей, проходящей в перерывах между фракциями.
Таким образом, была проведена сравнительная оценка эффективности и токсичности следующих методов лечения:
-
• стандартная лучевая терапия традиционным фракционированием по 2 Гр в очаге пять раз в неделю (исторический контроль);
-
• одновременная химиолучевая терапия с двумя вариантами УГФ ежедневной дозы облучения 1 Гр + 1,5 Гр и 1 Гр + 2 Гр с 4–6-часовым интервалом до СОД 60 Гр.
Токсичность лечения
Состояние слизистой оболочки полости рта и ротоглотки было оценено у всех пациентов, которым проводили противоопухолевую терапию. Следует отметить, что независимо от метода лечения острые лучевые реакции на слизистых оболочках возникали у 100 % пациентов и носили характер мукозитов различной тяжести, в основном второй и третьей степени, и у единичных больных – первой. Сравнительный анализ частоты побочных явлений степени тяжести мукозитов у больных исследуемых лечебных групп представлен на рис. 1.
Оценка данных показала, что при химиолучевой терапии УГФ дневной дозы облучения 1 Гр+1,5 Гр и 1 Гр+2 Гр частота возникновения тяжелых мукозитов (III степени) составила 40,5 и 77,8 % случаев соответственно, против 52,7 % при стандартном лучевом лечении. При этом отмечалось статистически значимое (р<0,05) увеличение тяжелых мукозитов при режиме фракционирования дозы 1 Гр+2 Гр по сравнению с другими методиками
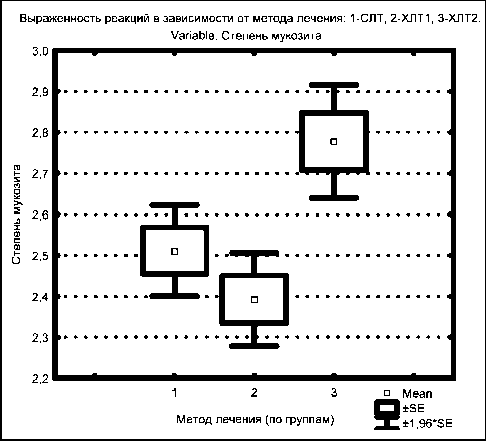
Рис. 1. Степень тяжести мукозита при различных методах лечения (метод χ ², непараметрический критерий).
1-СЛТ (1-я группа) – стандартная лучевая терапия; 2-ХЛТ 1 (2-я группа) и 3-ХЛТ 2 (3-я группа) – химиолучевая терапия УГФ дозы облучения 1 Гр+1,5 Гр и 1 Гр+2 Гр соответственно облучения. Однако при этом длительность перерыва, необходимого для регенерации слизистых оболочек, не превышала таковую при двух других способах терапии. Так, интервал перерыва, необходимого для стихания выраженной симптоматики мукозита при УГФ в режиме 1 Гр+1,5 Гр и 1 Гр+2 Гр, а также при стандартном облучении, составил 10,4 ± 2,3; 11,6 ± 3,3 и 11,3 ± 4,1 дня соответственно (р > 0,05). Следует отметить, что все пациенты, включенные в исследование, завершили запланированный курс радикального лечения. Такого результата удалось добиться благодаря адекватной профилактике мукозитов и своевременной терапии этого осложнения.
Поздние лучевые осложнения здоровых тканей и органов полости рта и ротоглотки, возникшие в сроки более трех месяцев после завершения лечения, были оценены у 94 пациентов после лучевой терапии стандартным облучением и у 127 больных после химиолучевой терапии УГФ дозы облучения. В анализ не включены пациенты, умершие от основного заболевания в сроки до трех месяцев после окончания терапии. Поздние лучевые повреждения, независимо от метода лечения, в различные сроки возникли у 31 из 221 (14,0 %) пациента. При этом после химиолучевой терапии с дроблением дозы 1 Гр + 1,5 Гр и 1 Гр + 2 Гр они имели место у 8 из 90 (8,9 %) и у 4 из 37 (10,8 %) больных соответственно, а после стандартного лучевого лечения – у 19 (20,2 %; р>0,05) из 94 пациентов. Следует отметить, что большинство поздних лучевых осложнений, независимо от
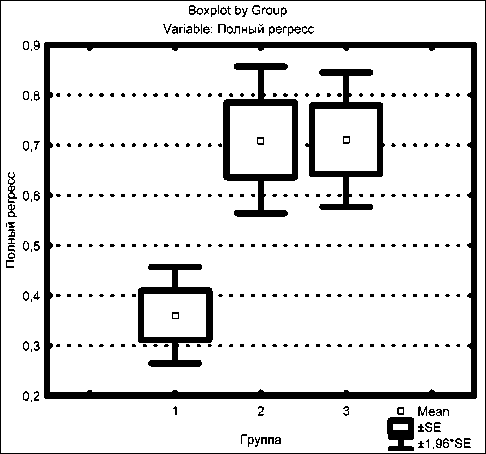
Рис. 2. Сравнительная оценка частоты полной регрессии первичной опухоли при различных методах лечения (метод χ ², непараметрический критерий). 1-я группа – стандартная лучевая терапия;
2 и 3-я группы – химиолучевая терапия УГФ дозы облучения 1 Гр+1,5 Гр и 1 Гр+2 Гр соответственно метода лечения, развиваются в течение первых четырех лет после окончания противоопухолевой терапии. Так, частота накопления повреждений в 1, 2, 3, 4-й годы составила 41,9, 64,5, 77,4, 90,3 % соответственно. И только три случая (9,7 %) имели место спустя четыре года.
Наиболее частым поздним повреждением в нашем исследовании были остеорадионекрозы нижней челюсти, которые возникли у 26 (11,8 %) из 221 пациента. Причем у 21 (80,8 %) больного развились остеорадионекрозы III и IV степени тяжести и у 5 (19,2 %) человек – второй степени тяжести. Из других осложнений имели место: в трех случаях (1,4 %) – лучевая язва и в одном (0,5 %) наблюдении – выраженный фиброз языка. Атрофический фарингит 3-й степени развился у одного пациента (0,5 %).
Полученные данные свидетельствуют о том, что после химиолучевой терапии УГФ дневной дозы 1 Гр + 1,5 Гр и 1 Гр + 2 Гр с 4–6-часовым интервалом до СОД 60 Гр не отмечается увеличения поздней местной токсичности по сравнению со стандартным облучением.
Непосредственные результаты леченияи анализ выживаемости
В группе лучевой терапии стандартным облучением полностью закончили лечение и были включены в анализ непосредственных результатов 97 пациентов; после химиолучевой терапии УГФ дозы облучения – 136 больных.
Данные исследования показали, что после хи-миолучевой терапии УГФ: в режиме 1 Гр + 1,5 Гр частота объективных ответов (сумма полных и частичных регрессий) составила 97,8 % и при методике 1 Гр + 2 Гр – 100 %, а после стандартной лучевой терапии – 61,9 % наблюдений; различия статистически значимые в пользу химиолучевого лечения с УГФ дозы облучения (р<0,05).
При этом после химиолучевой терапии по методикам 1 Гр + 1,5 Гр и 1 Гр + 2 Гр полная регрессия опухоли имела место у 60 (65,9 %) из 91 пациента и у 32 (71,1 %) из 45 больных соответственно, а после лучевой терапии стандартным облучением – у 35 (36,1 %) из 97 человек. Значимость различий показана на рис. 2. Частичная регрессия опухоли была отмечена у 29 (31,9 %), 13 (28,9 %) и 25 (25,8 %) больных соответственно.
Несмотря на тяжелый контингент больных в целом, после химиолучевой терапии УГФ дозы облучения 1 и 1,5 Гр частота объективных ответов была выше на 35,9 %, а при фракционировании 1 Гр + 2 Гр – на 38,1 %, по сравнению со стандартной лучевой терапией.
При оценке эффективности лечения и анализе суммарной очаговой дозы, подведенной к опухоли до вынужденного перерыва (вследствие лучевых реакций), было отмечено, что частота объективных ответов была выше в группах, где величина оча- таблица 2
Частота объективного ответа и величина очаговой дозы, подведенной к первичной опухоли до перерыва
|
Метод лечения |
СОД (Гр) |
Регрессия опухоли |
Объективный ответ (%) |
|
|
Полная (%) |
Частичная (%) |
|||
|
СЛТ |
30,2±6,8 |
36,1 |
25,8 |
61,9 |
|
ХЛТ-1 |
34,7±6,2* |
65,9* |
31,9 |
97,8* |
|
ХЛТ-2 |
37,1±5,9* |
71,1* |
28,9 |
100* |
Примечание: СЛТ – стандартная лучевая терапия, ХЛТ-1; ХЛТ-2 – химиолучевая терапия УГФ дозы облучения 1 Гр + 1,5 Гр и 1 Гр + 2 Гр соответственно. СОД – суммарная очаговая доза. * – р<0,05 по отношению к СЛТ.
говой дозы, подведенной к опухоли, была больше (табл. 2).
Из приведенных в табл. 2 данных следует, что в процессе химиолучевой терапии УГФ дозы 1 Гр + 1,5 Гр и 1 Гр + 2 Гр до перерыва к первичной опухоли подводится большая суммарная очаговая доза, чем при стандартном лучевом лечении. Это усиливает лучевое повреждение опухоли и снижает риск репопуляции опухолевых клеток, что приводит к увеличению частоты объективных ответов и полных регрессий опухоли. Вследствие этого можно предположить наличие заметной корреляции между методиками облучения 1 Гр + 1,5 Гр и 1 Гр + 2 Гр и биологическими характеристиками опухоли, такими как репарация и репопуляция, что делает эти методики более эффективными по сравнению со стандартным облучением. Однако такое предположение нуждается в морфологическом подтверждении.
Графическое изображение кривых выживаемости при различных методах лечения представлено на рис. 3, 4, 5.
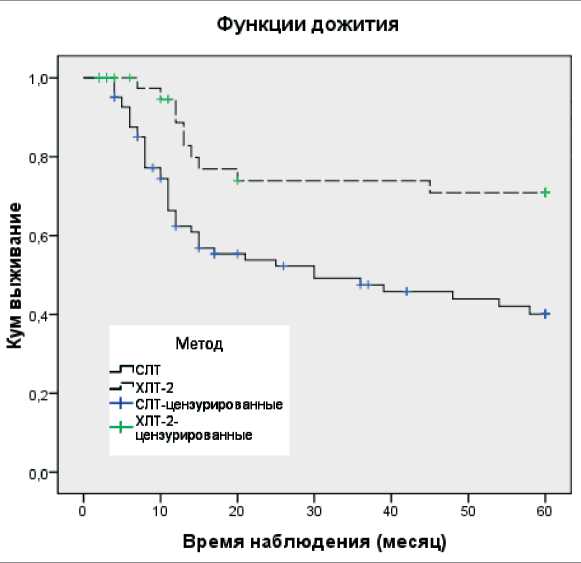
Рис. 4. Кривые выживаемости по Каплану – Мейеру после хи-миолучевой терапии УГФ дозы облучения 1 Гр + 2 Гр (ХЛТ-2) и стандартной лучевой терапии (СЛТ). Log Rank = 0,003.
Средние времена дожития составили при ХЛТ-2 – 47,3 ± 3,5 и СЛТ – 34,1 ± 2,8 мес. Пунктирная кривая – ХЛТ-2; сплошная кривая – СЛТ
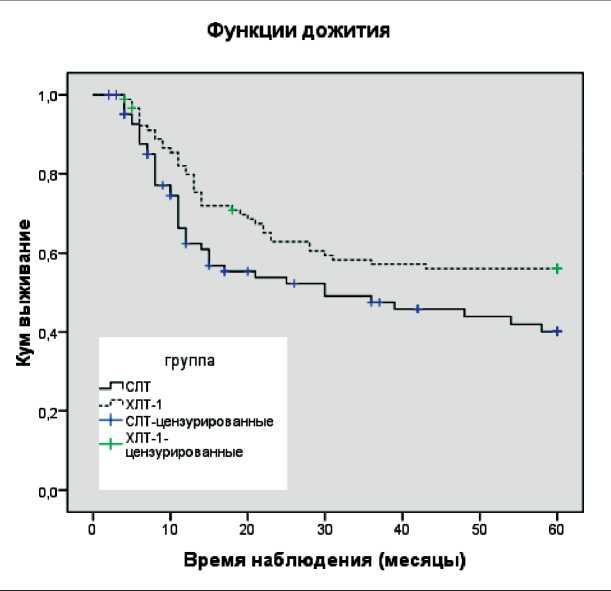
Рис. 3. Кривые выживаемости по Каплану – Мейеру после химиолучевой терапии УГФ дозы облучения 1 Гр + 1,5 Гр (ХЛТ-1) и стандартной лучевой терапии (СЛТ). Log
Rank = 0,039. Средние времена дожития при ХЛТ-1 – 40,4 ± 2,4 и при СЛТ – 34,1 ± 2,8 мес. Пунктирная кривая –
ХЛТ-1; сплошная кривая – СЛТ
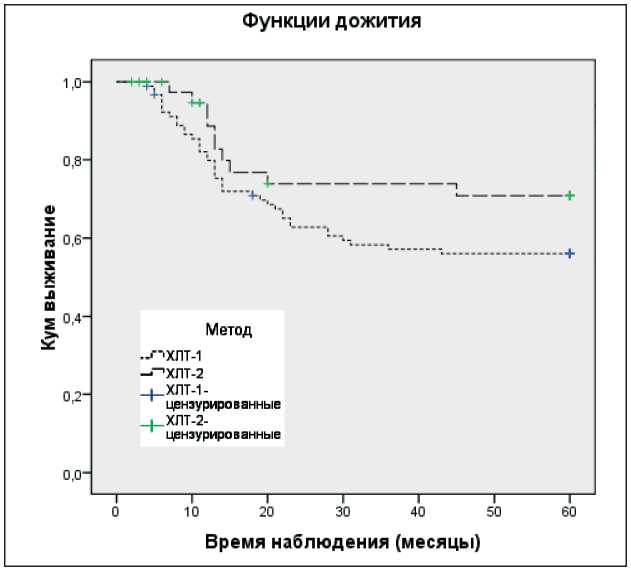
Рис. 5. Кривые выживаемости по Каплану – Мейеру после химиолучевой терапии УГФ 1 Гр + 1,5 Гр (ХЛТ-1) и 1 Гр + 2 Гр (ХЛТ-2). Log Rank = 0,126. Средние времена дожития составили при ХЛТ-1 – 40,4 ± 2,4 и при ХЛТ-2 – 47,3 ± 3,5 мес.
Верхняя пунктирная кривая (----------) – ХЛТ-2; нижняя пун ктирная кривая (………) – ХЛТ-1
Сразу можно отметить, что вероятность дожития пациентов после химиолучевой терапии УГФ дозы облучения значительно выше, чем при стандартной лучевой терапии. Для сравнения выживаемости в группах с различными методами лечения был использован логарифмический ранговый критерий. Оценка кривых выживаемости выявила статистическую значимость различий в пользу больных после химиолучевого лечения УГФ дозы облучения в режиме 1 Гр + 1,5 Гр (р=0,039) и 1 Гр + 2 Гр (р=0,003) по сравнению с пациентами, леченными по стандартной лучевой терапии. Величина времени жизни пациентов при различных методах лечения составила: при стандартной лучевой терапии – 34,1 ± 2,8 мес; химиолучевой терапии УГФ 1 Гр + 1,5 Гр – 40,4 ± 2,4 мес; химио-лучевом лечении УГФ 1 Гр + 2 Гр – 47,2 ± 3,5 мес. В группах химиолучевого лечения УГФ дозы облучения по методикам 1 Гр + 1,5 Гр и 1 Гр + 2 Гр различия выживаемости статистически незначимы (р=0,126).
Заключение
Непосредственные результаты лечения и анализ выживаемости по методу Каплана – Мейера свиде- тельствуют о статистически значимом преимуществе химиолучевого лечения УГФ дневной дозы облучения по сравнению со стандартной лучевой терапией больных раком ротоглотки и полости рта.
Список литературы Ускоренное гиперфракционирование дневной дозы облучения в схеме химиолучевого лечения больных раком ротоглотки и полости рта
- Алиева С.Б. Химиолучевая терапия больных местнораспространенным плоскоклеточным раком головы и шеи//Практическая онкология. 2008. Т. 9, № 1. С. 27-30.
- Алиева С.Б., Романов И.С., Подвязников С.О., Задеренко И.А., Тюляндин С.А. Эффективность индукционной химиотерапии с использованием доцетаксела, цисплатина и 5-фторурацила и последующей одновременной химиолучевой терапии в лечении рака глотки и полости рта III-IV стадии//Опухоли головы и шеи. 2011. № 2. C. 14-20.
- Давыдов М.И., Аксель Е.М. Заболеваемость злокачественными новообразованиями населения России и стран СНГ в 2007 г.//Вестник РОНЦ им. Н.Н. Блохина РАМН. 2009. Т. 20, № 3 (приложение). С. 52-90.
- Канаев С.В. Принципы и обоснование химиолучевого лечения злокачественных опухолей//Практическая онкология. 2008. Т. 9, № 1. С. 1-8.
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2012 году. М., 2013. 231 с.
- Пачес А.И. Опухоли головы и шеи. М., 2000. 480 с.
- Раджапова М.У., Мардынский Ю.С., Гулидов И.А., Медведев В.С., Семин Д.Ю., Иванова И.Н. Химиолучевая терапия больных раком слизистой оболочки полости рта и ротоглотки с использованием неравномерного дробления дневной дозы//Сибирский онкологический журнал. 2011. № 3. С. 35-39.
- Сокуренко В.П., Корытова Л.И., Луфт А.В., Некрасова А.В. Токсическое обременение агрессивного химиолучевого лечения орофарингеального рака: состояние проблемы//Паллиативная медицина и реабилитация. 2008. № 1. С. 51-57.
- Ярмоненко С.П., Вайнсон А.А. Радиобиология человека и животных М., 2004. 549 с.
- Ярмоненко С.П., Коноплянников А.Г., Вайнсон А.А. Клиническая радиобиология. М.: Медицина, 1992. 320 с.
- Jham B.C., da Silva Freire A.R. Oral complications of radiotherapy in the head and neck//Braz. J. Otorhinolaryngol. 2006. Vol. 72 (5). P. 704-708.
- Jereczek-Fossa B.A., Orecchia R. Radiotherapy-induced mandibular bone complications//Cancer Treat. Rev. 2002. Vol. 28 (1). P. 65-74.
- Langendijk J.A., Leemans Ch.R., Buter J., Berkhof J., Slotman B.J. The Additional Value of Chemotherapy to Radiotherapy in Locally Advanced Nasopharyngeal Carcinoma: A Meta-Analysis of the Published Literature//J. Clin. Oncol. 2004. Vol. 22 (15). P. 4604-4612.
- Lefebvre J.L., Lartigau E., Kara A., Sarini J. Oral Cavity, Pharynx and Larynx Cancer//Prognostic Factors in Cancer. 2-nd ed./Ed. Gospodarowicz M.K. . New York: A. John Wiley and sons, 2001. P. 151-166.
- Madrid C., Abarca M., Bouferrache K. Osteoradionecrosis: An update//Oral Oncol. 2010. Vol. 46 (6). P. 471-474 DOI: 10.1016/j.oraloncology.2010.03.017
- Mendenhall W.M. Mandibular osteoradionecrosis//J. Clin. Oncol. 2004. Vol. 22 (24). P. 4864-4868.
- Pignon J.P., Bourhis J., Domenge C., Designé L. Chemotherapy added to locoregional treatment for head and neck squamous-cell carcinoma: three meta-analyses of updated individual data. MACH-NC Collaborative Group. Meta-analysis of Chemotherapy on Head and Neck Cancer//Lancet. 2000. Vol. 355. (9208). P. 949-955.
- Trotti A, Bellm L.A., Epstein J.B., Frame D., Fuchs H.J., Gwedeт C.K., Komaroff E., Nalysnyk L., Zilberberg M.D. Mucositis incidence, severity and associated outcomes in patients with head and neck cancer receiving radiotherapy with or without chemotherapy: a systemic literature review//Radiother. Oncol. 2003. Vol. 66. (3). P. 253-263.


