Ускоренное гиперфракционирование дозы в лучевом лечении неоперабельного местнораспространенного рака желудка
Автор: Литинский Сергей Сергеевич, Ружникова Анна Алексеевна, Асахин Сергей Михайлович, Ружников Андрей Олегович, Вальков Михаил Юрьевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 (68), 2015 года.
Бесплатный доступ
Цель исследования - сравнить выживаемость больных местнораспространенным неоперабельным раком желудка (МРНРЖ), получавших лучевую терапию (ЛТ) в режиме ускоренного гиперфракционирования (УГФ) и традиционного фракционирования (ТФ). Материал и методы. Включено 137 больных МРНРЖ из госпитальной базы данных Архангельского клинического онкологического диспансера, получавших ЛТ с химиотерапией (ХТ) и без нее, с ноября 1993 г. по март 2010 г. в режиме ТФ (по 2 Гр ежедневно), либо УГФ (по 1,3 Гр два раза в день, ежедневно) до дозы не менее 50 иГр. Для оценки общей выживаемости (ОВ) использованы актуарный анализ, метод Каплана - Майера и регрессия Кокса. Результаты. В группе ТФ оказалось 102 человека, в группу УГФ было отобрано 35. Медиана времени наблюдения всех пациентов составила 12,4 года. К началу анализа погибло 123 (89,8 %) из 137 наблюдаемых больных. Медиана ОВ, 7-летняя ОВ в группе УГФ и ТФ составили 24 (95 % доверительный интервал ДИ 17-31) и 16,0 (95 % ДИ 11-21) мес, ОР=0,71 (95 % ДИ 0,46-1,06), р=0,097; 19 (95 % ДИ 8-34 %) и 6 % (95 % ДИ 2-13 %) соответственно. В многофакторной модели различия между группами сгладились - ОР 0,87 (95 % ДИ 0,49-1,55); единственным независимым фактором благоприятного прогноза была локализация опухоли в теле желудка, ОР 0,60 (95 % ДИ 0,37-0,99). Не выявлено влияния дозы ЛТ в выбранном диапазоне на ОВ. Заключение. В ретроспективном анализе выявлено недостоверное преимущество в ОВ больных МРНРЖ, получавших ЛТ в режиме УГФ, по сравнению с режимом ТФ. Эти результаты требуют подтверждения в проспективном рандомизированном исследовании с использованием современных методов облучения.
Неоперабельный местнораспространенный рак желудка, лучевая терапия, ускоренное гиперфракционирование, выживаемость
Короткий адрес: https://sciup.org/14056523
IDR: 14056523 | УДК: 616.33-006.6-08:615.849.1
Текст научной статьи Ускоренное гиперфракционирование дозы в лучевом лечении неоперабельного местнораспространенного рака желудка
Единственным радикальным методом лечения РЖ остается хирургическое вмешательство. Од- нако резектабельность РЖ составляет 25–50 % [21]. В России доля больных РЖ, получивших хирургическое и комбинированное лечение, в 2012 г. составляла 35 %. Это связано как с высоким уровнем первичной запущенности (27 % и 39 % вновь выявленных больных имели РЖ III и IV стадий соответственно), так и с наличием тяжелых сопутствующих заболеваний, особенно у пожилых больных РЖ [5].
При местнораспространенном неоперабельном РЖ (МРНРЖ) ESMO рекомендует химиотерапию (ХТ) [20], NCCN (2014) – лучевую и химиолучевую терапию (ХЛТ) [14]. Однако эти рекомендации основаны на данных исследований второй половины прошлого столетия, когда методы и дозы лучевой терапии (ЛТ) и ХТ были далеки от оптимальных [12, 16]. В ряде наших публикаций было показано, что ЛТ и ХЛТ имеют преимущество перед ХТ при МРНРЖ как по данным ретроспективного анализа [2], так и по данным проспективного рандомизированного исследования [3].
Важным, но мало изученным при НМРРЖ является вопрос о дозе и фракционировании ЛТ [1]. В большинстве исследований по ЛТ и ХЛТ использовалось традиционное фракционирование (ТФ) до суммарных доз диапазона 45–50,4 Гр, что послужило основанием рекомендовать этот диапазон в практике [14]. В то же время при учете наличия прямой связи между дозой и эффектом ЛТ и возрастания риска повреждения здоровых тканей с увеличением дозы использование нетрадиционных режимов фракционирования может привести к улучшению противоопухолевого эффекта и выживаемости за счет безопасного повышения суммарной дозы. Это было продемонстрировано теоретически [17] и в клинике при различных моделях рака [7, 19]. Ускоренное гиперфракционирование (УГФ), наряду с ТФ, применялось в лечении больных НМРРЖ в клинике ГБУЗ АО «Архангельский клинический онкологический диспансер» (АКОД).
Цель исследования – ретроспективное сравнение общей выживаемости больных МРНРЖ, получавших ЛТ в режиме УГФ и ТФ в клинике АКОД.
Материал и методы
Ретроспективно проанализированы отдаленные результаты у больных МРНРЖ, получавших лечение в условиях АКОД с 04.11.1993 по 19.03.2010. Пациенты, получавшие лечение до 2009 г., были рестадированы в соответствии с классификацией TNM 7-го пересмотра [18]. Для анализа отобраны больные, получавшие ЛТ как единственный вариант лечения либо как сочетание ЛТ с ХТ и соответствующие следующим критериям:
– морфологическая верификация диагноза;
– неоперабельная опухоль в силу местной распространенности либо по медицинским противопоказаниям;
– больные РЖ II–III стадий (Т2–4N0–3М0), отказавшиеся от хирургического лечения;
– общее состояние по критериям ECOG 0–2;
– возраст больных старше 18 лет;
– отсутствие отдаленных метастазов;
– отсутствие в анамнезе других злокачественных новообразований, кроме адекватно леченных базалиомы кожи и рака шейки матки in situ;
– отсутствие сопутствующих заболеваний в стадии декомпенсации, беременности.
В зависимости от вида проведенного лечения больных разделили на 2 группы: ТФ и УГФ. Дистанционную ЛТ проводили на гамма-терапевтических установках РОКУС-АМ (Равенство, СПб.) либо линейном ускорителе электронов Clinac2100 C (Varian, USA). Согласно локальному стандарту лечения МРНРЖ, облучение проводили в режиме традиционного фракционирования (d=2 Гр, ежедневно, 5 раз в нед) либо ускоренного гиперфракционирования (d=1,3 Гр, ежедневно, дважды в день с межфракционным интервалом не менее 5 ч, 5 дней в нед) до дозы 50–70 Гр либо ее биологического эквивалента.
Химиотерапию большинству больных проводили в стандартных дозных режимах. Использовалась ХТ как в монорежиме (5-фторурацил (ФУ) в дозе 425 мг/м2 с 1 по 5-й дни, каждые 28 дней; капецитабин – 2500 мг/м2 с 1 по 14-й дни, интервал 7 дней; УФТ – 400 мг per os 2 раза в день с 1 по 14-й дни), так и в комбинации (цисплатин – 100 мг/м2 в 1-й день + ФУ – 1000 мг/м2, 24-часовая инфузия с 1 по 5-й дни, каждые 28 дней; ФУ – 500 мг/м2 + + лейковорин – 300 мг/м2 + этопозид – 120 мг/м2 с 1 по 3-й дни, каждые 28 дней; доксорубицин – 20 мг/м2, 1, 7-й дни + этопозид – 100 мг/м2 в 4–6-й дни + цисплатин – 40 мг/м2 во 2, 8-й дни, каждые 28 дней) [4]. Химиотерапию и лучевую терапию в группе ХЛТ осуществляли последовательно.
Для удобства статистической обработки результатов непрерывные переменные (возраст больных и доза ЛТ) трансформировали в порядковые. Оценка распределения долей проводилась методом χ2 с помощью точного метода Фишера. Первичным критерием оценки выживаемости установлена общая выживаемость – как промежуток в месяцах между датой установления диагноза РЖ и смертью от любой причины. Цензурирование проводили по дате последней проверки базы данных либо по дате последней явки на контрольный осмотр для выбывших из-под наблюдения. Выживаемость больных оценивали методом Каплана – Майера, представляли в виде Ме (95 % доверительный интервал (ДИ)) и графически в виде кривых. Различия в выживаемости между группами определяли лог-ранговым методом. Оценка кумулятивной выживаемости проведена с помощью таблиц дожития. Значения выживаемости в течение 1, 3 и 5 лет представляли в виде процентов с ДИ. Коррекция отношения рисков смерти с учетом влияния исходных факторов (пол, возраст, группа лечения, распространенность первичной опухоли, поражение лимфоузлов, пробная лапаротомия) проводилась с помощью регрессионной модели пропорциональных рисков Кокса. Введение факторов в регрессионную модель осуществляли последовательным методом. Все сравнения были двусторонние, статистически значимым уровнем достоверности различий определено р<0,05.
Результаты исследования
таблица 1
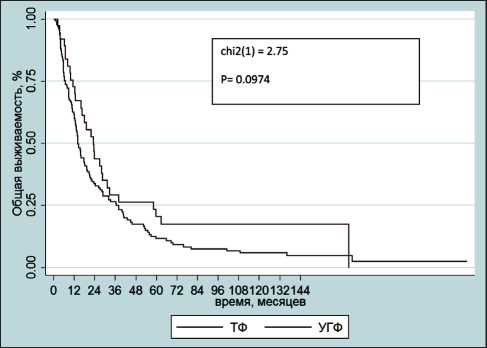
Медиана времени наблюдения для всех больных составила 12,4 года. К моменту анализа погибло 123 (89,8 %) из 137 наблюдаемых больных. Живы 5 (14,3 %) больных группы УГФ и 6 (5,9 %) в группе ТФ; трое больных выбыли из-под наблюдения через 15–45 мес после окончания ЛТ. Медиана выживаемости в группе УГФ составила 23,8 (ДИ 16,9–30,7) мес; в группе ТФ – 16,0 (ДИ 11,4–20,6) мес, χ2=2,75, р=0,097 (рис. 1).
При анализе показателей кумулятивной выживаемости недостоверное преимущество было выявлено в группе больных, получавших УГФ (табл. 2). Тем не менее следует отметить, что в отдаленные сроки наблюдения доли выживших отличаются в разы: 7-летняя выживаемость в группах УГФ и ТФ составляет 18,7 % и 6,2 % соответственно.
Учитывая неравномерность распределения в группах по локализации опухоли и лечебным факторам и возможность их самостоятельного влияния на выживаемость, проведена регрессия Кокса, результаты анализа представлены в табл. 3. После коррекции по включенным в модель факторам регрессионный коэффициент (отношение рисков,
ОР) для УГФ, исходно составлявший 0,71 (95 % ДИ 0,46–1,06), р=0,097, существенно потерял уровень значимости, составив 0,87 (95 % ДИ 0,49–1,55), р=0,642. В однофакторном анализе статистически значимыми в отношении прогноза общей выживаемости были локализация опухоли в средней трети (ОР=0,63 относительно кардиального отдела), IIIВ стадия (ОР=1,94 относительно I стадии) и пробная лапаротомия (ОР=1,57). В многофакторной модели независимое влияние на прогноз оказала только локализация опухоли. Применение ХТ в однофакторной модели, ассоциированное с недостоверным повышением риска смерти от любой причины, после коррекции на прочие факторы оказало слабое положительное влияние на прогноз, не достигшее статистической значимости. Анализ показывает также отсутствие связи между суммарной дозой ЛТ и общей выживаемостью. Сокращение общей продолжительности ЛТ было ассоциировано со статистически незначимым снижением риска смерти в однофакторной и многофакторной моделях: ОР составили 0,72 (95 % ДИ 0,50–1,03) и 0,79 (95 % ДИ 0,52–1,22) соответственно.
Обсуждение
В представленном исследовании проведен ретроспективный анализ общей выживаемости больных НМРРЖ, получавших ЛТ в двух различных режимах фракционирования. Режим УГФ, несмотря на более чем полугодовое преимущество в медиане выживаемости (23,8 против 16,0 мес) и в 3 раза более высокие показатели 7-летней выживаемости (18,7 % против 6,2 %), не продемонстрировал статистически значимого преимущества перед классическим режимом фракционирования.
Необходимо подчеркнуть, что ЛТ в настоящее время не является стандартом лечения больных МРНРЖ, по крайней мере в Европе и России, и, как правило, назначается c паллиативной целью для купирования дисфагии [10, 12] либо хронического кровотечения [20]. Тем не менее немногочисленные публикации, главным образом американских авторов [9, 12, 16], свидетельствуют о возможности таблица 2
Однофакторный и многофакторный анализ общей выживаемости больных Мрнрж (регрессия Кокса)
Использование устаревших методов облучения с двухмерным планированием также является недостатком исследования. Однако современные методы ЛТ, такие как интенсивно-модулированное
Список литературы Ускоренное гиперфракционирование дозы в лучевом лечении неоперабельного местнораспространенного рака желудка
- Зырянов Б.Н., Афанасьев С.Г., Завьялов А.А. Интраоперационная лучевая терапия с использованием малогабаритного бетатрона//Российский онкологический журнал. 1998. № 6. С. 32-36.
- Ружникова А.А., Асахин С.М., Вальков М.Ю. Химиолучевое лечение местно-распространенного неоперабельного рака желудка:проспективный анализ выживаемости//Вестник РНЦРР Минздрава России. 2013. Т. 13, № 2. Интернет-ресурс. URL:http://vestnik.rncrr.ru/vestnik/v13/papers/ruzhnikova1_v13.htm (дата обращения 30.12.2014).
- Ружникова А.А., Литинский С.С., Асахин С.М., Ружников А.О., Вальков М.Ю. Химиолучевое лечение местно-распространенного неоперабельного рака желудка: ретроспективный анализ выживаемости//Сибирский онкологический журнал. 2012. № 6. С. 13-20.
- Руководство по химиотерапии опухолевых заболеваний/Под ред. Н.И. Переводчиковой. М.: Практическая медицина, 2011. 511 с.
- Состояние онкологической помощи населению России в 2012 году/Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М., 2013. 231 с.
- Allemani C., Weir H.K., Carreira H., Harewood R., Spika D., Wang X.S., Bannon F., Ahn J.V., Johnson C.J., Bonaventure A., Marcos-Gragera R., Stiller C., Azevedo e Silva G., Chen W.Q., Ogunbiyi O.J., Rachet B., Soeberg M.J., You H., Matsuda T., Bielska-Lasota M., Storm H., Tucker T.C., Coleman M.P. Global surveillance of cancer survival 1995-2009: analysis of individual data for 25,676,887 patients from 279 populationbased registries in 67 countries (CONCORD-2)//Lancet. 2015. Vol. 385 (9972). P. 977-1010. (14) 62038-9 DOI: 10.1016/S0140-6736
- Horiot J.C., Bontemps P., van den Bogaert W., Le Fur R., van den Weijngaert D., Bolla M., Bernier J., Lusinchi A., Stuschke M., Lopez-Torrecilla J., Begg A.C., Pierart M., Collette L. Accelerated fractionation (AF) compared to conventional fractionation (CF) improves loco-regional control in the radiotherapy of advanced head and neck cancers: results of the EORTC 22851 randomized trial//Radiother Oncol. 1997. Vol. 44 (2). P. 111-121.
- International Agency for Research on Cancer. GLOBOCAN 2012: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2012. URL: http://globocan.iarc.fr/Default.aspx
- Lee S.S., Kim S.B., Park S.I., Kim Y.H., Ryu J.S., Song H.Y., Shin J.H., Jung H.Y., Lee G.H., Choi K.D., Cho K.J., Kim J.H. Capecitabine and cisplatin chemotherapy (XP) alone or sequentially combined chemoradiotherapy containing XP regimen in patients with three different settings of stage IV esophageal cancer//Jpn. J. Clin. Oncol. 2007. Vol. 37 (11). P. 829-835.
- Mantell B.S. Radiotherapy for dysphagia due to gastric carcinoma//Br. J. Surg. 1982. Vol. 69 (2). P. 69-70.
- Milano M.T., Garofalo M.C., Chmura S.J., Farrey K., Rash C., Heimann R., Jani A.B. Intensity-modulated radiation therapy in the treatment of gastric cancer: early clinical outcome and dosimetric comparison with conventional techniques//Br. J. Radiol. 2006. Vol. 79 (942). P. 497-503.
- Moertel C.G., Childs D.S. Jr., Reitemeier R.J., Colby M.Y. Jr., Holbrook M.A. Combined 5-fluorouracil and supervoltage radiation therapy of locally unresectable gastrointestinal cancer//Lancet. 1969. Vol. 2 (7626). P. 865-867.
- Myint A.S. The role of radiotherapy in the palliative treatment of gastrointestinal cancer//Eur. J. Gastroenterol. Hepatol. 2000. Vol. 12 (4). P. 381-390.
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Gastric Cancer. -URL: http://www.nccn.org/professionals/physician_gls/pdf/gastric.pdf
- Saunders M., Dische S., Barrett A., Harvey A., Griffiths G., Palmar M. Continuous, hyperfractionated, accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small cell lung cancer: mature data from the randomised multicentre trial. CHART Steering committee//Radiother. Oncol. 1999. Vol. 52 (2). P. 137-148.
- Schein P., Novak J. (for GITSG) Combined modality therapy (XRT-chemo) versus chemotherapy alone for locally unresectable gastric cancer//Cancer Chemother. Pharmacol. 1982. Vol. 49. P. 1771.
- Thames H.D. Jr., Withers H.R., Peters L.J., Fletcher G.H. Changes in early and late radiation responses with altered dose fractionation: implications for dose-survival relationships//Int. J. Radiat. Oncol. Biol. Phys. 1982. Vol. 8 (2). P. 219-2610.
- TNM classification of malignant tumours/Ed. by L.H. Sobin, M.K. Gospodarowicz, Ch. Wittekind. 7th edition.
- Valdagni R. Altered fractionation in radiotherapy//Tumori. 1998. Vol. 84 (2). P. 155-159.
- Waddell T., Verheij M., Allum W., Cunningham D., Cervantes A., Arnold D. Gastric cancer: ESMO-ESSO-ESTRO Clinical Practice Guidelines for diagnosis, treatment and follow-up//Ann. Oncol. 2013. Vol. 24 (Suppl. 6): vi57-vi63 DOI: 10.1093/annonc/mdt344
- Weese J.L, Nussbaum M.L. Gastric cancer -surgical approach//Hematol. Oncol. 1992. Vol. 10 (1). P. 31-35.


