Ускоренное гиперфракционирование с неравномерным дроблением дневной дозы при лучевом и химиолучевом лечении неоперабельного немелкоклеточного рака легкого
Автор: Гоголин Д.В., Гулидов И.А., Мардынский Ю.С., Иванова И.Н., Рагулин Ю.А., Курсова Л.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 (66), 2014 года.
Бесплатный доступ
Представлена сравнительная оценка химиолучевого лечения в режиме ускоренного гиперфракционирования с неравномерным дроблением дневной дозы с последовательной и одновременной химиотерапией у 187 больных неоперабельным немелкоклеточным раком легкого IIA-IIIB стадий. Пациенты были разделены на три группы. В первой (контрольной) группе - 75 пациентов, лучевая терапия проводилась в режиме традиционного фракционирования с последовательными 2-4 циклами химиотерапии по схеме цисплатин + этопозид. Во второй (промежуточной) группе - 66 пациентов, лучевая терапия проводилась в режиме ускоренного гиперфракционирования с неравномерным дроблением дневной дозы на две фракции 1 и 1,5 Гр до СОД 60-70 Гр с последовательными 2-4 циклами химиотерапии по схеме цисплатин + этопозид. В третьей (основной) группе - 46 пациентов, лучевая терапия проводилась в аналогичном режиме ускоренного гиперфракционирования, но с одновременными 2 циклами химиотерапии по схеме цисплатин + этопозид. Частота полного и частичного ответа в контрольной группе составила 60,0 %, в промежуточной группе - 89,4 %, в основной группе - 76,0 %. Показатели 5-летней общей и безрецидивной выживаемости в контрольной, промежуточной и основной группах равнялись 6,6 %, 10,5 %, 21,4 % и 2,5 %, 10,1 %, 16,4 % соответственно.
Немелкоклеточный рак легкого, ускоренное гиперфракционирование
Короткий адрес: https://sciup.org/14056480
IDR: 14056480 | УДК: 616.24-006.6-085.849.1-036.8
Текст научной статьи Ускоренное гиперфракционирование с неравномерным дроблением дневной дозы при лучевом и химиолучевом лечении неоперабельного немелкоклеточного рака легкого
Одной из актуальных проблем клинической онкологии является лечение злокачественных опухолей бронхов и лёгкого. Известно, что злокачественные
опухоли лёгких занимают устойчивое первое место в структуре смертности от онкологических заболеваний в мире. По данным GLOBOCAN (2012 г.), в мире ежегодно регистрируется около 1,8 млн новых случаев рака лёгкого и при этом смертность составляет более 1 млн человек. В России показатели заболеваемости и смертности также являются неудовлетворительными. Показатель заболеваемости раком лёгкого в 2013 г. составил 88,7 на 100 000 населения, летальность в течение года с момента установления диагноза в 2013 г. равнялась 51,8 % [4].
Единственным радикальным методом лечения рака лёгкого является хирургическое вмешательство, но в связи с тем, что на момент постановки диагноза около 70 % больных имеют III–IV стадию заболевания [3], у значительной части из них выполнить радикальную операцию невозможно, и лечение вынужденно носит консервативный характер. В крупных рандомизированных исследованиях была доказана эффективность платинсодержащих схем химиотерапии в лечении немелкоклеточного рака легкого (НМРЛ) [6, 8, 13]. При сравнительном анализе последовательного и одновременного хи-миолучевого лечения было установлено, что одновременное назначение облучения и химиотерапии улучшает результаты лечения у больных НМРЛ [7, 9]. Применение режима ускоренного гиперфракционирования у больных раком лёгкого позволяет улучшить как непосредственные, так и отдалённые результаты лечения [10–12].
Материал и методы
В исследование были включены 187 больных с верифицированным диагнозом немелкоклеточный рак лёгкого, которые получали лечение с 2005 по 2012 г. в ФГБУ МРНЦ Минздрава РФ на базе отделения дистанционной лучевой терапии и отделения хирургического и лучевого лечения заболеваний торакальной области с группой лечения заболеваний молочной железы. Критериями включения являлись следующие параметры: морфологически верифицированный немелкоклеточный рак легкого, IIA–IIIB стадия заболевания, статус по шкале Кар-новского не менее 60 %, наличие противопоказаний к оперативному вмешательству (опухоль неоперабельная по распространенности, сопутствующие заболевания, отказ больного от операции). Наиболее частым морфологическим вариантом был плоскоклеточный рак, который диагностирован в 157 (83,9 %) случаях. В большинстве наблюдений (78,1 %) был диагностирован НМРЛ IIIA–IIIB стадии, в остальных случаях (21,9 %) – IIA–IIB стадии. Все пациенты были разделены на три группы, которые были сопоставимы по основным демографическим, морфологическим и клиникоанатомическим признакам.
В первую (контрольную) группу вошли 75 больных, лучевую терапию которым проводили в традиционном режиме фракционирования дозы (РОД 2 Гр, подводимая ежедневно, кроме выходных, до СОД 60–66 Гр). После окончания лучевой терапии все пациенты получали 2–4 цикла химиотерапии по схеме цисплатин в дозе 80 мг/м2 + этопозид в дозе 100 мг/м2.
Во вторую (промежуточную) группу вошли 66 пациентов, лучевая терапия которым проводилась в режиме ускоренного гиперфракционирования с неравномерным дроблением дневной дозы на две фракции 1 и 1,5 Гр с интервалом между ними 5–6 ч, подводимых ежедневно, кроме выходных, до суммарной очаговой дозы 60–70 Гр. После окончания лучевой терапии все пациенты получали 2–4 цикла химиотерапии по схеме цисплатин в дозе 80 мг/м2 + этопозид в дозе 100 мг/м2.
Третью (основную) группу составили 46 пациентов, получивших лучевую терапию в режиме ускоренного гиперфракционирования с неравномерным дроблением дневной дозы на две фракции 1 и 1,5 Гр с интервалом между ними 5–6 ч, подводимых ежедневно, кроме выходных, до СОД 60–70 Гр с двумя одновременными циклами химиотерапии по схеме цисплатин (80 мг/м2в 1, 29 дни) и этопозид (100 мг/м2 в 1–3, 29–31 дни) и 2–4 консолидирующими циклами по аналогичной схеме.
Результаты и обсуждение
При анализе непосредственных результатов лечения (табл. 1) выявлено, что частота случаев полной регрессии опухоли была примерно одинаковой по всем группам (p=0,78), частота частичных регрессий была выше в группах, где лучевая терапия проводилась в режиме ускоренного гиперфракционирования (p=0,001). Суммарный выраженный эффект лечения (полная + частичная регрессия опухоли) был выше в группах, в которых применялось ускоренное гиперфракционирование. Этот показатель составил 89,4 % – в промежуточной (p=0,0001) и 76,0 % – в основной (p=0,06) группах, тогда как в контрольной группе он равнялся 60,0 %. Частота случаев стабилизации опухоли была выше
Таблица 1
|
Группа больных |
Полная регрессия |
Частичная регрессия |
Стабилизация |
Прогрессирование |
|
Контрольная (n=75) |
4 (5,4 %) |
41 (54,6 %) |
19 (25,3 %) |
11 (14,7 %) |
|
Промежуточная (n=66) |
4 (6,0 %) |
55 (83,4 %) |
5 (7,6 %) |
2 (3,0 %) |
|
Основная (n=46) |
3 (6,5 %) |
32 (69,5 %) |
8 (17,5 %) |
3 (6,5 %) |
Таблица 2
|
Группа больных |
1 год |
2 года |
3 года |
4 года |
5 лет |
|
Контрольная (n=75) |
76,5 ± 9,8 % |
46,5 ± 11,7 % |
27,7 ± 11,6 % |
17,1 ± 10,9 % |
6,6 ± 8,4 % |
|
Промежуточная (n=66) |
69,1 ± 10,9 % |
46,4 ± 11,9 % |
29,7 ± 12,1 % |
18,4 ± 12,3 % |
10,5 ± 12,4 % |
|
Основная (n=46) |
79,8 ± 10,2 % |
58,1 ± 11,9 % |
48,3 ± 13,7 % |
25,7 ± 16,0 % |
21,4 ± 17,4 % |
Частота регрессии опухоли через 1 мес. после проведенного лечения в группах
Показатели общей выживаемости в сравниваемых группах
в контрольной группе, по сравнению с аналогичными показателями в промежуточной (p=0,005) и основной (p=0,3) группах. Прогрессирование также чаще наблюдалось в контрольной группе, но при сравнении данного показателя с другими группам статистически значимых различий выявлено не было.
Анализ показателей общей и безрецидивной выживаемости выявил различные результаты лечения в сравниваемых группах (табл. 2, 3). В течение двух лет после окончания лечения показатели общей выживаемости у всех больных находятся примерно на одном уровне. В период от двух до трех лет наблюдения прослеживается тенденция к увеличению показателей в группах, где использовался режим ускоренного гиперфракционирования. При сравнении показателей общей выживаемости у больных контрольной и основной групп были получены статистически значимые различия (рис. 1). Таким образом, одновременная химиолучевая
Рис. 1. Сравнение показателей общей выживаемости у больных контрольной и основной групп (log-rank test, p=0,03)
(Каплан-Мейер)
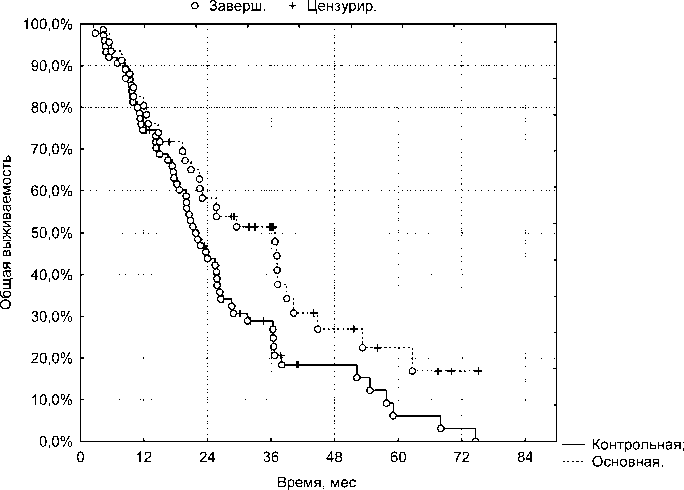
Таблица 3
|
Группа больных |
1 год |
2 года |
3 года |
4 года |
5 лет |
|
Контрольная (n=75) |
70,9 ± 10,2 % |
37,6 ± 10,9 % |
16,9 ± 9,0 % |
12,4 ± 8,4 % |
2,5 ± 4,7 % |
|
Промежуточная (n=66) |
62,4 ± 11,5 % |
38,3 ± 11,7 % |
28,3 ± 10,9 % |
15,9 ± 9,4 % |
10,1 ± 8,6 % |
|
Основная (n=46) |
65,0 ± 13,7 % |
40,5 ± 14,1 % |
30,9 ± 13,5 % |
20,7 ± 13,1 % |
16,4 ± 12,7 % |
Таблица 4
|
Группа больных |
Эзофагит II–III ст. |
Пульмонит II–III ст. |
Лейкопения II–III ст. |
Тромбоцитопения II–III ст. |
Анемия II–III ст. |
|
Контрольная (n=75) |
24 (29,2 %) |
10 (13,3 %) |
– |
– |
– |
|
Промежуточная (n=66) |
21 (31,8 %) |
7 (10,6 %) |
– |
– |
– |
|
Основная (n=46) |
15 (32,6 %) |
10 (21,7 %) |
17 (36,9 %) |
9 (19,5 %) |
10 (21,7 %) |
Показатели безрецидивной выживаемости в сравниваемых группах
Частота и степень тяжести острых лучевых и гематологических осложнений в сравниваемых группах
терапия с использованием режима ускоренного гиперфракционирования с неравномерным дроблением дневной дозы статистически значимо повышает показатели общей выживаемости (p=0,03) по сравнению с лучевой терапией, проводимой в традиционном режиме с последовательным назначением химиотерапии.
При сравнении показателей безрецидивной выживаемости по всем группам статистически значимых различий установлено не было. Однако наблюдается тенденция к увеличению данного показателя в период наблюдения от двух до пяти лет в группах, где лучевая терапия проводилась в режиме ускоренного гиперфракционирования и одновременного химиолучевого лечения (табл. 3).
Переносимость лечения оценивали по частоте и степени тяжести ранних и поздних лучевых и гематологических осложнений (табл. 4). Для оценки степени тяжести осложнений использовали шкалу RTOG. Частота развития острого лучевого эзофагита была примерно одинаковой во всех группах и составила около 30 %. Частота развития лучевого пульмонита была выше в основной группе, где проводилась одновременная химиолучевая терапия в режиме ускоренного гиперфракционирования, что можно объяснить радиосенсибилизирующим действием химиопрепаратов на лёгочную ткань. Острые гематологические реакции были диагностированы в процессе химиолучевого лечения только в основной группе. Наиболее частым осложнением была лейкопения, которая была диагностирована у
17 (36,9 %) пациентов, у 10 (21,7 %) – наблюдалась анемия, у 9 (19,5 %) больных – тромбоцитопения. Все гематологические осложнения были купированы при назначении консервативной терапии и не приводили к прерыванию курса лучевой терапии.
Наиболее перспективным направлением в консервативном лечении больных местнораспространенным неоперабельным НМРЛ является комбинирование лучевых и химиотерапевтических методов. В связи с тем, что традиционные курсы лучевой терапии не позволяют добиться удовлетворительных результатов, становится обоснованным поиск нетрадиционных режимов фракционирования в лечении этой категории больных [5, 10]. Режим ускоренного гиперфракционирования с неравномерным дроблением дневной дозы на две фракции 1 и 1,5 Гр с перерывом между ними 5–6 ч до СОД 60–70 Гр имеет радиобиологические преимущества по сравнению с традиционным режимом. Благодаря повышению дневной дозы снижается интенсивность ускоренной репопуляции клеток опухоли и сокращаются сроки лечения. Подведение двух фракций в день с перерывом между ними 5–6 ч снижает лучевую нагрузку на здоровые ткани за счёт восстановления сублетальных повреждений клеток [1, 2].
Заключение
Проведение двух циклов химиотерапии по схеме цисплатин + этопозид одновременно с радикальным курсом лучевой терапии в режиме ускорен- ного гиперфракционирования с неравномерным дроблением дневной дозы на две фракции 1 и 1,5 Гр удовлетворительно переносится больными и позволяет улучшить отдалённые результаты лечения неоперабельного рака лёгкого по сравнению с традиционным режимом и последовательным назначением химиотерапии.


