Ускоренное отторжение иммуногенной опухоли у мышей при ингибировании активности индоламин-2,3-диоксигеназы этилпируватом
Автор: Васильева Е.Д., Каледин В.И., Николин В.П., Попова Н.А., Кирилюк И.А., Григорьев И.а
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 (49), 2012 года.
Бесплатный доступ
Индоламин-2,3-диоксигеназа (ИДО) - недавно обнаруженный фермент, который катаболизирует триптофан, что создает локаль- ный дефицит этой незаменимой аминокислоты и подавляет пролиферацию и функцию иммунных лимфоцитов в данном регионе. Поэтому ингибиторы активности ИДО могут способствовать преодолению иммунорезистентности опухолей. В эксперименте на мышах линии С3НА, иммунизированных несингенной опухолью Г-29, изучали влияние системного и местного введения ингиби- тора ИДО этилпирувата на частоту и скорость отторжения повторных трансплантатов Г-29. Оба способа введения этилпирувата увеличивали частоту и ускоряли регрессиию опухолей по сравнению с контролем. Таким образом, ингибиторы активности ИДО, ослабляющие иммунорезистентность опухолей, могут оказаться полезными в плане увеличения эффективности противоопухо- левой терапии.
Индоламин-2, 3-диоксигеназа, этилпируват, гепатома г-29, регрессия опухоли
Короткий адрес: https://sciup.org/14056184
IDR: 14056184 | УДК: 616-006:612.017.1:577.155]-092.9
Текст научной статьи Ускоренное отторжение иммуногенной опухоли у мышей при ингибировании активности индоламин-2,3-диоксигеназы этилпируватом
После того как в 1998 г. было показано, что неотторжение аллогенных зародышей материнским организмом каким-то образом связано с катаболизмом триптофана [13], появилось большое количество публикаций, посвященных изучению механизма этого явления. Было обнаружено, что присутствующий в клетках трофобласта фермент индоламин-2,3-диоксигеназа (ИДО), катаболи-зирующий триптофан по кинурениновому пути, создает его локальный дефицит при избытке ток- сичных для Т-лимфоцитов продуктов катаболизма [4, 11]. Экспериментальное подавление активности ИДО у беременных мышей приводило к отторжению аллогенных, но не сингенных зародышей [13]. Для онкологов эти исследования открывают путь к пониманию того, каким образом заведомо иммуногенные опухоли избегают или могут избегать иммунологической атаки со стороны организма. Действительно, оказалось, что ИДО экспрессируется в клетках многих опухолей и в инфильтрирующих их макрофагах, причем высокая активность фермента в этих случаях, как правило, ассоциируется с плохим прогнозом [6, 12, 14]. Ингибиторы активности ИДО сами по себе снижают скорость роста таких опухолей [15], а в сочетании с воздействием химиопрепаратов в ряде случаев усиливают терапевтический эффект последних [8]. В качестве ингибитора ИДО обычно используют синтетический аналог триптофана 1-метил-D-триптофан, который вводят хронически в суточной дозе до 800 мг/кг массы тела животных [8]. Поскольку для преодоления обусловленной ИДО иммунорезистентности опухоли необходимо подавить активность фермента только в ее клетках и в инфильтрирующих опухоль макрофагах, дозу ингибитора можно значительно снизить, если вводить препарат местно в зону опухоли. Кроме того, в последнее время обнаружен ряд новых соединений, способных ингибировать активность ИДО [7], среди которых наше внимание привлек применяющийся в клинике сравнительно дешевый и малотоксичный противовоспалительный агент этилпируват [5, 9, 10]. В представленной работе, выполненной на модели заведомо иммуногенной несингенной опухоли мышей, мы показали, что хроническое системное или местное введение этилпирувата в район локализации опухоли приводит к ее ускоренному отторжению по сравнению с контролем.
Материал и методы
В работе использованы мыши линии С3НА и перевиваемая опухоль Гепатокарцинома-29 (Г-29) [1]. Опухоль происходит от мыши линии СВА, но прививается у 100 % мышей линии С3HA, у значительной части которых в последующем прекращает рост и регрессирует. При подготовке эксперимента в мышцы бедра самцам С3НА трансплантировали по 5×105 клеток Г-29 и месяц особей, у которых опухоль прогрессивно росла, выбраковывали, а отторгнувшим опухоль иммунным мышам прививали ее повторно значительно большей дозой клеток (в 5, а потом и в 10 раз). После этого животных распределяли по 2 группам, мышам одной группы вводили для ингибирования ИДО этилпируват, другую использовали в качестве контроля.
В эксперименте с системным введением этилпи-рувата последний растворяли в физиологическом растворе Рингера (5 мг/мл) и вводили мышам по 0,2 мл внутрибрюшинно 2 раза в сут на протяжении
20 сут. Контрольным мышам физраствор не вводили. В опыте с местным применением 0,1 мл 1 % раствора этилпирувата вводили внутримышечно в район локализации опухолевых клеток 1 раз в день на протяжении первых 10 сут после перевивки опухоли. Контрольным животным аналогично вводили 0,1 мл физраствора. Опухоли периодически пальпировали, измеряли с помощью штангенциркуля и регистрировали момент их исчезновения. Эксперимент заканчивали через 10 сут после регрессии последней опухоли в опытной группе.
Достоверность различий между опытом и контролем по проценту мышей с регрессировавшими опухолями оценивали по φ-критерию с помощью arc sin-преобразования Фишера.
Результаты и обсуждение
В нашей предыдущей работе при первичной трансплантации опухоли ГА-1 несингенным мышам С3НА ингибирование ИДО 1-метил-D-триптофаном привело не к торможению, а к стимуляции ее роста [2]. Полученный эффект кажется парадоксальным, однако только на первый взгляд. Дело в том, что впервые трансплантированная опухоль развивается в условиях так называемой патологической иммунной привилегии [3], при которой иммунный ответ на новообразование имеет сложную природу и наряду с тормозящим может оказывать и стимулирующее влияние. В этом случае ингибирование ИДО может приводить к активации не только Т-киллеров и Т-хелперов, но и Т-регуляторов, способствующих формированию толерантности и, как следствие, усилению роста опухоли. Напротив, в клинической онкологии обычно имеют дело с опухолями, иммунологические отношения которых с организмом хозяина уже определились и которые с помощью ИДО подавляют только эффекторное звено иммунного ответа. Поэтому и в экспериментах, имеющих целью изучение возможности воздействия на рост опухолей с помощью ингибиторов ИДО, очевидно, следует использовать предыммунизированных животных.
В представленной работе мы выполнили такое исследование, использовав в качестве реципиентов опухоли мышей, которым эта опухоль была перевита ранее и у которых она отторглась. При планировании первого эксперимента перевили опухоль Г-29 40 интактным 4-месячным мышам линии С3HA в мышцы бедра дозой 5×105 клеток.
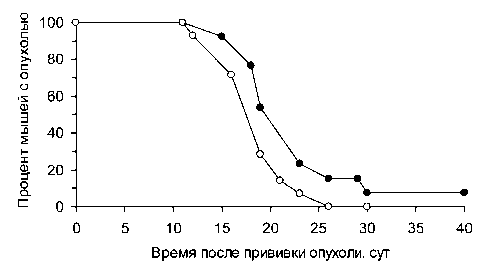
Рис. 1. Динамика регрессии трансплантатов опухоли Г-29 у мышей линии С3HA при системном введении ингибитора индоламин-2,3-диоксигеназы этилпирувата (светлые кружки) и в контроле (темные кружки)
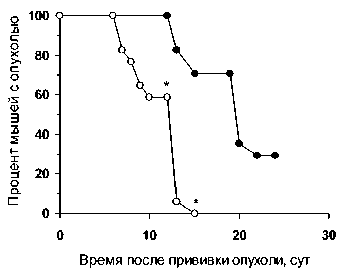
Рис. 2. Динамика регрессии трансплантатов опухоли Г-29 у мышей линии С3HA при местном введении ингибитора индоламин-2,3-диоксигеназы этилпирувата (светлые кружки) или физиологического раствора (темные кружки). Примечание: * – различия статистически значимы по сравнению с группой контроля (p<001)
Через неделю опухоли появились у всех животных, после чего у 13 из них они продолжали расти, а у 27 прекратили рост и постепенно регрессировали. Мышей с опухолями выбраковали, а всем животным, у которых опухоль отторглась, ее перевили повторно в то же бедро, но значительно (в 5 раз) большей дозой опухолевых клеток. Сразу после этого мышей разделили на 2 группы и 13 животных контрольной группы оставили без воздействия, а 14 подопытным стали 2 раза в сут вводить этилпи-руват, как описано в разделе «Материал и методы». Препарат вводили на протяжении 20 сут без перерывов; при разовой дозе 40 мг/кг это составило на курс около 1,6 г/кг массы тела животных. К 10-м сут после перевивки опухоли возникли у 100 % мышей обеих групп, после чего начали регресси- ровать – сначала (в течение 4 сут) с одинаковой, а затем с несколько большей скоростью в опыте по сравнению с контролем (рис. 1). К 26-м сут после перевивки в подопытной группе опухоли регрессировали у всех животных, тогда как в контрольной еще оставались 2 мыши с опухолями, из которых одна со временем регрессировала, а другая возобновила рост.
Через месяц после отторжения опухолей выживших мышей использовали повторно, для чего им трансплантировали еще большую, чем ранее (5×106), дозу клеток опухоли Г-29. После этого леченых и нелеченых мышей распределили поровну между опытной и контрольной группами нового эксперимента, добавив к ним по 4–5 появившихся к тому времени мышей с регрессировавшими опухолями, и начали лечение путем ежедневного местного введения этилпирувата или физраствора.
На 6-й день после перевивки опухоли появились у всех животных в обеих группах, при этом их средний объем был равен 0,30 ± 0,031 см3 в контроле и 0,20 ± 0,045 см3в опытной группе. Еще через 2 сут объем опухолей составлял – 0,23 ± 0,031 см3 и 0,15 ± 0,34 см3 соответственно (различия недостоверны). В дальнейшем опухоли постепенно уменьшались в обеих группах, но переставали прощупываться (полностью регрессировали) раньше и у большего числа мышей, которым вводили этилпируват, чем у контрольных животных (рис. 2). В обоих экспериментах этилпируват не оказывал на мышей сколько-нибудь заметного токсического действия, как при системном, так и при местном введении к концу курса масса их тела снизилась менее чем на 4 % по сравнению с исходной.
Таким образом, полученные результаты показывают, что у мышей, предыммунизированных опухолью, хроническое системное или местное введение этилпирувата в нетоксичной дозе приводит к ускоренному отторжению повторных трансплантатов этой опухоли. В настоящей работе (в особенности в первом эксперименте) мы применяли этилпируват по громоздкой схеме, применявшейся предложившими его в качестве ингибитора ИДО авторами [13]. Между тем в литературе имеется указание на то, что этилпируват используется как пищевая добавка, что предполагает сохранение по крайней мере какой-то его активности при приеме per os. Необходимо выяснить, относится ли это к способности этилпирувата ингибировать активность
ИДО, или эта способность проявляется только при парентеральном введении препарата. В дальнейшем нужно сосредоточиться на выяснении вопроса о возможности и перспективах использования его (и/или других ингибиторов ИДО) в сочетании с применяющимися в клинике препаратами для терапии опухолей.


