Условия интенсификации карботермического восстановления хромитов
Автор: Чернобровин В.П., Сенин A.B., Михайлов Г.Г., Пашкеев И.Ю.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 3 (43), 2005 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156514
IDR: 147156514 | УДК: 669.046.46
Текст обзорной статьи Условия интенсификации карботермического восстановления хромитов
Возможности интенсификации процессов восстановления определяются как особенностями взаимодействия оксидов с восстановителем, так и химическими и фазовыми превращениями в компонентах руды и в углеродсодержащем восстановителе при изменении температуры и окислительно-восстановительных условий по ходу плавки. Термодинамический анализ в сочетании с кинетическими исследованиями позволяют установить условия и механизм протекающих взаимодействий. На их основе становится возможной разработка конкретных технологических способов интенсификации процессов восстановления. В настоящей работе рассматриваются и обсуждаются существующие представления о механизме восстановления и термодинамические возможности интенсификации карботермического восстановления твердых хромсодержащих оксидных материалов при температурах до 1500 °C.
В настоящее время широкое распространение получило мнение, что восстановление твердых оксидов твердым углеродом осуществляется через газовую фазу, а роль контактно-диффузионных взаимодействий незначительна. Более спорным является вопрос о том, какой газообразный реагент обеспечивает взаимодействие между твердыми оксидами и восстановителем и наблюдаемую на практике высокую скорость восстановления.
При температуре менее 750...800 °C, когда скорость реакции газификации графита двуокисью углерода очень мала, т.е. реакция практически не идет из-за кинетических затруднений, экспериментально доказано, что начальные стадии восстановления осуществляются за счет непосредственного взаимодействия твердого углерода с оксидом, и чем совершеннее контакт между частицами, тем больше скорость восстановления [1,2].
При температурах выше 800 °C, когда реакция газификации графита двуокисью углерода получает заметное развитие, считается, что восстанавливающим газообразным компонентом может быть монооксид углерода СО. В этом случае процесс карботермического восстановления описывается «двухстадийным» механизмом:
МеО(тв) + СО(Га3) > Ме(тв) + СО2(газ), (1)
С(гр) + СО2(газ) ~* 2СО(газ); (2)
МеО(тв) + С($р) > Ме(тв) + СО^гдз). (э)
В этой схеме роль графита сводится к регенерации восстановителя СО в реакции газификации (2). В связи с рассматриваемым механизмом практиче ский интерес представляет вопрос о восстановительной способности СО по отношению к термодинамически прочным хромсодержащим оксидам, таким как Cr2O3, MgCr2O4 и др. В работе Елютина В.П. с сотрудниками [2] выполнен термодинамический анализ реакции
| Сг2О3 + СО | Сг+СО2, (4)
AG® = 23310 + 2,86-7’■ 107-12,03 , ккал/моль и из условия ag;+RTH в In^02^^ = о, \№о /факт где Тнв - температура начала взаимодействия; (№°2)Факг И ^со)факт - фактические парциальные давления газообразных участников реакции, определено значение Гнв= 1800К (1527 °C) при рСо2 =10-5 атм. Из-за невозможности поддержания столь низких значений парциального давления СО2 в реальных процессах делается вывод о том, что окись углерода не может быть использована для получения металлов из таких прочных оксидов, как Cr2O3, TiO2, ZrO2 и т.п. Замена хрома на карбиды хрома в качестве продуктов восстановления дает понижение Тнв, но принципиально выводов не меняет.
Нами проанализированы термодинамические условия равновесия при восстановлении оксида хрома монооксидом углерода в присутствии графита и без него.
В отсутствии графита равновесие можно описать уравнениями реакций
Сг20з(та) + ЗСО^) = 2СГ(та) + ЗСО2(газ); (5)
СО(газ) + — О2(газ) — СО2(газ)- (6)
Последняя реакция используется для того, чтобы оценить равновесное парциальное давление кислорода и при необходимости сопоставить его с упругостью диссоциации оксидов. Трехкомпонентная система Fe-Cr-O при равновесии трех фаз (оксид хрома, хром, газовая фаза) и постоянном общем давлении Р = 1 атм имеет одну степень свободы. Это означает, что из четырех переменных параметров, описывающих состояние системы (температура; парциальные давления СО, СО2 и О2), независимым является один. Задавая значение одного из параметров, значения остальных можно рассчитать из трех уравнений связи между параметрами:
з .
^(5) = ^у; lg^(5) = -13 730/7-0,80;
Рсо
Кр(6) = —^^у; lg^(6) = 14 767/7-4,575 ;
Рсо" Ро2 ’
Рсо+Рсо2 + Ро2=Р-
Результаты расчетов приведены в табл. 1. Каждой температуре соответствует свой состав газовой фазы.
Чтобы происходило восстановление оксида хрома в соответствии с реакцией (5), необходимо постоянно смещать равновесие в сторону продуктов реакции. Это возможно осуществить несколькими способами. При постоянной температуре можно увеличивать содержание СО, нагнетая его в систему, или отводить из системы СО2, тем самым понижая рс02 до равновесных значений и меньше. Если отсутствует возможность регулировать состав газовой фазы, то восстановление возможно
Таблица 1
Температурная зависимость равновесного состава газовой фазы
|
Т,°С |
Парциальные давления компонентов, атм |
||
|
Рсо |
Рсо2 "Ю3 |
Ро, |
|
|
1200 |
0,99958 |
0,42 |
2,26-10"18 |
|
1235 |
0,99950 |
0,50 |
9,00-10"18 |
|
1300 |
0,99933 |
0,67 |
1,06-10"16 |
|
. 1400 |
0,99900 |
1,00 |
3,12-10~15 |
|
1500 |
0,99858 ■ |
1,42 |
6,29-10'14 |
|
1600 |
0,99805 |
1,95 |
9,19-Ю”13 |
|
1700 |
0,99741 |
2,59 |
1,02Ю-11 |
|
1800 |
0,99665 |
3,35 |
9,04-10'11 |
|
1900 |
0,99577 |
4,23 |
6,53-1О~10 |
|
2000 |
0,99477 |
5,23 |
3,96-1 О*9 |
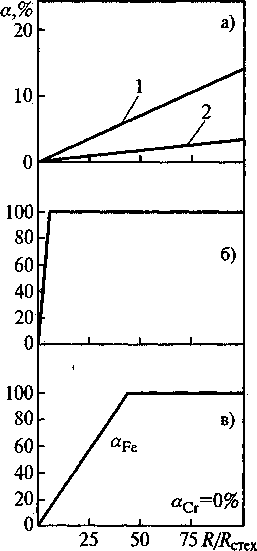
Рис. 1. Восстановление твердых оксидов газообразным СО при 1400 °C в зависимости от избытка восстановителя.
Химические схемы восстановления: '
а) 1 — СГгОз + R/Rcrex ЗСО(газ) —> СГ7С3; С0(газ)1 СОг(газ)!
2 — СГгОз + R/Rcrex ЗСО(газ) “> Сг; СО(газ); СО2(газ)>
-
б) FeO + R/Rcrex СО(газ) —^ Fej СО(газ)1 СО2(газЬ
-
в) FeCr2O4 + R/Rcrex 4СО(газ) —> Fe; Сг; СО(газ)j СО2(газ)
лишь в результате постоянного повышения температуры, когда каждому новому значению температуры будет соответствовать новый состав газовой фазы с повышающимся, но все-таки крайне низком, значении концентрации СО2. На рис. 1 приведены результаты расчета степени восстановления оксидов Fe2O3, Cr2O3, FeCr2O4 при 1400 °C в зависимости от избытка газообразного восстановителя. Для обозначения избытка восстановителя используется множитель R/Rctex , который показывает, во сколько раз исходное количество восстановителя превышает стехиометрический расход R^^, вычисленный на основе уравнения химической реакции восстановления. Расчеты, выполненные с использованием программного комплекса «АСТРА-4» [3], моделировали последовательность действий: стехиометрическое количество СО добавляли к одному молю оксида и рассчитывали, какие продукты и в каком количестве получатся из этих исходных веществ при 1400 °C и общем давлении 1 атм. В следующем расчете количество восстановителя увеличивали в R/R^ex раз, добавляли увеличенное количество восстановителя к 1 молю оксида, затем рассчитывали количества продуктов при тех же самых температуре и давлении и т.д. Из результатов расчетов следует, что газообразный СО является хорошим восстановителем по отношению к Fe2O3: достаточно 5-кратного избытка СО по сравнению со стехиометрически необходимым, чтобы восстановить все железо. Оксид Сг2О3 восстанавливается труднее: при стехиометрическом расходе степень
восстановления составляет всего 0,09% при восстановлении до хрома и 0,13 % при восстановлении до карбида Сг7С3. 100-кратный избыток СО повышает степень восстановления до 8,5 и 14 % соответственно. По отношению к хромиту железа FeCr2O4 монооксид углерода оказывается еще более слабым восстановителем: для полного восстановления железа требуется 40-кратный избыток восстановителя, а хром начинает восстанавливается лишь при 150-кратном избытке СО.
В присутствии графита равновесие описывается следующими уравнениями химических реакций:
Сг2О3(тв) + 3 СО(газ) = 2Сг(та) + 3 СО2(газ);(5)
СО(газ) + — О2(газ) — СО2(газ),(6)
С(гр) + СО2(газ) = 2СО(газ).(2)
Трехкомпонентная система Fe-Cr-О при равновесии четырех фаз (оксид хрома, графит, хром, газовая фаза) и постоянном давлении Р является нон-вариантной. Это означает, что восстановление осуществляется при фиксированной температуре и неизменном составе газовой фазы. Из решения системы уравнений связи
з
^(5) = ^;
Рсо
^(6) = —^ Рсо ' РО
К (2) = ^;
Рсо2
0,5 ’ *2
^Кр(2) = -9000/Т+9,22;
Рсо +Рсо2 + Ро2
установлены следующие параметры равновесного состояния при общем давлении Р=1атм: Т= 1235 °C: рсо = 0,99950 атм; />с02 = 0,50-Ю-3 атм; рОг = 9,00-10"18 атм. Как видно, равновесный состав газовой фазы в присутствии твердого углерода совпадает с составом газовой фазы при восстановлении только газообразным СО при этой же температуре (см. табл. 1). В данном случае равновесный состав газа не является достаточным параметром для сравнения восстановительной способности СО и твердого углерода, действующего как восстановитель через газообразный реагент СО.
Критерием восстановительной способности СО и твердого углерода может служить количество восстановителя, необходимое для восстановления одного и того же количества оксида. В соответствии со стехиометрическими уравнениями
Сг2О3(тв) ЗСО(газ) 2СГ(та) ЗСС^газ)?
Сг2О3(тв) 3 С(рр) 20^.^ + ЗСО(газ)
для восстановления 1 моля Сг2О3 необходимо 3 моля молекул СО или 3 моля атомов углерода. Термодинамические расчеты показывают, что при температуре чуть выше 1235 °C 3 моля углерода обеспечивают полное восстановление оксида хрома, а
3 моля СО - всего лишь десятые доли процента. С этой точки зрения можно сказать, что твердый углерод, действительно, является более сильным восстановителем, чем газообразный СО.
При объяснении механизма восстановления оксидов твердым углеродом возникает противоречие. С одной стороны, экспериментально наблюдаемые параметры восстановления, такие как температура начала восстановления, расход восстановителя, степень восстановления, отвечают «твердофазному» взаимодействию графита с углеродом и подтверждаются соответствующими термодинамическими расчетами. С другой стороны, экспериментально подтвержден «газофазный» механизм восстановления и доказана роль газовой фазы, однако газообразный СО как восстановитель не способен, с термодинамической точки зрения, обеспечить наблюдаемые результаты. Решение проблемы многие исследователи видят в поиске механизмов, которые удовлетворяли бы кинетике «газофазных» реакций и не противоречили термодинамическим результатам «твердофазного» взаимодействия.
Распространенным является мнение, что в присутствии твердого углерода работает своеобразный «химический насос», который за счет реакции газификации (2) уменьшает концентрацию СО2 и увеличивает концентрацию СО, чем и обеспечивается восстановление. Однако понизить концентрацию СО2 до значений меньших, чем равновесные, нельзя, поэтому использовать механизм газификации для термодинамического обоснования восстановления неправомерно. Руднотермическая плавка углеродистого феррохрома осуществляется в открытой печи, поэтому удаление газов из шихты и печного пространства в атмосферу можно условно представить как увеличение объема реакционного пространства по ходу процесса при неизменном общем давлении. Поддержание постоянства общего давления при увеличении объема достигается увеличением количества молекул СО и СО2 в газовой фазе при их неизменном равновесном соотношении. Такое увеличение обеспечивается совместным протеканием реакций восстановления оксида металла и газификации углерода. В этом смысле реакцию газификации можно считать кинетическим «инструментом», который позволяет осуществить восстановление оксида металла углеродом при создании условий для расширения газовой фазы. В рудовосстановительной печи эти условия обеспечиваются легкостью фильтрации газов через слой шихты и удаления их из печного пространства.
Затруднение газоотвода должно приводить к снижению скорости и степени восстановления как за счет кинетических причин, так и за счет термодинамических (смещение равновесия в сторону исходных веществ). Например, при дериватографическом исследовании карботермического восстановления оксида хрома и хромовой руды Пес-чанского месторождения (Уфалейский массив) в виде свободно засыпанной шихты и в виде прессовки наблюдается различие в скорости и степени восстановления (рис. 2). Из-за низкой пористости прессовки и затрудненного газоотвода скорость и степень восстановления а оксидов в прессованной шихте ниже.
Важное значение газопроницаемости при восстановлении кусковых хромовых руд отмечено Кадарметовым Х.Н. [4]: крупнокристаллические руды восстанавливаются только с поверхности кусков; мелкокристаллические руды, состоящие из зерен хромита, вкрапленных в рыхлую газопроницаемую магнийсиликатную породу, восстанавливаются по всему объему куска руды. Аналогичные результаты получены Жакибековым Т.Б. и Таке-новым Т.Д. [5] при изучении структуры кусков Кемпирсайской руды, извлеченных из нижних горизонтов рудовосстановительной печи. В глубине кусков, в трещинах между зернами хромшпинелида,

Рис. 2. Скорость карботермического восстановления оксида хрома (а), Песчанской хромовой руды (б) и степень восстановления а при 1500 °C: а = 71 % для смеси (Сг2О3+графит); а = 59 % для прессовки из смеси (Сг20з+графит); a = 87 % для порошка руды с графитом; а = 68 % для прессовки из порошка. руды с графитом обнаружено значительное количество металлических корольков с пониженным содержанием углерода (до 5,43 мас.%), с полностью восстановленным железом и частично восстановленным хромом. Авторы считают, что при отсутствии непосредственного контакта с коксом восстановление протекало за счет газовой фазы. В подтверждение газофазного механизма делается ссылка на кинетические исследования восстановления в лабораторных экспериментах.
Соответствие газофазного механизма термодинамическим характеристикам, например узкий температурный интервал восстановления, можно объяснить особенностями фазового состояния сис- темы (нонвариантное равновесие): пока есть твердый углерод, существование оксида металла выше температуры начала взаимодействия является термодинамически неустойчивым состоянием, поэтому весь процесс восстановления может завершиться в узком температурном интервале, чуть превышающем температуру начала взаимодействия. Однако остается необъясненным следующее противоречие. Стехиометрический расход твердого углерода на восстановление, например, Сг2О3 составляет 3 моля атомов углерода, газификация дает максимум 6 молей СО, но таким количеством молекул СО восстановить Сг2О3, с термодинамической точки зрения, не представляется возможным.
Нами выполнены эксперименты по карботер-мическому восстановлению оксидов Сг2О3 и Ге2О3 графитом, находящимся в смеси с порошками оксидов и отдельно от них (рис. 3).
Оксиды брали в виде порошков фракции менее 20 мкм, порошок графита марки ГЛ-1. Для простран-
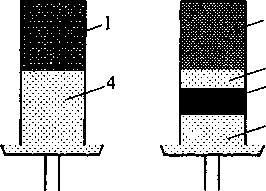
Рис. 3. Схема вариантов восстановления оксидов твердым углеродом: а) восстановление смеси оксида с графитом; б) восстановление оксида графитом через газовое пространство; 1 - смесь Ме2О2 + ЗС(гр), где Me = Ее или Сг; 2 - Ме2О2; 3 - графит; 4 - корунд ственного разделения порошков оксидов и графита использовали белый электрокорунд в виде зерен фракции 200...400 мкм (электрокорунд является практически инертным материалом в условиях эксперимента). Эксперименты проводили на дери-ватографе Q-1500D, в алундовом тигле высотой 20 мм, диаметром 8 мм, нагрев до 1500 °C в динамическом режиме со скоростью нагрева 15 °С/мин, примерно соответствующей скорости прогрева шихты в рудовосстановительной печи. Результаты приведены на рис. 4 в виде графиков зависимости степени восстановления а от температуры: Степень восстановления рассчитывали по потере массы образца. Предварительно были проведены холостые опыты (без оксидов) для определения угара графита.
При раздельном расположении реагентов степень восстановления оказалась значительно меньше. Возможно, это объясняется не только низкой восстановительной способностью СО, но и малой скоростью газификации графита. Чтобы разделить эти эффекты, провели дополнительный опыт с раздельным расположением реагентов Fe2O3 и графита (см. рис. 4), с нагревом до 1300 °C и после- дующей выдержкой вплоть до полной газификации графита, взятого в избытке в количестве 5 моль. Из результатов, приведенных на рис. 4, видно, что даже избытка графита не хватило для полного восстановления оксида Fe2O3. Результаты эксперимента согласуются с термодинамическими выводами о незначительной восстановительной способности газообразного СО.

Рис. 4. Степень восстановления оксидов графитом в зависимости от температуры нагрева: а) восстановление оксида Fe2O3; б) восстановление оксида Сг2О3. 1 - восстановление смеси Ме2О3 + ЗС(ГР); 2 - восстановление оксида графитом через газовое пространство; 3 - восстановление оксида Fe2O3 графитом через газовое пространство, нагрев до 1300 °C с последующей выдержкой 2 часа
Мнение о низкой восстановительной способности СО привело к тому, что в качестве возможного механизма высокотемпературного восстановления термодинамически прочных оксидов, таких как Сг2О3, ZrO2, А12О3, рассматривается еще несколько схем.
В оксид-сублимационной схеме (Елютин В.П. с сотрудниками) восстановление протекает через этап возгонки оксида металла с последующей конденсацией (адсорбцией) паров оксида на поверхности графита, где и происходит восстановление:
МеО(тв) -> МеО(газ);
МеО(газ) + С(тв) —> Ме(тв) + СО(газ),
К^еО^тв^ -ь С^тв^ ^ Ме^тв) CO^r33p
В газокарбидной схеме (Львов Б.В. с сотрудниками) предполагается, что восстановление идет за счет переноса углерода к оксиду металла газообразными карбидами восстанавливаемого металла:
МеО(тв) + МеС^рвз) > 2Ме^газ^ -ь СО(Га3),
^^®(газ) + ^-(тв) ^ ^4еС(газ),
МеО(ТВ) + С(та) —> Ме^газ) + СО(Га3).
Принципиальным в этой схеме является участие газообразных атомов восстанавливаемого металла, причем количество атомов в газовой фазе не зависит от условий сублимационного равновесия Ме(тв) = Ме(га3), что может быть справедливым для малых расстояний от поверхности оксида, соизмеримых с длиной свободного пробега атомов.
Любимов В.Д. и Швейкин Г.П. с сотрудниками [6] полагают, что основную роль при карбо-термическом восстановлении оксидов может играть газообразный оксид углерода С3О2, образование которого доказано экспериментально. Будучи неустойчивым соединением, С3О2 распадается на монооксид углерода и атомарный углерод. Последний выделяется на поверхности твердого оксида и является его непосредственным восстановителем. В этом варианте устраняется противоречие: восстановление удовлетворяет кинетике «газофазных» реакций и, в то же время, соответствует термодинамическим параметрам «твердофазного» взаимодействия. Однако остается открытым вопрос о механизме восполнения количества оксида углерода С3О2 по ходу восстановления оксида металла.
Следует отметить, что лимитирующей стадией восстановления может быть электрохимический перенос ионов кислорода в кристаллической решетке оксида из глубины частицы к ее поверхности. Установлено, что реальная, так называемая кинетическая, температура начала интенсивного восстановления оксидов практически совпадает с температурой перехода оксида в состояние собственной проводимости при нагреве (табл. 2). В данном случае интенсифицировать восстановление можно изменением состава оксида, что повлияет на подвижность ионов кислорода, а также применением активного восстановителя, значительно понижающего парциальное давление кислорода на поверхности оксида и, тем самым, увеличивающе-
Таблица2
Соотношение между температурой перехода оксида в состояние собственной проводимости, кинетической и термодинамической температурами начала взаимодействия с графитом [2]
|
Оксид |
Температура перехода, °C |
Кинетическая температура начала взаимодействия, °C |
Термодинамическая температура начала взаимодействия, °C |
|
v205 |
390 |
410 |
|
|
МоО3 |
420...480 |
440 |
150 |
|
wo3 |
660...700 |
720 |
357 |
|
ТЮ2 |
830 |
860 |
730 |
|
Cr2O3 |
1160 |
— |
— |
го разность электрохимических потенциалов кислорода внутри частицы и на ее поверхности.
Подводя итог существующим представлениям о механизме карботермического восстановления оксидов, можно сказать, что единой схемы, пригодной для описания всех случаев восстановления, пока не сформировано. Взаимодействие различных оксидов с углеродом может быть описано разными схемами, причем одновременно с основным механизмом могут реализовываться и другие. Доля реализации каждого из механизмов может изменяться в процессе восстановления в зависимости от условий (от температуры, давления, скорости газовых потоков, степени смешения реагентов, степени восстановления и других факторов).
Некоторые исследователи отмечают, что возможной причиной высокой скорости восстановления является особое активированное состояние газообразной формы восстановителя. Дигонский В.В. и др. [7] и Дигонский С.В. [8] считают, что основная интенсифицирующая роль принадлежит активному водороду, выделяющемуся из углеродсодержащих материалов или образующемуся по реакции газификации углерода парами воды. Тумарев А.С. и Пушкарев В.А., ссылка на работы которых приводится в [2], связывают это состояние с ионной формой существования газовых частиц. На наш взгляд, активное состояние восстановителя объясняется существованием в газовой фазе углеводородных радикалов. Радикалы могут быть как переносчиками активного углерода, так и сами выступать в качестве восстановителей.
Методом термодинамического расчета оценена восстановительная способность метана СН4 и газообразных радикалов СН3, СН2, CH, С, Н. Установлено, что метан является более сильным восстановителем, чем углерод: расчетные температуры начала восстановления хромсодержащих оксидов метаном имеют более низкие значения, чем при восстановлении графитом (рис. 5).
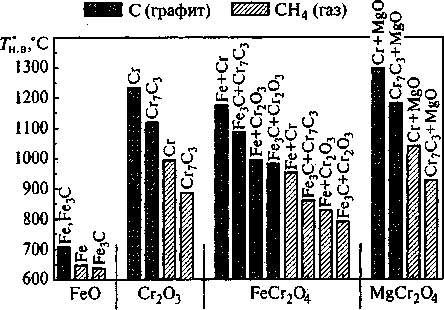
Рис. 5. Термодинамические температуры начала восстановления оксидов графитом и метаном в зависимости от восстановления до металлов или карбидов
Оценку восстановительной способности углеводородных радикалов проводили по величине равновесного парциального давления восстановителя в соответствии с реакцией
FeCr2O4+Rd^) -> Fe + 2Cr + COfra3) + Н2(газ) + Н2О(газ), где Rd - обобщенный символ радикала (СН3, СН2, CH, С, Н). Из результатов расчетов (рис. 6) следует,
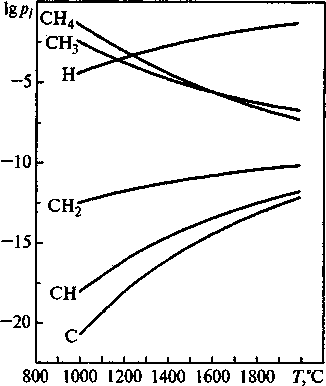
Рис. 6. Расчетные значения равновесных парциальных давлений газообразных радикалов при восстановлении хромита железа что радикалы обладают более высокой восстановительной способностью, чем графит, СО, Н2 и метан. Достаточно исчезающе малых концентраций радикалов (парциальных давлений порядка 10"10... 1О~20 атм), для начала восстановления хромитов. Восстановительная способность радикалов увеличивается при уменьшении количества атомов водорода в молекуле: СН4 -> СН3 -> СН2 -> СП -> С. С ростом температуры восстановительная способность СН4 и СН3 усиливается, а СН2, CH, С и Н -ослабевает. Следует отметить, что с термодинамической точки зрения атомарный водород обладает самой низкой восстановительной способностью из всех радикалов.
Образование радикалов в рудовосстановигельной печи возможно в результате следующих процессов.
Углеродсодержащие восстановители (уголь, кокс) содержат до 10 мае. % летучих веществ, которые возгоняются при нагреве в интервале температур 450...900 °C. Основными продуктами газовыде-ления являются водород Н2 и метан СН4. В результате термической диссоциации метана при нагреве, а также взаимодействия водорода с углеродом в зоне горения дуг возможно образование углеводородных радикалов. С другой стороны, в хромовых рудах в качестве вмещающей породы присутствуют силикаты и алюмосиликаты магния (серпентин и хлорит), содержащие до 15 мас.% конституционной воды. В интервале температур 700...900 °C серпентин и хлорит распадаются, а выделяющаяся вода может взаимодействовать с углеродом восстановителя с образованием различных газов, в том числе и углеводородных радикалов.
На рис. 7, 8 приведены результаты термодинамического расчета состава газовой фазы, образующейся в результате реакции газификации графита водяным паром и термического распада метана. Из результатов расчетов следует, что при температурах восстановления оксидов в рудовосстановительной печи (1200...1800°С) концентрация углеводородных радикалов хотя и мала, но может на несколько порядков превышать равновесные концентрации, необходимые для восстановления. Например, при 1500 °C парциальное давление рСН2, необходимое для восстановления FeCr2O4, составляет 10-11 атм. При термодиссоциации метана и газификации графита водой и водородом достигается />СН2 = 109 атм. Этим создаются термодинамические предпосылки для восстановления оксидов радикалами.
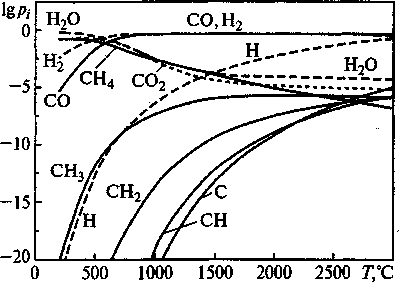
Рис. 7. Расчетные количества продуктов взаимодействия графита с парами воды (РОбщ = 1 атм)

Рис. 8. Расчетные количества продуктов термической диссоциации СН4 (Робщ = 1 атм)
Влияние водородсодержащих газов на интенсификацию карботермического восстановления оксидов известно в практике ферросплавного производства. В работе Строганова А.И. и др. [9] по восстановлению хромитовых руд графитом и газообразными восстановителями в кипящем и ста ционарном слоях установлено следующее. Наибольшие значения степени восстановления хрома при 1673 К наблюдаются при совместном восстановлении графитом и водородом: до 69,5 % в кипящем слое и до 81 % в стационарном слое. Степень восстановления оксидов графитом в токе СО и графитом в токе N2 примерно одинакова и значительно меньше (18...20 %). В работе Мизина В.Г. и др. [10] установлено, что добавки гидроксидов металлов (до 4 мас.% в шихте), выделяющих пары воды при нагреве, увеличивают скорость карботермического восстановления оксидов. Положительное влияние на показатели восстановительной плавки отмечено в работе Полякова И.И. и др. [11] при вдувании газовой смеси метана с парами воды в полые электроды ферросплавной печи, приводящем к образованию углеводородной плазмы в области горения дуг. В работе [12] отмечена интенсификация восстановления оксидов железа и хрома в факеле аргоно-водородной и аргоно-метано-вой низкотемпературной плазмы. Положительный эффект водородсодержащих газов наблюдается только в присутствии твердого углерода, когда создаются условия для его газификации водородсодержащими газами. Восстановление чистым водородом таких результатов не дает.
С точки зрения кинетических возможностей следует отметить, что большинство реакций с участием газообразных компонентов идет по радикальному механизму [13]. Кроме того, известен эффект «закалки» высокотемпературного состава газа, когда вследствие кинетических затруднений рекомбинация радикалов идет медленно и при низкой температуре сохраняется высокая, неравновесная в данных условиях, концентрация радикалов. Качественным подтверждением возможности реализации подобного механизма являются результаты работ, выполненных с участием авторов, по цементации стальных деталей газовой смесью СО-СО2-Н2-Н2О-СН4 при 800...850 °C. В результате пропускания части смеси через плазмотрон и образования радикалов удалось сократить длительность процесса насыщения поверхности деталей углеродом с 11...12 до 1,5...2,0 часов.
Таким образом, можно отметить, что значительным резервом интенсификации процессов восстановления может стать создание в рудовосстановительной печи условий д ля образования газообразных углеродсодержащих соединений, обладающих повышенной восстановительной способностью.
Список литературы Условия интенсификации карботермического восстановления хромитов
- Есин O.A., Гельд П.В. Физическая химия пи-рометаллургических процессов. -Свердловск: Металлургиздат, 1962. -Ч. 1. -671 с.
- Взаимодействие оксидов металлов с углеродом/В.П. Елютин, Ю.А. Павлов, В.П. Поляков, СБ. Шеболдаев. -М.: Металлургия, 1976. -360 с.
- Применение ЭВМ для термодинамических расчетов металлургических процессов/Г.Б. Синярев, H.A. Ватолин, Б.Г. Трусов, Г.К. Моисеев. -М.: Наука, 1982. -263 с.
- Кадарметов Х.Н. Восстановление оксидов железа и хрома по глубине куска хромовой руды//Металлы. -1975. -№ 6. -С. 94-99.
- Жакибеков Т.Е., Такенов Т.Д. Роль газофазного восстановления при электротермии высокоуглеродистого феррохрома//Проблемы научно-технического прогресса электротермии неорганических материалов: Тезисы докладов республ. научн.-техн. конференции. -Днепропетровск: ДМетИ, 1989. -С. 57.
- Исследование газообразных продуктов реакций восстановления оксидов переходных металлов углеродом/В.Д. Любимов, Г.П. Швейкин, Ю.Д. Афонин, Т.А. Тимощук, В.Н. Шалагинов, М.В. Калачева, С.И. Алямовский//Известия АН СССР. Металлы. -1984. -№ 2. -С. 57-66.
- Металлургия будущего/В.В. Дигонский, СВ. Дигонский, A.B. Дигонский, H.A. Дубинин. -Новосибирск: ВО «Наука». Сибирская издательская фирма, 1993. -128 с.
- Дигонский С.В. Новые способы получения металлов из их окисленных соединений. -СПб.: Наука, 1998. -109 с.
- Пути интенсификации процесса производства углеродистого феррохрома/А.И. Строганов,В.М. Гетманчук, М.А. Рысс, А.П. Бушуев//Сборник трудов Челябинского электрометаллургического комбината. -Челябинск: Южно-Уральское книжное издательство, 1968. -С. 3-9.
- Влияние добавки гидроокисей металлов на кинетику взаимодействия кварца с графитом/В.Г. Мизин, Г.А. Кошкин, Г.В. Серов, С.И. Гусев//Восстановительные процессы в производстве ферросплавов -М.: Наука, 1977. -С. 151-155.
- Поляков И.И., Кравченко В.А., Жердев И.Т. Экспериментальное исследование эффективности подачи парогазовой смеси в полые электроды ферросплавной электропечи//Повышение качества и эффективности производства ферросплавов: Тезисы докладов Всесоюзного совещания. -М.: Черметинформация, 1979. -С. 101-102.
- Kitamura I., Shibata К., Takeda К. In-Flight Reduction of Fe2О3, Сr2О3, TiО2 and Al2О3 by Ar -H2 and Ar -CH4 Plasma//ISIJ International. -1993. -V.33. -M 11. -P.l 150-1158.
- Гебхардт E., Фромм E. Газы и углерод в металлах. -М.: Металлургия, 1980. -712 с.


