Условия равновесия фаялита с железом
Автор: Кимяшов А.А., Штин С.В., Лыкасов А.А.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 24 (124), 2008 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156588
IDR: 147156588 | УДК: 669.01:541.123.3
Текст статьи Условия равновесия фаялита с железом
Данные по равновесиям Fe-Fe2SiO4-SiO2 (I) и Fe-FeO-Fe2SiO4 (II) ограничены и имеют противоречивый характер. Равновесие (I) изучалось несколькими исследователями. Опытные данные разных авторов приведены в работе [1] и сравниваются по величине энергии Гиббса реакции
2FeO + SiO2 =Fe2SiO4. (1)
Результаты сравнения представлены на рис. 1.
AG, Дж
-5000 -
-10000 -
-15000 -
-20000 -


1000 1100 1200 1300 1400 Т,К
Рис. 1. Зависимость энергии Гиббса реакции (1) от температуры: • - расчет по данным настоящего исследования; ▼ - данные Келли; о - расчет по справочным данным; А - данные Тейлора; ■ - данные Муана
Данные Муана и Тейлора согласуются между собой, но существенно отличаются от оценки этой величины, выполненной Келли. В настоящей работе энергия Гиббса реакции (1) рассчитана по справочным данным для реакций
2Fe + О2 + SiO2 = Fe2SiO4 [2], (2)
2Fe + О2 = 2FeO [3]. (3)
Как видно из рис. 1, результаты расчета не воспроизводят имеющиеся в литературе данные. В связи с этим были предприняты экспериментальные исследования условий равновесий (I) и (II).
Экспериментальные данные получены методом ЭДС в виде температурной зависимости ЭДС гальванического элемента
Pt|Fe, FeO|ZrO2+Y2O3 [(исследуемый образец)|Р1, (4) где Fe, FeO - равновесная смесь железа и вюстита, ZrO2+Y2O3 - кислородпроводящий твердый электролит, исследуемый образец - равновесная смесь Fe-Fe2SiO4-SiO2 или Fe-FeO-Fe2SiO4. Образцы для исследований получали твердофазным синтезом из Fe, Fe2O3 и SiO2. Порошок SiO2 получали, измельчая монокристалл кварца. Смесь железа, гематита и кварца перетирали в агатовой ступке, спрессовывали в таблетки и спекали в вакууме. Продолжительность синтеза образца заданного химического и фазового состава существенно зависит от дисперсности порошка кристаллического кварца. Крупные кристаллы SiO2 медленно реагируют с оксидами железа и даже после 80-часовой выдержки при температуре 1273 К по данным микрорентгеноспектрального анализа в смеси Fe-FeO-Fe2SiO4 (II) наблюдались включения кварца. При использовании порошка кварца размером менее 80 мкм, после спекания в течение 45 часов, получили образцы соответствующие фазовым областям Fe-Fe2SiO4-SiO2 (I) и Fe-FeO-Fe2SiO4 (II) диаграммы состояния систем Fe-Si-O. На рис. 2 изображен результат электронно-зондового микроанализа на спектрометре JEOL JSM - 6460LV (микрорентгеноспектральный анализ) образца фазового состава (II), а на рис. 3 -фазового состава (I).

Рис. 2. Результат микрорентгеноспектрального анализа образца фазового состава (II)

Рис. 3. Результат микрорентгеноспектрального анализа образца фазового состава (I)
На рис. 2 область, окрашенная в белый цвет, соответствует железу, светло-серая - вюститу, а темно-серая - фаялиту. На рис. 3 белая область соответствует железу, серая - фаялиту, а черная -кварцу.
ЭДС элемента (4) измеряли в ячейке с неразделенным газовым пространством. Подробно конструкция ячейки описана в работе [3]. Температурные зависимости ЭДС областей (I) и (II) представлены на рис. 4.
Е, мВ 0 1
-
- 5 -
-
- 10 -
-
- 15 -
-
- 20 -
1050 1100 1150

■ " П тД о I о
1200 1250 1300 Т, К
Рис. 4. Температурные зависимости ЭДС элемента (4) с образцами фазового состава (I) или (II)
Данные зависимости обработали методом наименьших квадратов. Для образцов состава Fe-FeO-Fe2SiO4 (II) температурная зависимость ЭДС имеет вид:
£ = -56,29+ 4,232-10'2 7, (5)
а для области Fe-Fe2SiO4-SiO2 (I):
Е = -80,76 + 5,624-10-2 Т. (6)
Используя данные ЭДС, рассчитали давление кислорода равновесное исследованным образцам:
4FF тлю lg[/§2, атм] =--—+6,920, (911-1644К). (8)
Здесь lg[/o2, атм] - данные для равновесной смеси железа и вюстита.
Зависимость lg[/o2, атм] от температуры для равновесия (I) приведена на рис. 5.
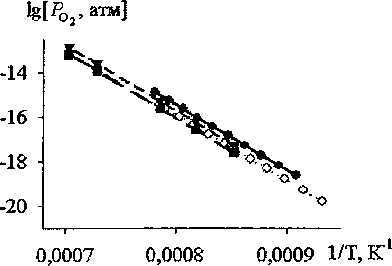
Рис. 5. Зависимость давления кислорода от температуры над равновесной смесью Fe, SIO2, Fe2SiO4: • - данные настоящего исследования; о - расчет по данным энергии Гиббса реакции (2); ▼ - по данным Келли; Д- по данным Тейлора; ■ - по данным Муана
На рис. 5 полученные в настоящей работе давления кислорода сопоставлены с литературными данными. Как видно из рисунка, давление кислорода для равновесия (I) выше данных других исследователей.
По полученным данным была рассчитана Энергия Гиббса реакции (1). Она оказалась существенно менее отрицательной, чем по данным других исследователей (см. рис. 1).
Условия равновесия Fe-FeO-Fe2SiO4 (II) с газовой смесью СО-СО2 исследованы в работе [1]. При 1273 К отношение /со/^со2 в равновесной газовой смеси равно 2,51, а при 1423 К - 3,00. Используя данные для реакции
2СО + О2=2СО2, (9)
lgA =^^-9,141, (700-1200К)[4], (10)
lg^ =^^-8,936, (12001700К)[4], (11) нами были рассчитаны давления кислорода отвечающие этим соотношениям Рсо/^со2 • При Т= 1273 К давление кислорода соответствует величине lg[7o2, атм] = -14,874, а для 1423 К --12,604. По результатам настоящих исследований, рис. 4 и уравнение (7), при 1273 К
№о2,атм] = -14,927, а при 1423 К (результат экстраполяции) №о2,атм] = -12,538.
Результаты исследований в совокупности со справочными данными по AG0 для реакций (3) и
Si + O2=SiO2, (12)
AG0 = —871527 + 181,177, кДж/моль,[5] (13) позволяют рассчитать активность кремния в железе, находящегося в равновесии с фаялитом. Для равновесия (II) активность кремния в железе при 1273 К равна 3,6-1012, а для равновесия (I) при той же температуре - 7,1-Ю-12.
Список литературы Условия равновесия фаялита с железом
- Muan, А./А. Muan, К. Schwedtfeger//Trans. Met. Soc. of AIME. 1966. V. 236. P. 201-211.
- Journal of The National Chemical Laboratory for Industry. 1988. V. 83. P. 59-60.
- Физико-химические свойства вюстита и его растворов/А.А. Лыкасов, К. Карел, и др. Свердловск: УНЦ АН СССР, 1987. 230 с.
- Лыкасов, А.А. Термодинамика вюститных растворов: дис.... д-ра хим. наук/А.А. Лыкасов. Челябинск: ЧГТУ, 1991. 309 с.
- Кубашевский, О. Термохимия в металлургии/О. Кубашевский, Э. Эванс. М.: Иностранная литература, 1954. 421 с.