Усовершенствованный метод препаративного выделения вируса оспы сливы и иммунохимический анализ белка оболочки
Автор: Шевелева А.А., Никитин Н.А., Трифонова Е.А., Закубанский А.В., Чирков С.Н.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Молекулярная фитопатология. Вирусология
Статья в выпуске: 3 т.51, 2016 года.
Бесплатный доступ
В препаратах потивирусов белок оболочки (БО) обычно гетерогенен по молекулярной массе из-за частичного протеолиза N-концевого домена, происходящего, как считается, в процессе препаративного выделения и хранения вирусного препарата под действием клеточных протеаз, которые высвобождаются при гомогенизации растительных тканей и контаминируют очищенный препарат. Неупорядоченный N-домен БО вируса оспы сливы ( Plum pox virus, PPV) длиной около 100 аминокислот экспонирован на поверхности вирусной частицы. Он содержит вирус- и штамм-специфичные эпитопы и является самой изменчивой частью молекулы БО. Деградация иммунодоминантного N-терминального домена затрудняет получение вирус-специфических антисывороток и штамм-специфических моноклональных антител и иммунохимический анализ вирусных изолятов. PPV считается самым вредоносным вирусным патогеном косточковых культур. Иммунохимические методы играют важнейшую роль в его диагностике, идентификации штамма, работе по получению устойчивых сортов, а также в эпидемиологических исследованиях и разработке превентивных мер по ограничению распространения этого вируса в насаждениях косточковых культур. Анализ БО PPV методами электрофореза в полиакриламидном геле, иммуноэлектронной микроскопии и вестерн-блота с моноклональными антителами 5В и 4DG5 соответственно к универсальному и PPV-D-специфичному эпитопам показал, что в очищенном вирусном препарате содержатся три типа субъединиц: полноразмерный БО и продукты частичного протеолиза БО с молекулярной массой 31 и 28 кДа. Три зоны БО PPV с аналогичной или близкой молекулярной массой регулярно выявлялись также при анализе экстрактов из свежих зараженных листьев табака Nicotiana benthamiana и ряда косточковых культур (персика, сливы и алычи), гомогенизированных непосредственно в буфере для нанесения образца, методом вестерн-блота с антителами к универсальному эпитопу. Эти результаты позволяют предположить, что протеолиз БО может происходить уже в зараженных клетках. Нами разработан усовершенствованный протокол препаративного выделения PPV, основанный на сочетании двух оригинальных методик (H.J. van Oosten, 1972; S. Lain с соавт., 1988). Процедура включает накопление вируса в растениях табака Nicotiana benthamiana, его экстракцию из зараженных листьев нейтральным HEPES-буфером, инкубацию экстракта, осветленного низкоскоростным центрифугированием, с 5 % Тритоном Х-100, ультрацентрифугирование на 20 % сахарозной подушке и очистку вируса посредством ультрацентрифугирования в градиенте концентрации сахарозы (10-40 %) в 0,1 М натрий-боратном буфере (рН 8,2). Метод обеспечивает выход очищенного вируса до 10 мг из 100 г свежих листьев. Вирусные частицы содержат преимущественно полноразмерный БО. Высокий выход обусловлен, по-видимому, эффективной экстракцией вируса с помощью HEPES-буфера, а также отсутствием потерь после осветления экстракта, его обработки Тритоном Х-100 и ультрацентрифугирования на сахарозной подушке. Применение Тритона Х-100 в указанной концентрации приводит к более полному отделению вируса от мембранных комплексов и солюбилизации агрегатов вирусных частиц, что повышает выход вируса. Использование таких вирусных препаратов для иммунизации животных может способствовать получению высокоспецифичных антисывороток и моноклональных антител для диагностики и иммунохимического анализа PPV
Вирус оспы сливы, препаративное выделение, белок оболочки, иммуноблот, иммуноэлектронная микроскопия, моноклональные антитела, эпитоп
Короткий адрес: https://sciup.org/142213947
IDR: 142213947 | УДК: 634.2:632.3:578.1:57.083 | DOI: 10.15389/agrobiology.2016.3.385rus
Текст научной статьи Усовершенствованный метод препаративного выделения вируса оспы сливы и иммунохимический анализ белка оболочки
Вирус оспы сливы (Plum pox virus, PPV, род Potyvirus, сем. Potyviri-dae) считается самым вредоносным вирусным патогеном косточковых культур (1, 2). Нитевидный вирион состоит из молекулы геномной РНК длиной 9,8 тыс. нуклеотидов и 2 тыс. молекул белка оболочки (БО) с молекулярной массой около 36,5 кДа, рассчитанной по аминокислотному составу (3). PPV системно заражает культурные и дикорастущие растения рода Primus
Работа выполнена при поддержке Российского научного фонда, проект № 14-24-00007.
и многие виды травянистых растений других родов (4-8). В экспериментах, в частности для накопления и препаративного выделения PPV, используют различные виды табака (9, 10).
БО потивирусов состоит из N-терминального, корового и С-тер-минального доменов. Неупорядоченный N-домен экспонирован на поверхности вирусной частицы. Он содержит вирус- и штамм-специфичные эпитопы и представляет собой самую изменчивую часть молекулы (11). В препаратах потивирусов БО обычно гетерогенен по молекулярной массе из-за частичного протеолиза N-концевого домена, осуществляемого растительными протеазами (12). Так, при электрофорезе очищенных препаратов PPV в полиакриламидном геле выявляются 2-3 белковых зоны. Мажорная зона с молекулярной массой 35-43 кДа соответствует полноразмерному БО. Различия в молекулярной массе определяются штаммовой принадлежностью вирусного изолята, наличием делеций и, по-видимому, зависят от степени посттрансляционных модификаций БО в результате его фосфорилирования и(или) гликозилирования (13-15). Минорные зоны с большей электрофоретической подвижностью образуются при отщеплении от N-конца БО пептидов разной длины (10, 16).
Деградация иммунодоминантного N-конца БО затрудняет получение вирус-специфических антисывороток и штамм-специфических моноклональных антител и иммунохимический анализ вирусных изолятов (17). Между тем, иммунологические методы играют важнейшую роль в диагностике PPV, идентификации его штамма, получении PPV-устойчивых сортов, а также в эпидемиологических исследованиях и разработке превентивных мер по ограничению распространения этого вируса в насаждениях косточковых культур.
Целью нашей работы было усовершенствование процедуры препаративного выделения вируса оспы сливы (PPV) для достижения высокой степени очистки вирусного препарата и высокого выхода вируса, содержащего преимущественно полноразмерный БО. Также мы провели анализ протеолиза БО PPV с помощью моноклональных антител известной специфичности.
Методика. Изолят вируса PPV-NAT (номер последовательности в базе данных GenBank NC_001445), штамм D, был любезно предоставлен E. Maiss (18) и размножен в растениях Nicotiana benthamiana.
Листья с мозаикой собирали через 3-4 нед после инокуляции и использовали для выделения вируса. Свежие листья гомогенизировали вручную в 0,02 М HEPES-буфере (рН 6,8), содержащем 0,2 М сахарозу и 10 мМ диэтилдитиокарбамат натрия, при соотношении навески и буфера 1:4 (г/мл). Экстракт осветляли на центрифуге J2-21 («Beckman», США) в роторе JA-20 в течение 15 мин при 13000 об/мин и температуре 4 ° C и фильтровали через нетканый материал Miracloth («Calbiochem», США). К осветленному экстракту при непрерывном перемешивании на магнитной мешалке добавляли Тритон Х-100 до конечной концентрации 5 % и перемешивали еще 40 мин при 4 ° С. Смесь наслаивали на 20 % (масса/масса) сахарозную подушку в 0,02 М HEPES-буфере (рН 6,8) и центрифугировали на ультрацентрифуге L5-50 («Beckman», США) в угловом роторе 50.2 Ti 210 мин при 28000 об/мин. Осадок ресуспендировали в 0,1 М натрийборатном буфере (рН 8,2), содержащем 5 мМ ЭДТА.
Вирусный препарат осветляли 5 мин на настольной центрифуге MiniSpin («Eppendorf», Германия) при 13400 об/мин и очищали посредством ультрацентрифугирования в градиенте концентрации сахарозы. С этой целью вирусную суспензию наслаивали на преформированный сахарозный 386
градиент (10-40 %, масса/масса), приготовленный на 0,1 М натрий-боратном буфере (pH 8,2), и центрифугировали в роторе SW 27 120 мин при 25000 об/мин. Содержимое пробирок фракционировали с помощью Auto Densi-Flow IIC («Haakebuchler», США) и Uvicord S («LKB», Швеция), собирая фракции объемом 2 мл. Фракции, содержащие наибольшее количество вируса, объединяли и диализовали против 0,05 M боратного буфера (pH 8,2) в течение ночи. Вирус осаждали центрифугированием в роторе 50.2 Ti 150 мин при 30000 об/мин. Осадок ресуспендировали в 0,05 M боратном буфере (pH 8,2). На всех стадиях очистки содержание вируса определяли полуколичественным методом иммуноферментного анализа с помощью наборов Reagent Set SRA 31505 («Agdia», США). Концентрацию вируса в очищенном препарате оценивали спектрофотометрически, используя коэффициент экстинкции А260 (1 мг/мл) = 2,5 (16).
Анализ вирусного препарата и экстрактов из листьев зараженных растений выполняли с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS) и иммуноблота с моноклональными антителами 5В и 4DG5, как описано ранее (15). Источником антител служили наборы K10B и K12B («Agritest», Италия). Были также использованы обнаруженные и охарактеризованные нами изоляты PPV штамма D Cr11 (KR028385), Kobr8 (KP198590), Pav6a (KP198596) соответственно из персика (Prunus persica), сливы (P. domestica) и алычи (P cerasifera) (19). Им-муноэлектронную микроскопию вирусного препарата проводили, как описано ранее (20), используя первичные антитела 5B в разведении 1:200 и вторичные антитела, конъюгированные с частицами коллоидного золота диаметром 6 нм («Jackson Immuno Research, Inc.», США), в разведении 1:50. Образцы контрастировали 2 % раствором уранилацетата и анализи ровали, используя электронный микроскоп JEM-1400 («JEOL», Япония). Изображение получали с помощью программного обеспечения «Olympus
Soft Imaging Solutions GmbH» (Германия).
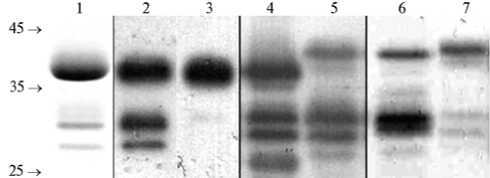
Рис. 1. Результат анализа белка оболочки вируса оспы сливы (Plum pox virus) с помощью электрофореза в 12 % полиакриламидном геле и иммуноблота: 1, 2 и 3 — очищенный вирусный препарат (окраска соответственно Кумасси бриллиантовым синим, моноклональными антителами 5В и 4DG5 в иммуноблоте), 4, 5, 6, 7 — экстракт соответственно из зараженных листьев табака ( Nicotiana bentha-miana), алычи (Prunus cerasifera), персика ( P persica), сливы ( P domestica) (окраска антителами 5В в иммуноблоте). Слева указано положение маркеров молекулярной массы, кДа («Fermentas», Литва).
Результаты. Разработанный способ препаративного выделения PPV был основан на экстракции вируса из зараженных листьев N. benthami-ana нейтральным HEPES-буфером и сочетании известных способов его последующей очистки (9, 10). Усовершенствованная процедура выделения обеспечивала высокий выход вируса (до 10 мг из 100 г свежих листьев), что в 1,52,0 раза больше, чем при использовании традици онного метода (10). Высокий выход, по-видимому, был обусловлен эффективной экстракцией вируса с помощью HEPES-буфера, а также отсутствием потерь после осветления экстракта, его обработки 5 % Тритоном Х-100 и ультрацентрифугирования на сахарозной подушке (данные не представлены). Применение Тритона Х-100 в высокой концентрации (5 %) способствует более полному извлечению вируса из мембранных комплексов и солюбилизации агрегатов вирусных частиц, что повышает выход вируса (9).
При электрофорезе очищенного препарата PPV в полиакриламидном геле были выявлены три зоны (рис. 1, дорожка 1). Мажорная зона, по-видимому, представляла собой полноразмерный БО, а минорные зоны 31 и 28 кДа — продукты его частичного протеолиза (10, 16). Явное превалирование зоны полноразмерного БО свидетельствовало о его низкой деградации, что позволяет использовать такой вирусный препарат для получения антисыворотки и моноклональных антител к вирусу.
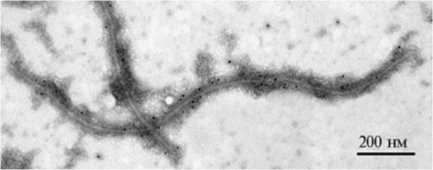
Рис. 2. Иммуноэлектронная микроскопия вируса оспы сливы (Plum pox virus), выделенного из листьев табака (Nicotiana benhamianO), с использованием первичных антител 5B и вторичных антител, конъюгированных с коллоидным золотом (6 нм). Контрастирование 2 % уранилацетатом. Инструментальное увеличение *20000, электронный микроскоп JEM-1400 («JEOL», Япония).
Иммунохимический анализ БО выполняли с антителами 5B и 4DG5, распознающими соответственно универсальный эпитоп (экспрессированный у большинства изолятов PPV) и эпитоп, специфичный для штамма D (21). Универсальный эпитоп 94DRDVDAG100 локализован в начале корового домена (22). Антитела 5В окрашивали в иммуноблоте все белковые зоны, выявляемые в очищенном препарате вируса, то есть они относились к БО (см. рис. 1, дорожка 2). Методом иммуно-электронной микроскопии было показано, что антитела к универсальному эпитопу связывались с интактным БО по всей длине вирусной частицы (рис. 2). Антитела 4DG5 распознают эпитоп внутри последовательности 49FTPATTQPATKPVS62, характерной для изолятов штамма D (22, 23). Они взаимодействовали с полноразмерным БО, но не выявляли полипептид 28 кДа (см. рис. 1, дорожка 3), который представлял собой БО, лишенный 70 N-терминальных аминокислот. Поскольку сайт протеолиза локализован между остатками глутамина (Q) и треонина (Т) в позициях соответственно 70 и 71 (10), полипептид 28 кДа не содержал эпитопа, распознаваемого антителами 4DG5. Кроме того, антитела 4DG5 слабо реагировали с полипептидом 31 кДа (см. рис. 1, дорожка 3). Промежуточный продукт протеолиза 33 кДа, полученный при обработке очищенного препарата изолята 5.15 (L42473) трипсином, четко окрашивался антителами 4DG5 (17). Вероятно, PPV-D-специфический эпитоп сохранялся в полипептиде 33 кДа, но был поврежден в более коротком продукте 31 кДа. Различия в молекулярной массе образовавшихся продуктов могут быть обусловлены разной субстратной специфичностью трипсина и протеазы, ответственной за протеолиз N-конца БО у изолята NAT.
I 20 40 60 80 100
Crll ADEREDEEEVDAGKPIWTAPAATSPILQPTPVIQPAPRTTAPMFNPIETPATTQPATKPVSRVSGPQLQTFGTYGNEDASPSNSNALVNTNRDRDVDAG KobrS ADEREDEEEVDAGKPIWTAPAATSPILQPPPVIQPAPRTTAPMLNPIFTPATTQPATKPVSQVSGPQLQTFGTHGNEDASPSNSNALVNTNRDRDVDAG РахОа ADEREDEEEVDAGKPIWTAPAATSPILQPPPVIQPAPRTTAPMLNPIFTPATTQPATKPVSQVSGPQLQTFGTYGNEDASPSNSNALVNTNRDRDVDAG NAT ADEREDEEEVDA---------------LQPPPVIQPAPRTTAPMLNPIFTPATTQPATKPVSQVSGPOLQTFGTYSHEDASPSNSNALVNTNRDRDVDAG
Рис. 3. Выравнивание аминокислотных последовательностей N-конца белка оболочки у изолятов вируса оспы сливы (Plum pox virus). Последовательности D-специфичного эпитопа, дипептида QT и универсального эпитопа затенены. Серия дефисов в последовательности NAT обозначает делецию 15 аминокислот. Цифры сверху элайнмента показывают позицию аминокислоты в последовательности.
Принято считать, что деградация N-конца БО потивирусов происходит в процессе препаративного выделения и хранения вирусного препарата под действием клеточных протеаз, которые высвобождаются при го-388
могенизации растительных тканей и контаминируют очищенный препарат (12). Однако три зоны БО PPV с аналогичной или близкой молекулярной массой регулярно выявлялись на иммуноблотах при анализе экстрактов из навесок свежих зараженных листьев, гомогенизированных непосредственно в буфере для нанесения образца. Так, окрашивание антителами 5В всех трех зон наблюдали в экстрактах из листьев N benthamiana, сливы, алычи и персика, зараженных изолятами штамма D (см. рис. 1, дорожки 4-7). Кроме того, в образцах 4-7 антитела 5В окрашивали еще один фрагмент молекулы БО с молекулярной массой около 26 кДа. В экстрактах из неза-раженных листьев окрашивания не обнаружили (данные не представлены). Аналогичное окрашивание нескольких зон БО PPV наблюдали при анализе экстрактов из листьев N. benthamiana и сливы канадской (P. nigra), зараженных изолятом 1410 штамма W (24). Таким образом, наши данные показывают, что протеолиз БО мог происходить непосредственно в зараженных клетках. На такую возможность указывают и результаты препаративного выделения PPV c применением ингибиторов протеиназ. В вирусных препаратах, очищенных с применением ингибиторов, также выявляются продукты протеолиза БО, хотя и в меньшем количестве (16, 17). Следует отметить, что подвижность зон 31 и 28 кДа была одинаковой для всех изолятов и растений-хозяев, что предполагает высокую специфичность протеолиза БО. Большая электрофоретическая подвижность интактного БО PPV в очищенном препарате и образце из N. benthamiana была обусловлена, по всей вероятности, делецией 15 аминокислот у изолята NAT (18).
Нельзя исключить, что в протеолизе БО принимают участие не только клеточные, но и вирус-специфические протеазы (10). Как известно, в зараженной клетке геномная РНК потивирусов транслируется с образованием полипротеина, который нарезается тремя вирус-специфиче-скими протеазами (P1, HcPro и NIa) на 10-11 белков, включая БО (3). Дипептид 70QT71 может служить субстратом для вирус-специфической протеиназы NIa PPV (25) и ряда других потивирусов (26). В нашей работе он был обнаружен у всех изученных изолятов (рис. 3), что могло бы объяснить происхождение полипептида 28 кДа. Локализацию сайта протеолиза, продуктом которого является полипептид 31 кДа, предстоит выяснить.
Итак, разработанная методика препаративного выделения вируса оспы сливы (PPV) обеспечивает высокий выход очищенного вируса, содержащего преимущественно полноразмерный белок оболочки (БО). Применение таких вирусных препаратов для иммунизации животных может способствовать получению высокоспецифичных антисывороток и моноклональных антител для диагностики и иммунохимического анализа изолятов PPV. Анализ продуктов протеолиза БО PPV с помощью моноклональных антител к различным эпитопам N-конца молекулы показал, что протеолиз может происходить непосредственно в зараженных клетках.
Список литературы Усовершенствованный метод препаративного выделения вируса оспы сливы и иммунохимический анализ белка оболочки
- Cambra M., Boscia D., Myrta A., Llacer G. Plum pox virus and estimated cost associated with Sharka disease. EPPO Bull., 2006, 36: 202-204 ( ) DOI: 10.1111/j.1365-2338.2006.01027.x
- Чирков С.Н., Приходько Ю.Н. Генетическое разнообразие и структура популяции вируса оспы (шарки) сливы в России. Сельскохозяйственная биология, 2015, 50(5): 529-539 ( , 10.15389/agrobiology.2015.5.529eng) DOI: 10.15389/agrobiology.2015.5.529rus
- Garcia J.A., Glasa M., Cambra M., Candresse T. Plum pox virus and sharka: a model potyvirus and a major disease. Mol. Plant Pathol., 2014, 15: 226-241 ( ) DOI: 10.1111/mpp.12083
- Llacer G., Cambra M. Host and symptoms of Plum pox virus: fruiting Prunus species. EPPO Bull., 2006, 36: 219-221 ( ) DOI: 10.1111/j.1365-2338.2006.00975.x
- James D., Thompson D. Host and symptoms of Plum pox virus: ornamental and wild Prunus species. EPPO Bull., 2006, 36: 222-224 ( ) DOI: 10.1111/j.1365-2338.2006.00976.x
- Polak J. Host and symptoms of Plum pox virus: woody species other than fruit and ornamental species of Prunus. EPPO Bull., 2006, 36: 225-226 ( ) DOI: 10.1111/j.1365-2338.2006.00977.x
- Llacer G. Host and symptoms of Plum pox virus: herbaceous hosts. EPPO Bull., 2006, 36: 227-228 ( ) DOI: 10.1111/j.1365-2338.2006.00978.x
- van Oosten H.J. Herbaceous host plants for the sharka (plum pox) virus. Neth. J. Pl. Path., 1970, 76: 253-260 ( ) DOI: 10.1007/BF01976584
- van Oosten H.J. Purification of plum pox (sharka) virus with the use of Triton X-100. Neth. J. Pl. Path., 1972, 78: 33-44 ( ) DOI: 10.1007/BF02077555
- Laín S., Riechmann J.L., Méndez E., García J.A. Nucleotide sequence of the 3' terminal region of plum pox potyvirus RNA. Virus Res., 1988, 10: 325-341 ( ) DOI: 10.1016/0168-1702(88)90074-3
- Shukla D.D., Jilka J., Tosic M., Ford R.E. A novel approach to the serology of potyviruses involving affinity-purified polyclonal antibodies directed towards virus-specific N termini of coat protein. J. Gen. Virol., 1989, 70: 13-23 ( ) DOI: 10.1099/0022-1317-70-1-13
- Shukla D.D., Strike P.M., Tracy S.L., Gough K.H., Ward C.W. The N and C termini of the coat proteins of potyviruses are surface-located and the N terminus contains the major virus-specific epitopes. J. Gen. Virol., 1988, 69: 1497-1508 ( ) DOI: 10.1099/0022-1317-69-7-1497
- Subr Z., Glasa M. Plum pox virus variability detected by the advanced analytical methods. Acta Virologica, 2008, 52: 75-90.
- Kollerova E., Glasa M., Subr Z.W. Western blotting analysis of the Plum pox virus capsid protein. J. Plant Pathol., 2008, 90: S1.19-S1.22 ( ) DOI: 10.4454/jpp.v90i1sup.610
- Sheveleva A., Ivanov P., Prihodko Y., James D., Chirkov S. Occurrence and genetic diversity of Winona-like Plum pox virus isolates in Russia. Plant Dis., 2012, 96: 1135-1142 ( ) DOI: 10.1094/PDIS-12-11-1045-RE
- Lopez-Moya J.J., Canto T., Lopez-Abella D., Diaz-Ruiz J.R. Differentiation of Mediterranean plum pox virus isolates by coat protein analysis. Plant Pathol., 1994, 43: 164-171 ( ) DOI: 10.1111/j.1365-3059.1994.tb00566.x
- Lopez-Moya J.J., Sanz A., Cambra M., Gorris M.T., Anaya C., Miguet J.G., Cortes E., Lopez-Abella D. Production and characterization of monoclonal antibodies to plum pox virus and their use in differentiation of Mediterranean isolates. Arch. Virol., 1994, 135: 293-304 ( ) DOI: 10.1007/BF01310015
- Maiss E., Timpe U., Brisske A., Jelkman W., Casper R., Himmler G., Mattanovich D., Kattinger H.W. The complete nucleotide sequence of plum pox virus RNA. J. Gen. Virol., 1989, 70: 513-524 ( ) DOI: 10.1099/0022-1317-70-3-513
- Chirkov S., Ivanov P., Sheveleva A., Kudryavtseva A., Prikhodko Y., Mitrofanova I. Occurrence and characterization of Plum pox virus strain D isolates from European Russia and Crimea. Arch. Virol., 2016, 161: 425-430 ( ) DOI: 10.1007/s00705-015-2658-x
- Nikitin N., Trifonova E., Karpova O., Atabekov J. Examination of biologically active nanocomplexes by nanoparticle tracking analysis. Microsc. Microanal., 2013, 19: 808-813 ( ) DOI: 10.1017/S1431927613000597
- Cambra M., Asensio M., Gorris M.T., Perez E., Camarasa E., Garcia J.A., Moya J.J., Lopez-Abella D., Vela C., Sanz A. Detection of plum pox potyvirus using monoclonal antibodies to structural and non-structural proteins. EPPO Bull., 1994, 24: 569-577 ( ) DOI: 10.1111/j.1365-2338.1994.tb01070.x
- Candresse T., Saenz P., Garcia J.A., Boscia D., Navratil M., Gorris M.T., Cambra M. Analysis of the epitope structure of Plum pox virus coat protein. Phytopathology, 2011, 101: 611-619 ( ) DOI: 10.1094/PHYTO-10-10-0274
- Candresse T., Cambra M., Dallot S., Lanneau M., Asensio M., Gorris M.T., Revers F., Macquaire G., Olmos A., Boscia D., Quiot J.B., Dunez J. Comparison of monoclonal antibodies and polymerase chain reaction assays for the typing of isolates belonging to the D and M serotypes of plum pox potyvirus. Phytopathology, 1998, 88(3): 198-204 ( ) DOI: 10.1094/PHYTO.1998.88.3.198
- Sheveleva A., Chirkov S., Nemova E. Detection of a new Winona-like Plum pox virus isolate in naturally infected Canadian plum (Prunus nigra) in Russia. Acta Horticulturae, 2011, 899: 49-55 ( ) DOI: 10.17660/ActaHortic.2011.899.5
- Garcia J.A., Martin M.T., Cervera M.T., Reichmann J.L. Proteolytic processing of the plum pox virus polyprotein by the NIa protease at a novel cleavage site. Virology, 1992, 188: 697-703 ( ) DOI: 10.1016/0042-6822(92)90524-S
- Adams M.J., Antoniw J.F., Beaudoin F. Overview and analysis of the polyprotein cleavage sites in the family Potyviridae. Mol. Plant Pathol., 2005, 6: 471-487 ( ) DOI: 10.1111/J.1364-3703.2005.00296.X


