Устойчивость коллекционных штаммов родококков к воздействию экотоксиканта - этоксилированного нонилфенола
Автор: Баяндина Е.А., Поздеева А.В., Куюкина М.С., Ившина И.Б.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2023 года.
Бесплатный доступ
Этоксилированный нонилфенол (ЭНФ) - широко применяемый поверхностно-активный агент, относящийся к наиболее распространенным ксеноэстрогенам - гормоноподобным ксенобиотикам, накопление которых в окружающей среде оказывает негативное воздействие на эндокринную систему животных и человека, повышая тем самым уровень экологического риска. Естественные процессы биодеградации ЭНФ затруднены вследствие его высокой токсичности для водных и почвенных микроорганизмов, что требует поиска устойчивых штаммов-биодеструкторов данного экополлютанта. В работе выполнен скрининг 50 штаммов актинобактерий рода Rhodococcus из Региональной профилированной коллекции алканотрофных микроорганизмов (акроним ИЭГМ, http://www.iegmcol.ru) по устойчивости к ЭНФ и изучено воздействие ксенобиотика на динамику формирования биопленок родококков. Отобраны устойчивые к высоким (МИК > 125 г/л) концентрациям ЭНФ штаммы R. ruber ИЭГМ 615, ИЭГМ 1263, R. rhodochrous ИЭГМ 655, выделенные из нефтезагрязненных экосистем. Показано, что длительное (до 72 ч.) культивирование биопленок R. ruber ИЭГМ 71 в присутствии 15 г/л ЭНФ способствовало увеличению адгезивной активности клеток и синтезу экзополимерного матрикса, играющего основную роль в защите бактерий от токсичного воздействия ЭНФ. Полученные данные раскрывают потенциал родококков для детоксикации ксеноэстрогенов из группы алкилированных фенолов, что может быть использовано при разработке биотехнологических методов очистки окружающей среды от данных экотоксикантов.
Биоремедиация, этоксилированный нонилфенол, устойчивость, минимальная ингибирующая концентрация, биопленки, клсм
Короткий адрес: https://sciup.org/147242767
IDR: 147242767 | УДК: 579:873:579.222.2 | DOI: 10.17072/1994-9952-2023-4-337-348
Текст научной статьи Устойчивость коллекционных штаммов родококков к воздействию экотоксиканта - этоксилированного нонилфенола
Этоксилаты нонилфенола широко используются в различных отраслях промышленности в качестве поверхностно-активных веществ, эмульгаторов, смачивающих и диспергирующих веществ, а также солюбилизаторов [Quina, Hinze, 1999; Materna et al., 2001; Dong, Hao, 2010; Negin, Ali, Xie, 2017; Priac et al., 2017]. Попадая в окружающую среду со сточными водами, этоксилированный нонилфенол (ЭНФ) и продукты его разложения оказывают негативное воздействие на представителей флоры и фауны, что связано с их способностью выступать как эстрогены и нарушать гормональный баланс у живых организмов [Ferguson et al., 2003]. Эти соединения могут накапливаться в тканях организмов и вызывать изменения в репродуктивной системе, гормональные нарушения, воздействуя на иммунную, нервную системы, проявляя токсичность для экосистемы в целом. Поэтому контроль, ограничение использования и распространения ЭНФ являются важными мерами для защиты окружающей среды и сохранения биологического разнообразия [Kovalchuk et al., 2007; Fucic et al., 2012; Shen et al., 2016; Ademollo et al., 2018; Petrick et al., 2020; Seralini, Jungers, 2021]. В почве и воде ЭНФ подвергается частичной деградации и превращается в нонилфенол, который может длительно существовать в различных изомерных формах [White, 1993; Eganhouse et al., 2009; Lu, Gan, 2014; Korsman et al., 2015; Peng et al., 2023].
Процессы биодеградации ЭНФ и нонилфенола описаны для некоторых родов бактерий, в частности Acidovorax , Bacillus , Klebsiella , Pseudomonas , Sphingomonas и Stenotropomonas [Soares et al., 2003; Corvini et al., 2004; Yuan, Yu, Chang, 2004; Watanabe et al., 2012; Ruiz et al., 2013], а также грибов Rhodotorula [Wu, Qiu, 2011] и Metarhizium [Różalska et al., 2015]. Некоторые исследователи изучали деградацию алкилфенолов природными сообществами загрязненных почв [Kim, Kwak, An, 2019], речных отложений [Cladière et al., 2014], смешанными микробными популяциями в биореакторах [Buitrón, Torres-Bojorges, Cea-Barcia, 2015; Ferrer-Polonio et al., 2022] и очистных сооружениях [Lara-Moreno et al., 2022]. При этом показано [Кузикова и др., 2019], что естественные процессы биодеградации ЭНФ затруднены вследствие его высокой токсичности для водных и почвенных микроорганизмов.
Актинобактерии рода Rhodococcus характеризуются широким спектром деградируемых соединений, включая алифатические и ароматические углеводороды, галогенированные и азотсодержащие производные, а также органические растворители, пестициды, фармполютанты, гормоны и средства личной гигиены [Ivshina et al., 2012; Krivoruchko, Kuyukina, Ivshina, 2019, Nazari et al., 2022, Tian et al., 2022]. Родококки способны к формированию биопленок, состоящих из бактериальных клеток и ассоциированного с ними экзополимерного матрикса (ЭПМ), образованного полисахаридами, белками и липидами и играющего важную роль в защите клеток от воздействия токсичных факторов [Bayandina et al., 2022]. Следует отметить, что формирование биопленок является преимущественным способом существования микроорганизмов в окружающей среде, который обеспечивает защиту клеток от физико-химических и биологических воздействий, тем самым позволяя им выживать в стрессовой среде [Flemming, Wuertz,
-
2019] . В литературе описан процесс разложения 17β-эстрадиола клетками Rhodococcus equi DSSKP-R-001 [Wang, 2019], однако биодеградация других ксеноэстрогенов родококками ранее не исследовалась.
Цель работы – изучение влияния ЭНФ на жизнеспособность актинобактерий рода Rhodococcus в планктонной культуре и в составе биопленок, а также отбор устойчивых коллекционных штаммов для возможного применения в технологиях очистки окружающей среды от токсичных ксеноэстрогенов.
Материалы и методы
Бактериальные культуры и условия культивирования. В работе использовали 50 штаммов родококков из Региональной профилированной коллекции алканотрофных микроорганизмов (официальный акроним коллекции ИЭГМ, номер во Всемирной федерации коллекций культур 285, . Культуры принадлежали к трем видам Rhodococcus: R. erythropolis (33 штамма), R. rhodochrous (4 штамма), R. ruber (13 штаммов). Выбор коллекционных штаммов определялся их высокой каталитической активностью по отношению к сложным органическим соединениям.
Культивирование биопленок на покровных стеклах (24 x 50 x 0.15 мм) для микроскопии (Gerhard Menzel, UK) осуществляли в жидкой минеральной среде К [Ившина, Каменских, Ляпунов, 1994], содержащей 1.0 об. % н- гексадекана, в колбах Эрленмейера объемом 150 мл при постоянном перемешивании (130 об/мин), 28°С в течение 24‒72 ч. В экспериментах использовали ЭНФ марки «Berol 09» (Akso Nobel, Швеция) в концентрации 5, 10 и 15 г/л.
Определение минимальной ингибирующей концентрации (МИК) ЭНФ в отношении родокок-ков проводили методом двукратных серийных разведений в среде RS [Куюкина и др., 2000] с использованием 96-луночных микропланшетов («Медполимер», Россия). ЭНФ вносили в лунки микропланшета в начальной концентрации 250 г/л с последующим двукратным разведением, после чего добавляли по 10 мкл бактериальной суспензии (3.0×107 кл/мл) и осуществляли инкубирование в течение 3 сут. при температуре 28ºС. Затем бактериальные клетки окрашивали 0.2%-ным водным раствором йодонитротет-розолия (ИНТ). Оценку жизнеспособности клеток проводили по изменению оптической плотности (ОП) суспензии вследствие образования красно-фиолетового формазана с помощью планшетного спектрофотометра Multiskan Ascent (Thermo Electron Corporaton, США) при длине волны 630 нм.
Методика КЛСМ-сканирования . Покровное стекло с выращенной биоплёнкой подсушивали на воздухе в течение 10‒15 мин., затем добавляли флуоресцентный краситель LIVE/DEAD® BacLight™ Bacterial Viability Kit (Invitrogen, США) и оставляли в темном месте на 15–20 мин. Препарат промывали деионизированной водой для удаления остатков красителя, среды и планктонных клеток. КЛСМ-сканирование проводили с помощью микроскопа FluoView 1000 (Olympus, Япония) с использованием иммерсионного объектива (×100, числовая апертура 1.4). Для возбуждения флуоресценции SYTO9 и пропидиум йодида, входящих в состав красителя LIVE/DEAD®, применяли аргоновый лазер (λ = 488 нм) с 505/525-нм барьерным фильтром, и гелий-неоновый лазер (λ = 543 нм) с 560/660-нм барьерным фильтром. Полученные изображения анализировали с помощью программы FV10-ASW 3.1 (Olympus Corporation, Япония).
Статистический анализ результатов исследований проводили с использованием стандартной программы Excel 2016, вычисляя среднее значение и стандартное отклонение (m ± SD). Кластерный и корреляционный анализ данных (коэффициент Пирсона с уровнем значимости p < 0.005) проводили с помощью программы Past3.
Результаты и их обсуждение
Представленная дендрограмма (рис. 1) иллюстрирует распределение исследованных коллекционных штаммов родококков по кластерам в зависимости от значений МИК ЭНФ. По нашим данным, почти половина (24 из 50 исследованных культур) представителей Rhodococcus spp. не сохраняли жизнеспособность при концентрации ЭНФ свыше 0.5‒2.0 г/л, что указывает на высокую токсичность данного соединения. Остальные штаммы группировались в 3 основные группы с соответствующими значениями МИК ЭНФ: 2–50, 50–125 и >125 г/л. Видоспецифические различия в чувствительности родококков к действию ЭНФ не выявлены. При этом штаммы R. erythropolis в целом характеризовались более высокой чувствительностью к воздействию ЭНФ по сравнению с представителями R ruber и R. rhodochrous (соответствующие средневидовые значения МИК ЭНФ составили 22, 96 и 100 г/л). Возможно, более высокая устойчивость представителей R. rhodochrous и R ruber связана с их способностью продуцировать недиффундирующий красно-оранжевый пигмент (тогда как колонии R. erythropolis имеют палево-телесную окраску), участвующий в защите клеток от повреждающих факторов, в частности ионов тяжелых металлов [Ившина, Куюкина, Костина, 2013]. Отобраны наиболее устойчивые к высоким (МИК ≥ 125 г/л) концен- трациям ЭНФ штаммы R. ruber ИЭГМ 615, R. ruber ИЭГМ 1263 и R. rhodochrous ИЭГМ 655, являющиеся представителями экологически значимых видов родококков.
МИК (г/л)
>125 '
50-125 -
2-50 ■
R ra/w IEGM 615 НП
R. ruber IEGM 1263 НИ
R rhodochrous IEGM 655 II
R. enihropolis IEGM 22 НВ
R. mihropolis IEGM 24 HB
R. ruber IEGM 379 Till
R. rafter IEGM 1217 П
R cnihropolis IEGM 180 MB
R enihropolis IEGM 16 Illi
R. enihropolis IEGM 196 ДО
R ruber IEGM 70 II
R ruber IEGM 896 ТЗП
R. rhodochrous IEGM 654 II
R rhodochrous IEGM 62T II
R. ruber IEGM 1219 П
R. ruber IEGM 759 CB
R rafter IEGM 71ПВ
R enihropolis IEGM II Illi
R enihropolis IEGM 207 Illi
R. enihropolis IEGM 18 Hll
R enihropolis IEGM 767 HB
R cnihropolis IEGM 7 Hll
R enihropolis IEGM 206 Hll
R enihropolis IEGM 20 Hll
R cnihropolis IEGM 711 CB
0.5-2
R. ruber IEGM 1215 П
- R. enihropolis IEGM 256 Hll
R. enihropolis IEGM 209 HB
R cnihropolis IEGM 13 HB
R. enihropolis IEGM 21 11
R cnihropolis IEGM 184 HB
R. ruber IEGM 84 11
R. enihropolis IEGM 15 Hll
R. enihropolis IEGM 8 Hll
R enihropolis IEGM 25 HB
R cnihropolis IEGM 179 Hll
R. enihropolis IEGM 23 HB R rhodochrous IEGM 1362 II
R. enihropolis IEGM 19 HB
R. ruber IEGM 79 II
R. enihropolis IEGM 12 Hll
R enihropolis IEGM 208 Hll
R cnihropolis IEGM 258 НП IR rhodochrous IEGM 1363 Hll
R enihropolis 180 IIВ
R enihropolis 181 IIВ
R. enihropolis 260 Hll
R. ruber 1211 П
R. enihropolis IEGM 14 Hll
R enihropolis IEGM 254 Hll
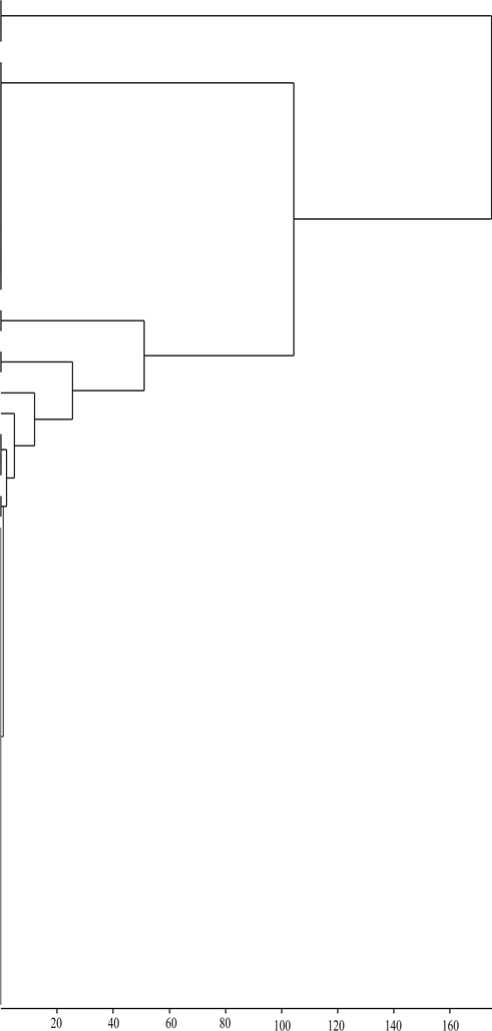
Евклидово растояннс
Рис. 1. Дендрограмма распределения коллекционных штаммов Rhodococcus spp. по чувствительности к ЭНФ.
МИК – минимальная ингибирующая концентрация. ДО – донные отложения, НП – нефтезагрязненная почва, НВ – нефтезагрязненная вода, П – почва, ТЗП – техногенно загрязненная почва, СВ – сточная вода
[Dendrogram of distribution of collection strains of Rhodococcus spp. according to sensitivity to ENP.
MIC – minimum inhibitory concentration. BS – bottom sediments, OCS – oil-contaminated soil, OCW – oil-contaminated water, S – soil, TCP – technogenically contaminated soil, SW – sewage wastewater]
Родококки представляют собой значительную часть почвенных бактериальных сообществ, обитающих в местах, загрязненных углеводородами и их производными [Ившина и др., 2021]. Результаты проведенного корреляционного анализа указывают на отсутствие строгой корреляции (коэффициент Пирсо- на составил 0.14 при p = 0.34) между устойчивостью исследованных штаммов к ЭНФ и их приуроченностью к нефтезагрязненным местообитаниям. Тем не менее, в группе высокорезистентных (МИК ≥ 50 г/л) штаммов в основном присутствовали культуры, выделенные из техногенно загрязненных, в том числе нефтезагрязненных, почв (R. erythropolis ИЭГМ 16, R. rhodochrous ИЭГМ 62Т, ИЭГМ 655, R. ruber ИЭГМ 70, ИЭГМ 379, ИЭГМ 615, ИЭГМ 896, ИЭГМ 1263), нефтезагрязненных (R. erythropolis ИЭГМ 22, ИЭГМ 24, ИЭГМ 180, R. ruber ИЭГМ 615) и сточных (R. ruber ИЭГМ 759) вод. Полученные результаты согласуются с данными [Кузикова и др., 2019], отмечающими повышение доли актинобактерий, в частности представителей семейства Micrococcaceae, в почве при увеличении концентрации нонилфенолов в загрязненной почве. Аналогично при изучении биоразнообразия активного ила очистных сооружений [Vil-lemur et al., 2013], из всех бактериальных изолятов только Rhodococcus sp. EMS-1 проявлял устойчивость и значительную способность к деградации ксеноэстрогенов.
В качестве примера на рис. 2 представлена динамика жизнеспособности клеток устойчивых и чувствительных штаммов родококков в присутствии возрастающих концентраций ЭНФ. Клетки R. ruber ИЭГМ 71 сохраняли 40–80% дыхательной активности при концентрации ЭНФ в диапазоне 125–250 г/л. Для сравнения, в клетках чувствительного штамма R. erythropolis ИЭГМ 711 процессы дыхания снижались на 70–80% при концентрации ЭНФ 0.5–1.0 г/л и практически полностью прекращались в присутствии >2.0 г/л ЭНФ.
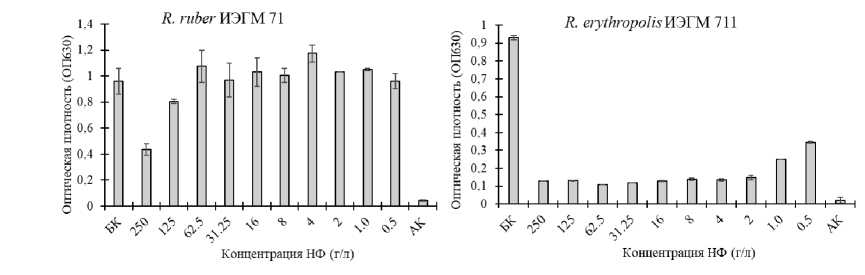
Рис. 2. Динамика жизнеспособности клеток R. ruber ИЭГМ 71 и R. erythropolis ИЭГМ 711 в присутствии возрастающих концентраций ЭНФ.
Представлены значения ОП 630 клеточных суспензий, окрашенных ИНТ. АК – абиотический контроль, БК – биотический контроль
[Dynamics of cell viability of R. ruber IEGM 71 and R. erythropolis IEGM 711 in the presence of increasing concentrations of ENP.
The OD 630 values of cell suspensions stained with INT are presented. AK – abiotic control, BC – biotic control]
Далее с помощью КЛСМ была изучена сравнительная динамика формирования биопленок клетками R. ruber ИЭГМ 71 при воздействии различных концентраций ЭНФ (рис. 3). Формирование биопленок – комплексный динамический процесс, включающий несколько этапов: адгезию клеток на поверхности и перераспределение клеточной массы, активное деление клеток для создания клеточных колоний или кластеров и в конечном итоге образование ЭПМ, который способствует защите клеток от неблагоприятных воздействий [Flemming, Wuertz, 2019]. Адгезивная активность бактерий во многом определяется свойствами клеточной поверхности, прежде всего степенью ее гидрофобности [Hoostal, Bidart-Bouzat, Bouzat, 2008], на которую значительное влияние оказывают условия культивирования. По данным [Wilmaerts et al., 2019; Ившина и др., 2021], клетки родококков лучше коадгезируют при росте на гидрофобных субстратах. В этой связи биопленки родококков выращивали в минеральной среде в присутствии 1.0 об. % н -гексадекана в ранее подобранных [Bayandina et al., 2022] динамических условиях, обеспечивающих равномерную адгезию клеток к покровному стеклу.
Как видно из рис. 3, морфология клеток R. ruber ИЭГМ 71 в биопленках изменялась незначительно при воздействии сравнительно высоких (5‒15 г/л) концентраций ЭНФ. При этом уже при минимальной (5 г/л) концентрации ЭНФ наблюдался процесс коагрегации клеток, усиливающийся равномерно при повышении концентрации экотоксиканта. На КЛСМ-сканах биопленок, окрашенных дифференцирующим красителем LIVE/DEAD®, видно (рис. 3В), что при воздействии высоких (10‒15 г/л) концентраций ЭНФ живые клетки родококков заключены в экзополимерный матрикс, образованный мертвыми клетками и компонентами ЭПМ. По мере созревания биопленок (24‒72 ч.) интенсивность образования ЭПМ увеличивалась в прямой зависимости от воздействующей концентрации ЭНФ.
По нашим данным (рис. 4), жизнеспособность клеток R. ruber ИЭГМ 71 в составе биопленок поддерживалась на высоком (70–80%) уровне при воздействии 5‒10 г/л ЭНФ и снижалась на 40–60% в присутствии повышенной (15 г/л) концентрации ЭНФ. Полученные результаты согласуются с данными других исследователей, отмечающих выраженный ингибиторный эффект высоких концентраций ЭНФ в отношении как микробных биопленок, так и планктонных клеток [Writer, Joseph, Larry, 2011]. При этом жизнеспособность родококков в составе зрелых (48‒72 ч.) биопленок была заметно выше и при концентрациях 5 и 10 г/л ЭНФ практически не отличалась от контрольных значений, что подтверждает защитную роль ЭПМ в формирующихся биопленках.
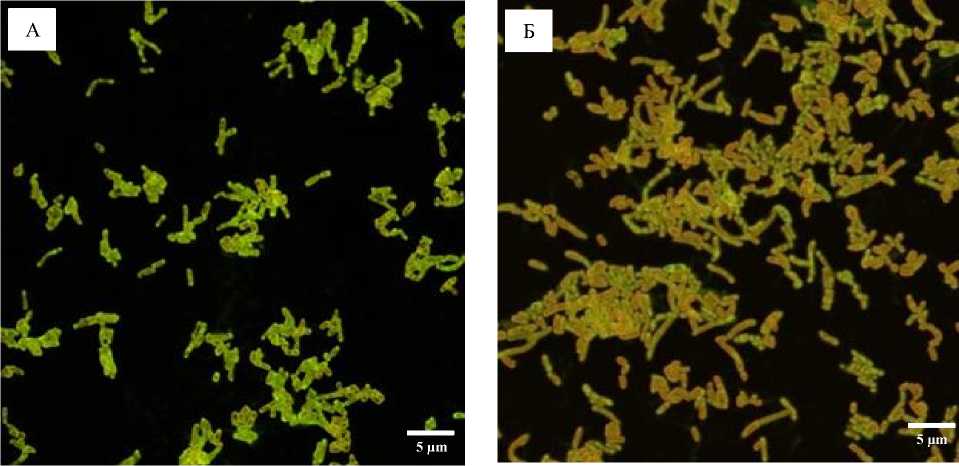
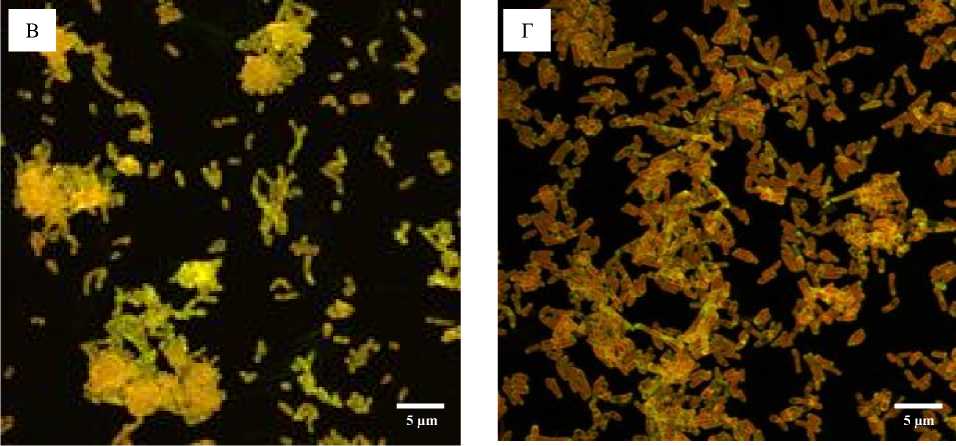
Рис. 3. КЛСМ-изображения биопленок R. ruber ИЭГМ 71, выращенных в минеральной среде К с 1.0% н- гексадекана в присутствии различных концентраций ЭНФ в течение 48 ч. и окрашенных LIVE/DEAD® для выявления живых (зеленые) и мертвых (красные) клеток.
А – Контроль, Б–Г – концентрация ЭНФ: 5.0 г/л (Б), 10 г/л (В), 15 г/л (Г)
[CLSM images of biofilms of R. ruber IEGM 71 grown in mineral medium K with 1.0% n -hexadecane in the presence of various concentrations of ENP for 48 hours and stained with LIVE/DEAD® to identify living (green) and dead (red) cells.
А – Control, Б–Г – ENP concentration: 5.0 g/l (B), 10 g/l (C), 15 g/l (D)]
Важно отметить, что общая численность клеток в формирующихся биопленках была в 2–2.5 раза выше при максимальной (15 г/л) концентрации ЭНФ по сравнению с контрольными значениями на протяжении всего (24‒72 ч.) срока наблюдения (рис. 5). Это указывает на увеличение адгезивной (коадгезив-ной) активности родококков в присутствии высокой концентрации ЭНФ, несмотря на подавление клеточной жизнеспособности. Возможно, данный эффект обусловлен поверхностно-активными свойствами
ЭНФ, благодаря которым стимулировалась адгезивная активность родококков, аналогично действию биогенных сурфактантов, синтезируемых клетками R. ruber , которые формируют кондиционирующие пленки на поверхности твердых субстратов, тем самым облегчая адгезию к ним клеток родококков [Ivshina et al., 2013].
[Effects of ENP on the viability of R. ruber IEGM 71 cells in biofilms grown in mineral medium K with
1.0% n -hexadecane]
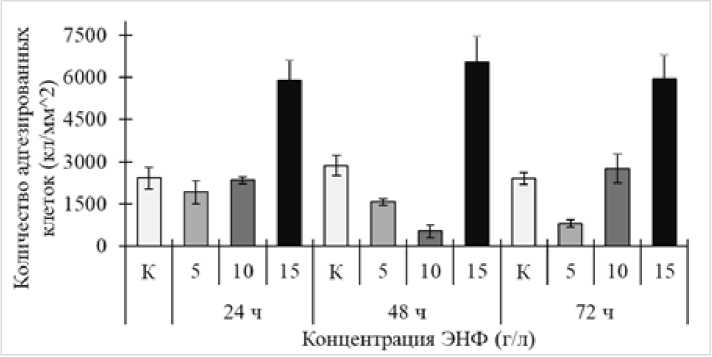
Рис.5. Динамика общей численности R. ruber ИЭГМ 71 в биопленках, выращенных в минеральной среде К с 1.0% н- гексадекана в присутствии различных концентраций ЭНФ
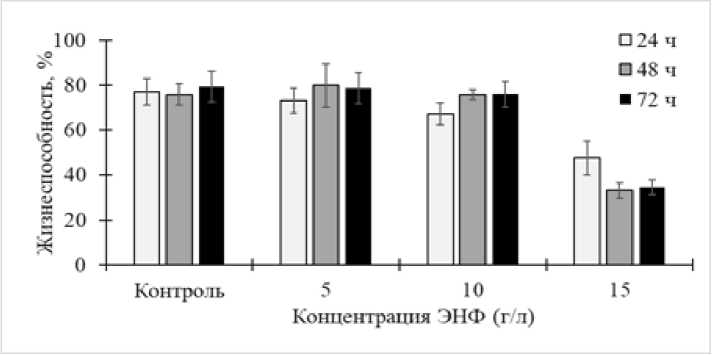
Рис. 4. Влияние ЭНФ на жизнеспособность клеток R. ruber ИЭГМ 71 в биопленках, выращенных в минеральной среде К с 1.0% н- гексадекана
[Dynamics of R. ruber IEGM 71 cell numbers in biofilms grown in mineral medium K with 1.0% n- hexadecane in the presence of different ENP concentrations]
Выявленное разнонаправленное воздействие ЭНФ на планктонные культуры и формирующиеся биопленки родококков свидетельствует, с одной стороны, о комплексном характере взаимодействия поверхностно-активных ксеноэстрогенов из группы алкилфенолов с бактериальными клетками [Corvini et al., 2004; Wu, Qiu, 2011; Ruiz et al., 2013; Lu, Gan, 2014; Кузикова и др., 2019; Lara-Moreno et al., 2022], с другой стороны, о сложных, хорошо скоординированных механизмах адаптации актинобактерий рода Rhodococcus (включая усиленную агрегацию клеток к твердым поверхностям и коагрегацию, сверхсинтез экзополимеров) к действию токсичных ксенобиотиков [Ившина и др., 2021].
Заключение
Установлено, что актинобактерии рода Rhodococcus характеризуются различной степенью чувствительности к воздействию широко распространенного ксеноэстрогена – этоксилированного нонилфенола. При этом почти половина исследованных культур родококков не сохраняла жизнеспособность при концентрации ЭНФ свыше 0.5‒2.0 г/л, что указывает на высокую токсичность данного соединения. По результатам кластерного анализа выявлены 4 основные группы штаммов родококков, не совпадающие с их видовой принадлежностью, с соответствующими значениями МИК ЭНФ: 0.5‒2.0, 2–50, 50–125 и
>125г/л. Обнаружено, что штаммы R. erythropolis в целом характеризовались более высокой чувствительностью к воздействию ЭНФ по сравнению с представителями R ruber и R. rhodochrous. Отобраны устойчивые к высоким (МИК > 125 г/л) концентрациям ЭНФ штаммы R. ruber ИЭГМ 615, 1263, R. rhodochrous ИЭГМ 655, выделенные из нефтезагрязненных сред. Показано, что длительное (до 72 ч.) культивирование биопленок R. ruber ИЭГМ 71 в присутствии 15 г/л ЭНФ способствовало увеличению адгезивной активности и коагрегации бактериальных клеток (при снижении их жизнеспособности), а также синтезу экзополимерного матрикса, играющего основную роль в защите бактерий от токсичного воздействия ЭНФ. Отобранные устойчивые к ЭНФ штаммы Rhodococcus spp. и полученные данные могут использоваться при разработке биотехнологических методов очистки окружающей среды от ксено-эстрогенов группы алкилфенолов.
Список литературы Устойчивость коллекционных штаммов родококков к воздействию экотоксиканта - этоксилированного нонилфенола
- Ivshina I.B., Kamenskih T.N., Lyapunov Ya.E. Katalog štammov Regional’noj profiirovannoj kollekcii a;anottrofnych mikroorganizmov [Catalogue of strains of the Regional profiled collection of alkanotrophic mi-croorganisms]. Moscow, Nauka Publ., 1994. 163 p. (In Russ.).
- Ivshina I.B., Kuyukina M.S., Kostina L.V. [Adaptive mechanisms of nonspecific resistance of alka-notrophic actinobacteria to heavy metal ions]. Èkologija. Iss. 2 (2013): pp. 115-123. (In Russ.).
- Ivshina I.B., Kuyukina M.S., Kamenskih T.N.,Krivoruchko A.V., Tyumina E.A., Elkin A.A. Uglevo-dorodokisljajuščie rodokokki [Hydrocarbon-oxidizing rhodococci: features of biological organization under the influence of eco-pollutants]. Perm, 2021. 139 p. (In Russ.).
- Kuzikova I.L., Zaytseva T.B., Kichko A.A., Zinoveva S.V., Russu A.D., Mayachkina N.V., Medvedeva N.G. [Effect of nonylphenols on the abundance and taxonomic structure of the soil microbial community]. Počvovedenie. No. 6 (2019): pp. 722-733. (In Russ.).
- Kuyukina M.S., Ivshina I.B., Rychkova M.I., Chumakov O.B. [Effect of the cell lipid composition on the formation of nonspecific antibiotic resistance in alkanotrophic rhodococci]. Mikrobiologija. V. 69, No. 1 (2000): pp. 62-69. (In Russ.).
- Ademollo N., Patrolecco L., Rauseo J., Nielsen J., Corsolini S., Bioaccumulation of nonylphenols and bi-sphenol A in the Greenland shark Somniosus microcephalus from the Greenland seawaters. Microchemical Journal. V. 136 (2018): pp. 106-112.
- Bayandina E.A., Glebov G.G., Kuyukina M.S., Ivshina I.B. Resistance of Rhodococcus ruber biofilms to CuO nanoparticles depending on exopolymer matrix composition. Acta Biomedica Scientifica. V. 7(5‒1) (2022): pp. 100-109.
- Buitrón G., Torres-Bojorges A.X., Cea-Barcia G. Removal of p-nonylphenol isomers using nitrifying sludge in a membrane sequencing batch reactor. Chemical Engineering Journal. V. 281 (2015): pp. 860-868.
- Cladière M., Bonhomme C., Vilmin L., Gasperi J., Flipo N., Tassin B. Modelling the fate of nonylphenolic compounds in the Seine River — part 1: Determination of in-situ attenuation rate constants. Science of the To-tal Environment. V. 468-469 (2014): pp. 1050-1058.
- Corvini P., Vinken R., Hommes G, Schmidt D., Dohmann M. Degradation of the Radioactive and Non-labelled Branched 4(3',5'-dimethyl 3'-heptyl)-phenol Nonylphenol Isomer by Sphingomonas TTNP3. Biodegra-dation. V. 15 (2004): pp. 9-18.
- Dong R., Hao J. Complex fluids of poly(oxyethylene) monoalkyl ether nonionic surfactants. Chemical Reviews. V. 110 (2010): pp. 4978-5022.
- Eganhouse R.P., Pontolillo J., Gaines R.B., Frysinger G.S., Gabriel, F.L.P., Kohler H.-P.E., Giger W., Barber L.B. Isomer-specific determination of 4-nonylphenols using comprehensive two-dimensional gas chromatog-raphy/time-of-flight mass spectrometry. Environmental Science & Technology. V. 43 (24) (2009): pp. 9306-9313.
- Ferguson P.L., Bopp R.F., Chillrud S.N., Aller R.C., Brownawell B.J. Biogeochemistry of nonylphenol eth-oxylates in urban estuarine sediments. Environmental Science & Technology. V. 37 (2003): pp. 3499-3506.
- Ferrer-Polonio E., Fernández-Navarro J., Mendoza-Roca J.A., Bes-Piá A., Alonso-Molina J.L., Effect of 4-nonylphenol on the performance and microbial community of a sequencing batch reactor. Journal of Envi-ronmental Chemical Engineering. V. 10, No. 2 (2022): p. 107249.
- Flemming H.C, Wuertz S. Bacteria and archaea on Earth and their abundance in biofilms. Nature Re-views Microbiology. V. 17 (2019): pp. 247-260.
- Fucic A., Gamulin M., Ferencic Z., Katic J., Krayer von Krauss M., Bartonova A., Merlo D.F. Environ-mental exposure to xenoestrogens and oestrogen related cancers: reproductive system, breast, lung, kidney, pancreas, and brain. Environmental Health. V. 11 (2012): Article S8.
- Hoostal M.J., Bidart-Bouzat M.G., Bouzat J.L. Local adaptation of microbial communities to heavy metal stress in polluted sediments of Lake Erie. FEMS Microbiology Ecology. V. 65 (2008): pp. 156-168.
- Ivshina I.B., Richkova M.I. Mukhutdinova A.N., Karpenko Ju.N. Biodegradation of drotaverine hydro-chloride by free and immobilized cells of Rhodococcus rhodochrous IEGM 608. World Journal of Microbiolo-gy and Biotechnology. V. 28, No. 10 (2012): pp. 2997-3006.
- Ivshina I.B., Kuyukina M.S., Krivoruchko A.V., Plekhov O.A., Naimark O.B., Podorozhko E.A., Lozinsky V.I. Biosurfactant-enhanced immobilization of hydrocarbon-oxidizing Rhodococcus ruber on sawdust. Applied Microbiology and Biotechnology. V. 97 (2013): pp. 5315-5327.
- Kim D., Kwak J.I., An Y.-J. Physiological response of crop plants to the endocrine-disrupting chemical nonylphenol in the soil environment. Environmental Pollution. V. 251 (2019): pp. 573-580.
- Korsman J.C., Schipper A.M., de Vos M.G, van den Heuvel-Greve M.J., Vethaak A.D., de Voogt P., Hen-driks A.J. Modeling bioaccumulation and biomagnification of nonylphenol and its ethoxylates in estuarine–marine food chains. Chemosphere. V. 138 (2015): pp. 33-39.
- Kovalchuk O., Tryndyak V.P., Montgomery B., Boyko A., Kutanzi K., Zemp F., Warbritton A.R., Laten-dresse J.R, Kovalchuk I., Beland F.A., Pogribny I.P. Estrogen-induced rat breast carcinogenesis is characterized by alterations in DNA methylation, histone modifications, and aberrant microRNA expression. Cell Cycle. V. 6, No. 16 (2007): pp. 2010-2018.
- Krivoruchko A.V., Kuyukina M.S., Ivshina I.B. Advanced Rhodococcus biocatalysts for environmental biotechnologies. Catalysts. V. 9 (2019): pp. 1-19.
- Lara-Moreno A., Aguilar-Romero I., Rubio-Bellido M., Madrid F., Villaverde J., Santos J.L., Alonso E., Morillo E. Novel nonylphenol-degrading bacterial strains isolated from sewage sludge: Application in bioremedi-ation of sludge. Science of the Total Environment. V. 847 (2022): Article 157647.
- Lu Z., Gan J. Analysis, toxicity, occurrence and biodegradation of nonylphenol isomers. Environment In-ternational. V. 73 (2014): pp. 334-345.
- Materna K., Milosz I., Miesiac I., Cote G., Szymanowski J. Removal of phenols from aqueous streams by the cloud point extraction technique with oxyethylated methyl dodecanoates as surfactants. Environmental Science & Technology. V 35 (2001): pp. 2341-2346.
- Nazari M.T., Simon V., Strieder Machado B., Crestani L., Marchezi G., Concolato G., Ferrari V., Colla L.M., Piccin J.S. Rhodococcus: A promising genus of actinomycetes for the bioremediation of organic and inor-ganic contaminants. Journal of Environmental Management. V. 323 (2022): Article 116220.
- Negin C., Ali S., Xie Q. Most common surfactants employed in chemical enhanced oil recovery. Petrole-um. V. 3 (2017): pp. 197-211.
- Peng C., Zhou S., Zhang Y., Zhang H., Zhang W., Ling S., Hu S. Dynamics and mechanisms of bioaccu-mulation and elimination of nonylphenol in zebrafish. Toxicology. V. 483 (2023): Article 153375.
- Petrick J.L., McMenamin U.C., Zhang X., Zeleniuch-Jacquotte A., Wactawski-Wende J., Simon T.G., Sin-ha R., Sesso H.D., Schairer C., Rosenberg L., Rohan T.E., Robien K., Purdue M.P., Poynter J.N, Palmer J R, Lu Y., Linet M.S., Liao L.M., Lee I-M., Koshiol J., Kitahara C.M., Kirsh V.A., Hofmann J.N., Graubard B.I., Gio-vannucci E., Gaziano J.M., Gapstur S.M., Freedman N.D., Florio A.A., Chong D.Q., Chen Y., Chan A.T., Buring J.E., Beane Freeman L.E., Bea J.W, Cardwell C.R., Campbell P.T., McGlynn K.A. Exogenous hormone use, re-productive factors and risk of intrahepatic cholangiocarcinoma among women: results from cohort studies in the Liver Cancer Pooling Project and the UK Biobank. British Journal of Cancer. V. 123 (2020): pp. 316-324.
- Priac A., Morin-Crini N., Druart C., Gavoille S., Bradu C., Lagarrigue C., Torri G., Winterton P., Crini G. Alkylphenol and alkylphenol polyethoxylates in water and wastewater. Arabian Journal of Chemistry. V. 10 (2017): pp. S3749‒S3773.
- Quina F.H., Hinze W.L. Surfactant-mediated cloud point extractions. Industrial & Engineering Chemis-try Research. V. 38 (1999): pp. 4150-4168.
- Różalska S., Soboń A., Pawłowska J., Wrzosek M., Długoński J. Biodegradation of nonylphenol by a novel entomopathogenic Metarhizium robertsii strain. Bioresource technology. V. 191 (2015): pp. 166-172.
- Ruiz Y., Medina L., Borusiak M., Ramos N., Pinto G., & Valbuena O. Biodegradation of polyethoxylated nonylphenols. ISRN microbiology. (2013): Article 284950.
- Seralini G. E., Jungers G. Endocrine disruptors also function as nervous disruptors and can be renamed endocrine and nervous disruptors. Toxicology reports. V. 8 (2021): pp. 1538-1557.
- Shen C., Miao J., Li Y., Pan L. Effect of benzo[a]pyrene on detoxification and the activity of antioxidant enzymes of marine microalgae. Journal of Ocean University of China. V. 15 (2016): pp. 303-310.
- Soares A., Guieysse B., Delgado O., Mattiasson B. Aerobic biodegradation of nonylphenol by cold-adapted bacteria. Biotechnology Letters. V. 25 (2003): pp. 731-738.
- Tian K., Meng Q., Li S., Chang M., Meng F., Yu Y., Li H., Qiu Q., Shao J., Huo H., Mechanism of 17β-estradiol degradation by Rhodococcus equi via the 4,5-seco pathway and its key genes. Environmental Pollu-tion. V. 312 (2022): 120021.
- Villemur R., Dos Santos S.C., Ouellette J., Juteau P., Lépine F., Déziel, E. Biodegradation of endocrine dis-ruptors in solid-liquid two-phase partitioning systems by enrichment cultures. Applied and Environmental Mi-crobiology. V. 79(15) (2013): pp. 4701-4711.
- Wang Y. Degradation of 17β-estradiol and products by a mixed culture of Rhodococcus equi DSSKP-R-001 and Comamonas testosteroni QYY20150409. Biotechnology and Biotechnological Equipment. V. 33, No. 1 (2019): pp. 268-277.
- Watanabe W., Hori Y., Nishimura S., Takagi A., Kikuchi M., Sawai J. Bacterial Degradation and Reduc-tion in the Estrogen activity of 4-nonylphenol. Biocontrol Science. V. 17 (2012): pp. 143-147.
- White G. F. Bacterial biodegradation of ethoxylated surfactants. Pesticide Science. V. 37 (1993): pp. 159-166.
- Wilmaerts D., Windels E.M., Verstraeten N., Michiels J. General mechanisms leading to persister for-mation and awakening. Trends Genet. V. 35 (2019): pp. 401-411.
- Writer J., Joseph N.R., Larry J.B. Role of biofilms in sorptive removal of steroidal hormones and 4-nonylphenol compounds from streams. Environmental Science & Technology. V. 45 (2011): pp. 7275-7283.
- Wu F.F., Qiu L.F. Kinetic study on the biodegradation of nonylphenol by Rhodotorula sp. Advanced Ma-terials Research. V. 233-235 (2011): pp. 575-578.
- Yuan S.Y., Yu C.H., Chang B.V. Biodegradation of nonylphenol in river sediment. Environmental Pollu-tion. V. 127 (2004): pp. 425-430.


