Устойчивость ооцитов коров к возрастным изменениям после воздействия лютеотропных факторов во вторую фазу культивирования до стадии метафазы II
Автор: Лебедева И.Ю., Сингина Г.Н., Шедова Е.Н., Лопухов А.В., Митяшова О.С.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Репродуктивные технологии
Статья в выпуске: 6 т.53, 2018 года.
Бесплатный доступ
После завершения первого деления мейоза в ооцитах у разных видов млекопитающих, включая крупный рогатый скот (КРС), резко активизируются процессы старения, которые негативно влияют на качество созревших яйцеклеток и их способность к эмбриональному развитию после оплодотворения. Как известно, эндогенный прогестерон (Р4) играет важную роль в поддержании жизнеспособности ооцитов коров, причем его продукция окружающими клетками кумулюса значительно возрастает в завершающий период созревания женских гамет от метафазы I до метафазы II (MII). Однако влияние Р4 и двух его основных стимуляторов - пролактина (ПРЛ) и лютеинизирующего гормона (ЛГ) во время созревания ооцитов на их последующую резистентность к возрастным трансформациям до сих пор не изучено. Нами впервые проведено сравнение аномальных изменений хромосом на стадии MII, а также апоптотической дегенерации ооцитов, дозревших при воздействии Р4, ПРЛ и ЛГ в отсутствие и в присутствии клеток гранулезы, в процессе последующего пролонгированного культивирования яйцеклеток...
Крупный рогатый скот, ооцит, двухфазная система дозревания in vitro, возрастные изменения ооцитов, прогестерон, пролактин, лютеинизирующий гормон, клетки гранулезы
Короткий адрес: https://sciup.org/142220068
IDR: 142220068 | УДК: 636.2:591.39 | DOI: 10.15389/agrobiology.2018.6.1202rus
Текст научной статьи Устойчивость ооцитов коров к возрастным изменениям после воздействия лютеотропных факторов во вторую фазу культивирования до стадии метафазы II
Вспомогательные репродуктивные технологии служат одним из способов поддержания воспроизводства стада в молочном скотоводстве. В практике животноводства широко распространена трансплантация животным-реципиентам эмбрионов, полученных in vitro. В основе этой технологии лежит метод экстракорпорального созревания ооцитов, используемых
* Работа выполнена при финансовой поддержке РНФ (проект 16-16-10069).
для продукции нативных, клонированных или генетически модифицированных эмбрионов (1). Известно, что качество созревших ооцитов, детерминирующее их способность к дальнейшему развитию, представляет ключевой лимитирующий фактор при получении эмбрионов, пригодных для трансплантации (2). При этом состав системы культивирования критически влияет на качество яйцеклеток, что делает последние объектом направленного воздействия (3, 4).
Несмотря на совершенствование методов экстракорпорального созревания ооцитов крупного рогатого скота (КРС), качество получаемых in vitro эмбрионов остается ниже качества эмбрионов, полученных в естественных условиях, что приводит к более высокой частоте их последующего аномального развития и рождению потомства с ослабленной жизнеспособностью (5). В стандартной практике модернизация культуральных систем направлена в первую очередь на моделирование условий, имеющих место in vivo внутри овариальных фолликулов (6-8). Однако используемые подходы, как правило, учитывают только изменения, происходящие в функциональном состоянии ооцитов в процессе их созревания. Вместе с тем in vivo и in vitro в ооцитах различных видов млекопитающих, включая коров, после завершения первого деления мейоза резко активизируются процессы старения, которые негативно влияют на качество созревших яйцеклеток и их компетенцию к эмбриональному развитию после оплодотворения (9, 10). Кроме того, соматические клетки кумулюса, окружающие ооциты, подвергаются апоптотической дегенерации при завершении созревания женских гамет и могут ускорять негативные изменения последних, связанные со старением (10, 11).
Старение созревших ооцитов, которое называют постовуляторным, инициируется очень быстро на молекулярном уровне (9, 12). Этот процесс, очевидно, протекает и во время оплодотворения яйцеклеток, что следует учитывать при разработке научных подходов к модернизации систем созревания ооцитов in vitro (in vitro maturation, IVM). Любая задержка в оплодотворении (или искусственной активации) яйцеклеток может приводить к низкой жизнеспособности эмбрионов, а в случае рождения потомства — к ослаблению его фертильности и сокращению продолжительности жизни (13, 14). Создание системы культивирования ооцитов, способствующей повышению их устойчивости к возрастным изменениям, может быть одним из способов повышения качества эмбрионов, получаемых in vitro.
В процессе старения молекулярные изменения ооцитов сопровождаются морфофункциональными изменениями, которые наблюдаются значительно позднее и исследованы в большей степени (9, 14). Нами установлено, что у КРС к таким изменениям относится деструктивная трансформация метафазных хромосом, а также апоптотическая дегенерация яйцеклеток (10, 15). Гипофизарный гормон пролактин (ПРЛ), выполняющий лютеотропную функцию у самок млекопитающих (16), способен тормозить эти возрастные изменения и поддерживать потенцию к развитию созревших in vitro ооцитов коров в процессе их дальнейшего пролонгированного культивирования (15). При этом выявленное влияние ПРЛ, возможно, связано с продукцией прогестерона (Р4) клетками кумулюса, окружающими стареющие яйцеклетки.
Как известно, эндогенный Р4 играет важную роль в приобретении ооцитами КРС способности к дальнейшему развитию, причем его продукция клетками кумулюса значительно возрастает в завершающий период созревания женских гамет от метафазы I до метафазы II (MII) (17, 18). Кроме того, в работе F. Nuttinck с соавт. (19) было обнаружено 2-кратное повышение секреции Р4 кумулюсными клетками, связанными с созревшими ооцитами коров, через 24 ч после их оплодотворения in vitro, что свидетельствует о возможной позитивной роли этого овариального стероидного гормона в сохранении качества яйцеклеток после созревания. Вместе с тем вопрос о влиянии ПРЛ и Р4 во время созревания ооцитов на их последующую резистентность к возрастным трансформациям остается открытым. Нет также информации о роли лютеинизирующего гормона (ЛГ), еще одного лютеотропного фактора, в регуляции старения ооцитов.
Наибольший интерес представляет исследование регуляторного влияния лютеотропных факторов на антивозрастную устойчивость ооцитов во время завершающей стадии созревания, поскольку именно в этот период происходят основные молекулярно-цитоплазматические преобразования, благодаря которым ооциты приобретают компетенцию к дальнейшему эмбриональному развитию (2). Ранее мы разработали двухфазную систему созревания ооцитов коров in vitro и показали, что она может применяться как альтернатива общепринятому протоколу IVM при получении эмбрионов на стадии бластоцисты (20).
В настоящей работе впервые проведено сравнительное исследование аномальных изменений хромосом на стадии MII, а также апоптотиче-ской дегенерации ооцитов, дозревших при воздействии Р4, ПРЛ и ЛГ в отсутствие и в присутствии клеток гранулезы, в процессе последующего пролонгированного культивирования яйцеклеток.
Цель представленной работы заключалась в изучении влияния лю-теотропных факторов (прогестерона, пролактина и лютеинизирующего гормона) во время второй фазы cозревания in vitro ооцитов крупного рогатого скота на устойчивость последних к возрастным изменениям.
Методика . Исследования проводили на ооцит-кумулюсных комплексах (ОКК) коров и половозрелых телок, выделенных из антральных фолликулов диаметром 2-8 мм. В экспериментах использовали полученные после убоя яичники без видимых признаков патологии, которые доставляли в лабораторию в течение 3-4 ч в физиологическом растворе при 30-35 ° С. За исключением специально оговоренных случаев, применяли реагенты фирмы «Sigma-Aldrich» (США).
Перед выделением ооцитов яичники несколько раз отмывали в стерильном физиологическом растворе с антибиотиками (100 МЕ/мл пенициллина и 50 мкг/мл стрептомицина) и помещали в чашку Петри с манипуляционной средой ТС-199, содержащей 5 % фетальной бычьей сыворотки (ФБС), 10 мкг/мл гепарина, 0,2 мМ пируват натрия и 50 мкг/мл гентамицина. Стенки фолликулов рассекали стерильным лезвием, освободившиеся ОКК собирали из манипуляционной среды и промывали 3 раза свежей манипуляционной средой. Отбор ооцитов для исследований выполняли, как описано нами ранее (20). Выделение и селекцию ооцитов осуществляли при 37 ° С, используя стереомикроскоп SMZ («Nikon Corpora-tion», Япония) и нагревательный столик MATS-OZ («Tokai Hit», Япония).
ОКК (по 30-35 шт. на 500 мкл среды) культивировали в 4-луночных планшетах при температуре 38,5 ° С, 90 % влажности и содержании 5 % СО2 в атмосфере. Для получения созревших ооцитов применяли двухфазную систему культивирования. В течение первых 12 ч ооциты созревали в среде ТС-199, содержащей 10 % ФБС, 1 мМ пируват натрия, 50 мкг/мл гентамицина, 10 мкг/мл свиного ФСГ и 10 мкг/мл овечьего ЛГ. Затем ОКК переносили в новую среду и инкубировали в течение последующих 12 ч в присутствии или в отсутствие монослойной культуры клеток гранулезы. На втором этапе двухфазного культивирования применяли среду ТС-1204
-
199, содержащую 10 % ФБС, 1 мМ пируват натрия и 50 мкг/мл гентамицина (контроль) или эту же среду, дополненную P4 (50 нг/мл), бычьим ПРЛ (50 нг/мл) («Эндокринологический научный центр РАН», Москва) или овечьим ЛГ (5 мкг/мл) (согласно нашим предварительным исследованиям, при этих концентрациях гормонов наблюдается наименьшая частота хромосомных аномалий в созревших ооцитах коров).
Выделение и подготовку клеток гранулезы выполняли согласно описанной нами ранее методике (20). Отмытые от крови и фолликулярной жидкости клетки (1½106/мл) предварительно культивировали в 4-луночных планшетах в 500 мкл среды ТС-199, содержащей 10 % ФБС, 1 мМ пируват натрия и 50 мкг/мл гентамицина. Через 12 ч заменяли 250 мкл среды свежей средой, в которую добавляли один из исследуемых гормонов в вышеуказанных концентрациях. Затем в лунки вносили ОКК и проводили их совместное культивирование с клетками гранулезы в течение 12 ч.
После 24 ч созревания в двухфазной системе ОКК переносили в среду старения (ТС-199, содержащую 10 % сыворотки и 50 мкг/мл гентамицина) и дополнительно культивировали в течение 24 ч. В конце культивирования среды собирали и хранили при - 20 ° С. Концентрацию прогестерона в средах, кондиционированных ОКК и клетками гранулезы, определяли методом иммуноферментного анализа с использованием планшетного ИФА-анализатора Униплан («Пикон», Россия) и коммерческих наборов реагентов («НВО Иммунотех», Россия). Чувствительность метода составляла 0,4 нмоль/л. Все анализы выполняли в двух повторностях, коэффициент вариации между измерениями не превышал 13 %.
Через 24 ч пролонгированного культивирования ооциты освобождали от клеток кумулюса посредством инкубации ОКК в 0,1 % растворе гиалуронидазы (в свежей среде старения) в течение 1 мин при 37 ° С и последующей дезагрегации комплексов пипетированием (диаметр отверстия микропипетки 130 мкм). Изолированные ооциты использовали для цитогенетического анализа или выявления апоптоза иммунофлуоресцентным методом.
Препараты ядерного материала ооцитов готовили согласно описанной ранее методике (10). Стадии мейоза определяли в соответствии с общеизвестными морфологическими критериями (21). Наличие деструктивных изменений хромосом на стадии MII оценивали на основании следующих признаков: деконденсация (потеря четких морфологических очертаний, увеличение объема хромосом, неровные морфологические контуры), частичное слипание, образование единой комковатой массы (10). Ядерный материал в ооцитах исследовали с помощью микроскопа Axio Imager.M2 («Carl Zeiss», Германия) при увеличении ½1000.
Для анализа апоптоза ооциты фиксировали 4 % раствором параформальдегида в натрий-фосфатном буфере (pH 7,2) в течение 1 ч при комнатной температуре. После фиксации яйцеклетки инкубировали в течение 1 ч в 0,1 % растворе цитрата натрия, содержащем 0,5 % Тритона Х-100. Наличие признаков апоптоза ядерного материала в ооцитах оценивали методом TUNEL с использованием набора In Situ Cell Death Detection Kit, fluorescein («Roche Diagnostics», Швейцария) согласно инструкции компании-производителя. Затем ооциты окрашивали в течение 20 мин раствором DAPI (1 мкг/мл) с целью локализации хромосом, переносили на предметное стекло SuperFrostPlus («Thermo Scientific», США) и заключали в среду Vectashield («Vector Laboratories», Великобритания). Микрофотосъемку и оценку препаратов выполняли при увеличении ½400 под микроскопом Axio Imager.M2, оснащенным флуоресцентной приставкой, с использованием программы ZEN 2 pro («Carl Zeiss», Германия). Степень апоптоза в экспериментальных группах определяли по доле TUNEL-позитивных ооцитов (зеленая окраска MII хромосом) от общего числа ооцитов на стадии MII.
Опыты по культивированию ооцитов выполняли в 4-5 независимых повторностях, общее число ОКК в каждой экспериментальной группе — не менее 75 шт. Полученные данные обрабатывали методом однофакторного (one-way ANOVA) и двухфакторного (two-way ANOVA) дисперсионного анализа в программе SigmaStat («Systat Software, Inc.», США). Результаты представлены в виде средних ( M ) и стандартных ошибок средних (±SEM). Для оценки достоверности различий между сравниваемыми средними значениями использовали критерий Тьюки (Tukey’s test).
Результаты . Ранее мы разработали двухфазную систему для экстракорпорального дозревания ооцитов КРС, позволяющую повышать качество полученных in vitro поздних морул/бластоцист (20). Одной из причин, лежащих в основе такого улучшения, могло быть увеличение устойчивости созревших яйцеклеток к возрастным изменениям, снижающим их способность к эмбриональному развитию после оплодотворения (14). Кроме того, созревание ооцитов в двухфазной системе приводило к оптимизации профиля эстрадиола-17 β в культуральной среде, тогда как содержание в ней Р4 к концу второй фазы cозревания оставалось недостаточно высоким (20). В то же время роль эндогенного P4 как позитивного регулятора жизнеспособности ооцитов, очевидно, возрастает на завершающем этапе созревания яйцеклеток (17, 18).
В представленной работе с целью нормализации содержания Р4 на втором этапе созревания ооцитов мы добавляли в среду лютеотропные факторы (Р4 и два потенциальных стимулятора его продукции клетками кумулюса — ПРЛ и ЛГ). Для идентификации возможных путей влияния гормонов на компетенцию ооцитов к эмбриональному развитию в процессе пролонгированного культивирования исследовали возрастные изменения ооцитов коров, созревших в двухфазной системе.
Среда дозревания ооцитов
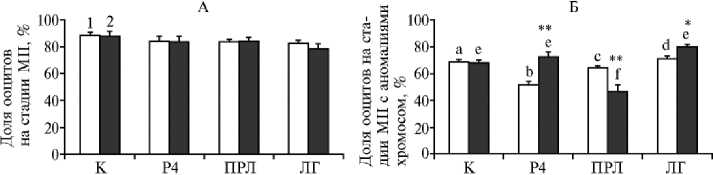
Рис. 1. Состояние хромосом в окруженных кумулюсом ооцитах коров после 12-часового дозревания при воздействии лютеотропных факторов в отсутствие (1) и в присутствии (2) клеток гранулезы и последующего старения в течение 24 ч: А — ядерное созревание ооцитов, Б — аномальные изменения хромосом на стадии метафазы II. К — контроль, P4 — прогестерон, ПРЛ — пролактин, ЛГ — лютеинизирующий гормон. Вертикальные отрезки — стандартные ошибки средних значений (±SEM). Число независимых экспериментов n = 4.
a, b; b, c; b, d; e, f Различия между сравниваемыми группами статистически значимы соответственно при p < 0,01; p < 0,05; p < 0,001 и p < 0,001.
*, ** Различия между системами 1 и 2 статистически значимы соответственно при p < 0,05 и p < 0,001 .
Цитогенетический анализ не выявил влияния лютеотропных факторов на завершение ядерного созревания ооцитов или на поддержание блокады мейоза в процессе последующего пролонгированного культивирования (рис. 1, А). Доля ооцитов, находящихся на стадии MII мейоза через 24 ч старения (рис. 2), была сходной во всех группах и составляла
78,2-88,4 % (см. рис. 1, А). Тем не менее, было обнаружено влияние Р4 и ПРЛ во время дозревания ооцитов на дальнейшее состояние хромосом в стадии MII (см. рис. 1, Б).
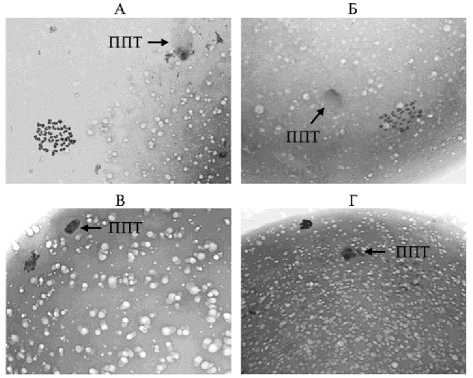
Рис. 2. Репрезентативные микрофотографии морфологии хромосом в ооцитах коров на стадии метафазы II (цитогенетические препараты): А — без признаков аномальных изменений, Б — деконденсация, В — деконденсация и частичное слипание, Г — образование единой комковатой массы. Стрелками отмечены первые полярные тельца (ППТ) (увеличение ½1000, микроскоп Axio Imager.M2, «Carl Zeiss», Германия).
В отсутствие клеток гранулезы воздействие Р4 на ооциты во вторую фазу созревания приводило к последующему уменьшению частоты деструктивных изменений хромосом в MII с 67,1±2,0 (контроль) до 51,2±2,9 % (p < 0,01), тогда как внесение этих клеток в культуральную систему устраняло позитивный эффект гормона (p < 0,001). Напротив, сходное влияние ПРЛ, снижающее долю стареющих яйцеклеток с аномальной морфологией хромосом в стадии MII с 67,7±1,6 (контроль) до 46,5±5,0 % (p < 0,001), было выявлено только в присутствии гранулезных клеток. В то же время ЛГ не влиял на деструктивные изменения хромосом в обеих системах.
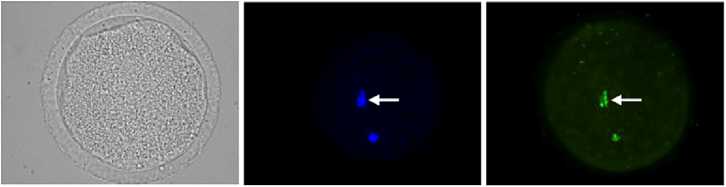
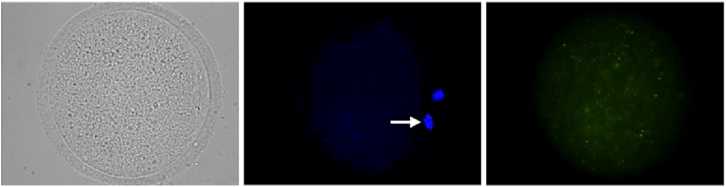
Рис. 3. Репрезентативные микрофотографии ооцитов коров с признаками апоптоза (верхний ряд) и без признаков апоптоза (нижний ряд) методом TUNEL: А, Г — морфология стареющих ооцитов; Б, Д — окраска ядерного материала ооцитов с помощью DAPI (синий цвет), хромосомы на стадии метафазы II отмечены стрелкой; В, Е — окраска ядерного материала ооцитов методом TUNEL (зеленый цвет), TUNEL-позитивные хромосомы на стадии MII отмечены стрелкой (увеличение ½400, микроскоп Axio Imager.M2, «Carl Zeiss», Германия).
Характер долговременного влияния Р4 на апоптоз в стареющих ооцитах (рис. 3, 4) был сходен с его воздействием на аномальные транс- формации хромосом в стадии MII. После дозревания в системе, не содержащей клеток гранулезы, и 24-часового пролонгированного культивирования частота апоптотической дегенерации оказалась самой низкой в группе ооцитов, подвергшихся обработке Р4 (17,6 против 23,5-25,2 % в остальных группах, p < 0,05). Клетки гранулезы не подавляли антиапоптотический эффект Р4 в отношении ооцитов, однако в присутствии таких клеток значительные различия наблюдались только между группами, дозревшими при добавлении в среду культивирования Р4 и ЛГ (18,3 против 26,6 %, p < 0,05). При этом ни ПРЛ, ни ЛГ не оказывал долговременного влияния на апопто-тическую дегенерацию стареющих ооцитов.
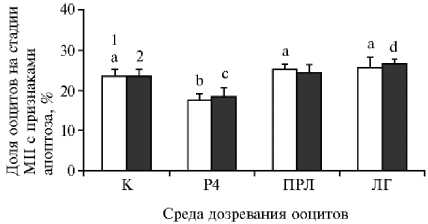
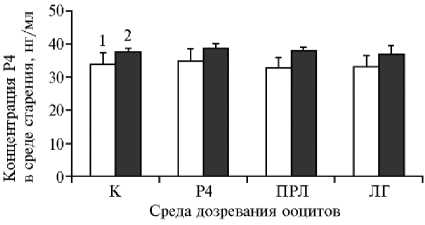
Рис. 4. Частота апоптотической дегенерации окруженных кумулюсом ооцитов коров после 12-часового дозревания при воздействии лютеотропных факторов в отсутствие (1) и в присутствии (2) клеток гранулезы и последующего старения в течение 24 ч. К — контроль, P4 — прогестерон, ПРЛ — пролактин, ЛГ — лютеинизирующий гормон. Вертикальные отрезки — стандартные ошибки средних значений (±SEM). Число независимых экспериментов n = 5.
-
a, b; c, d Различия между сравниваемыми
группами статистически значимы соответственно при p < 0,05 и p < 0,05.
Рис. 5. Концентрация прогестерона (P4) в среде старения окруженных кумулюсом ооцитов коров после дозревания под воздействием лютеотропных факторов в отсутствие (1) и в присутствии (2) клеток гранулезы. К — контроль, P4 — прогестерон, ПРЛ — пролактин, ЛГ — лютеинизирующий гормон. Вертикальные отрезки — стандартные ошибки средних (±SEM). Число независимых экспериментов n = 6.
Мы не обнаружили различий между всеми сравниваемыми группами по содержанию P4 в среде старения (рис. 5). Следовательно, воздействие лютеотропных факторов на ОКК во время второй фазы cозревания в системе in vitro не вызывало усиления секреции Р4 клетками кумулюса, окружающими стареющие ооциты. Влияние Р4 и ПРЛ в процессе созревания ооцитов на их устойчивость к возрастным изменениям не было связано со стимуляцией продукции эндогенного Р4 в ОКК во время старения.
В представленной работе нами впервые исследовано долговременное влияние Р4 и ПРЛ на ооциты коров во второй фазе cозревания in vitro. Ранее мы показали, что внесение ПРЛ в общепринятую однофазную систему IVM (то есть непосредственно перед началом созревания) не приводит к торможению деструктивных изменений хромосом на стадии MII в ооцитах при их последующем пролонгированном культивировании (22). Кроме того, в однофазной системе созревания экзогенный Р4 не усиливал способность ооцитов КРС к эмбриогенезу после оплодотворения in vitro (23). Хотя ЛГ рассматривается как общепризнанный стимулятор компетенции яйцеклеток к дальнейшему развитию и широко используется в рутинной практике IVM у КРС (1, 24, 25), в нашей двухфазной системе он не оказывал позитивного влияния на выход бластоцист (20). В настоящей работе ЛГ также не повышал устойчивость ооцитов коров к возрастным изменениям. То есть характер влияния Р4, ПРЛ и ЛГ на ооциты во время второй фазы созревания (то есть перехода от метафазы I к метафазе II) кардинально отличается от такового при воздействии на ооциты, блокированные на стадии диплотены. Полученные нами результаты согласуются с данными об особенностях регуляции созревания ооцитов мышей и свиней во время преобразования хромосом от стадии MI к стадии MII (26, 27).
Таким образом, воздействие прогестерона и пролактина на ооциты коров во время второй фазы созревания в предложенной нами двухфазной системе in vitro приводит к повышению их резистентности к последующим возрастным изменениям, которые снижают качество яйцеклеток и, как следствие, выход полноценных эмбрионов после оплодотворения. Следовательно, указанные гормоны могут быть использованы для оптимизации условий созревания ооцитов крупного рогатого скота в двухфазной системе.
Список литературы Устойчивость ооцитов коров к возрастным изменениям после воздействия лютеотропных факторов во вторую фазу культивирования до стадии метафазы II
- Moore S.G., Hasler J.F. A 100-year review: reproductive technologies in dairy science. J. Dairy Sci., 2017, 100(12): 10314-10331 ( ) DOI: 10.3168/jds.2017-13138
- Conti M., Franciosi F. Acquisition of oocyte competence to develop as an embryo: integrated nuclear and cytoplasmic events. Hum. Reprod. Update, 2018, 24(3): 245-266 ( ) DOI: 10.1093/humupd/dmx040
- Sutton M.L., Gilchrist R.B., Thompson J.G. Effects of in-vivo and in-vitro environments on the metabolism of the cumulus-oocyte complex and its influence on oocyte developmental capacity. Hum. Reprod. Update, 2003, 9(1): 35-48 ( ) DOI: 10.1093/humupd/dmg009
- Hansen P.J., Block J., Loureiro B., Bonilla L., Hendricks K.E. Effects of gamete source and culture conditions on the competence of in vitro-produced embryos for post-transfer survival in cattle. Reprod. Fert. Develop., 2010, 22(1): 59-66 ( ) DOI: 10.1071/RD09212
- Farin P.W., Piedrahita J.A., Farin C.E. Errors in development of fetuses and placentas from in vitro-produced bovine embryos. Theriogenology, 2006, 65(1): 178-191 ( ) DOI: 10.1016/j.theriogenology.2005.09.022
- Wrenzycki C., Stinshoff H. Maturation environment and impact on subsequent developmental competence of bovine oocytes. Reprod. Domest. Anim., 2013, 48(Suppl. 1): 38-43 ( )
- DOI: 10.1111/rda.12204
- Thompson J.G., Lane M., Gilchrist R.B. Metabolism of the bovine cumulus-oocyte complex and influence on subsequent developmental competence. Soc. Reprod. Fertil. Suppl., 2007, 64: 179-190.
- Sudiman J., Sutton-McDowall M.L., Ritter L.J., White M.A., Mottershead D.G., Thompson J.G., Gilchrist R.B. Bone morphogenetic protein 15 in the pro-mature complex form enhances bovine oocyte developmental competence. PLoS ONE, 2014, 9(7): e103563 ( )
- DOI: 10.1371/journal.pone.0103563
- Takahashi T., Igarashi H., Amita M., Hara S., Kurachi H. Cellular and molecular mechanisms of various types of oocyte aging. Reproductive Medicine and Biology, 2011, 10(4): 239-249 ( )
- DOI: 10.1007/s12522-011-0099-0
- Lebedeva I.Yu., Singina G.N., Lopukhov A.V., Zinovieva N.A. Dynamics of morphofunctional changes in aging bovine ova during prolonged culture in vitro. Cell and Tissue Biology, 2014, 8(3): 258-266 ( )
- DOI: 10.1134/S1990519X14030080
- Kong Q.Q., Wang J., Xiao B., Lin F.H., Zhu J., Sun G.Y., Luo M.J., Tan J.H. Cumulus cell-released tumor necrosis factor (TNF)-a promotes post-ovulatory aging of mouse oocytes. Aging (Albany NY), 2018, 10(7): 1745-1757 ( )
- DOI: 10.18632/aging.101507
- Liang X., Ma J., Schatten H., Sun Q. Epigenetic changes associated with oocyte aging. Science China Life Sciences, 2012, 55(8): 670-676 ( )
- DOI: 10.1007/s11427-012-4354-3
- Tarín J.J., Pérez-Albalá S., Pérez-Hoyos S., Cano A. Postovulatory aging of oocytes decreases reproductive fitness and longevity of offspring. Biol. Reprod., 2002, 66(2): 495-499 ( )
- DOI: 10.1095/biolreprod66.2.495
- Takahashi T., Igarashi H., Amita M., Hara S., Matsuo K., Kurachi H. Molecular mechanism of poor embryo development in postovulatory aged oocytes: mini review. J. Obstet. Gynaecol. Re., 2013, 39(10): 1431-1439 ( )
- DOI: 10.1111/jog.12111
- Lebedeva I.Y., Singina G.N., Shedova E.N., Taradajnic T.E., Zinovieva N.A. Progesterone is involved in anti-aging effects of prolactin on bovine cumulus-enclosed oocytes matured in vitro. Anim. Reprod., 2016, 13(3): 652.
- Bachelot A., Carré N., Mialon O., Matelot M., Servel N., Monget P., Ahtiainen P., Huhtaniemi I., Binart N. The permissive role of prolactin as a regulator of luteinizing hormone action in the female mouse ovary and extragonadal tumorigenesis. Am. J. Physiol.-Endoc. M., 2013, 305(7): E845-E852 ( )
- DOI: 10.1152/ajpendo.00243.2013
- Fair T., Lonergan P. The role of progesterone in oocyte acquisition of developmental competence. Reprod. Domest. Anim., 2012, 47(Suppl. 4): 142-147 ( )
- DOI: 10.1111/j.1439-0531.2012.02068.x
- Tosca L., Uzbekova S., Chabrolle C., Dupont J. Possible role of 5´AMP-activated protein kinase in the metformin-mediated arrest of bovine oocytes at the germinal vesicle stage during in vitro maturation. Biol. Reprod., 2007, 77(3): 452-465 ( )
- DOI: 10.1095/biolreprod.107.060848
- Nuttinck F., Marquant-Le Guienne B., Clément L., Reinaud P., Charpigny G., Grimard B. Expression of genes involved in prostaglandin E2 and progesterone production in bovine cumulus-oocyte complexes during in vitro maturation and fertilization. Reproduction, 2008, 135(5): 593-603 ( )
- DOI: 10.1530/REP-07-0453
- Singina G.N., Lebedeva I.Yu., Shedova E.N., Taradajnic T.E., Mityashova O.S., Tsyndrina E.V., Danch S.S. Bovine oocyte ability to embryonic development when maturing in different two-phase culture systems. Agricultural Biology, 2017, 52(4): 776-784 ( )
- DOI: 10.15389/agrobiology.2017.4.776eng
- Homa S.T. Effects of cyclic AMP on the spontaneous meiotic maturation of cumulus-free bovine oocytes cultured in chemically defined medium. J. Exp. Zool., 1988, 248(2): 222-231 ( )
- DOI: 10.1002/jez.1402480214
- Лебедева И.Ю., Сингина Г.Н., Лопухов А.В. Влияние пролактина на состояние метафазных хромосом при пролонгированном культивировании яйцеклеток коров. Цитология, 2013, 55(9): 643-644.
- Aparicio I.M., Garcia-Herreros M., O'Shea L.C., Hensey C., Lonergan P., Fair T. Expression, regulation, and function of progesterone receptors in bovine cumulus oocyte complexes during in vitro maturation. Biol. Reprod., 2011, 84(5): 910-921 ( )
- DOI: 10.1095/biolreprod.110.087411
- Sirard M.A. Somatic environment and germinal differentiation in antral follicle: the effect of FSH withdrawal and basal LH on oocyte competence acquisition in cattle. Theriogenology, 2016, 86(1): 54-61 ( )
- DOI: 10.1016/j.theriogenology.2016.04.018
- Xiao X., Zi X.D., Niu H.R., Xiong X.R., Zhong J.C., Li J., Wang L., Wang Y. Effect of addition of FSH, LH and proteasome inhibitor MG132 to in vitro maturation medium on the developmental competence of yak (Bos grunniens) oocytes. Reprod. Biol. Endocrinol., 2014, 12: 30 ( )
- DOI: 10.1186/1477-7827-12-30
- Kim Y., Kim E.Y., Seo Y.M., Yoon T.K., Lee W.S., Lee K.A. Function of the pentose phosphate pathway and its key enzyme, transketolase, in the regulation of the meiotic cell cycle in oocytes. Clin. Exp. Reprod. Med., 2012, 39(2): 58-67 ( )
- DOI: 10.5653/cerm.2012.39.2.58
- Zhang Z., Chen C., Ma L., Yu Q., Li S., Abbasi B., Yang J., Rui R., Ju S. Plk1 is essential for proper chromosome segregation during meiosis I/meiosis II transition in pig oocytes. Reprod. Biol. Endocrinol., 2017, 15(1): 69 ( )
- DOI: 10.1186/s12958-017-0289-7


