Утилизация нитрилов и амидов штаммом Rhodococcus erythropolis Е84
Автор: Демаков В.А., Максимов А.Ю., Кузнецова М.В., Овечкина Г.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 9, 2008 года.
Бесплатный доступ
Исследовано влияние ряда нитрилов и амидов карбоновых кислот на рост и каталитическую активность штамма Rhodococcus erythropolis E84 - продуцента фермента нитрилгидратазы. Показано, что насыщенные незамещенные алифатические нитрилы и амиды являются богатым источником углерода и азота, но их присутствие в среде культивирования не является строгим условием проявления нитрилгидратазной активности. Нитрилгидратаза штамма Е84 способна гидратировать алифатические и, в меньшей степени, ароматические нитрилы.
Короткий адрес: https://sciup.org/147204435
IDR: 147204435 | УДК: 579.222:579.873.6
Текст научной статьи Утилизация нитрилов и амидов штаммом Rhodococcus erythropolis Е84
Известны штаммы бактерий, обладающие способностью использовать нитрилы и амиды в качестве единственного источника углерода или азота, их относят к различным таксономическим группам, в частности к роду Rhodococcus (Bunch, 1998). Большой интерес к таким микроорганизмам, продуцирующим фермент нитрилгидратазу (КФ 4.2.1.84), обусловлен их практической значимостью для процессов биока-талитического синтеза акриламида и других амидов карбоновых кислот (Kobayashi et al., 1992; Mylerova, Martinkova, 2003). Штаммы–продуценты нитрилгид-ратазы различаются между собой условиями индукции этого фермента, а также спектром утилизируемых субстратов. Известно, что для индукции нит-рилгидратазы многих штаммов необходимо присутствие нитрилов и амидов (Астаурова и др., 1991, Kobayashi et al., 1992). В то же время описаны бактерии, активность нитрилгидратазы у которых не требует присутствия индуктора (Cowan et al. 1998; Максимов и др., 2004). Изучение влияния компонентов среды на экспрессию нитрилгидратазы у новых продуцентов может быть использовано для улучшения существующих технологий синтеза амидов карбоновых кислот и для получения новых химических продуктов.
Целью настоящей работы было изучение влияния нитрилов и амидов на рост и нитрилгидратаз-ную активность клеток R. erythropolis E84.
Материалы и методы исследования
Штамм R. erythropolis E84 выделен из загрязненной акрилонитрилом почвы методом накопительной культуры и последующей селекции, на- правленной на повышение нитрилгидратазной активности (Демаков и др., 2003).
В работе использованы нитрилы и амиды производства Sigma-Aldrich-Fluka: алифатические – ацетонитрил, акрилонитрил, бутиронитрил, лактонитрил (2-гидроксипропионитрил), 3-гидрокси-пропионитрил, изобутиронитрил, ацетамид, пропионамид, акриламид, бутирамид, изобутирамид, лактамид (2-гидроксипропионамид); метилацетамид; динитрилы и диамиды: адипонитрил, мало-нонитрил, адипамид и малонамид; ароматические – бензонитрил и бензамид; гетероциклические – 2-цианопиридин и 3-цианопиридин.
Клетки R. erythropolis E84 выращивали на синтетической среде N следующего состава (г/л): KH 2 PO 4 - 1.0; K2HPO 4 x 3H 2 O - 1.6; NaCl - 0.5; MgSO 4 x 7H 2 O - 0.5; CaCl 2 x 2H 2 O - 0.005; Fe-SO 4 X 7H 2 O - 0.01; COCI 2 X 6H 2 O - 0.01; pH 7.2-7.4 В качестве источника углерода использовали глюкозу в концентрации 0.1%, а в качестве источника азота – хлористый аммоний в концентрации 5 мМ либо другие субстраты, соответствующие условиям эксперимента.
Нитрилгидратазную активность клеток R. erythropolis E84 оценивали по изменению концентрации нитрила и амида в реакционной среде в течение 10 мин. трансформации. Удельную активность фермента определяли как количество амида в мкмоль, образуемое за 1 мин. биомассой, соответствующей 1 мг сухого веса клеток. Единица нитрилгидратазной активности (1 ЕД) соответствует 1 мкмоль амида x мг сухих клеток-1 x мин-1.
Трансформацию нитрилов с использованием биомассы штамма R. erythropolis E84 проводили в 10 мМ калий-фосфатном буфере, pH 7.5 при начальной концентрации нитрила, равную 5%. Реак-
цию останавливали добавлением HCl до концентрации 2%. Пробы анализировали на газовом хроматографе Chrom 5 с пламенно-ионизационным детектором и стальной колонкой длиной 2 м, заполненной «Полисорб-1», фракция 0.25–0.5. В качестве стандартов использовали растворы чистых нитрилов, амидов и карбоновых кислот. Концентрации алифатических амидов измеряли также по разности оптической плотности (ОП) реакционной среды при 240 нм (Максимов и др., 2003).
Плотность культуры бактерий оценивали по оптической плотности клеточной суспензии при 540 нм с учетом разведения. Одна единица ОП540 соответствует 0.42 мг сухого веса клеток.
Минимальную ингибирующую концентрацию нитрилов и амидов определяли в суспензионном тесте на 96-луночных планшетах. Для этого в ряды лунок планшета последовательно вносили серийные двукратные разведения нитрилов и амидов в свежей питательной среде в диапазоне концентраций от 1 до 100 г/л. В каждую лунку добавляли свежевыращенную культуру R. erythropolis E84 до концентрации 105 кл/мл. В отдельных лунках проводили контроль роста культуры и контроль стерильности среды.
Для оценки степени индукции нитрилгидрата-зы клетки R. erythropolis E84 выращивали в колбах Эрленмейера на синтетической среде с 5 мМ сульфатом аммония и 0.1% глюкозой в течение 48 час. После этого добавляли нитрилы или амиды в концентрации 10 мМ. Активность ферментов была измерена после 4 час. инкубации.
Концентрацию белка оценивали по методу Лоури, а также по соотношению оптической плотности при 280 и 235 нм (Whitaker, Granum, 1980).
Результаты исследования и их обсуждение
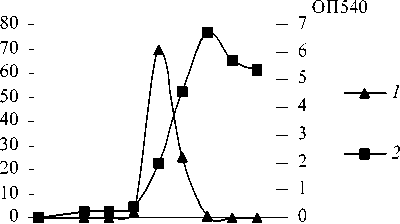
Для определения зависимости нитрилгидратаз-ной активности от фазы роста клетки R. erythropolis E84 выращивали в течение 60 час. на среде N, содержащей глюкозу в концентрации 0.1% и ацетонитрил в концентрации 15 мМ. В данных условиях максимальная нитрилгидратаз-ная активность культуры R. erythropolis E84 проявлялась в первой трети экспоненциальной фазы роста и достигала 70 ЕД. К середине логарифмической фазы нитрилгидратазная активность снижалась в два раза, а при выходе культуры на стационарную фазу, падала до нуля (рис. 1).
Таким образом, экспрессия нитрилгидратазы R. erythropolis E84 происходила только в определенный период экспоненциальной фазы роста. Это позволяет предположить, что данный фермент является индуцибельным, как и нитрилгидратазы ряда других штаммов, но его выражение подвержено более жесткой метаболической регуляции, чем активность нитрилгидратазы штамма R. ruber gt1 (Максимов и др., 2003).
0 12 24 36 48 60
ч
Рис. 1. Зависимость нитрилгидратазной активности клеток R . erythropolis 84 от фазы роста. 1 – нитрилгидратаз-ная активность; 2 – плотность культуры
Исследована способность бактерий к утилизации ряда нитрилов и амидов: а) как единственного источника углерода на среде, содержащей 5 мМ аммония; б) как единственного источника азота на среде, содержащей 0.1% глюкозы; в) в качестве единственного источника углерода и азота.
В условиях эксперимента линейные алифатические нитрилы и амиды оказались хорошими источниками углерода и/или азота для штамма R. erythropolis E84 (табл. 1). Изобутиронитрил также использовался в качестве источника углерода или азота, но скорость роста на нем была меньше, чем на линейных алифатических нитрилах. Акрилонитрил, акриламид и адиподинитрил являлись хорошими источниками азота, но не усваивались как источник углерода. В отличие от адиподинитрила короткоцепочечный динитрил – мало-нонитрил использовался клетками во всех вариантах эксперимента.
Лактонитрил и бензонитрил в концентрации 5 мМ не поддерживали рост штамма R. erythro-polis E84. При этом лактамид был хорошим ростовым субстратом во всех вариантах эксперимента, а бензамид обеспечивал быстрый рост как источник азота. N-метилацетамид использовался в качестве источника углерода, но слабо поддерживал рост бактерий на безазотной среде.
Для проверки возможного ингибирующего действия нитрилы и амиды были добавлены в концентрации 20 мМ в среду N, содержащую 0.1% глюкозу и 5 мМ сульфат аммония. В этих условиях подавляли рост только лактонитрил и 2-циано-пиридин.
Таблица 1
Рост штамма R. erythropolis E84 на нитрилах и амидах
|
Нитрил / амид |
мМ |
Источник азота и углерода1 |
Источник азота2 |
Источник углерода3 |
|
Ацетонитрил |
10 |
++ |
++ |
++ |
|
Пропионитрил |
10 |
++ |
++ |
++ |
|
Бутиронитрил |
10 |
++ |
++ |
++ |
|
Изобутиронитрил |
10 |
+ |
++ |
+ |
|
3-ОН-пропионитрил |
10 |
+ |
++ |
+ |
|
2-цианопиридин |
10 |
– |
± |
– |
|
Акрилонитрил |
5 |
– |
++ |
– |
|
Адипонитрил |
5 |
– |
++ |
– |
|
Малононитрил |
5 |
+ |
++ |
++ |
|
Бензонитрил |
5 |
– |
– |
– |
|
Лактонитрил |
5 |
– |
– |
– |
|
Ацетамид |
10 |
++ |
++ |
++ |
|
Акриламид |
10 |
– |
++ |
– |
|
Пропионамид |
10 |
++ |
++ |
++ |
|
Бутирамид |
10 |
++ |
++ |
++ |
|
Изобутирамид |
10 |
++ |
++ |
++ |
|
Метилацетамид |
10 |
± |
± |
++ |
|
Лактамид |
10 |
++ |
++ |
++ |
|
Бензамид |
10 |
– |
++ |
± |
|
*1 среда N, 2 среда N, 0.1% глюкоза, 3 среда N, 5 мМ NH 4 Cl; ++ ОП540 > 0.5 через 48 часов; + ОП540 > 0.5 на 5 сутки; |
||||
± ОП 540 > 0.5 на 8 сутки; - отсутствие роста на 10 сутки.
Определены минимальные ингибирующие концентрации ряда нитрилов и амидов, влияющие на рост клеток R. erythropolis E84 (табл. 2).
Таблица 2
Минимальная ингибирующая концентрация (МИК) нитрила и амида для клеток
R. erythropolis E84
|
Нитрил |
МИК, г/л |
Амид |
МИК, г/л |
|
Ацетонитрил |
50.0 |
Ацетамид |
60.0 |
|
Акрилонитрил |
2.5 |
Акриламид |
2.5 |
|
Пропионитрил |
20.0 |
Пропионамид |
30.0 |
|
Бутиронитрил |
5.0 |
Бутирамид |
30.0 |
|
Изобутиронитрил |
10.0 |
Изобутирамид |
30.0 |
|
Лактонитрил |
1.5 |
Лактамид |
60.0 |
|
Малононитрил |
2.5 |
Малонамид |
2.5 |
|
Бензонитрил |
2.5 |
Бензамид |
15.0 |
|
Адипонитрил |
5.0 |
Метилацетамид |
30.0 |
|
3-Цианопиридин |
2.0 |
Тиоацетамид |
2.5 |
|
3-ОН-пропионитрил |
20.0 |
Выявлено, что нитрилы в целом более токсичны для штамма R. erythropolis E84, чем соответствующие амиды. Ингибирующее рост бактерий действие уменьшалось в ряду нитрилов: лактонитрил = акрилонитрил = малононитрил = бензонитрил = 2-цианопиридин > адипонитрил = бутиронитрил > изобутиронитрил > 3-гидроксипропио-нитрил = пропионитрил > ацетонитрил. Из амидов существенно подавляли рост только малонамид, акриламид и тиоацетамид.
Влияние концентрации ацетонитрила на рост и нитрилгидратазную активность R. erythropolis E84
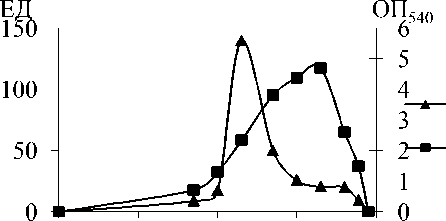
Клетки R. erythropolis E84 выращивали на среде, содержащей в качестве единственного источника углерода и азота ацетонитрил в ряде концентраций от 0.1 мМ до 1 М.
1,0E-011,0E+001,0E+011,0E+021,0E+03
Концентрация ацетонитрила,
Рис. 2. Влияние концентрации ацетонитрила на рост и нитрилгидратазную активность R . erythropolis 84: 1 – нит-рилгидратазная активность; 2 – плотность культуры
В этих условиях при интервале концентрации ацетонитрила от 5 до 20 мМ наблюдалось повышение нитрилгидратазной активности и плотности культуры (рис. 2). Максимальная активность, достигающая 140 ЕД, наблюдалась в варианте опыта, содержащем 20 мМ ацетонитрила. Максимальная плотность культуры (ОП 540 ) при этом составляла 2.3. При повышении концентрации ацетонитрила до 50 мМ активность нитрилгидратазы уменьшалась в 3 раза, а оптическая плотность возрастала до 3.8. Максимальный выход культуры наблюдался в варианте, содержащем 200 мМ ацетонитрила. При дальнейшем повышении концентрации ацетонитрила нитрилгидратазная активность, скорость роста культуры и ее выход с единицы объема среды пропорционально снижались. При концентрации ацетонитрила 800 мМ рост отсутствовал. Таким образом, оптимальной для экспрессии нитрил-гидратазы является концентрация ацетонитрила около 20 мМ.
Исследовано действие ряда нитрилов и амидов в качестве индукторов нитрилгидратазы. Как видно из табл. 3, уровень активности нитрилгидрата-зы штамма R. erythropolis E84 значительно возрастает после внесения в среду алифатических нитрилов или амидов.
При этом способность усиливать нитрилгидра-тазную активность культуры в рядах ацетонитрил – пропионитрил – бутиронитрил – валеронитрил и ацетамид – пропионамид – бутирамид снижалась с увеличением углеводородной цепи.
Максимальная индукция нитрилгидратазы наблюдалась в присутствии адипонитрила, метил- ацетамида и ацетамида. Лактонитрил, акриламид, бензонитрил и бензамид вызывали снижение активности фермента. Следует отметить, что высокий уровень нитрилгидратазной активности клеток R. erythropolis E84 наблюдался и в отсутствие нитрилов или амидов. Следовательно, присутствие нитрила или амида не является обязательным условием экспрессии нитрилгидратазы у R. erythr-opolis E84, как это описано для штамма R. rho-dochrous J1 (Nagasawa et al., 1998), а уровень активности фермента в большей степени зависит от обеспеченности клетки источником углерода и азота.
Таблица 3
Влияние нитрилов и амидов на индукцию нитрилгидратазной активности клеток R. erythropolis E84
|
Нитрил / амид |
Удельная активность, ЕД |
|
Контроль (среда без индуктора) |
92 |
|
Ацетонитрил |
185 |
|
Пропионитрил |
144 |
|
Бутиронитрил |
125 |
|
Валеронитрил |
117 |
|
Акрилонитрил |
142 |
|
Изобутиронитрил |
97 |
|
3-гидроксипропионитрил |
110 |
|
Лактонитрил |
29 |
|
Адипонитрил |
273 |
|
Бензонитрил |
47 |
|
Ацетамид |
214 |
|
Пропионамид |
153 |
|
Бутирамид |
132 |
|
Изобутирамид |
100 |
|
Метилацетамид |
244 |
|
Акриламид |
22 |
|
Лактамид |
85 |
|
Бензамид |
39 |
Была определена субстратная специфичность нитрилгидратазы штамма R. erythropolis E84. Результаты представлены в табл. 4.
В качестве субстратов нитрилгидратазы исследуемого штамма были проверены предельные и непредельные алифатические нитрилы, в том числе гидрокси- и динитрилы, гетероциклические, ароматические нитрилы.
Наилучшим субстратом для нитрилгидратазы был ацетонитрил, имеющий самую короткую углеродную цепь. Хорошо гидратировались предельные алифатические нитрилы – пропионитрил и бутиронитрил. Длинноцепочечный динитрил – адипонитрил конвертировался клетками R. erythro-polis Е84 в 6 раз быстрее короткоцепочечного ма-лонодинитрила. Присутствие гидроксильной или метильной группы в молекулах нитрилов в значительной степени снижало скорость гидратации. Например, гидратация лактонитрила составила только 6% от скорости конверсии ацетонитрила. В качестве субстратов для нитрилгидратазы штамма R. erythropolis Е84 были мало эффективны бензонитрил и 3-цианопиридин.
Таблица 4
Субстратная специфичность нитрилгидратазы штамма R. erythropolis E84
|
Субстрат, 100 мМ |
Активность, % |
|
Ацетонитрил |
100.0 |
|
Пропионитрил |
34.1 |
|
Бутиронитрил |
50.4 |
|
Изобутиронитрил |
17.5 |
|
Акрилонитрил |
26.3 |
|
Лактонитрил |
6.3 |
|
Адипонитрил |
48.5 |
|
Малонодинитрил |
8.3 |
|
Бензонитрил |
0.8 |
|
3-цианопиридин |
1.6 |
*За 100 % принимали удельную активность нитрил-гидратазы по отношению к ацетонитрилу.
Работа выполнена при поддержке грантов РФФИ №07-04-96071 и №07-04-97617, программы Президиума РАН «Биоразнообразие и генетика генофондов», программы Отделения биологических наук РАН «Фундаментальные основы управления биологическими ресурсами».
Список литературы Утилизация нитрилов и амидов штаммом Rhodococcus erythropolis Е84
- Астаурова, О.Б. Регуляция биосинтеза ферментов биодеградации нитрилов у Rhodococcus rhodochrous М0/О.Б. Астаурова, Т.Е. Погорелова, О.Р. Фомина, и др.//Биотехнология. 1991. № 5. С. 10-14.
- Максимов, А.Ю. Влияние нитрилов и амидов на рост и нитрилгидратазную активность штамма Rhodococcus sp. gt1/А.Ю. Максимов, М.В. Кузнецова, Г.В. Овечкина и др.//Прикладная биохимия и микробиология. 2003. Т. 39, № 1. С. 63-68.
- Штамм бактерий Rhodococcus erythropolis -продуцент нитрилгидратазы: пат. 2196822 Рос. Федерация/В.А.Демаков, А.Ю. Максимов,М.В. Кузнецова, Г.В. Овечкина, С.В. Козлов,Н.Б. Ремезовская, Ю.Г. Максимова. № 2001120750; заявл. 25.07.2001; опубл.. 20.01.2003.
- Bunch, A.W. Biotransformation of nitriles by rhodococci//Antonie van Leeuwenhoek. 1998. Vol. 74. P. 89-97.
- Cowan, D. Biochemistry and biotechnology of mesophilic and thermophilic nitrile metabolizing enzymes/Cowan D., R. Cramp, R. Pereira et al.//Extremophiles. 1998. Vol. 2. P. 207-216.
- Kobayashi, M. Enzymatic synthesis of acrylamide: a success story not yet over…/M. Kobayashi, T. Nagasawa, H. Yamada//Trends in Biotechnol. 1992. Vol. 10. Р. 402-408.
- Mylerova, V. Synthetic application of nitrileconverting enzymes/V. Mylerova, L. Martinkova//Curr. Org. Chem. 2003. Vol. 7. P. 1-17.
- Nagasawa, T. Occurrence of a cobalt-induced and cobalt containing nitrile hydratase in Rhodococcus rhodochrous J1/T. Nagasawa, K. Takeuchi, H. Yamada//Biochim. Biophys. Res. Commun. 1988. Vol. 155. P. 1008-1016.
- Whitaker, J.R. An absolute method for protein determination based on difference in absorbance at 235 and 280 nm/J.R. Whitaker, P.E. Granum//Anal Biochem. 1980. Vol. 109(1). P. 156-159.


