Утилизация печенью пентагастрина под влиянием трипсина и гексапептида- SLIGRL
Автор: Жураева Мохигул Азимджановна, Алейник Владимир Алексеевич, Бабич Светлана Михайловна, Зулунова Икболой Бахтияровна, Легкоев Александр Юрьевич
Журнал: Re-health journal @re-health
Рубрика: Патофизиология
Статья в выпуске: 1 (5), 2020 года.
Бесплатный доступ
Изучали влияние трипсина и гексапептида- SLIGRL, на утилизацию печенью пентагастрина по изменению желудочной секреции. Исследованияпроведены на 56 крысах в 8 сериях, по 7 острых экспериментов в каждой серии. Сделаны выводы, что у крыс печень утилизирует короткоцепочный пептид пентагастрин. Трипсин, также как агонист PAR-2 рецепторов гексапептид-SLIGRL, незначительно увеличивает секреторную активность желудка при введении в периферическую вену и существенно при введении в портальную вену, что указывает на возможность трипсина за счет PAR-2 печени снижать способность печени утилизировать короткоцепочный пептид пентагастрин.
Трипсин, гексапептид - sligrl, печень, пентагастрин, par-2 рецепторы, желудочная секреция
Короткий адрес: https://sciup.org/14125398
IDR: 14125398 | DOI: 10.24411/2181-0443/2020-10020
Текст научной статьи Утилизация печенью пентагастрина под влиянием трипсина и гексапептида- SLIGRL
Введение. В настоящее время в связи с открытием протеазо-активируемых рецепторов, высказывается мнение, что панкреатические протеазы не следует рассматривать только с традиционной точки зрения как пищеварительные ферменты, но дополнительно в качестве сигнальных молекул. Которые активно участвуют в спектре физиологических и патологических состояний, как желудочнокишечного тракта, так и других систем организма. Предлагается протеазы в целом теперь рассматривать как гормоны, а формирование в связи с этим новых сигнальных путей, как новых механизмов регуляции в физиологических условиях или новых патогенетических звеньев в условиях патологии. [1].
В связи с появившимся в последние годы большим количеством работ о рецепторах активируемых протеазами 2 типа (PAR-2). Все большую актуальность приобретает изучение панкреатических протеаз, инкретируемых пищеварительными железами в кровь, так как являются агонистами этих рецепторов. PAR-2 расположены на клеточных мембранах различных органов и тканей, через которые может осуществляться усиление или снижение функциональной активности этих органов и тканей организма под влиянием панкреатических протеаз [2, 3].
Ранее в работах нашей лаборатории было показано участие печени в утилизации короткоцепочных пептидных регуляторов (пентагастрина, лейэнкефалина и ХЦК-8), что может рассматриваться как дополнительный модифицирующий фактор в пептидергических механизмах регуляции пищеварительных желез [4]. Так же в нашей лаборатории было установлено, что под влиянием внутрипортального введения трипсина увеличивается ферментовыделительная деятельность желудочных желез, за счет уменьшения утилизации печенью пентагастрина, вводимого внутри портально. Нами сделано предположение, что эти эффекты реализуются через PAR-2 [5].
Показано, что у человека PAR-2 представляет собой рецептор, связанный с G-белком, активируемый сериновыми протеазами, которые расщепляют его N-конец, и синтетическими пептидами, соответствующими новому N-концу. Пептидные агонисты широко используются для характеристики физиологической роли для PAR-2 [6].
Синтетические агонисты и антагонисты являются ценным инструментом для исследования функций PAR2 in vivo. Большинство лигандов к настоящему времени используемых для оценки биологии PAR-2 были пептиды. Синтетический гексапептид - SLIGRL (последовательность серина, лейцина, изолейцина, глицина, аргинина, лейцина), является более сильным, чем другие аминокислотные последовательности, и был наиболее широко используемым пептидным агонистом [7].
Предполагается, что активация эндотелиального PAR-2 триптазой тучных клеток или другими протеазами способствует воспалительным реакциям. Многие исследования связывают PAR-2 с воспалительными состояниями (артрит, воспаление дыхательных путей, IBD) и ключевыми событиями в развитии опухоли (ангиогенез, метастазирование), они в значительной степени полагаются на использование отдельных агонистов для определения физиологических ролей для PAR-2 [8].
Для нас представляло интерес изучить в сравнительном плане, изменение утилизации печенью пентагастрина под влиянием трипсина и отдельно гексапептида – SLIGRL (гексапептид), как агонистов PAR-2 по изменению желудочной секреции. При введении их в портальную и периферическую вены. С целью подтверждения эффектов трипсина реализуемых через PAR-2 печени на уменьшение утилизации печенью пентагастрина.
Цель исследования: Изучить влияние трипсина и гексапептида- SLIGRL, на утилизацию печенью пентагастрина по изменению желудочной секреции.
Материал и методы исследования. Исследования проведены на 56 крысах в 8 сериях, по 7 острых экспериментов в каждой серии. Изучали изменение желудочной секреции: в 1 серии (контрольная) при введении в портальную вену 0,3 мл физиологического раствора, во 2 серии (контрольная) при введении в периферическую вену 0,3 мл физиологического раствора. В 3 серии (опытная) вводили в портальную вену короткоцепочный пептид - пентагастрин (Г-5) 0,1 мкг/кг в 0,3 мл физиологического раствора, в 4 серии (опытная) - в периферическую вену вводили пентагастрин (Г-5) 0,1 мкг/кг в 0,3 мл физиологического раствора. В 5 серии (опытная) вводили совместно в портальную вену пентагастрин (Г-5) 0,1 мкг/кг и гексапептид 50 мкг/кг в 0,3 мл физиологического раствора, в 6 серии (опытная) вводили в периферическую вену пентагастрин (Г-5) 0,1 мкг/кг и гексапептид 50 мкг/кг в 0,3 мл физиологического раствора. В 7 серии (опытная) вводили совместно в портальную вену пентагастрин (Г-5) 0,1 мкг/кг и трипсин в дозе (300 мкг/кг) в 0,3 мл физиологического раствора. В 8 серии (опытная) вводили совместно в периферическую вену пентагастрин (Г-5) 0,1 мкг/кг и трипсин в дозе (300 мкг/кг) в 0,3 мл физиологического раствора.
В составе желудочного перфузата определяли: выделение протеаз по общей протеолитической активности (ОПА) спектрофотометрическим методом [10,11], дебит соляной кислоты титрованием перфузата NaOH [10, 11].
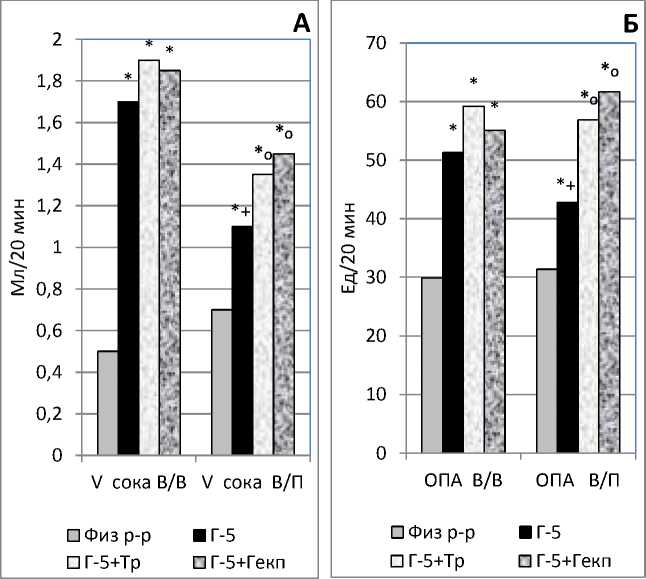
Результаты и их обсуждение. Результаты экспериментов на крысах показали, что объем выделяемого желудочного сока под влиянием Г-5, введенного как в периферическую вену, так и портальную вену, был достоверно выше, таковых показателей после введения физиологического раствора. При этом показатели объема под влиянием Г-5, введенного в портальную вену, были достоверно ниже показателей при введении в периферическую вену. Подобная направленность наблюдалась и под влиянием совместно трипсина и Г-5. Отмечалось достоверное увеличение показателей объем при введении, как в периферическую, так и в портальную вену, по отношению к показателям с введением физиологического раствора, и не достоверное увеличение показателей объем при введении в периферическую вену и достоверное в портальную вену по отношению с введением только пентагастрина. Похожая направленность эффектов наблюдалась, под влиянием совместно гексапептида и Г-5, по отношению к показателям с введением как физиологического раствор, так и пентагастрина (рис. А).
Под влиянием Г-5, введенного как в периферическую вену, так и в портальную вену, показатели ОПА были достоверно выше, чем таковые показатели после введения физиологического раствора. При этом показатели ОПА под влиянием Г-5, введенного в портальную вену, были недостоверно ниже показателей при введении в периферическую вену. В тоже время под влиянием совместно трипсина и Г-5 отмечалось недостоверное увеличение показателей при введении в периферическую вену и достоверное увеличение при введении в портальную вену, по отношению к показателям с введением только пентагастрина. Под влиянием совместно гексапептида и Г-5 также отмечалось недостоверное увеличение показателей при введении в периферическую вену и достоверное увеличение при введении в портальную вену, по отношению к показателям с введением только пентагастрина. (рис. Б).
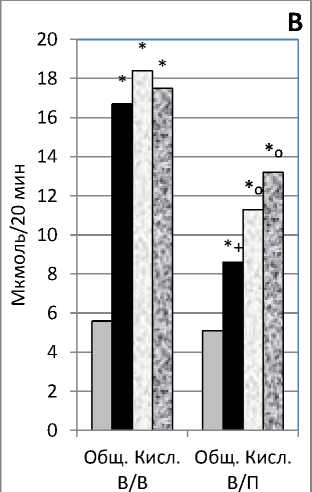
Показатели общей кислотности желудочного сока имели закономерности, отмеченные по выделению объема желудочного сока и ОПА. Под влиянием Г-5, введенного как в периферическую вену, так и портальную вену, показатели общей кислотности желудочного сока ОПА были достоверно выше, показателей после введения физиологического раствора. При этом показатели под влиянием Г-5, введенного в портальную вену, были достоверно ниже показателей при введении в периферическую вену. В тоже время под влиянием совместно трипсина и Г-5
отмечалось достоверное увеличение показателей, как при введении в периферическую вену, так при введении в портальную вену. Подобная направленность наблюдалась и под влиянием совместно гексапептида и Г-5, отмечалось недостоверное увеличение показателей при введении в периферическую вену и достоверное увеличение при введении в портальную вену, по отношению к показателям с введением только пентагастрина. (рис. В).
Физ р-р Г-5
Г-5+Тр Г-5+Гекп
Рисунок. Изменение показателей желудочной секреции у крыс, при введении в периферическую вену (В/В) и в портальную вену (В/П) физиологического раствора (физ р-р), пентагастрина (Г-5), совместно трипсина (Тр) и Г-5, а также совместно гексапептида (Гекп) и Г-5.
-
* - достоверно отличающиеся величины относительно показателей с
введением физиологического раствора.
-
о - достоверно отличающиеся величины относительно показателей с
введением пентагастрина.
-
+ - достоверно отличающиеся величины относительно показателей с
введением пентагастрина в периферическую вену.
Представленные данные показывают, что введение пентагастрина, как в периферическую, так и портальную вену вызывало достоверное увеличение всех учитываемых показателей по отношению к таковым показателям с введением физиологического раствора. При этом все показатели под влиянием пентагастрина, введенного в портальную вену, были достоверно ниже показателей при введении в периферическую вену. Эти результаты свидетельствуют, что при прохождении через печень короткоцепочного пептида пентагастрина происходит значительное снижение всех учитываемых показателей, что указывает на значительную утилизацию печенью пентагастрина.
Список литературы Утилизация печенью пентагастрина под влиянием трипсина и гексапептида- SLIGRL
- Ramachandran R., Hollenberg M.D. Proteinases and signaling: pathophysiological and therapeutic implications via PARs and more. Br. J. Pharmacol 2008, vol. 153, pp. 263-282.
- Kawabata A., Matsunami M., Sekiguchi F. Gastrointestinal roles for proteinase-activated receptors in health and disease. Review. Br. J. Pharmacol, 2008,vol. 153, pp. 230-240.
- Adams, M. N., Ramachandran, R., Yau, M. K., Suen, J. Y., Fairlie, D. P., Hollenberg, M. D., & Hooper, J. D. Structure, function and pathophysiology of protease activated receptors. Pharmacology & therapeutics, 2011, vol. 130, no 3, pp. 248-282.
- Бабич С.М., Алейник В.А. Изменение желудочной секреции при введении в периферическую и портальную вены пентагастрина и лей-энкефалинаю. Журнал Врач-аспирант (Воронеж) 2010;5,2 (42):252-257.
- Бабич С.М., Алейник В.А. Участие трипсина в утилизации пентагастрина в печени. Инфекция, иммунитетифармакология 2016;3:46-49.


