Валидация ИФА-набора для обнаружения антител к вирусу африканской чумы свиней в крови и селезенке домашних свиней и диких кабанов
Автор: Стрижакова О.М., Лыска В.М., Малоголовкин А.С., Новикова М.Б., Сидлик М.В., Ногина И.В., Шкаев А.Э., Балашова Е.А., Куриннов В.В., Васильев А.П.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Африканская чума свиней: протеомика, диагностика
Статья в выпуске: 6 т.51, 2016 года.
Бесплатный доступ
Особенности протекания африканской чумы свиней (АЧС, возбудитель - ДНК-со-держащий вирус семейства Asfarviridae, поражает как диких кабанов Sus scrofa, так и домашних свиней Sus scrofa domestica ) и ее формы следует учитывать для эффективного использования различных методов диагностики АЧС, направленных на выявление возбудителя или специфических антител. Особенно важна диагностика АЧС у диких кабанов. Восприимчивость к вирусу АЧС дикого кабана хорошо известна, заболевание неоднократно воспроизводилось в эксперименте, а также было установлено в естественных условиях у дикого европейского кабана. При отстреле диких кабанов очень часто в лаборатории доставляются только пробы органов, поэтому мы приняли решение изучить диагностическое значение антител, выявленных в тканях, и определить эффективность применения разработанной ранее тест-системы при таких исследованиях. В статье представлены результаты валидации непрямого варианта ИФА (коммерческий набор «ВНИИВВиМ АЧС-ИФА Ат/Аг») для обнаружения специфических антител против вируса АЧС в сыворотках крови и экстрактах тканей селезенки. В качестве метода сравнения использовали реакцию непрямой иммунофлуоресценции (РНИФ). Для оценки полученных данных применили ROC-анализ. Тестирование с помощью непрямого ИФА положительных ( n = 66) и отрицательных ( n = 410) проб сывороток крови свиней показало высокую чувствительность и специфичность ИФА относительно РНИФ. Из 476 проб сывороток, исследованных методом непрямого ИФА, только 8 (1,6 %) попали в область положительной/отрицательной отсечки. Самые высокие показатели чувствительности (100 %) и специфичности (99,27 %) непрямого ИФА при исследовании сывороток крови от домашних свиней и диких кабанов установлены при величине отсечки 0,264. Пробы экстрактов селезенки были отобраны после отстрела клинически здоровых диких кабанов из неблагополучной по АЧС Смоленской области (2013-2014 годы). С учетом характера течения острой формы болезни мы можем предположить у положительно реагировавших животных состояние, соответствующее инкубационному периоду развития патологии. При тестировании положительных ( n = 59) и отрицательных ( n = 678) проб экстрактов ткани селезенки мы также установили высокую чувствительность и специфичность непрямого ИФА относительно РНИФ. Из проверенных проб ( n = 737) 10 проб (1,3 %) попали в область положительной/отрицательной отсечки. Самая высокая чувствительность (100 %) и специфичность (98,82 %) установлены при величине отсечки 0,284. Таким образом, тестовый набор показал хорошие результаты при исследовании сывороток крови свиней - чувствительность 100 % (94,6-100 %) и специфичность 99,27 % (97,90-99,80 %), при исследовании проб экстрактов ткани селезенки - чувствительность 100 % (93,90-100 %), специфичность 98,82 % (97,70-99,50 %).
Африканская чума свиней, специфические антитела, непрямой ифа, roc-анализ
Короткий адрес: https://sciup.org/142213988
IDR: 142213988 | УДК: 619:616.98:578.842.1:57.083.3 | DOI: 10.15389/agrobiology.2016.6.845rus
Текст научной статьи Валидация ИФА-набора для обнаружения антител к вирусу африканской чумы свиней в крови и селезенке домашних свиней и диких кабанов
Африканская чума свиней (АЧС) — высококонтагиозная болезнь с 100 % летальности при остром течении, приводящая к существенным экономическим потерям (1). Характеризуется лихорадкой, геморрагическим диатезом и некродистрофическими изменениями паренхиматозных органов (2-5). Возбудитель АЧС — ДНК-содержащий вирус семейства Asfar-viridae (6). Различают сверхострое, острое, подострое, хроническое и латентное течение болезни (7-9). Особенности протекания АЧС и ее формы следует учитывать для эффективного использования различных методов диагностики АЧС (10), направленных на выявление возбудителя или специфических антител. При сверхострой и острой формах выявление вирусоспецифических антител возможно только в пробах селезенки, так как специфические продуцирующие антитела клетки и, следовательно, сами антитела появляются там на 2-3-е сут после инфицирования, в то время как животные гибнут уже на 3-7-е сут (11, 12). При подостром и хрониче-845
ском течении болезни вирусоспецифические антитела в крови обнаруживаются на 7-10-е сут (13-16), до того времени целесообразно проводить выявление вирусного антигена или генома в крови (17), так как этот период течения АЧС характеризуется виремией (17-19).
Диагностика АЧС у диких кабанов особенно важна, поскольку их восприимчивость к вирусу АЧС хорошо известна. Заболевание неоднократно воспроизводилось в эксперименте, а также было установлено в естественных условиях у дикого европейского кабана (20).
В Российской Федерации АЧС циркулирует с ноября 2007 года по настоящее время в популяциях домашних свиней ( Sus scrofa domestica ) и диких кабанов ( Sus scrofa ). Поскольку высокая вирулентность вируса АЧС, циркулирующего в РФ (21), и, соответственно, острое течение болезни доказаны, основное значение в схеме лабораторной диагностики приобрели методы прямого обнаружения вируса — полимеразная цепная реакция и реакция прямой иммунофлуоресценции (ПЦР и РПИФ) (15). В то же время длительность регистрации АЧС в популяции диких кабанов на территории России предполагает возможность эндемичности инфекции, поэтому серологические обследования могли бы проводиться более широко, особенно в неблагополучных по АЧС субъектах Российской Федерации. При отстреле диких кабанов очень часто в лаборатории доставляют только образцы органов, поэтому мы приняли решение оценить диагностическое значение обнаружения антител в тканях и валидировать набор «ВНИИ-ВВиМ АЧС-ИФА Ат/Аг» для проведения таких исследований. Ранее при изучении диагностического значения специфических тканевых антител мы использовали случайные выборки экстрактов селезенки от павших домашних свиней и диких кабанов, инфицированных вирусом АЧС (16). У 49 % павших от острой формы АЧС домашних свиней и 33 % кабанов (ПЦР- и РПИФ-положительные) реакцией непрямой иммунофлуоресценции (РНИФ) в экстрактах селезенки обнаружены тканевые антитела против вируса АЧС. РНИФ считается референс-тестом для обнаружения антител к вирусу АЧС (22), но наряду с высокой чувствительностью и специфичностью имеет низкую производительность при некоторых технологических неудобствах. Поэтому требуется разработка, валидация и применение в ветеринарной практике методов ИФА, позволяющих не только исследовать сыворотки, но и обнаруживать специфические антитела в экстрактах тканей инфицированных животных.
В последние годы в медицине и ветеринарии часто используется методология ROC (receiver operating characteristic) анализа (23-25), которая позволяет (при наличии положительной и отрицательной референс-выборок) в числовом выражении и графически определить точки отсечки и валидировать метод по соотношению доли объектов, которые верно (true positive rate) и ошибочно (false positive rate) классифицированы как несущие признак. При обработке результатов диагностических тестов с помощью ROC-кривых необходимо определить уровень отсечки — показатель, без оценки которого невозможно проводить предусмотренные расчеты и интерпретацию положительного и отрицательного результатов анализа (26, 27).
Мы валидировали диагностический набор «ВНИИВВиМ АЧС-ИФА Ат/Аг» (Всероссийский НИИ ветеринарной вирусологии и микробиологии — ВНИИВВиМ) для выявления антител к вирусу АЧС как в крови, так и в тканях в ИФА-тесте (иммуноферментный анализ), оценив полученные результаты с помощью ROC-анализа.
Цель исследований — определение операционных характеристик разработанного коммерческого набора для непрямого иммуноферментного 846
анализа (ИФА) «ВНИИВВиМ АЧС-ИФА Ат/Аг» в сравнении с реакцией непрямой иммунофлуоресценции (РНИФ) при обнаружении специфических антител к вирусу АЧС в сыворотках и экстрактах тканей инфицированных животных и выбор оптимальной точки отсечки (cutoff), обеспечивающей высокую достоверность результата.
Методика . Референс-положительные пробы были получены случайно и независимо от домашних свиней и диких кабанов в эксперименте или при вспышках АЧС. Выборка референс-положительных образцов включала 43 пробы сывороток крови от 10 свиней, экспериментально зараженных авирулентным вирусом АЧС (штамм PSA-1-NH, титр 10 — 4,5 ТЦД50/мл), которые получили в процессе развития инфекции; 23 пробы сыворотки крови от вынужденно убитых домашних свиней и диких кабанов после отстрела при полевых вспышках АЧС; 59 проб селезенки убитых кабанов из неблагополучной по АЧС Смоленской области, отобранных в 2013-2014 годах (наличие специфических антител подтверждено в РНИФ). Во всех референс-отрицательных пробах отсутствие антител к вирусу АЧС было подтверждено в РНИФ (референс-тест, рекомендованный Международным эпизоотическим бюро, МЭБ — World Organisation for Animal Health, OIE, Франция), а также в ПЦР и РПИФ для гарантии отсутствия вирусной инфекции. Выборка референс-отрицательных образцов включала 410 проб сывороток крови от домашних свиней и кабанов после отстрела (исторически свободные от АЧС фермы и территории РФ); 678 ПЦР-, РПИФ- и РНИФ-отрицательных проб селезенки отстрелянных диких кабанов (Смоленская обл., неблагополучная по АЧС, отбор 2013-2014 годов).
Сыворотки крови осветляли центрифугированием (2000 об/мин). Пробы для ИФА разводили Трис-HCl буфером с казеином (0,01 М Трис-HCl, 0,154 М NaCl, 0,5 % казеин; рН 7,8) в соотношении 1:50 согласно инструкции по применению набора «ВНИИВВиМ АЧС-ИФА Ат/Аг».
Для выделения тканевых экстрактов образцы селезенки (1 г) гомогенизировали в стерильном 0,85 % растворе NaCl (5 см3). Полученные 20 % гомогенаты (масса/объем) дважды замораживали при -18±2 °С, размораживая при комнатной температуре, и осветляли центрифугированием (3000 об/мин, 10-15 мин). Надосадочную жидкость (экстракт) использовали в РНИФ и непрямом ИФА (без дополнительных разведений) для обнаружения специфических тканевых антител против вируса АЧС.
РНИФ выполняли с коммерческим «Набором препаратов для дифференциальной иммунофлуоресцентной диагностики африканской чумы свиней, классической чумы свиней, болезни Ауески» (ВНИИВВиМ). Тест-препарат готовили, используя культуру клеток почки африканской зеленой мартышки CV-1 (Коллекция культур клеток ВНИИВВиМ), зараженную авирулентным негемадсорбирующим вирусом АЧС штамм 691/88 (Государственная коллекция микроорганизмов ВНИИВВиМ). Люминесцентную микроскопию и учет результатов проводили на флуоресцентном микроскопе Eclipse E200 («Nikon Corp.», Япония) согласно инструкции.
Для ИФА использовали коммерческий набор для иммунофермент-ной диагностики африканской чумы свиней «ВНИИВВиМ АЧС-ИФА Ат/Аг» в соответствии с рекомендуемым регламентом. Согласно процедуре, интерпретация результатов основана на принципе стандартного отклонения (2,5-кратное различие), но для введения в программу MedCalc мы вычисляли S/P (отношение оптической плотности исследуемого образца к оптической плотности положительного контроля), используя величину оптической плотности (ОП) при X = 405 нм (спектрофотометр Sunrise™, «Teсan Austria GmbH», Австрия), по формуле:
S = ОПср. исследуемой пробы - ОПср. отрицательного контроля ,
P ОПср. положительного контроля - ОПср. отрицательного контроля
ROC-кривые для определения точки отсечки и статистического анализа строили с использованием значений S/P. Массив S/P положительных проб в РНИФ обозначали как Диагностика 1, отрицательных — Диагностика 0. Данные вводили в программу MedCalc согласно процедуре для текущей версии (доступна по .
Результаты . Относительную чувствительность и относительную специфичность непрямого ИФА (набор «ВНИИВВиМ АЧС-ИФА Ат/Аг») определяли в сравнении с РНИФ (тест «золотого стандарта»). При анализе сывороток крови (табл. 1) от экспериментально зараженных домашних свиней ( n = 43) и здоровых животных (исторически свободные от АЧС фермы, n = 100) относительная чувствительность составляла 100 % (43 пробы из 143 — положительные как в ИФА, так и в РНИФ, 2 — положительные только в ИФА), относительная специфичность — 98 % (при 95 % доверительном интервале).
1. Результаты сравнительного тестирования сывороток крови экспериментально зараженных африканской чумой свиней и здоровых животных
|
ИФА-тест |
РНИФ |
|
положительные отрицательные всего |
|
|
Положительные |
43 |
2 |
45 |
|
Отрицательные |
0 |
98 |
98 |
|
Всего |
43 |
100 |
143 |
ИФА — непрямой иммуноферментный
Примечание.
анализ, РНИФ — реакция непрямой иммунофлуоресценции. Использованы коммерческие диагностические наборы (Всероссийский НИИ ветеринарной вирусологии и микробиологии).
При проверке величины положительной/отрицате-льной отсечки для непрямого ИФА на основании результатов проверки 66 положительных и 410 отрицательных проб сыворотки крови от домашних свиней и диких кабанов построили диаграмму (рис. 1) для частоты распределения полученных показателей. Видно, что в интервале S/P от 0,2 до
0,4 располагались одновременно 5 референс-положительных и 19 референс-отрицательных проб, то есть в этом диапазоне находились оптические плотности образцов, которые могут быть классифицированы и как ложноотрицательные, и как ложноположительные.
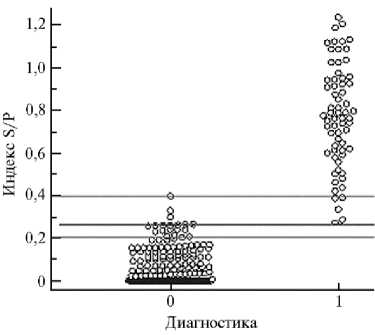
Рис. 1. Диаграмма частоты распределения 410 референс-отрицательных (диагностика 0) и 66 референс-положительных по африканской чуме свиней (диагностика 1) проб сывороток крови свиней в непрямом ИФА по индексу S/P (соотношение оптической плотности исследуемого образца и положительного контроля). Каждая точка представляет средний показатель дубликатов анализа индивидуального образца. Линии отсечки при S/P > 0,264 соответствует чувствительность 100 % и специфичность 99,3 %. Отмечены границы зоны S/P, в которую одновременно попадают положительные и отрицательные пробы.
Чувствительность и специфичность непрямого ИФА при проверке сывороток крови у свиней и диких кабанов рассчитали для раз ных величин отсечки (табл. 2). При исследовании сывороток крови от домашних свиней и диких кабанов самую высокую диагностическую чувствительность (100 %) с 95 % доверительным интервалом (CI) между 94,6 и 100 % в сочетании с самой высокой специфичностью 99,27 % (95 % CI:
97,9-99,8 %) наблюдали при значении cutoff 0,264.
-
2. Значения критериев и координат ROC-кривой при оценке операционных характеристик непрямого ИФА для определения антител к вирусу африканской чумы свиней в сыворотке крови в зависимости от величины отсечки
Критерий
Ч, %
95 % CI
С, %
95 % CI
+LR
95 % CI
- LR
95 % CI
> 0,258
100,00
94,6-100,0
98,54
96,8-99,5
68,33
30,9-151,2
0,000
> 0,261
100,00
94,6-100,0
98,78
97,2-99,6
82,00
34,3-196,0
0,000
> 0,263
100,00
94,6-100,0
99,02
97,5-99,7
102,50
38,7-271,8
0,000
> 0,264
100,00
94,6-100,0
99,27
97,9-99,8
136,67
44,3-422,0
0,000
> 0,271
98,48
91,8-100,0
99,27
97,9-99,8
134,60
43,6-415,8
0,015
0,002-0,1
> 0,285
96,97
89,5-99,6
99,27
97,9-99,8
132,53
42,9-409,5
0,031
0,008-0,1
> 0,298
96,97
89,5-99,6
99,51
98,2-99,9
198,79
49,9-792,7
0,030
0,008-0,1
> 0,388
93,94
85,2-98,3
99,76
98,6-100,0
385,15
54,3-2730,4
0,061
0,020-0,2
П р и м е ч а н и е. Исследовано 66 проб сывороток от инфицированных вирусом африканской чумы свиней (положительная группа — Диагностика = 1) и 410 проб от неинфицированных свиней и диких кабанов (отрицательная группа — Диагностика = 0); общий размер выборки — 476 проб. Ч — чувствительность, С — специфичность, CI — доверительный интервал, +LR и - LR — отношения правдоподобия: +LR = Ч/(100 - С), - LR = (100 - Ч)/С. В таблице представлена часть критериев и координат ROC-анализа, рассчитанных в программе MedCalc, с наиболее актуальными величинами отсечки в диапазоне оптимальных показателей чувствительности и специфичности.
Площадь под ROC-кривой (AUC): площадь под ROC-кривой — 1,000; стандартная ошибка — 0,000269; 95 % доверительный интервал — от 0,992 до 1,000; Z-статистика — 1857,961; уровень значимости P (площадь = 0,5) < 0,0001. Индекс Юдена: индекс J — 0,9927; ассоциированный критерий > 0,264.
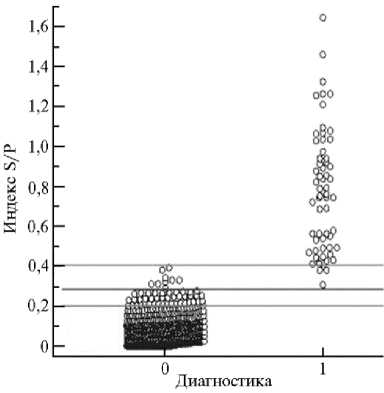
Рис. 2. Диаграмма частоты распределения 678 референс-отрицательных (диагностика 0) и 59 референс-положительных по африканской чуме свиней (диагностика 1) проб тканей (селезенка) свиней в непрямом ИФА по индексу S/P (соотношение оптической плотности исследуемого образца и положительного контроля). Каждая точка представляет средний показатель дубликатов анализа индивидуального образца. Линии отсечки при S/P > 0,284 соответствует чувствительность 100 % и специфичность 98,8 %. Отмечены границы зоны S/P, в которую одновременно попадают положительные и отрицательные пробы.
При тестировании 59 референс-положительных и 678 референс-отрицательных экстрактов ткани селезенки (рис. 2) частоты S/P перекрывания ложноположительных (51 проба) и ложноотрицательных
(3 пробы) результатов располагались в том же в интервале (0,2-0,4), что и для сывороточных антител. Оптимальные показатели были установлены при значении cutoff 0,284: чувствительность метода — 100 % (95 % CI: 93,9-100 %), специфичность — 98,82 % (95 % CI: 97,7-99,5 %) (табл. 3).
В настоящее время метод ИФА одобрен МЭБ для первичного скрининга сывороток против вируса АЧС (26), однако в основном все предложенные тесты позволяют обнаруживать специфические антитела только в сыворотках крови (10, 12, 14). Проведенная нами с применением ROC-анализа валидация ИФА-набора показала возможность его применения для обнаружения специфических антител к вирусу АЧС в сыворотках крови и экстрактах тканей у инфицированных домашних свиней и диких кабанов. Тестирование положительных ( n = 66) и отрицательных ( n = 410) проб сывороток крови свиней подтвердило высокую чувствительность и специфичность этого метода в сравнении с РНИФ: из 476 проб только 8 (1,6 %) попали в область положительной/отрицательной отсечки (см. рис. 1).
При анализе положительных ( n = 59) и отрицательных ( n = 678)
образцов селезенки от клинически здоровых диких кабанов, обитающих на неблагополучной по АЧС территории, также установили высокую чувствительность и специфичность непрямого ИФА в сравнении с РНИФ. В область положительной/отрицательной отсечки (см. рис. 2) попали только 10 (1,3 %) проб. С учетом характера течения острой формы болезни мы можем предположить у положительно реагировавших животных состояние, соответствующее инкубационному периоду развития инфекции.
-
3. Значения критериев и координат ROC-кривой при оценке операционных характеристик непрямого ИФА для определения антител к вирусу африканской чумы свиней в тканях селезенки в зависимости от величины отсечки
Критерий 1
Ч, %
] 95 % CI
1 С, %
1 95 % CI
1 +LR
1 95 % CI 1
- LR
95 % CI
> 0,263
100,00
93,9-100,0
97,94
96,6-98,9
48,43
28,8-81,3
0,000
> 0,268
100,00
93,9-100,0
98,08
96,7-99,0
52,15
30,4-89,4
0,000
> 0,269
100,00
93,9-100,0
98,23
96,9-99,1
56,50
32,2-99,0
0,000
> 0,270
100,00
93,9-100,0
98,53
97,3-99,3
67,80
36,6-125,4
0,000
> 0,276
100,00
93,9-100,0
98,67
97,5-99,4
75,33
39,4-144,2
0,000
> 0,284
100,00
93,9-100,0
98,82
97,7-99,5
84,75
42,6-168,8
0,000
> 0,304
98,31
90,9-100,0
98,82
97,7-99,5
83,31
41,8-166,1
0,017
0,002-0,1
> 0,310
98,31
90,9-100,0
99,12
98,1-99,7
111,08
50,0-246,6
0,017
0,002-0,1
> 0,320
98,31
90,9-100,0
99,26
98,3-99,8
133,30
55,6-319,4
0,017
0,002-0,1
> 0,330
98,31
90,9-100,0
99,56
98,7-99,9
222,17
71,8-687,5
0,017
0,002-0,1
> 0,380
94,92
85,9-98,9
99,85
99,2-100,0
643,53
90,7-4566,1
0,051
0,020-0,2
П р и м еч а ни е. Исследовано 59 проб ткани селезенки от инфицированных вирусом африканской чумы свиней (положительная группа — Диагностика = 1) и 678 проб от неинфицированных свиней и диких кабанов (отрицательная группа — Диагностика = 0); общий размер выборки — 737 проб. Ч — чувствительность, С — специфичность, CI — доверительный интервал, +LR и - LR — отношения правдоподобия: +LR = Ч/(100 - С), - LR = (100 - Ч)/С. В таблице представлена часть критериев и координат ROC-анализа, рассчитанных в программе MedCalc, с наиболее актуальными величинами отсечки в диапазоне оптимальных показателей чувствительности и специфичности.
Площадь под ROC-кривой (AUC): площадь под ROC-кривой — 1,000; стандартная ошибка — 0,000243; 95 % доверительный интервал — от 0,994 до 1,000; Z-статистика — 2055,362; уровень значимо сти P (площадь = 0,5) < 0,0001. Индекс Юдена: индекс J — 0,9882; ассоциированный критерий > 0,284.
Данные ROC-анализа непрямого ИФА, полученные при исследовании проб сывороток крови и тканей, позволяют выбрать точки отсечки в широком диапазоне с возможностью оптимизации рабочих характеристик метода. В обоих случаях возможны альтернативные варианты в зависимости от планируемых целей — диагностики, мониторинга или подтверждения отсутствия инфекции в популяции домашних свиней (фермы) или диких кабанов (охотничьи хозяйства) от АЧС в субъекте РФ. Так, при необходимости воспрепятствовать заносу инфекции важнее высокая чувствительность и меньшее значение имеет специфичность (например, при диагностике или скрининге в неблагополучной зоне). В этом случае устанавливаемый уровень отсечки 0,264 (сыворотки) или 0,284 (ткани). Если недопустим ложноположительный результат, то есть важна специфичность (например, при скрининге животных на АЧС в благополучной зоне), порог отсечки можно увеличить до 0,380 с минимальным влиянием на чувствительность.
Таким образом, результаты валидации свидетельствуют о том, что набор «ВНИИВВиМ АЧС-ИФА Ат/Аг» позволяет достоверно выявлять антитела к вирусу африканской чумы свиней (АЧС) как в сыворотке крови, так и в экстрактах ткани селезенки при величине отсечки S/P соответственно 0,264 (сыворотки) или 0,284 (ткани). Это особенно актуально при работе с дикими кабанами, когда в лаборатории после отстрела часто доставляют только образцы органов. Разработанный и валидированный нами коммерческий набор целесообразно использовать для оценки наличия антител к вирусу АЧС и статуса по АЧС у животных и в популяции в целом.
Список литературы Валидация ИФА-набора для обнаружения антител к вирусу африканской чумы свиней в крови и селезенке домашних свиней и диких кабанов
- Куриннов В.В., Колбасов Д.В., Цыбанов С.Ж., Васильев А.П., Шендрик А.Г., Балышев В.М., Миколайчук С.В., Белянин С.А., Калантаенко Ю.Ф., Жуков А.Н. Африканская чума свиней -главная проблема для свиноводства России. Жизнь без опасностей, 2010, 3: 82-87.
- Atuhaire D.K., Afayoa M., Ochwo S., Mwesigwa S., Mwiine F.N., Okuni J.B., Olaho-Mukani W., Ojok L. Prevalence of African swine fever virus in apparently healthy domestic pigs in Uganda. BMC Vet. Res., 2013, 9: 263-271 ( ) DOI: 10.1186/1746-6148-9-263
- Gallardo C., Reoyo A.T., Fernández-Pinero J., Iglesias I., Muñoz J., Arias L. African swine fever: a global view of the current challenge. Porcine Health Management, 2015, 1: 21 ( ) DOI: 10.1186/s40813-015-0013-y
- Carrasco L. An update on the epidemiology and pathology of African swine fever. J. Comp. Pathol., 2015, 152: 9-21 ( ) DOI: 10.1016/j.jcpa.2014.09.003
- Guinat C., Reis A.L., Netherton C., Goatley L., Pfeiffer D., Dixon L. Dynamics of African swine fever virus shedding and excretion in domestic pigs infected by intramuscular inoculation and contact transmission. Vet. Res., 2014, 45: 93 ( ) DOI: 10.1186/s13567-014-0093-8
- Diseases of swine/D.J. Taylor, J.J. Zimmerman, S. D’Allaire (eds.) Iowa State University Press, 2006.
- Gallardo C., Soler A., Nieto R., Cano C., Pelayo V., Sánchez M.A., Pridotkas G., Fernandez-Pinero J., Briones V., Arias M. Experimental infection of domestic pigs with African swine fever virus Lithuania 2014 genotype II field isolate. Transbound. Emerg. Dis., 2015 Mar 22: 1-5 ( ) DOI: 10.1111/tbed.12346
- Boinas F.S., Hutchings G.H., Dixon L.K., Wilkinson P.J. Characterisation of pathogenic and non-pathogenic African swine fever virus isolated from Ornithodoros erraticus inhabiting pig premises in Portugal. J. Gen. Virol., 2004, 5(8): 2117-2187 ( ) DOI: 10.1099/vir.0.80058-0
- Howey E.B., O’Donnell V., de Carvalho Ferreira H.C., Borca M.V., Arzt J. Pathogenesis of highly virulent African swine fever virus in domestic pigs exposed via intraoropharyngeal, intranasopharyngeal, and intramuscular inoculation, and by direct contact with infected pigs. Virus Res., 2013, 178: 328-339 ( ) DOI: 10.1016/j.virusres.2013.09.024
- Charleston B., Bankowski B.M., Gubbins S., Chase-Topping M.E., Schley D., Howey R., Barnett P.V., Gibson D., Juleff N.D., Woolhouse M.E. Relationship between clinical signs and transmission of an infectious disease and the implications for control. Science, 2011, 332: 726-729 ( ) DOI: 10.1126/science.1199884
- Botija S., Ordas A. Rapid diagnosis by identification of antibodies extracted from tissues using indirect immunofluorescence. Hog Cholera. In: Classical swine fever and African swine fever. Luxembourg, 1977: 658-659.
- Reis A.L., Parkhouse R.M., Penedos A.R., Martins C., Leitão A. Systematic analysis of longitudinal serological responses of pigs infected experimentally with African swine fever virus. J. Gen. Virol., 2007, 88: 2426-2434 ( ) DOI: 10.1099/vir.0.82857-0
- Pérez J., Fernández A.I., Sierra M.A., Herraez P., Fernández A. Serological and immunohistochemical study of African swine fever in wild boar in Spain. Vet Rec., 1998, 143: 136-139.
- Gallardo C., Soler A., Nieto R., Carrascosa A.L., De Mia G.M., Bishop R.P., Martins C., Fasina F.O., Couacy-Hymman E., Heath L., Pelayo V., Martín E., Simón A., Martín R., Okurut A.R., Lekolol I., Okoth E., Arias M. Comparative evaluation of novel African swine fever virus (ASF) antibody detection techniques derived from specific ASF viral genotypes with the OIE internationally prescribed serological tests. Vet. Microbiol., 2013, 162: 32-43 ( ) DOI: 10.1016/j.vetmic.2012.08.011
- Куриннов В.В., Васильев А.П., Белянин С.А., Стрижакова О.М., Ногина И.В., Сидлик М.В., Газаев И.Х., Цыбанов С.Ж., Миронова Л.П., Аликова Г.А., Джаилиди Г.А., Черных О.Ю. Диагностические оценки ПЦР и РПИФ при использовании выборки от полевых вспышек АЧС. Ветеринария Кубани, 2014, 3: 5-9.
- Куриннов В.В., Белянин С.А., Васильев А.П., Стрижакова О.М., Лыска В.М., Ногина И.В., Зубаирова С.Н., Балышев В.М., Цыбанов С.Ж., Колбасов Д.В., Миронова П.Л., Черных О.Ю., Аликова Г.А. Экспериментальные и полевые исследования специфических антител в тканях органов у инфицированных вирусом АЧС домашних свиней и кабанов с острым течением болезни. Ветеринария Кубани, 2012, 4: 9-11.
- Cubillos C., Gómez-Sebastian S., Moreno N., Nuñez M.C., Mulumba-Mfumu L.K., Quembo C.J., Heath L., Etter E.M.C., Jori F., Escribano J.M., Blanco E. African swine fever virus serodiagnosis: A general review with a focus on the analyses of African serum samples. Virus Res., 2013, 173(1): 159-167 ( ) DOI: 10.1016/j.virusres.2012.10.021
- Nieto-Pelegr E., Rivera-Arroyo B., Sanchez-Vizcaıno J.M. First detection of antibodies against African swine fever virus in faeces samples. Transbound. Emerg. Dis., 2015, 62(6): 594-602 ( ) DOI: 10.1111/tbed.12429
- Zsak L., Borca M., Risatti G., Zsak A., French R., Lu Z., Kutish G., Neilan J., Callahan J., Nelson W. Preclinical diagnosis of African swine fever in contact-exposed swine by a real-time PCR assay. J. Clin. Microbiol., 2005, 43: 112-119 ( ) DOI: 10.1128/JCM.43.1.112-119.2005
- Макаров В.В., Сухарев О.И., Боев Б.В., Гаврюшкин Д., Коломыцев А.А., Литвинов О.Б. Дикий европейский кабан. Природная очаговость африканской чумы свиней. Ветеринария, 2010, 9: 24-28.
- Khomenko S., Beltrán-Alcrudo D., Rozstalnyy A., Gogin A., Kolbasov D., Pinto J., Lubroth J., Martin V. African swine fever in the Russian Federation: risk factors for Europe and beyond. EMPRES Watch, 2013, 28: 1-14.
- Manual of diagnostic tests and vaccines for terrestrial animals. 7th Ed. OIE, France. 2012. Режим доступа: http://www.oie.int/manual-of-diagnostic-tests-and-vaccines-for-terrestrial-animals/. Без даты.
- Gardner A., Greiner M., Dubey J. Statistical evaluation of test accuracy studies for Toxoplasma gondii in food animal intermediate hosts. Zoonoses and Public Health, 2010, 57: 82-94 ( ) DOI: 10.1111/j.1863-2378.2009.01281
- Greiner M., Sohr D., Gijbel P. A modified ROC analysis for the selection of cut-off values and the definition of intermediate results of serodiagnostic tests. J. Immunol. Methods, 1995, 185: 123-132.
- The ELISA guidebook/J.R. Crowther (ed.). Vienna, 2009.
- Jacobson R.H. Validation of serological assays for diagnosis of infectious diseases. Rev. Sci. Tech. OIE, 1998, 17(2): 469-486.
- Tignon M., Gallardo C., Iscaro C., Hutet E., Van der Stede Y., Kolbasov D., De Mia G.M., Le Potier M.-F., Bishop R.P., Arias M. Development and inter-laboratory validation study of an improved new real-time PCR assay with internal control for detection and laboratory diagnosis of African swine fever virus. J. Virol. Methods, 2011, 178: 161-170 ( ) DOI: 10.1016/j.jviromet.2011.09.007


