Вариабельность и уровень экспрессии микроРНК в ткани опухолей головы и шеи
Автор: Никитина Екатерина Геннадьевна, Уразова Людмила Николаевна, Черемисина Ольга Владимировна, Кульбакин Денис Евгеньевич, Стегний В.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 (63), 2014 года.
Бесплатный доступ
Малые некодирующие РНК (микроРНК) являются не только важнейшими регуляторами экспрессии генов, участвуя практически во всех базовых процессах в клетке, но и являются специфичными молекулами и могут быть использованы для многих целей в клинической диагностике. В данном исследовании проведена оценка уровня экспрессии микроРНК в опухолевой ткани пациентов с новообразованиями в разных анатомических сайтах головы и шеи. По результатам данного проекта получены новые данные относительно паттерна экспрессии восьми микроРНК в опухолевой ткани пациентов с раком гортани (РГ), языка (РЯ) и папиллярной карциномы щитовидной железы (РЩЖ), а именно микроРНК-18а, -21, -155, -200а, -200с, -205, -221 и -494. Определен спектр микроРНК, специфичных для анализируемых локализаций, что позволяет предположить наличие различий в механизмах участия одних и тех же микроРНК при онкогенезе опухолей разных эпитопов головы и шеи. Показано, что панель из микроРНК-200а, -200с, -21 и -205 является специфичной для определения двух локализаций (РГ и РЩЖ) и, вероятно, может быть использована для уточнения сайта вторичной опухоли и/или метастаза неясного генеза.
Опухоли головы и шеи, микрорнк
Короткий адрес: https://sciup.org/14056429
IDR: 14056429 | УДК: 617.51/.617.57-006.04:577.218
Текст научной статьи Вариабельность и уровень экспрессии микроРНК в ткани опухолей головы и шеи
В структуре онкологической заболеваемости опухоли головы и шеи (ОГШ) занимают 5-е место в мире по частоте встречаемости и 6-е место – по летальности. В России ежегодно регистрируются более 80 тыс. больных с этой патологией. Наблюдается тенденция к увеличению уровня заболеваемости и смертности при ОГШ, на фоне стабилизации этих показателей для других локализаций [1]. В настоящее время достигнуты значительные успехи в терапии зло качественных опухолей головы и шеи, которые связаны с совершенствованием методов лечения, однако показатели 5-летней выживаемости, к сожалению, не превышают 50 % [14]. Предпосылкой успешного лечения является своевременная и точная диагностика, что позволяет повысить эффективность лечения, увеличить сроки без-рецидивной выживаемости, а также улучшить качество жизни пациентов, снизив долю и тяжесть побочных эффектов [5].
Для ОГШ в качестве молекулярных биомаркеров для определения риска возникновения рака и неблагоприятного прогноза течения заболевания применяются мутации генов EGFR , k-Ras , b-Raf , p53 , а также инфицирование онкогенными вирусами, в частности вирусом папилломы человека, Эпштейна – Барр и другими [14]. Открытие принципиально нового класса малых молекул РНК (микроРНК), которые регулируют экспрессию генов, стало весьма значительным событием в биологии конца XX века [13]. В ходе биогенеза микроРНК претерпевают ряд изменений – от молекулы при микроРНК длиной 1000 нуклеотидов к конечной форме зрелой микроРНК (около 25 нуклеотидов). Делеции в генах микроРНК, а также сбой механизма их созревания могут являться важным звеном процесса трансформации клетки [12]. МикроРНК не только регулируют многие ключевые процессы в жизнедеятельности клетки и поддержании ее гомеостаза, но и участвуют в патогенезе многих заболеваний, в том числе и онкологических [8, 16].
Показано, что отдельные микроРНК (-21, -18а, -200а, -200с, -205) играют ключевую роль в регуляции процессов апоптоза, роста, инвазии, пролиферации клеток [4, 10, 11], клеточного цикла (-18а, -21, -200а, -200с, -221, -494) [17]. Кроме того, отмечено их непосредственное участие в формировании иммунного ответа (микроРНК-155) [19]. Учитывая роль этих молекул в столь значимых фи- зиологических процессах, логично предположить взаимосвязь экспрессии определенных микроРНК с патоморфологическими характеристиками опухоли и течением заболевания (развитие рецидивов, лимфогенных метастазов). Также существует возможность использования экспрессии определенного профиля микроРНК для идентификации происхождения ткани метастаза. Высказывается предположение о более высокой, чем у применяемых молекулярных маркеров, специфичности и чувствительности данного метода [7].
Крайняя противоречивость литературных данных не дает возможности составить четкие представления об участии тех или иных микроРНК-маркеров, которые бы обладали клинической значимостью в этиопатогенезе опухолей, локализованных, в частности, в области головы и шеи [2, 15]. Следовательно, представляется достаточно актуальным изучение микроРНК для оценки возможности применения в качестве потенциальных онкомаркеров, уровень экспрессии которых может быть специфичен для опухолей разных локализаций.
Целью исследования явилась оценка уровня и вариабельности экспрессии микроРНК в опухолевой ткани больных ОГШ.
Материал и методы
В исследование включены данные о 56 пациентах (таблица), получивших лечение в ФГБУ
Таблица
«НИИ онкологии» СО РАМН. Работа проведена с соблюдением принципов добровольности и конфиденциальности в соответствии с «Основами законодательства РФ об охране здоровья граждан» (Указ президента РФ, от 24.12.93 № 2288). На исследование получено разрешение этического комитета ФГБУ «НИИ онкологии» СО РАМН.
В работе был использован парный операцион-ный/биопсийный материал (опухолевая и прилежащая условно-нормальная ткань) от пациентов с первичным диагнозом плоскоклеточного рака гортани (n=34), языка (n=13) и папиллярной карциномы щитовидной железы (n=6). Диагноз пациентов морфологически верифицирован. Транспортировку и хранение (при –80°С) биоматериала осуществляли в пробирках типа Ep-pendorf в консервирующем растворе RNAlater (Sigma, USA). Тотальная фракция РНК из ткани была выделена набором реагентов mirVana™ (Ambion, USA). Количество РНК оценивали на спектрофотометре NanoDrop 2000 (ThermoSci-entific, USA) (выход продукта варьировал от 30 до 800 нг/мкл, А260/280=1,99). Целостность РНК оценивали на капиллярном электрофорезе на приборе TapeStation 2200 (Agilent Technologies, USA). Среднее значение RIN (RNA Integrity Number) составило 8,77 (от 8,3 до 9,0), что свидетельствует о высоком качестве образцов и пригодности их к анализу методом количественной ПЦР в режиме реального времени.
Мультиплексная обратная транскрипция была проведена с использованием специфичных к определенным микроРНК (hsa-miR-18a-5p, hsa-miR-21-5p, hsa-miR-155-5p, hsa-miR-200a-3p, hsa-miR-200c-3p, hsa-miR-205-5p, hsa-miR-221-3p, hsa-miR-494-3p) праймерам особой шпилевидной конструкции (IyevlevaA., et al 2012). Все реакции ПЦР в режиме реального времени проведены в триплете согласно протоколу [9]. В качестве гена-рефери выбрана микроРНК-103 [9], калибровка выполнена относительно нормальной ткани, уровень экспрессии микроРНК рассчитан согласно методу Pfaffl [18]. В качестве результата использовано логарифмически трансформированное по основанию е нормализованное значение уровня экспрессии (ln(fold+0,02)). Дискриминантный и корреляционный анализ, а также обработка данных с применением U-критерия Манна – Уитни проводились в программе Statistica 8.0.
Результаты исследования
Проведенный анализ экспрессии микроРНК в опухоли относительно прилежащей условнонормальной ткани для 8 микроРНК (-18а, -21, -155, 200а, -200с, -205, -221 и -494) на примере 3 локализаций выявил аберрантную экспрессию некоторых микроРНК в обследованных группах (рис. 1).
В своих исследованиях мы установили, что другие изученные микроРНК демонстрируют разнонаправленное изменение уровня экспрессии в обследуемых группах пациентов (рис. 1Б-Г). Следует отметить, что в опухолевой ткани больных раком языка выявлена значительная гиперэкспрессия не только микроРНК-21, -155, но и микроРНК-200с (72 % случаев, отмечены ln>0), а также гипоэкспрессия микроРНК-494 (100 % случаев – ln<0). Во всех исследованных образцах опухолевой ткани пациентов с диагнозом папиллярной карциномы щитовидной железы показана гиперэкспрессия микроРНК-155, -200а и гипоэкспрессия микроРНК205, в то время как для микроРНК-21 и -221 при повышенной их экспрессии в большинстве случа-
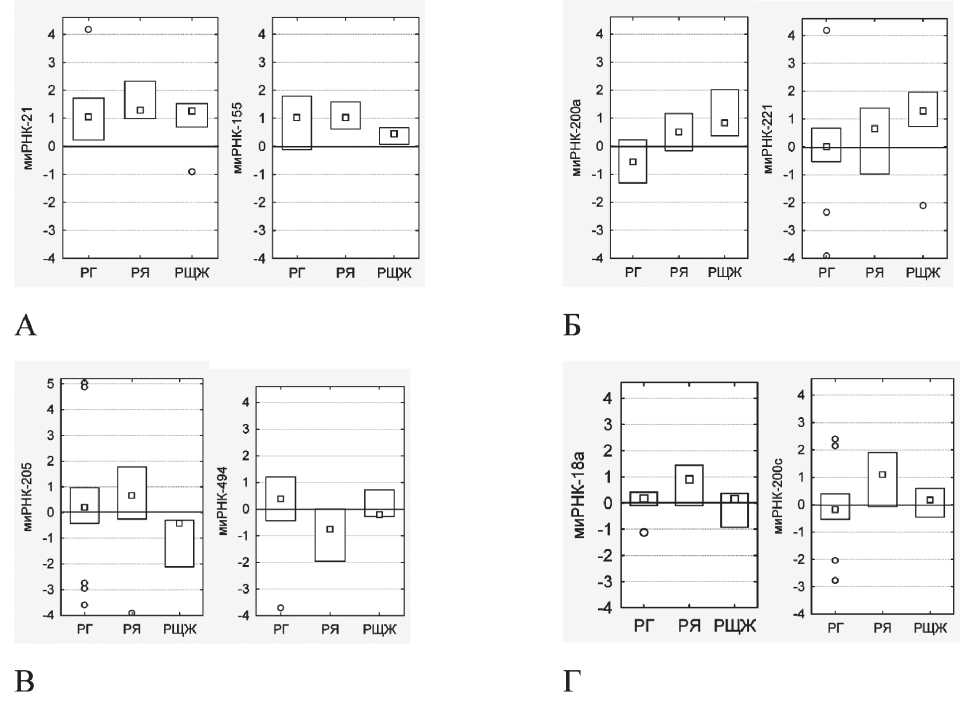
Рис. 1. Уровень экспрессии микроРНК в патологически измененной опухолевой ткани относительно условно-нормальной (значение нормы экспрессии – 0). Примечание: РГ – рак гортани; РЯ – рак языка; РЩЖ – рак щитовидной железы
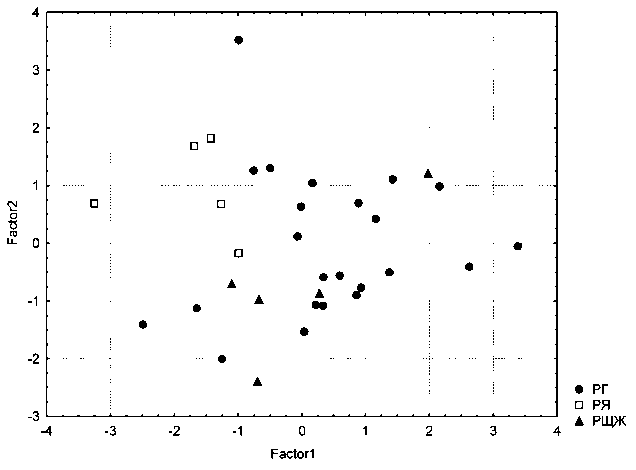
Рис. 2. Расположение объектов в пространстве на плоскости дискриминантных осей. Примечание: Factor 1 и 2 – условное значение, объединяющее данные по экспрессии анализируемых микроРНК. Точками, квадратами и ромбами отмечены пациенты с диагнозом РГ, РЯ и РЩЖ соответственно ев наблюдаются и единичные выбросы значений изученных показателей. Вероятно, эти микроРНК могут играть определенную роль в канцерогенезе изученных локализаций (рис. 1), что, однако, требует уточнения на более репрезентативных группах, унифицированных по анамнестическим и клиникоморфологическим показателям.
Сравнительный анализ уровня экспрессии каждой из анализируемых микроРНК между локализациями значимых различий в изученных показателях не выявил. Однако дискриминантный анализ показал, что есть значимое различие в значениях уровня экспрессии между 3 сравниваемыми группами (F(4.58)=4.094, p<0,0054), что позволяет судить о наличии специфичности экспрессии некоторых микроРНК в группах (рис. 2). Несмотря на разброс значений, что, вероятно, связано с гетерогенностью выборок по таким показателям, как пол, возраст и TNM (таблица), наблюдается тенденция к группированию случаев согласно диагнозу (рис. 2).
Обсуждение
Проведенный анализ позволил выделить микроРНК (-200а, -200с, -21 и -205), которые формируют специфичную картину экспрессии в группе и позволяют отнести анализируемые образцы к определенной локализации. Панель вышеперечисленных микроРНК специфична и с вероятностью 93,5 % или 66,6 % позволяет отнести анализируемые образцы к плоскоклеточной карциноме гортани или к папиллярной карциноме щитовидной железы соответственно. Кроме того, корреляционный анализ также выявил наличие связи между этими микроРНК. Наблюдалась положительная корреляция между микроРНК-200с и микроРНК-200а, -205 (r=0,44 и r=0,53 соответственно), а также между микроРНК-21 и -155 (r=0,51). Следует отметить, что все эти микроРНК объединяет участие в регуляции апоптоза, клеточного роста, инвазии и пролиферации [4, 10, 11, 21]. При этом микроРНК-200а, -200с, -205 играют определенную роль и в регуляции клеточного цикла [11, 20, 21]. В литературе широко представлены данные о значительной роли представителей семейства микроРНК-200, а также микроРНК-205 в онкогенезе, в частности, в эпителиально-мезенхимальном переходе и процессе приобретения клеткой эмбрионального фенотипа. Многочисленные исследования показали онкосупрессорную роль микроРНК-200
в канцерогенезе опухолей мочевого пузыря, молочной железы, рото- и носоглотки и др. [6]. Для микроРНК-205 свойственна двойственная роль в онкогенезе в зависимости от локализации опухоли и мишеней этой молекулы. Так, при раке молочной железы показана ее гипоэкспрессия, в то время как при опухолях легкого, мочевого пузыря, яичника, головы и шеи выявлена гиперэкспрессия этой микроРНК [21].
Полученные нами результаты позволили представить специфичную картину экспрессии изученных микроРНК в опухолевой ткани относительно прилежащей условно нормальной при трех локализациях опухолей в области головы и шеи – плоскоклеточном раке гортани и языка, а также папиллярной карциноме щитовидной железы, что может внести определенный вклад в имеющиеся литературные данные относительно роли микроРНК в процессах канцерогенеза. При этом различия в спектре их экспрессии в обследованных группах больных позволяют предположить отличия в механизмах их участия в процессе канцерогенеза опухолей отдельных локализаций.
Несмотря на отсутствие значимых различий по отдельным микроРНК между группами, статистический анализ позволил выявить микроРНК, формирующих специфичную картину экспрессии и позволяющих идентифицировать локализацию опухоли, что может быть использовано для уточнения сайта первичной или вторичной злокачественной опухоли и/или метастаза неясного генеза. Представляется целесообразным продолжить исследования с привлечением более многочисленных и унифицированных по анамнестическим и клиникоморфологическим показателям групп пациентов, что даст возможность получить новые данные относительно механизмов участия микроРНК в канцерогенезе опухолей различных локализаций, а также возможных аспектах использования в качестве диагностических и прогностических молекулярных маркеров в клинической онкологии.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект №12-04-31505) и гранта НШ-1279.2014.4.


