Вариантная анатомия нижней брыжеечной артерии и ее значение при выборе уровня перевязки. Обзор литературы
Автор: Ермаков И.В., Шихин И.С., Гасанов М.М., Атрощенко А.О., Сажин А.В.
Журнал: Московский хирургический журнал @mossj
Рубрика: Обзор литературы
Статья в выпуске: 3 (85), 2023 года.
Бесплатный доступ
Введение. В хирургии колоректального рака (КРР) высокая перевязка нижней брыжеечной артерии (НБА) является «золотым» стандартом. Низкая перевязка НБА может снижать частоту несостоятельности анастомоза.Цель исследования. Изучить вариантную анатомию НБА и определить ее значение при выборе уровня перевязки.Материалы и методы исследования. Проведен поиск исследований в электронной базе данных PubMed и eLIBRARY. В окончательный обзор и анализ включено 30 статей.Результаты. В практической деятельности наибольший интерес представляет классификация Yada-Murono, согласно которой выделяют 4 типа анатомии НБА: I тип - левая ободочная артерия (ЛОА) отходит изолировано от НБА; II тип - ЛОА и сигмовидная артерия (СА) имеют общий ствол; III тип - ЛОА, СА и верхняя прямокишечная артерия (ВПА) исходят веерообразно из одной точки; IV - ЛОА отсутствует.Обсуждение. Сохранение ЛОА у пациентов с I типом не вызывает сложностей. При II типе низкая перевязка за счет короткой НБА может стать причиной натяжения зоны анастомоза и развития несостоятельности. У пациентов с III типом необходимо стремиться сохранить ЛОА, т. к. высокая перевязка сопровождается гипоперфузией левых отделов ободочной кишки. Для IV типа поиск ЛОА сопряжен с риском выхода из слоя и повреждением соседних структур.Заключение. Оценка анатомии НБА имеет практическое значение в хирургии КРР, позволяя выбрать оптимальный уровень ее пересечения.
Колоректальный рак, нижняя брыжеечная артерия, сосудистая анатомия, левая ободочная артерия
Короткий адрес: https://sciup.org/142238983
IDR: 142238983 | УДК: 616.34-006.6 | DOI: 10.17238/2072-3180-2023-3-17-26
Текст обзорной статьи Вариантная анатомия нижней брыжеечной артерии и ее значение при выборе уровня перевязки. Обзор литературы
Согласно данным Всемирной организации здравоохранения, в мире сохраняется тенденция к росту заболеваемости колоректальным раком (КРР). До 80 % всех случаев КРР – опухоли левой половины ободочной и прямой кишки [1]. Нижняя брыжеечная артерия (НБА) и вена (НБВ) являются основными анатомическими ориентирами в хирургии рака данной локализации. Протяженность НБА варьирует от 4 до 7 см. Первой и постоянной ветвью НБА является левая ободочная артерия (ЛОА). Она начинается примерно на расстоянии 3–5 см от основания НБА и делится на две ветви: восходящую и нисходящую. Первая ветвь кровоснабжает левый изгиб ободочной кишки, вторая – нисходящую ободочную кишку. Анастомозируют данные ветви с левой ветвью средней ободочной (бассейн ВБА) и сигмовидной артериями (СА), сохранение которых определяет не только онкологические результаты, но и влияет на развитие осложнений после хирургического лечения КРР [2].
Основным методом лечения КРР на сегодняшний день остается хирургический – перевязка НБА и НБВ, резекция участка кишки в пределах собственной фасции с лимфодиссекцией вдоль питающего сосуда (D2 или D3) [3]. На сегодняшний день нет единого мнения в отношении уровня перевязки НБА у пациентов с КРР. В мировой практике можно встретить два подхода. Общепринятым считается высокая перевязка, когда НБА лигируют и пересекают у ее основания, другой подход – низкая перевязка, когда НБА скелетизируют на протяжении и пересекают дистальнее места отхождения ЛОА [4]. При низкой перевязке кровоснабжение левой половины толстой кишки сохраняется за счет ЛОА и ее ветвей, а при высокой перевязке за счет краевой артерии и межбрыжеечных анастомозов [5]. Последние встречаются не у всех пациентов. В случае их отсутствия в раннем послеоперационном периоде существует риск недостаточного кровоснабжения в области колоректального анастомоза [2]. Сохранение ЛОА, по данным литературы, достоверно повышает давление в краевой артерии и способствует улучшению кровоснабжения в зоне анастомоза [6].
При выборе уровня перевязки НБА рекомендуется учитывать анатомический тип строения НБА и ее ветвей. Есть данные, что адекватность кровоснабжении зоны колоректального анастомоза напрямую связана с типом анатомии НБА [7]. В данном обзоре рассмотрены анатомические варианты НБА и их влияние на выбор уровня перевязки.
Материалы и методы
В данном исследовании проведен поиск статей в PubMed, eLIBRARY с использованием комбинации ключевых слов: колоректальный рак, нижняя брыжеечная артерия, сосудистая анатомия, левая ободочная артерия. В ходе первоначального поиска в базах данных выявлено в общей сложности 76 исследований. После исключения повторяющихся ссылок и тщательного изучения материалов полнотекстового обзора было отобрано 46 статей. Всего в окончательный обзор было включено 30 исследований.
Результаты
Первые описания ветвей НБА принадлежат L. Testut (1895) и W. Spalteholz (1898). В первом случае автором описаны три ветви левой толстокишечной артерии (левая, средняя и правая сигмовидная), во втором две – левая ободочная и сигмовидная артерии. В 1949 году A. Latarjet описал два типа вариантной анатомии НБА и впервые предложил ее классификацию: I тип – изолированное начало ветвей, при котором ЛОА и СА имеют самостоятельное начало; II тип – ЛОА и СА имеют общее веерообразное начало (рис. 1) [8]. Предложенная классификация A. Latarjet основывалась на данных аутопсий и не охватывала все возможные варианты анатомии НБА. Позже, в 1971 году,
W. Zebroski предложил классификацию анатомии НБА из восьми типов (рис. 2) [9]. В отличие от классификации A. Latarjet классификация W. Zebroski оказалась слишком сложной для практической деятельности хирурга.
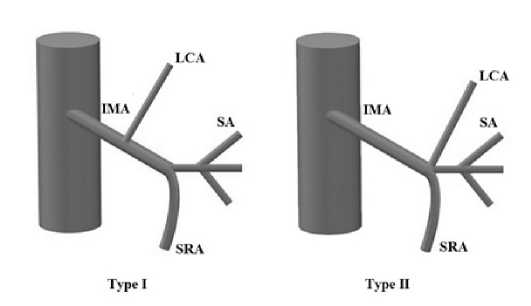
Рис. 1. Классификация ветвления НБА, предложенная A. Laterjet (тип I и тип II: IMA – нижняя брыжеечная артерия, LCA – левая ободочная артерия, SA – сигмовидная артерия, SRA – верхняя прямокишечная артерия)
Fig. 1. A. Laterjet’s classification of the branching pattern of the
IMA (type I and type II: IMA – inferior mesenteric artery, LCA – left colic artery, SA – sigmoid artery, SRA – superior rectal artery)
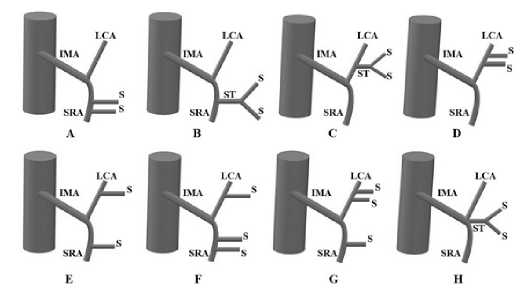
Рис. 2. Классификация ветвления НБА, предложенная W. Zebrowski (IMA — нижняя брыжеечная артерия, LCA – левая ободочная артерия, ST – сигмоидный ствол, S – сигмовидная артерия, SRA – верхняя прямокишечная артерия) Fig. 2. W. Zebrowski classification of the branching pattern of the
IMA (IMA – inferior mesenteric artery, LCA – left colic artery, ST – sigmoid trunk, S – sigmoid artery, SRA – superior rectal artery)
Применение прямой ангиографии способствовало активному изучению взаимоотношений НБА и ее ветвей между собой. Доказано, что постоянной ветвью НБА является ЛОА. Последняя, по данным литературы, встречается у 94,9 % пациентов. Одним из первых в мировой практике классификацию НБА с учетом анатомии ЛОА в 1997 году предложил H. Yada из Японии. По результатам анализа ангиограмм 260 пациентов с КРР автором были предложены три типа анатомии: I тип – ЛОА отходит от НБА изолировано, независимо от СА; II тип – ЛОА и СА имеют общий ствол; III тип – ЛОА, СА и верхняя прямокишечная (ВПА) исходят веерообразно из одной точки (рис. 3). Перечисленные анатомические варианты встречались с частотой 58 %, 27 % и 15 %, соответственно. Широкого практического применения данная классификация в конце XX и начале XXI века не нашла [10].
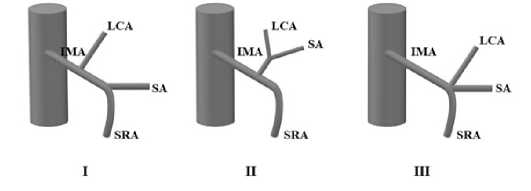
Рис. 3. Классификация ветвления НБА, предложенная H. Yada (IMA – нижняя брыжеечная артерия, LCA – левая ободочная артерия, SA – сигмовидная артерия, SRA верхняя прямокишечная артерия) Fig. 3. H. Yada’s classification of the branching pattern of the IMA (IMA – inferior mesenteric artery, LCA – left colic artery, SA – sigmoid artery, SRA – superior rectal artery)
На протяжении последних лет предлагались различные классификации анатомии НБА. Например, D. Predescu усовершенствовал предложенную классификацию A. Latarjet и ввел понятие средней ветви ЛОА. Автором были дополнительно описаны следующие типы: I тип – идентичен I типу A. Latarjet, в то время как II тип был разделен на подтипы; IIа – НБА делится на ЛОА, СА и ВПА; IIb – ЛОА, СА и ВПА исходят из одного ствола; IIс – IIb + ЛОА дополнительно делится на среднюю и нижнюю ветви; IId – ЛОА и СА имеют общий ствол (рис. 4). В его работе проведен анализ ангиограмм 49 пациентов, 11 из которых уже были оперированы на органах брюшной полости. Несмотря на небольшое число наблюдений, автор акцентировал внимание на важность взаимоотношений ЛОА и ее ветвей, в том числе с ветвями бассейна ВБА [11].
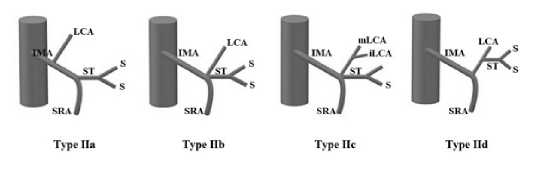
Рис. 4. Классификация ветвления НБА, предложенная D. Predescu (IMA – нижняя брыжеечная артерия, LCA – левая ободочная артерия, iLCA – нижняя левая ободочная артерия, mLCA – средняя левая ободочная артерия, ST – сигмоидный ствол, S – сигмовидная артерия, SRA — верхняя прямокишечная артерия)
Fig. 4. D. Predescu’s classification of the branching pattern of the IMA (IMA – inferior mesenteric artery, LCA – left colic artery, iLCA – inferior left colic artery, mLCA – middle left colic artery, ST – sigmoid trunk, S – sigmoid artery, SRA – superior rectal artery)
По аналогии с D. Predescu в своей работе Y. Wang также указал на значимость ветвей ЛОА в кровоснабжении левого изгиба ободочной кишки. В зависимости от анатомии восходящей и нисходящей ветвей ЛОА и коллатерального кровоснабжения с ветвями средней ободочной артерии (СОА) автором были предложены следующие варианты взаимосвязей бассейнов ВБА и НБА. При первом варианте (L1), который встречался у 10,5 % пациентов, восходящая ветвь располагалась медиально от ворот левой почки и достигала поперечно-ободочной кишки напрямую, без отхождения нисходящей ветви. Второй вариант (L2) наблюдался у 13,9 %. В данном случае восходящая ветвь делилась еще на две (правую и левую), которые начинались V-образно на уровне ворот почки. Первая ветвь отходила к поперечно-ободочной кишке, а другая к нисходящей ободочной кишке. Третий тип (L3) наблюдался чаще всего – 24,3%. Как правило, восходящая ветвь на уровне ворот почки направлялась в сторону селезеночного изгиба, где отдавала две ветви (рис. 5) [12].
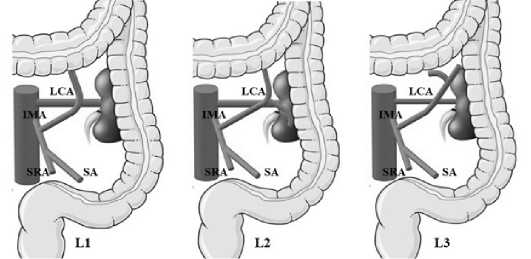
Рис. 5. Классификация ветвления ЛОА, предложенная Y. Wang (IMA – нижняя брыжеечная артерия, LCA – левая ободочная артерия, SA – сигмовидная артерия, SRA – верхняя прямокишечная артерия) Fig. 5. Y. Wang’s classification of the branching pattern of the LCA (IMA – inferior mesenteric artery, LCA – left colic artery, SA – sigmoid artery, SRA – superior rectal artery)
На сегодняшний день нет четкого определения ветвей ЛОА. Так, например, многие авторы нисходящую ветвь ЛОА ошибочно принимают за СА, и наоборот. С хирургической точки зрения это имеет значение при выполнении лимфодиссекции. Лимфатические узлы вдоль ЛОА артерии – 232 группа, вдоль СА – 242 группа, что необходимо учитывать при определении уровня перевязки и объема лимфодиссекции. Y. Tachikawa дал определение нисходящей ветви ЛОА как артерии, которая берет начало от ЛОА и идет вниз к нисходящей кишке, а СА как артерии, которая берет начало от ВПА или ЛОА и идет к сигмовидной кишке. По данным автора, из 360 пациентов c достоверно выявленной ЛОА, 93 % (n = 333) имели нисходящую ветвь ЛОА. У 62 % (n = 222) пациентов была лишь одна такая ветвь, две ветви у 27 % (n = 98) пациентов. Первой ветвью ЛОА у 59 % (n = 214) пациентов была нисходящая ветвь ЛОА, а СА у 41 % (n = 146) пациентов [13].
В ретроспективном обсервационном исследовании Ke J. проанализировал результаты компьютерной томографии (КТ) 188 пациентов, выделив согласно классификации H. Yada 4 группы пациентов. В зависимости от направления хода ЛОА авторы дополнительно предложили четыре подтипа. При типе А – ЛОА направлялась вверх и анастомозировала с краевой артерией в дистальной части поперечно-ободочной кишки; при типе В – ЛОА направлялась вверх и на уровне почки отдавала по диагонали ветвь к нисходящей ободочной кишке; при типе С – ЛОА располагалась более латерально и отдавала на уровне нижнего полюса почки ветвь к нисходящей кишке, анастомозируя с краевой артерией; при типе D – ЛОА отсутствовала. Данные типы встречались у 53 %, 27,1 %, 14,9 % и 4,8 % пациентов, соответственно. В ходе работы авторы пришли к выводу, что тип анатомии ЛОА в первую очередь связан с длинной НБА (рис. 6) [14].
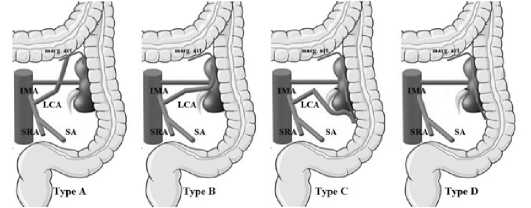
Рис. 6. Классификация ветвления ЛОА, предложенная J. Ke (IMA – нижняя брыжеечная артерия, LCA – левая ободочная артерия, SA – сигмовидная артерия, SRA – верхняя прямокишечная артерия, marg. art. – краевая артерия) Fig. 6. J. Ke’s classification of the branching pattern of the LCA (IMA – inferior mesenteric artery, LCA – left colic artery, SA – sigmoid artery, SRA – superior rectal artery, marg. art – marginal artery)
A. Patroni в проспективном исследовании, в которое вошли 113 пациентов, предложил классификацию НБА с учетом взаимоотношений ЛОА с НБВ. Автор разделил пациентов на две группы с учетом типа НБА по A. Latarjet и дополнительно, с учетом расстояния между ЛОА и НБВ у нижнего края поджелудочной железы, добавил еще две группы пациентов: N (меньше 20 мм) и F (больше 20 мм) (рис. 7).
Такое разделение автор объяснил стандартным размахом бранш лапароскопического инструмента. Первый тип встречался у 71 % пациентов, второй – у 29 %. С учетом расстояния от ЛОА до НБВ 66 % отнесены к группе N (среднее расстояние 7,7 ± 4,1 мм) и 34 % к группе F (среднее расстояние 45,5 ± 20,4 мм). По данным автора сохранение ЛОА возможно в 2/3 случаев при I типе, т. е. при ее изолированном начале. Стремление к высокой перевязке НБВ увеличивает риск повреждения ЛОА на уровне нижнего края поджелудочной железы. Авторы рекомендуют отдавать предпочтение лигированию НБВ на уровне пересечения НБА, сразу же после сохранения ЛОА [15].
В 2018 году K.X. Wang ретроспективно проанализировал 110 пациентов и предложил классификацию НБА, состоящую из трех типов: тип А – ЛОА отходит изолировано от НБА; тип В – ЛОА и СА берут начало от единого ствола, исходящего из НБА; тип С –ЛОА, СА и ВПА берут начало от одной точки НБА (рис. 8) [5].
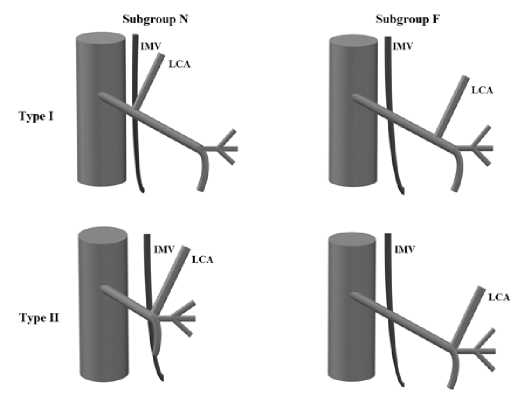
Рис. 7. Классификация A. Patroni. Тип I и тип II (типирование по Latarjet). Подгруппа N – расстояние IMV-LCA равно или меньше 20 мм по нижнему краю поджелудочной железы; подгруппа F – расстояние IMV-LCA больше 20 мм по нижнему краю поджелудочной железы, соответственно (IMV – нижняя брыжеечная вена, LCA – левая ободочная артерия) Fig. 7. A. Patroni’s classification. Type I and Type II (Latarjet typing). Subgroup N represents IMV-LCA distances equal to or less than 20 mm at the inferior margin of the pancreas; subgroup F represents IMV-LCA distances greater than 20 mm at the inferior margin of the pancreas, respectively (IMV – inferior mesenteric vena, LCA – left colic artery)
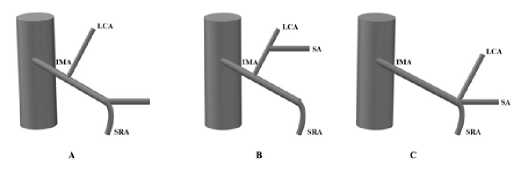
Рис. 8. Классификация ветвления НБА, предложенная K.X. Wang (IMA – нижняя брыжеечная артерия, LCA – левая ободочная артерия, SA – сигмовидная артерия, SRA – верхняя прямокишечная артерия)
Fig. 8. K.X. Wang’s classification of the branching pattern of the IMA (IMA – inferior mesenteric artery, LCA – left colic artery, SA – sigmoid artery, SRA – superior rectal artery)
Предложенные типы во многом схожи с классификацией H. Yada и точно отражают анатомические взаимоотношения НБА и ЛОА. Анализируя полученные результаты у пациентов, автор не выявил достоверных различий во времени операции, в объеме интраоперационной кровопотери, в количестве удаляемых лимфатических узлов, в частоте кровотечений и несостоятельности анастомоза в зависимости от типа анатомии
НБА [5]. Ретроспективный характер исследования, небольшое число наблюдений и отсутствие контрольной группы пациентов с высокой перевязкой несомненно ограничили полученные результаты. Схожая классификация из трех типов была предложена R. Miyamoto. Автор изучил компьютерные томограммы в режиме 3D реконструкции, которые в последующем сравнил с интраоперационными данными. Были предложены следующие типы НБА: тип А – ЛОА и СА берут начало из одной точки НБА, тип B – ЛОА и СА отходят от НБА общим стволом и тип С – ЛОА и СА отходят последовательно от НБА (рис. 9) [16].
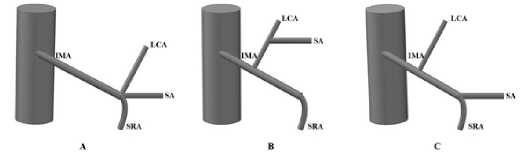
Рис. 9. Классификация ветвления НБА, предложенная R. Miyamoto (IMA – нижняя брыжеечная артерия, LCA – левая ободочная артерия, SA – сигмовидная артерия, SRA – верхняя прямокишечная артерия)
Fig. 9. R. Miyamoto’s classification of the branching pattern of the IMA (IMA – inferior mesenteric artery, LCA – left colic artery, SA – sigmoid artery, SRA – superior rectal artery)
В литературе также встречаются работы российских авторов. А.Е. Войновский и соавторы, анализируя данные мультиспиральной компьютерной томографии (МСКТ) 158 пациентов обнаружили примерно 15 типов строения НБА. Такая классификация, как и классификация W. Zebroski, стала бы неприменимой в практике хирургов. Поэтому авторами была предложена классификация, в основу которой лег принцип отхождения толстокишечных ветвей от основного ствола НБА, и выделено три хирургически значимых типа ветвления сосудов: тип I – несколько толстокишечных ветвей отходят от НБА отдельными стволами (57 %); тип II – все толстокишечные ветви отходят от НБА из одной точки в виде гусиной лапки (25 %); тип III – от НБА отходит единственный ствол, который на своем протяжении делится на толстокишечные ветви (18%) (рис. 10) [17].
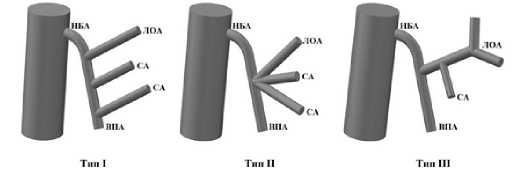
Рис. 10. Классификация ветвления НБА, предложенная А.Е. Войновским и соавторами (НБА – нижняя брыжеечная артерия, ЛОА – левая ободочная артерия, СА – сигмовидная артерия, ВПА – верхняя прямокишечная артерия) Fig. 10. Classification of the branching pattern of the IMA proposed by A.E. Voynovsky and co-authors (НБА – inferior mesenteric artery, ЛОА – left colic artery, СА – sigmoid artery, ВПА – superior rectal artery)
П.В. Царьков и соавторы с целью стандартизации предложили следующие варианты строения НБА: E-, K-, H-типы (рис. 11). Тип Е был самым распространенным и разделен авторами на три подтипа: Е1 – от ствола НБА независимо отходят несколько толстокишечных ветвей; Е2 – ЛОА и СА начинаются в одной точке веерообразным образом в проксимальной части НБА, СА так же и в дистальной части НБА; Е3 – ЛОА начинается как независимая ветвь, а СА веерообразно отходят от ВПА. При К-типе – ЛОА и СА начинаются из одной точки НБА или от короткого общего ствола до 0,5 см в проксимальной части НБА при отсутствии дополнительных сигмовидных ветвей дистальнее. При Н-типе – если ЛОА и СА начинаются общим корнем длиннее 0,5 см. Данная классификация была основана авторами на хирургических потребностях при скелетизации сосудов бассейна НБА [18].
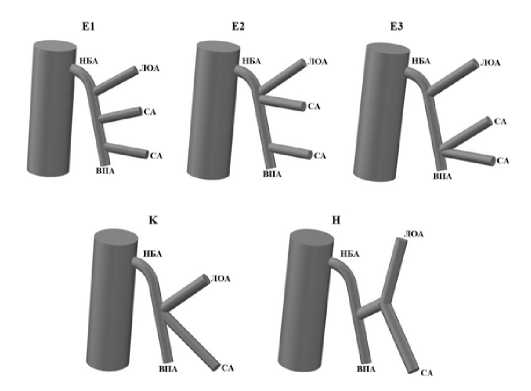
Рис. 11. Классификация ветвления НБА, предложенная П.В. Царьковым и соавторами (НБА – нижняя брыжеечная артерия, ЛОА – левая ободочная артерия, СА – сигмовидная артерия, ВПА – верхняя прямокишечная артерия)
Fig. 11. Classification of the branching pattern of the IMA proposed by
P.V. Tsarkov and co-authors (НБА – inferior mesenteric artery, ЛОА – left colic artery, СА – sigmoid artery, ВПА – superior rectal artery)
В попытках систематизировать данные литературы по анатомии НБА R. Cirocchi в 2019 году опубликовал результаты систематического обзора и мета-анализа. В исследование включены 19 работ, 2040 пациентов. Для оценки анатомии НБА авторами была использована классификация A. Latarjet. Согласно полученным результатам у 4,1 % пациентов ЛОА отсутствовала. I тип встречался чаще всего – у 921 пациента, II тип выявлен у 901 пациента. При I типе ЛОА отходит изолированно от СА и ВПА. Скелетизация НБА в данном случае была простой, а сохранение ЛОА безопасной процедурой. Ограничением данного исследования является выделение только двух типов [19].
Одним из недостатков большинства описанных ранее классификаций стало отсутствие типа, при котором отсутствует
ЛОА. В 2015 году К. Murono в проспективном наблюдательном исследовании дополнил классификацию H. Yada, выделив дополнительно IV тип – отсутствие ЛОА. В исследование включены данные КТ-ангиограмм 468 пациентов. Большинство пациентов были распределены в I тип – 41,2 %, либо III тип – 44,7 %. По мнению автора, II тип встречался примерно у 9,0 % и вызывал больше всего технических сложностей. ЛОА отсутствовала у 5,1 % [20]. Дополнительно к IV типу автор по аналогии с работой А. Patroni предложил классификацию в зависимости от взаимоотношения ЛОА и НБВ: тип А – ЛОА располагается медиальнее НБВ; тип В – ЛОА располагается латеральнее НБВ; тип С – ЛОА располагается очень латерально. Данная классификация широко используется на практике, о чем свидетельствуют данные литературы [7].
J. Zhou и соавторы проанализировали пациентов с учетом классификации H. Yada и пришли к выводу, что длина НБА при вышеперечисленных типах составляет 35,59 ± 8,99; 42,59 ± 10,06; 40,96 ± 10,36 и 42,84 ± 8,96 мм, соответственно [21]. Аналогичные данные были получены и J. Ke. Таким образом, у пациентов с I типом длина НБА по данным литературы достоверно меньше в сравнении со II, III и IV типами, соответственно, что необходимо учитывать на практике [14, 21].
Обсуждение
Принципы тотальной мезоколонэктомии, мезоректумэктомии и центральной лимфаденэктомии при местно-распространенном КРР утверждены действующими рекомендациями. НБА и ее ветви приняты как основные хирургические ориентиры при лечении КРР. Вопрос уровня пересечения НБА по-прежнему не решен [22]. Сторонники высокой перевязки указывают на отсутствие необходимости в протяженной скелетизации НБА и ее ветвей. Как правило, апикальные лимфатические узлы удаляются единым блоком с опухолью. Такой подход позволяет увеличить число удаляемых лимфатических узлов, обеспечить правильное стадирование, увеличить выживаемость, снизить риск диссеми-нации опухолевых клеток и частоту местного рецидива. Кроме того, высокое пересечение НБА исключает натяжение кишки за счет отсутствия физиологической точки фиксации брыжейки и делает левую половину ободочной кишки свободной от натяжения [23]. Однако, высокая перевязка приводит к значимому расширению объема операции по причине нарушения кровоснабжения левой половины ободочной кишки и требует мобилизации селезеночного изгиба, что в ряде ситуаций сопряжено с увеличением риска интраоперационных осложнений и повреждением межбрыжеечных анастомозов [3]. Снижение притока крови к анастомозу может сопровождаться ишемией и, как следствие, увеличением частоты несостоятельностей и стриктур анастомоза. Описаны случаи некроза проксимального отдела кишки [24]. Связано это в первую очередь с особенностями кровообращения селезеночного изгиба. Доказано, что краевая артерия Драммонда является основной и постоянной артерией, питающей ободочную кишку. У 38 % пациентов она является единственным анастомозом между ВБА и НБА в области селезеночного изгиба, в основном за счет левой ветви СОА и восходящей ветви ЛОА. Промежуточные анастомозы (дуга Риолана) наблюдаются у 46 %, а центральные анастомозы (артерия Московица) у 16 % пациентов [2]. Ряд авторов центральными анастомозами (межбрыжеечным стволом) называют восходящие ветви ЛОА, которые по данным литературы встречаются у 18 % пациентов [25]. Последние играют роль в кровоснабжении левых отделов ободочной кишки.
Противники низкой перевязки НБА считают, что сохранить ЛОА лапароскопически технически сложнее из-за наличия плотной соединительной ткани вокруг НБА. Однако, с опытом скелетизация НБА не приводит к увеличению интраоперационных осложнений и позволяет сохранить хорошее кровоснабжение кишки за счет коллатерального кровотока по ЛОА, избегая возможной ишемии низводимой части ободочной кишки, в частности, в зоне будущего анастомоза [4]. Доказано, что фактор ишемии играет ключевую роль в этиологии несостоятельности анастомоза [26]. В проведенном J. Zeng метаанализе частота несостоятельности анастомоза у пациентов в группе высокой перевязки составила 9,8 %, в то время как в группе с низкой перевязкой – 7,0 % (р = 0,004). Достоверных различий в послеоперационной летальности, количестве удаленных лимфатических узлов, частоте рецидивов и 5-летней выживаемости автором не получено [4].
Приведенные в литературе многочисленные классификации вариантной анатомии НБА в большинстве случаев не способствуют пониманию хирургом анатомических структур НБА, создают путаницу и не позволяют систематизировать накопленный опыт. Предложенная классификация A. Latarjet не охватывала все возможные варианты анатомии НБА и основывалась лишь на данных аутопсий. В отличии от классификации A. Latarjet, классификация W. Zebroski оказалась слишком сложной для практического применения. Перспективной на сегодняшний день следует считать классификацию, предложенную авторами из Японии — H. Yada в варианте К. Murono (рис. 3). Отсутствие подтипов и простота классификации привлекла внимание исследователей, и на текущий момент она активно используется в клинической практике. Например, S. Zeng и соавторы в проведенном систематическом обзоре определили частоту различных типов ЛОА с учетом классификацию H. Yada в варианте К. Murono. В анализ включены 9 статей, проанализированы данные 1315 пациентов. Согласно полученным данным частота встречаемости I типа составляет 32,1 – 59,4%; II типа – 10,3–53,6 %; III типа – 8,5–44,7 % и IV типа – 2,8 %. Данная классификация отражает взаимосвязь НБА с ЛОА, СА и ВПА и целесообразна для использования в рутинной практике.
Согласно данным работ J. Zhou, у пациентов с I типом длина НБА до отхождения ЛОА является самой короткой [21]. Скелетизация НБА при этом не вызывает сложностей и у 2/3 пациентов с изолированным отхождением ЛОА возможно ее сохранить [15, 27]. Согласно последним данным, изолированное отхождение ЛОА (I тип по классификации A. Latarjet и H. Yada) является показанием для низкой перевязки НБА. При II типе C. Zhang пришел к выводу, что сохранение ЛОА приводит к сложностям во время скелетизации, а также к натяжению кишечника в зоне анастомоза с увеличением вероятности развития несостоятельности. У пациентов с III типом проще всего визуализировать ЛОА, потому что ветви НБА имеют общее основание. По мнению C. Zhang, низкая перевязка в данном случае требует опыта, т. к. неосторожность в ходе диссекции может стать причиной кровотечения с последующей затем высокой перевязкой. Кровоснабжение селезеночного изгиба и нисходящей кишки в данном случае обеспечивается за счет краевой дуги между левой ветвью СОА и ЛОА. Высокая перевязка в таком случае приведет к снижению перфузии нисходящей ободочной кишки за счет отсутствия прямого кровоснабжения [27]. У пациентов с IV типом рекомендовано выполнение высокой перевязки НБА, т. к. поиск и выделение ЛОА напрасно сопровождается ее поиском и выходом из слоя, увеличивая риск повреждения гонадных сосудов или даже мочеточника [21, 27].
Описанные различные варианты взаимоотношений ЛОА и НБВ имеют цель повлиять на снижение частоты интраоперационных осложнений. Стремление к высокой перевязке НБВ увеличивает риск повреждения ЛОА на уровне нижнего края поджелудочной железы, в связи с чем пациентам, которым планируется сохранение ЛОА, рекомендовано пересечение НБВ на одном уровне с ЛОА [15]. И вопреки имеющимся литературным данным, такой уровень лигирования НБВ не увеличивал частоту натяжения анастомоза. Высокая перевязка НБВ по данным аутопсий позволяет увеличить длину низводимого участка кишки лишь на 2,5±1,2 см и имеет свои недостатки. Во-первых, при дополнительной мобилизации создается дефект в мезоколоне, который в последующем может стать причиной внутренней грыжи [28]. Во-вторых, высокая перевязка НБВ является причиной повышения мезентериального венозного давления в низведенной кишке [29]. Высокая перевязка НБВ не увеличивает число удаляемых лимфатических узлов и не сопровождается увеличением общей выживаемости [30].
Таким образом, опубликованные на данный момент работы указывают на участие ЛОА в формировании коллатерального кровотока и диктуют актуальность дальнейшего изучения вариативной анатомии НБА. Оценка анатомии НБА с использованием классификации H. Yada в варианте К. Murono, возможно, позволит в перспективе систематизировать полученные данные.
Заключение
Оценка анатомии НБА и ее ветвей имеет практическое значение в хирургии КРР, позволяя выбрать оптимальный уровень ее пересечения с точки зрения сохранения кровоснабжения анастомоза с сохранением оптимального объема лимфодис-секции. Требуется дальнейшее изучение данной проблемы.
Список литературы Вариантная анатомия нижней брыжеечной артерии и ее значение при выборе уровня перевязки. Обзор литературы
- Sung H., Ferlay J., Siegel R.L. et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin., 2021, № 71(3), рр. 209-249. https://doi.org/10.3322/caac.21660
- Kuzu M.A., Güner M.A., Kocaay A.F. et al. Redefining the collateral system between the superior mesenteric artery and inferior mesenteric artery: a novel classification. Colorectal Dis., 2021, № 23(6), рр. 1317-1325. https://doi.org/10.1111/codi.15510
- You Y.N., Hardiman K.M., Bafford A. et al. The American Society of Colon and Rectal Surgeons Clinical Practice Guidelines for the Management of Rectal Cancer. Dis Colon Rectum, 2020, № 63(9), рр. 1191-1222. https://doi.org/10.1097/DCR.0000000000001762
- Zeng J., Su G. High ligation of the inferior mesenteric artery during sigmoid colon and rectal cancer surgery increases the risk of anastomotic leakage: a meta-analysis. World J Surg Oncol., 2018. № 16(1), рр. 157. Published 2018 Aug 2. https://doi.org/10.1186/s12957-018-1458-7
- Wang K.X., Cheng Z.Q., Liu Z., Wang X.Y., Bi D.S. Vascular anatomy of inferior mesenteric artery in laparoscopic radical resection with the preservation of left colic artery for rectal cancer. World J Gastroenterol., 2018, № 24(32), рр. 3671-3676. https://doi.org/10.3748/wjg.v24.i32.3671
- Li B., Wang J., Yang S. et al. Left colic artery diameter is an important factor affecting anastomotic blood supply in sigmoid colon cancer or rectal cancer surgery: a pilot study. World J Surg Oncol., 2022, № 20(1), рр. 313. Published 2022 Sep 27. https://doi.org/10.1186/s12957-022-02774-0
- Zeng S., Wu W., Zhang X., Qiu T., Gong P. The significance of anatomical variation of the inferior mesenteric artery and its branches for laparoscopic radical resection of colorectal cancer: a review. World J Surg Oncol., 2022, № 20(1), рр. 290. Published 2022 Sep 10. https://doi.org/10.1186/s12957-022-02744-6
- Latarjet A. Traite d’anatomie humaine. Tome quatrieme: Appareil de la Digestion, 1949.
- Zebrowski W., Augustyniak E., Zajac S. Zmienność odejścia i sposobu rozgałezienia tetnicy krezkowej dolnej oraz jej wzajemne zespolenia [Variations of origin and branching of the interior mesenteric artery and its anastomoses]. Folia Morphol (Warsz). 1971. № 30(4), рр. 575-583.
- Yada H., Sawai K., Taniguchi H., Hoshima M., Katoh M., Takahashi T. Analysis of vascular anatomy and lymph node metastases warrants radical segmental bowel resection for colon cancer. World J Surg., 1997. № 21(1), рр. 109-115. https://doi.org/10.1007/s002689900202
- Predescu D., Popa B., Gheorghe M. et al. The vascularization pattern of the colon and surgical decision in esophageal reconstruction with colon. A selective SMA and IMA arteriographic study. Chirurgia (Bucur)., 2013, № 108(2), рр. 161-171
- Wang Y., Shu W., Ouyang A., Wang L., Sun Y., Liu G. The New Concept of Physiological «Riolan’s Arch» and the Reconstruction Mechanism of Pathological Riolan’s Arch After High Ligation of the Inferior Mesenteric Artery by CT Angiography-Based Small Vessel Imaging. Front Physiol., 2021, № 12, рр. 641290. Published 2021 Jun 22. https://doi.org/10.3389/fphys.2021.641290
- Tachikawa Y., Nozawa H., Otani K. et al. Definition and characterization of the descending branch of the left colic artery. Abdom Radiol (NY), 2021, № 46(7), рр. 2993-3001. https://doi.org/10.1007/s00261-021-02969-1
- Ke J., Cai J., Wen X. et al. Anatomic variations of inferior mesenteric artery and left colic artery evaluated by 3-dimensional CT angiography: Insights into rectal cancer surgery - A retrospective observational study. Int J Surg., 2017, № 41, рр. 106-111. https://doi.org/10.1016/j.ijsu.2017.03.012
- Patroni A., Bonnet S., Bourillon C. et al. Technical difficulties of left colic artery preservation during left colectomy for colon cancer. Surg Radiol Anat., 2016, № 38(4), рр. 477-484. https://doi.org/10.1007/s00276-015-1583-8
- Miyamoto R, Nagai K, Kemmochi A, Inagawa S, Yamamoto M. Three-dimensional reconstruction of the vascular arrangement including the inferior mesenteric artery and left colic artery in laparoscope-assisted colorectal surgery. Surg Endosc., 2016, № 30(10), рр. 4400-4404. https://doi.org/10.1007/s00464-016-4758-4
- Войновский А.Е., Башанкаев Б.Н., Сеурко К.И., Винокуров И.А. Новый взгляд на вариантную анатомию нижней брыжеечной артерии у пациентов с колоректальным раком. Клиническая и экспериментальная хирургия. Журнал имени академика Б.В. Петровского, 2021. Т. 9, № 3. С. 44-50. https://doi.org/10.33029/2308-1198-2021-9-3-44-50
- Царьков П.В., Ефетов С.К., Зубайраева А.А., Пузаков К.Б., Оганян Н.В. Роль хирурга в определении анатомии нижней брыжеечной артерии по данным компьютерной томографии при лечении колоректального рака. Хирургия. Журнал им. Н.И. Пирогова, 2022, № 9, рр. 40-49. https://doi.org/10.17116/hirurgia202209140
- Cirocchi R., Randolph J., Cheruiyot I. et al. Systematic review and meta-analysis of the anatomical variants of the left colic artery. Colorectal Dis., 2020. № 22(7), рр. 768-778. https://doi.org/10.1111/codi.14891
- Murono K., Kawai K., Kazama S. et al. Anatomy of the inferior mesenteric artery evaluated using 3-dimensional CT angiography. Dis Colon Rectum., 2015. № 58(2), рр. 214-219. https://doi.org/10.1097/DCR.0000000000000285
- Zhou J., Chen J., Wang M. et al. A study on spinal level, length, and branch type of the inferior mesenteric artery and the position relationship between the inferior mesenteric artery, left colic artery, and inferior mesenteric vein. BMC Med Imaging., 2022, № 22(1), рр. 38. Published 2022 Mar 8. https://doi.org/10.1186/s12880-022-00764-y
- Hajibandeh S., Hajibandeh S., Maw A. Meta-analysis and Trial Sequential Analysis of Randomized Controlled Trials Comparing High and Low Ligation of the Inferior Mesenteric Artery in Rectal Cancer Surgery. Dis Colon Rectum, 2020, № 63(7), рр. 988-999. https://doi.org/10.1097/DCR.0000000000001693
- Guraya S.Y. Optimum level of inferior mesenteric artery ligation for the left-sided colorectal cancer. Systematic review for high and low ligation continuum. Saudi Med J., 2016, № 37(7), рр. 731-736. https://doi.org/10.15537/smj.2016.7.14831
- Tsujinaka S., Kawamura Y.J., Tan K.Y. et al. Proximal bowel necrosis after high ligation of the inferior mesenteric artery in colorectal surgery. Scand J Surg., 2012, № 101(1), рр. 21-25. https://doi.org/10.1177/145749691210100105
- Bertelli L., Lorenzini L., Bertelli E. The arterial vascularization of the large intestine. Anatomical and radiological study. Surg Radiol Anat., 1996. № 18. Suppl: A1-S59.
- Dworkin M.J., Allen-Mersh T.G. Effect of inferior mesenteric artery ligation on blood flow in the marginal artery-dependent sigmoid colon. J Am Coll Surg., 1996, № 183(4), рр. 357-360.
- Zhang C., Li A., Luo T., Li Y., Li F., Li J. Evaluation of characteristics of left-sided colorectal perfusion in elderly patients by angiography. World J Gastroenterol., 2020, № 26(24), рр. 3484-3494. https://doi.org/10.3748/wjg.v26.i24.3484
- Sereno Trabaldo S., Anvari M., Leroy J., Marescaux J. Prevalence of internal hernias after laparoscopic colonic surgery. J Gastrointest Surg., 2009, № 13(6), рр. 1107-1110. https://doi.org/10.1007/s11605-009-0851-5
- Shumeyko V., Eid I., Muir V.H. et al. Routine division of the inferior mesenteric vein during left sided colonic surgery: will it leave the anastomosis hanging by a thread? In: Paper presented at the annual scientific meeting of the association of surgeons of Great Britain and Ireland, Manchester, England, April, 2007
- Planellas P., Marinello F., Elorza G. et al. Extended Versus Standard Complete Mesocolon Excision in Sigmoid Colon Cancer: A Multicenter Randomized Controlled Trial. Ann Surg., 2022, № 275(2), рр. 271-280. https://doi.org/10.1097/SLA.0000000000005161


